修回日期: 2014-03-11
接受日期: 2014-04-14
在线出版日期: 2014-05-18
目的: 观察microRNA-34a、Notch1在肝细胞癌(hepatocellular carcinoma, HCC)组织的表达, 探讨其与HCC发生、发展、临床病理特征的关系及可能的临床意义.
方法: 在132例HCC组织及癌旁组织、49例正常肝脏组织中应用实时荧光定量PCR法检测microRNA-34a的表达和免疫组织化学染色检测Notch1表达.
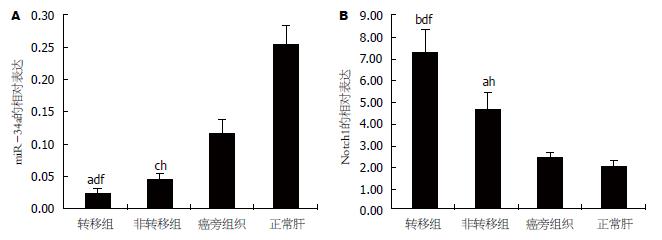
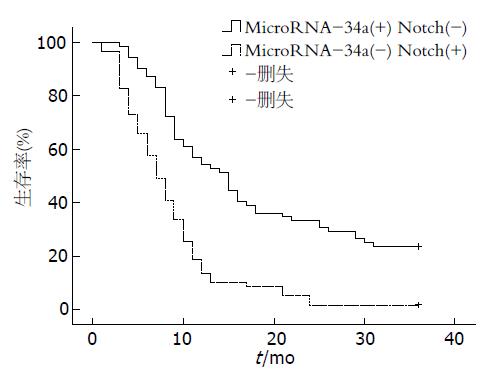
结果: HCC组织中microRNA-34a表达水平明显低于癌旁组织(2.57±0.71, P = 0.003)及正常肝组织(8.65±0.21, P<0.001), 在转移性癌组织中microRNA-34a表达水平明显低于非转移性癌组织(1.34±0.13, P = 0.014), 差异均有统计学意义. Notch1的免疫组织化学染色结果: HCC组织中Notch1表达水平明显高于癌旁组织(3.12±0.67, P = 0.001)及正常肝组织(4.65±0.14, P<0.001), 转移性癌组织高于非转移性癌组织(2.14±0.37, P = 0.008), 差异有统计学意义. MicroRNA-34a与Notch1在HCC及癌旁组织中均成负相关, 相关系数分别为(r = -0.259, P = 0.003)、(r = -0.274, P = 0.002), 两者在HCC组织中的表达与患者年龄、性别、肝功能、肿瘤部位、是否合并肝硬变、是否伴随肝炎病毒感染及甲胎蛋白(α-fetoprotein, αFP或AFP)含量无相关性(P>0.05), 而与肿瘤恶性程度、肿瘤个数、肿瘤体积、淋巴结转移、浸润深度、TNM分期密切相关(P<0.05). Kaplan-Meier分析显示: microRNA-34a低表达、Notch1高表达组患者术后3年生存率(11.3%), 明显低于microRNA-34a高表达、Notch1低表达组(34.7%), 差异具有统计学意义(χ2 = 38.163, P = 0.011).
结论: MicroRNA-34a在HCC组织中较癌旁和正常肝脏组织明显减低, 其通过逆向调节靶蛋白Notch1参与肿瘤肿瘤恶性行为; 检测microRNA-34a及Notch1在HCC组织中的表达情况, 对HCC的临床诊断、治疗及预后判断有潜在的重要意义.
核心提示: 该文应用qRT-PCR法和SP法联合检测了肝癌、癌旁及正常肝脏组织显示肝癌中microRNA-34a表达减低, Notch1表达增高; 两者在各组织中均呈负相关. 因此, MicroRNA-34a与Notch1的此种表达异常可能共同参与了肝癌细胞的恶性生物学行为, 对临床肝癌的诊疗具有一定的参考价值.
引文著录: 于泳, 李霄, 周亮, 窦科峰, 李小磊, 阮柏, 张卓超, 戴斌, 汪建林, 杨西胜, 王德盛. MicroRNA-34a、Notch1在肝细胞癌组织中的表达及临床意义. 世界华人消化杂志 2014; 22(14): 1943-1952
Revised: March 11, 2014
Accepted: April 14, 2014
Published online: May 18, 2014
AIM: To detect the expressions of microRNA-34a and Notch1 in hepatocellular carcinoma (HCC) and to explore their relationships with HCC occurrence and development and the clinical and pathological features of HCC.
METHODS: Real-time RT-PCR and immunohistochemistry were used to detect the expression of microRNA-34a and Notch1 protein in 132 HCC tissues, matched tumor-adjacent tissues and 49 normal liver tissues, respectively.
RESULTS: The expression of microRNA-34a in HCC tissues were significantly lower than that in tumor-adjacent tissues (P = 0.003) and normal liver tissues (P < 0.001). The expression of microRNA-34a in HCC tissues with metastasis was significantly lower than that in HCC tissues without metastasis (P = 0.014). The expression of Notch1 was significantly higher in HCC tissues than in tumor-adjacent tissues (P = 0.001) and normal liver tissues (P < 0.001). The expression of Notch1 in HCC tissues with metastasis was significantly lower than that in HCC tissues without metastasis (P = 0.008). The expression of microRNA-34a was negatively correlated with that of Notch1 in HCC and tumor-adjacent tissues (r = -0.259, P = 0.003; r = -0.274, P = 0.002). The expression of microRNA-34a and Notch1 in HCC had no correlation with patient age, gender, liver cirrhosis, tumor site, viral hepatitis, or AFP (P > 0.05 for all), but was closely correlated with tumor malignancy, tumor size, lymph node metastasis, tumor number, infiltration depth, and TNM stage (P < 0.05 for all). The 3-year survival rate in the group with low expression of microRNA-34a and high expression of Notch1 (11.3%) was significantly lower than that in the group with high expression of microRNA-34a and low expression of Notch1 (34.7%)(χ2 = 38.163, P = 0.011).
CONCLUSION: The expression of microRNA-34a is significantly down-regulated in HCC tissues, which may reversely regulate its target protein Notch1. Detecting the expression of microRNA-34a and Notch1 in HCC had a potential significance for diagnosis, therapy and prognosis of HCC.
- Citation: Yu Y, Li X, Zhou L, Dou KF, Li XL, Ruan B, Zhang ZC, Dai B, Wang JL, Yang XS, Wang DS. Clinical significance of expression of microRNA-34a and Notch1 in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(14): 1943-1952
- URL: https://www.wjgnet.com/1009-3079/full/v22/i14/1943.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i14.1943
肝细胞癌(hepatocellular carcinoma, HCC)简称肝癌, 恶性程度极高, 是全球发病率和死亡率均很高的肝脏恶性肿瘤, 病死率在恶性肿瘤中居第2位[1]. 虽然该病的治疗方法日新月异, 但总体预后仍然很差[2]. 究其原因, 主要与肝癌的早期诊断方法及结果敏感性的局限, 肝癌细胞在发展过程中易发生侵袭转移等相关. 所以目前许多研究热点关注于肝癌的早期诊断及如何针对其侵袭转移进行治疗.
随着对肝癌发生发展分子机制的深入研究[3-5], 发现microRNAs可以引起靶基因的翻译抑制和直接降解, 从转录后水平调控各种癌基因和抑癌基因的表达, 在肿瘤进程中发挥着重要作用. 有研究表明microRNA-34a与多种肿瘤的发生、发展密切相关, 如恶性胶质瘤[6]、成神经管细胞瘤[7]、儿童神经母细胞瘤[8]、前列腺癌[9]、膀胱癌[10]、结直肠癌[11,12]、骨肉瘤[13]、宫颈癌[14]、绒毛膜癌[14]、胰腺癌[15]、非小细胞型肺癌[16]和肝癌[17].
Notch信号通路广泛存在于多种组织细胞中, 影响细胞分化、发育及凋亡, Notch1基因是Notch家族中4个同源体之一, 与人类肿瘤的发生、发展相关. 近几年的研究显示其与肿瘤的发生、发展过程也密切相关. 有研究[18]发现在肝癌中Notch1受体也呈现高表达, 并参与了肝癌细胞的侵袭迁移过程, 这说明Notch信号通路在肝癌的发生、发展过程中也起到了重要的作用.
研究[19,20]发现在一些肿瘤中, microRNA-34a可抑制包括Notch1在内的多种基因, 发挥抑癌作用. 迄今为止, 关于肝癌组织中两者之间的关系知之甚少. 本研究通过对microRNA-34a与Notch1在肝癌组织、癌旁正常组织与正常肝组织中共表达的差异进行检测, 初步探讨了两者在肝癌中的相互关系.
132组HCC组织标本取自2010-01/2010-12在我院行手术切除的HCC组织及癌旁组织(规定距癌组织5 cm以上), 49例正常肝组织取自在此期间行肝脏良性肿瘤手术切除的正常活检肝组织, 所有标本均分别保存于液氮(50%体积)及40 g/L甲醛固定(50%体积), 后常规石蜡包埋, 切片保存. 肝癌患者: 男性70例, 女性62例; 中位年龄50.3岁, 所有标本均经术后病理证实, 术前均未接受抗肿瘤治疗. 试验经第四军医大学西京医院伦理委员会批准, 严格遵照《赫尔辛斯基宣言》医学伦理道德准则实施, 与所有患者或家属进行充分沟通并签署试验知情同意书. 肿瘤长径≤5.0 cm 52例, 直径>5.0 cm 80例. 肿瘤按TNM分期[2003-01-01, 美国癌症联合会(American Joint Committee on Cancer, AJCC)/国际抗癌联盟(Union for International Cancer Control, UICC), 第6版]:Ⅰ期30例, Ⅱ期19例, Ⅲ期51例, Ⅳ期32例. 低分化59例, 中分化44例, 高分化29例. 伴远处转移68例, 卫星灶69例. 抗人Notch1单克隆抗体和二抗试剂盒购自Abcam公司. SP试剂盒和浓缩型DAB试剂盒购自北京中杉金桥生物技术有限公司. U6内参引物(U6-forward 5'-CGCTTCGGCAGCACATATACTA-3', U6-reverse 5'-CGCTTCACGAATTTGCGTGTCA-3')、microRNA-34a引物由德国QIAGEN公司合成. miRNeasy Mini Kit(50)提取试剂盒、miscript Primer Assays引物试剂盒、miscript ⅡRT(50)反转录试剂盒和miscript SYBR Green PCR kit(200)定量试剂盒购自QIAGEN公司.
1.2.1 免疫组织化学检测: 组织经4%甲醛溶液固定; 石蜡包埋后按照5 µm厚度常规切片; 切片经二甲苯脱蜡、梯度乙醇水化; 后进行抗原修复、封闭内源性过氧化物酶及正常山羊血清封闭抗原; 依据试剂说明滴加稀释后兔抗人Notch1单克隆抗体4 ℃冰箱过夜; 湿盒室温复温1 h后滴加生物素标记二抗, 37 ℃孵育30 min; PBS冲洗后DAB显色; 苏木紫衬染; 重新脱水透明; 封片; 显微镜下观察.
1.2.2 实时荧光定量PCR: MicroRNA-34a提取: 无菌层流实验室分别取液氮保存的HCC、癌旁、正常肝组织块约0.3 cm3于研钵中加液氮充分研磨至极细粉末, 转入1.5 mL离心管, 加入700 µL QIAzollysisreagent封盖混匀, 室温匀浆5 min, 加140 µL氯仿震荡15 s后室温静置3 min, 4 ℃ 12000 g离心15 min, 转上清液至新1.5 mL离心管, 加525 µL 100%乙醇混匀, 取700 µL混匀液至过滤柱上管, 室温封盖≥8000 g离心15 s弃去滤过液并重复此步, 依次加入RWT缓冲液、RPE缓冲液室温封盖≥8000 g离心15 s均弃去滤过液, 加RPE缓冲液室温下封盖≥8000 g离心15 s弃去滤过液, 重复并离心后将过滤柱上管转移至新的收集管室温封盖≥8000 g离心1 min再次甩干, 将过滤柱上管转移至新的1.5 mL离心管加RNase-free water室温封盖≥8000 g离心洗脱3 min后保留下方滤过液并重复. 反转录: 在冰盒中依次加入各反转录试剂及指定量的HCC、癌旁、正常肝样本至各0.2 mL离心管, 完成20 µL反转录体系并实施. qRT-PCR: 在2套8联管中依次加入各试剂和引物完成25 µL体系, 室温下封盖1000 g离心1 min去气泡, 设定IQ5型定量PCR仪(BIA- RAD公司)程序为: 变性: 95 ℃ 15 min; 40个循环: 94 ℃ 15 s; 复性: 55 ℃ 30 s; 新链DNA合成: 70 ℃ 30 s. Notch1的检测步骤同理. 在扩增待测miRNAs的同时, 我们还扩增了U6-RNA作为内参对照.
1.2.3 结果判定标准: (1)免疫组织化学染色: 以出现淡黄-棕褐色颗粒作为阳性结果, 由2名副高级职称病理医师进行独立双盲评分. 每张病理切片随机选取5个10×40倍光学显微镜视野, 将Notch1的染色范围及染色强度依据以下标准半定量化, 结果取平均值. 标准如下: A: 染色范围: 染色阳性细胞数占总细胞数的比率按≤5%、6%-25%、26%-50%、51%-75%、≥76%分别记为0、1、2、3、4分; B染色强度: 按照未染色、淡黄色、棕色、棕褐色分别记为0、1、2、3. 将染色范围与染色强度计分相乘得出结果: 0分为阴性, 1-4分为弱阳性, 5-8分为阳性, 9-12分为强阳性. 不同Notch1表达的HCC组织分成两组: 0-4分: 低表达组, 5-12分: 高表达组; (2)实时荧光定量PCR: MicroRNA-34a与U6-RNA表达水平通过2-∆∆Ct法确定, ∆∆Ct = (CtmiRNA-CtU6RNA)待测样品-(CtmiRNA-CtU6RNA)对照组. 对照组为相应的癌旁组织, 并经病理学证实, 实时PCR反应结果为3次独立实验的校正结果.
1.2.4 随访: 所有患者术后进行3年定期随访, 开始时间为接受手术的时间, 截止日期为2013-12-31. 采用门诊随访及电话随访, 平均1次/3 mo. 规定死亡患者死亡时间为终止时间. 中途失访7例, 终止时间为最后一次随访时间, 亦纳入生存分析.
统计学处理 采用SPSS19.0 统计软件进行统计学分析, 采用Pearson χ2检验计算microRNA-34a、Notch1的表达与不同临床病理特征的关系; 按照试验小组的原始设计及研究目的选取microRNA-34a低表达、Notch1高表达以及microRNA-34a高表达、Notch1低表达组为研究对象, Spearman's相关性分析microRNA-34a与Notch1的关系; 运用Kaplan-Meier法进行生存分析, Log-rank检验分析曲线有无统计学差异. 可信区间为95%, P<0.05为差异具有统计学意义.
2.1.1 microRNA-34a的qRT-PCR表达: microRNA-34a与U6-RNA在反应体系中均有效扩增, 依据CT值间的比较, 通过2-∆∆Ct法分别计算每个被检HCC组织样品中microRNA-34a相对癌旁组织及正常肝脏组织的表达变化比率. 对所得到的每一变化比率取平均值(n = 132), 用以评估microRNA-34a在HCC中的变化. 我们发现HCC组织中转移组的microRNA-34a表达水平低于非转移组(P = 0.014), 癌旁组织(P = 0.003)及正常肝组织(P<0.001); 非转移组的microRNA-34a表达水平低于癌旁组织(P = 0.017)及正常肝组织(P<0.001), 差异均有统计学意义(图1A).
2.1.2 microRNA-34a与临床病理指标: microRNA-34a在HCC组织中的表达与患者年龄、性别、肝功能、肿瘤部位、肿瘤体积、是否合并肝硬变及是否伴随肝炎病毒感染及AFP含量无统计学意义(P>0.05), 而与肿瘤数量、肿瘤分化等级、转移情况、静脉侵袭、卫星状损害及TNM分期有统计学意义(P<0.05), 并且随着HCC病理分级的增高而减低(P<0.05)(表1).
| 临床病理因素 | n | MicroRNA-34a | P值 | χ2 | |
| 低表达 | 高表达 | ||||
| 性别 | 0.222 | 1.494 | |||
| 男性 | 70 | 39(55.71) | 31(44.29) | ||
| 女性 | 62 | 41(66.13) | 21(33.87) | ||
| 年龄(岁) | 0.398 | 0.715 | |||
| ≤50 | 60 | 34(56.67) | 26(43.33) | ||
| >50 | 72 | 46(63.89) | 26(36.11) | ||
| 肝功能(Child-Pugh分级) | 0.422 | 0.644 | |||
| A级 | 73 | 41(56.20) | 32(43.80) | ||
| B级+C级 | 59 | 29(49.15) | 30(50.85) | ||
| 合并肝硬变 | 0.601 | 0.274 | |||
| 是 | 75 | 44(58.67) | 31(41.33) | ||
| 否 | 57 | 36(63.16) | 21(36.84) | ||
| 肝炎病毒感染 | 0.468 | 0.526 | |||
| 是 | 71 | 41(58.57) | 30(41.43) | ||
| 否 | 61 | 39(63.93) | 22(36.07) | ||
| 肿瘤部位 | 0.517 | 0.420 | |||
| 左肝 | 63 | 40(63.49) | 23(46.51) | ||
| 右肝 | 69 | 40(57.97) | 29(42.03) | ||
| 肿瘤数量 | 0.029 | 0.864 | |||
| 单发 | 84 | 53(63.10) | 31(36.90) | ||
| 多发 | 48 | 31(64.60) | 17(35.40) | ||
| 肿瘤体积(cm) | 0.014 | 6.009 | |||
| ≤5 | 52 | 25(48.10) | 27(51.90) | ||
| >5 | 80 | 54(67.50) | 26(32.50) | ||
| 肿瘤等级(分化) | 0.005 | 7.977 | |||
| 高分化 | 29 | 13(44.83) | 16(55.17) | ||
| 中或低度分化 | 103 | 75(72.80) | 28(27.20) | ||
| 转移 | 0.039 | 4.256 | |||
| 是 | 68 | 47(69.12) | 21(30.88) | ||
| 否 | 64 | 33(51.56) | 31(48.44) | ||
| 静脉侵袭 | 0.002 | 9.369 | |||
| + | 70 | 51(72.86) | 19(27.14) | ||
| - | 62 | 29(46.77) | 33(53.23) | ||
| 卫星灶损害 | 0.010 | 6.560 | |||
| + | 69 | 49(72.01) | 20(27.99) | ||
| - | 63 | 31(49.21) | 32(50.79) | ||
| TNM分期 | 0.005 | 8.054 | |||
| Ⅰ+Ⅱ | 49 | 22(44.90) | 27(54.10) | ||
| Ⅲ+Ⅳ | 83 | 58(69.88) | 25(30.12) | ||
| AFP(ng/mL) | 0.944 | 0.005 | |||
| ≤400 | 33 | 21(63.64) | 12(36.36) | ||
| >400 | 99 | 68(68.69) | 40(31.31) | ||
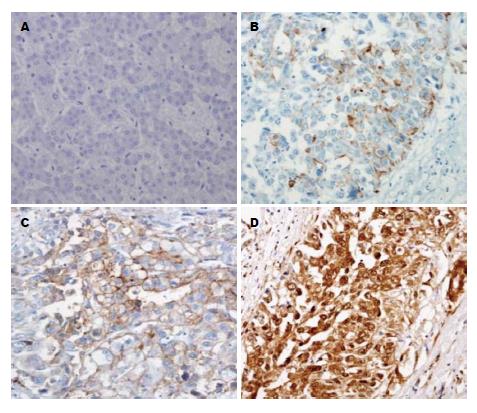
2.2.1 Notch1的qRT-PCR及免疫组织化学染色结果: qRT-PCR结果显示HCC组织中转移组的Notch1表达水平高于非转移组(P = 0.008), 癌旁组织(P = 0.001)及正常肝组织(P<0.001), 非转移组的Notch1表达水平高于癌旁组织(P = 0.011)及正常肝组织(P = 0.006), 差异均有统计学意义(图1B). 免疫组织化学染色结果显示Notch1阳性染色主要存在于细胞膜中, 呈棕色、棕黄色颗粒样, 细胞浆中仅有少量表达. 在132例HCC组织中, 26例(19.70%)阴性表达(图2A), 34例(25.76%)弱阳性表达(图2B), 37例(28.02%)中等阳性表达(图2C), 35例(26.52%)强阳性表达(图2D); 染色结果低表达者60例(45.45%), 高表达者72例(54.55%). Notch1在癌旁组织及正常肝组织中, 35例(26.52%)染色显示为弱阳性, 其余均为阴性, 且染色结果均为低表达.
2.2.2 Notch1与临床病理指标: Notch1在HCC组织中的表达与患者年龄、性别、肝功能、肿瘤部位、肿瘤体积、是否合并肝硬变及是否伴随肝炎病毒感染及AFP含量无统计学意义(P>0.05), 而与肿瘤数量、肿瘤分化等级、转移情况、静脉侵袭、卫星状损害及TNM分期有统计学意义(P<0.05), 并且随着HCC病理分级的增高而增高(P<0.05)(表2).
| 临床病理因素 | n | Notch1 | P值 | χ2 | |
| 低表达(0-4分) | 高表达(5-12分) | ||||
| 性别 | 0.210 | 1.572 | |||
| 男性 | 70 | 33(47.10) | 37(52.90) | ||
| 女性 | 62 | 36(58.10) | 26(41.90) | ||
| 年龄(岁) | 0.055 | 3.682 | |||
| ≤50 | 60 | 31(51.70) | 29(48.30) | ||
| >50 | 72 | 49(68.10) | 23(31.90) | ||
| 肝功能(Child-Pugh分级) | 0.124 | 2.370 | |||
| A级 | 73 | 48(65.80) | 25(34.20) | ||
| B级+C级 | 59 | 31(52.50) | 28(47.50) | ||
| 合并肝硬变 | 0.214 | 1.543 | |||
| 是 | 75 | 39(52.00) | 36(48.00) | ||
| 否 | 57 | 37(62.70) | 22(37.30) | ||
| 肝炎病毒感染 | 0.748 | 0.104 | |||
| 是 | 71 | 45(63.40) | 26(36.60) | ||
| 否 | 61 | 37(60.70) | 24(39.30) | ||
| 肿瘤部位 | 0.899 | 0.016 | |||
| 左肝 | 63 | 34(54.00) | 29(46.00) | ||
| 右肝 | 69 | 38(55.10) | 31(44.90) | ||
| 肿瘤数量 | 0.029 | 0.864 | |||
| 单发 | 84 | 53(63.10) | 31(36.90) | ||
| 多发 | 48 | 31(64.60) | 17(35.40) | ||
| 肿瘤体积(cm) | 0.002 | 9.265 | |||
| ≤5 | 52 | 36(69.20) | 16(30.80) | ||
| >5 | 80 | 33(41.25) | 47(58.75) | ||
| 肿瘤等级(分化) | 0.000 | 18.876 | |||
| 高分化 | 29 | 23(79.30) | 6(20.70) | ||
| 中或低度分化 | 103 | 35(34.00) | 68(66.00) | ||
| 转移 | 0.001 | 11.565 | |||
| 是 | 68 | 39(57.40) | 29(42.60) | ||
| 否 | 64 | 54(84.40) | 10(15.60) | ||
| 静脉侵袭 | 0.009 | 6.894 | |||
| + | 70 | 39(55.70) | 31(44.30) | ||
| - | 62 | 48(77.40) | 14(22.60) | ||
| 卫星灶损害 | 0.043 | 4.111 | |||
| + | 69 | 45(65.20) | 24(34.80) | ||
| - | 63 | 51(81.00) | 12(19.00) | ||
| TNM 分期 | 0.009 | 6.854 | |||
| Ⅰ+Ⅱ | 49 | 25(51.00) | 24(49.00) | ||
| Ⅲ+Ⅳ | 83 | 61(73.50) | 22(26.50) | ||
| AFP (ng/mL) | 0.686 | 0.163 | |||
| ≤400 | 33 | 19(57.60) | 14(42.40) | ||
| >400 | 99 | 53(53.50) | 46(46.50) | ||
应用qRT-PCR、免疫组织化学染色方法检测HCC及癌旁组织标本中microRNA-34a、Notch1, 如文献报道我们将Notch1评分值5作为分界值将患者分成两组, 其中Notch1值低患者26例(19.7%), 较高患者106例(80.3%). 分析发现microRNA-34a 与Notch1在HCC及癌旁组织中均成负相关, 相关系数分别为-0.259(P = 0.003)、-0.274(P = 0.002)(表3, 4).
| 变量 | MicroRNA-34a | P值 | r值 | |
| 高表达 | 低表达 | |||
| Notch1 | 0.003 | -0.259 | ||
| 高表达 | 32 | 74 | ||
| 低表达 | 16 | 10 | ||
| 变量 | MicroRNA-34a | P值 | r值 | |
| 高表达 | 低表达 | |||
| Notch1 | 0.002 | -0.274 | ||
| 高表达 | 9 | 18 | ||
| 低表达 | 70 | 35 | ||
入组患者的随访时间1-36 mo, 平均随访时间17 mo, 中位随访时间10.2 mo. 对132例肝癌患者的生存资料进行Kaplan-Meier分析显示: microRNA-34a低表达、Notch1高表达者3年生存率为11.3%, 平均生存时间为9.7 mo, 中位生存时间为7.4 mo; microRNA-34a高表达、Notch1低表达者3年生存率为34.7%, 平均生存时间为19.4 mo, 中位生存时间为13.7 mo. microRNA-34a低表达、Notch1高表达者生存时间较后者明显降低, 差异具有统计学意义(χ2 = 38.163, P = 0.011)(图3).
HCC是成年人常见恶性肿瘤, 恶性程度高, 极易转移和复发, 预后一直较差[21], 诊断后存活率常少于1年. 虽然随着手术(包括同种异体肝脏移植术)技术的日新月异、现代高清影像技术的普遍推广[22]和非手术治疗方式的广泛认可与普及, 其治疗效果已明显改善, 但均未能达到医患双方预期的疗效. 现临床上多依靠肿瘤分化程度、TNM分期、是否转移等病理指标进行预后判断及实施后续治疗. 同时, 以AFP、组织多肽抗原(tissue polypeptide antigen, TPA)、α-L-岩藻糖苷酶(α-L-fucosidase, AFU)为代表的肿瘤标志物所进行的早期诊断亦不能十分准确, 对预后判断存在局限性[23]. 目前暂未发现满足临床需求的敏感、特异、简便、易测的HCC标志物. 因此, 在分子水平寻求HCC的标志物, 以预测患者预后、指导临床治疗的指标业已成为目前医学科学研究的热点.
mRNA基因大多位于染色体某些脆性位点或杂合子缺失区域, 可以参与细胞的增殖、分化及凋亡的调节, 与肿瘤、银屑病和糖尿病等疾病的发生、发展密切相关[24,25], 但具体作用机制不明. 其中, 作为p53的直接转录靶标, microRNA-34a可下调多种细胞周期相关基因[26], 具有调节细胞周期、抑制细胞生长等作用[13]. 在人类多种肿瘤中microRNA-34a表达异常, 如胰腺癌、乳腺癌、非小细胞肺癌中microRNA-34a表达缺失或低表达, 与肿瘤的发生、发展、侵袭、转移等生物功能密切相关, 发挥着癌基因或抑癌基因的作用. Pang等[14]发现非小细胞型肺癌组织中miR-34家族的高表达降低了肿瘤的发生, miR-34基因表达恢复能抑制非小细胞型肺癌细胞生长. Welch等[8]研究发现microRNA-34a基因经常在儿童神经母细胞瘤中缺失, 试验提高microRNA-34a表达能抑制肿瘤细胞增殖, 同时激活细胞凋亡途径. 我们的试验同样显示HCC组织中microRNA-34a表达水平明显低于癌旁组织及正常肝组织, 转移性癌组织低于非转移性癌组织; 同时其表达与肿瘤数量、肿瘤分化等级、转移情况、静脉侵袭、卫星状损害及TNM分期相关, 随着HCC病理分级的增高而减低, 提示microRNA-34a可能在肝癌的发生、发展中起到了抑制作用.
Notch是在进化过程中结构具有高度保守性的一种生物信号通路, 在诸如正常细胞的分化、发育、增殖、凋亡、黏附, 及恶性肿瘤细胞的侵袭、迁移、血管形成、致癌作用等方面都起着重要的调节作用, 保持细胞增殖、分化和凋亡之间的动态平衡. 失控的Notch信号与肿瘤细胞的生长相关, 异常活化Notch信号可促使正常细胞向恶性转化. Notch信号在多数情况下作为癌基因促进肿瘤生长, 我们实验室前期的研究[27]表明高表达的Notch1与HCC进展及患者预后不良是密切相关的. 已有试验研究[28,29]显示Notch1通过调节Snail蛋白(snail protein, Snail)、E-钙黏连蛋白(E-cadherin, EC)、金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)、MMP-9和血管内皮生长因子(vascular endothelial growth factor, VEGF), 进而影响HCC细胞的侵袭和迁移能力. 同时, 这些试验证据也支持了在HCC细胞中下调Notch1, 肿瘤细胞的侵袭和迁移能力被抑制的事实. 我们试验中同样表现出相似结果, HCC组织中Notch1表达水平明显高于癌旁组织及正常肝组织, 转移性癌组织高于非转移性癌组织. 提示Notch1可能在肝癌的发生、发展中起到了促进作用.
但是这两者在肝癌中又是怎样的关系尚需进一步研究. 既往研究提示在前列腺癌中microRNA-34a几乎均为低表达, 同时引起有助于前列腺癌发展和增殖的Notch1上调. 引入过表达microRNA-34a可以导致Notch1表达降低, 同时显著地抑制了前列腺癌细胞系的生长和自我更新能力[30]. 所以, 在前列腺癌中Notch1是microRNA-34a的直接靶标, 并且microRNA-34a表达减低与前列腺癌袭能力是相关的. Ji等[31]对于胰腺癌的研究表明: microRNA-34a通过直接调控下游靶标Notch1/2, 参与了胰腺癌干细胞的自我更新和凋亡, 试验恢复microRNA-34a表达水平, 有望成为缺失或低表达p53-miR34的胰腺癌患者新的治疗方法. 为探讨microRNA-34a与Notch1在肝癌中的关系, 我们分析了所得结果, 发现microRNA-34a与North1在HCC及癌旁组织中均成负相关, 生存分析显示microRNA-34a低表达、Notch1高表达者生存时间较microRNA-34a高表达、Notch1低表达者明显降低, 与上述试验结论是非常吻合的. 所以, 我们认为Notch1可能是microRNA-34a的下游靶标, microRNA-34a可能通过抑制Notch1的表达来抑制肝癌的发生和发展过程. 但尚需通过体外实验进一步验证, Notch1是否直接受microRNA-34a的调控.
总之, microRNA-34a和Notch1在HCC组织中表达情况及其与临床病理特征、预后的关系提示两者可能同时影响着HCC的发生、发展过程, 并且microRNA-34a与Notch1呈现出负相关的调控作用. 因此, microRNA-34a、Notch1也可能成为HCC早期诊断的分子标志物、潜在的治疗靶点及预后预测因子, 但是关于两者在肝癌中具体的作用机制尚待进一步研究.
中国人民解放军第四军医大学附属西京医院肝胆胰脾外科实验室的张福琴老师、李侠老师及细胞工程研究中心李郁副教授对于本研究课题和试验小组的技术支持及倾力帮助.
MicroRNAs是一类内生的、长度约为18-25个核苷酸的小RNA, 具有多种重要的调节作用. 每个miRNA可以有多个靶基因, 在生物胚胎发育和肿瘤形成等生理或病理发展过程中发挥其重要作用. Notc信号系统在多种肿瘤中异常表达, 他与肿瘤的发生、发展过程也密切相关. 在肝癌中二者的共同表达和作用情况尚无报道, 故此项研究会对肝癌相关分子机制的进一步认识产生积极影响.
李孟森, 教授, 海南医学院/海南省肿瘤发生和干预重点实验室
MicroRNAs和Notch信号系统的表达与多种肿瘤密切相关, 其中microRNA10b、-93、-122、-224、-337等在肝癌中均呈异常表达, 与恶性肿瘤的生物学特征及患者生存周期存在着非常密切的联系, 直接影响着疾病的转归. MicroRNA-34a和Notch1在恶性胶质瘤、膀胱癌、乳腺癌等恶性肿瘤中均呈低表达, 与肿瘤的发生、发展、侵袭、转移相关.
在浸润性膀胱癌细胞系中miR-34a可与Notch1结合, 靶向抑制Notch1基因表达, 从而导致Notch1信号通路活化, 异常活化的Notch1信号通路可与多个信号通路相互作用, 影响浸润性膀胱癌细胞系的增殖、迁移等生物学行为.
本文拟通过试验提出在肝癌的中microRNA-34a呈现低表达, Notch1呈现高表达, 他们可能在肿瘤的发生、发展过程中起到了逆向协同作用. 两者可能成为肝癌新的分子标志物.
应用分子生物学相关技术可靠检测肝癌中microRNA-34a和Notch1的共同表达情况, 以后有望可以成为常规的临床肿瘤检测手段, 使其成为早期诊断标志物、潜在的治疗靶点及预后预测因子.
本文通过严格的试验设计、合理的试验方法、科学的检测手段, 联合检测了microRNA-34a和Notch1两种分子, 较之日常检测某一种肿瘤相关分子, 获得了更加丰富的试验数据, 结论分析可靠, 理论推理充分, 具有较好的基础研究特点, 对临床开展肿瘤防治工作可以产生一定的指导性意义.
编辑 郭鹏 电编 鲁亚静
| 4. | Huang YS, Dai Y, Yu XF, Bao SY, Yin YB, Tang M, Hu CX. Microarray analysis of microRNA expression in hepatocellular carcinoma and non-tumorous tissues without viral hepatitis. J Gastroenterol Hepatol. 2008;23:87-94. [PubMed] [DOI] |
| 5. | Midorikawa Y, Makuuchi M, Tang W, Aburatani H. Microarray-based analysis for hepatocellular carcinoma: from gene expression profiling to new challenges. World J Gastroenterol. 2007;13:1487-1492. [PubMed] |
| 6. | Marnila P, Rokka S, Rehnberg-Laiho L, Kärkkäinen P, Kosunen TU, Rautelin H, Hänninen ML, Syväoja EL, Korhonen H. Prevention and suppression of Helicobacter felis infection in mice using colostral preparation with specific antibodies. Helicobacter. 2003;8:192-201. [PubMed] [DOI] |
| 7. | Guessous F, Zhang Y, Kofman A, Catania A, Li Y, Schiff D, Purow B, Abounader R. microRNA-34a is tumor suppressive in brain tumors and glioma stem cells. Cell Cycle. 2010;9:1031-1036. [PubMed] [DOI] |
| 8. | Welch C, Chen Y, Stallings RL. MicroRNA-34a functions as a potential tumor suppressor by inducing apoptosis in neuroblastoma cells. Oncogene. 2007;26:5017-5022. [PubMed] [DOI] |
| 10. | 姚 志勇, 张 超, 马 鑫, 朱 鸣阳, 张 瑜, 史 涛平, 司马 晋, 艾 青, 刘 尚文, 黄 庆波. microRNA-34a靶向抑制Notch-1基因对膀胱癌J82细胞增殖和迁移的影响. 中华泌尿外科杂志. 2012;33:210-214. |
| 11. | 田 智丹, 任 勇亚, 戚 晓红, 冯 振卿. microRNA-34a在结直肠癌中的表达及其临床意义. 临床与实验病理学杂志. 2011;27:347-350. |
| 12. | Tazawa H, Tsuchiya N, Izumiya M, Nakagama H. Tumor-suppressive miR-34a induces senescence-like growth arrest through modulation of the E2F pathway in human colon cancer cells. Proc Natl Acad Sci U S A. 2007;104:15472-15477. [PubMed] [DOI] |
| 13. | Yan K, Gao J, Yang T, Ma Q, Qiu X, Fan Q, Ma B. MicroRNA-34a inhibits the proliferation and metastasis of osteosarcoma cells both in vitro and in vivo. PLoS One. 2012;7:e33778. [PubMed] [DOI] |
| 14. | Pang RT, Leung CO, Ye TM, Liu W, Chiu PC, Lam KK, Lee KF, Yeung WS. MicroRNA-34a suppresses invasion through downregulation of Notch1 and Jagged1 in cervical carcinoma and choriocarcinoma cells. Carcinogenesis. 2010;31:1037-1044. [PubMed] [DOI] |
| 15. | Chang TC, Wentzel EA, Kent OA, Ramachandran K, Mullendore M, Lee KH, Feldmann G, Yamakuchi M, Ferlito M, Lowenstein CJ. Transactivation of miR-34a by p53 broadly influences gene expression and promotes apoptosis. Mol Cell. 2007;26:745-752. [PubMed] [DOI] |
| 16. | Bommer GT, Gerin I, Feng Y, Kaczorowski AJ, Kuick R, Love RE, Zhai Y, Giordano TJ, Qin ZS, Moore BB. p53-mediated activation of miRNA34 candidate tumor-suppressor genes. Curr Biol. 2007;17:1298-1307. [PubMed] [DOI] |
| 17. | Nomura S, Suzuki H, Masaoka T, Kurabayashi K, Ishii H, Kitajima M, Nomoto K, Hibi T. Effect of dietary anti-urease immunoglobulin Y on Helicobacter pylori infection in Mongolian gerbils. Helicobacter. 2005;10:43-52. [PubMed] [DOI] |
| 18. | 张 勇, 王 德盛, 周 亮, 孙 伟, 王 建锋, 韩 炜, 苟 泽鹏, 祝 普利. Notch1在肝细胞癌组织中的表达情况及其临床意义. 中华消化外科杂志. 2013;12:378-382. |
| 19. | 张 超, 姚 志勇, 朱 鸣阳, 史 涛坪, 司马 晋, 马 鑫, 李 宏召, 张 瑜, 张 旭. MicroRNA-34a通过Notch1对膀胱肿瘤细胞株T24增殖的影响. 解放军医学杂志. 2012;37:426-430. |
| 20. | Yu X, Zhang W, Ning Q, Luo X. MicroRNA-34a inhibits human brain glioma cell growth by down-regulation of Notch1. J Huazhong Univ Sci Technolog Med Sci. 2012;32:370-374. [PubMed] [DOI] |
| 21. | Forner A, Llovet JM, Bruix J. Hepatocellular carcinoma. Lancet. 2012;379:1245-1255. [PubMed] [DOI] |
| 23. | Li P, Wang SS, Liu H, Li N, McNutt MA, Li G, Ding HG. Elevated serum alpha fetoprotein levels promote pathological progression of hepatocellular carcinoma. World J Gastroenterol. 2011;17:4563-4571. [PubMed] [DOI] |
| 24. | Li W, Lebrun DG, Li M. The expression and functions of microRNAs in pancreatic adenocarcinoma and hepatocellular carcinoma. Chin J Cancer. 2011;30:540-550. [PubMed] [DOI] |
| 25. | Calin GA, Ferracin M, Cimmino A, Di Leva G, Shimizu M, Wojcik SE, Iorio MV, Visone R, Sever NI, Fabbri M. A MicroRNA signature associated with prognosis and progression in chronic lymphocytic leukemia. N Engl J Med. 2005;353:1793-1801. [PubMed] [DOI] |
| 27. | Zhou L, Zhang N, Li QJ, Sun W, Zhang Y, Wang DS, Dou KF. Associations between high levels of Notch1 expression and high invasion and poor overall survival in hepatocellular carcinoma. Tumour Biol. 2013;34:543-553. [PubMed] |
| 28. | Zhou L, Wang DS, Li QJ, Sun W, Zhang Y, Dou KF. The down-regulation of Notch1 inhibits the invasion and migration of hepatocellular carcinoma cells by inactivating the cyclooxygenase-2/Snail/E-cadherin pathway in vitro. Dig Dis Sci. 2013;58:1016-1025. [PubMed] [DOI] |
| 29. | Zhou L, Wang DS, Li QJ, Sun W, Zhang Y, Dou KF. Downregulation of the Notch signaling pathway inhibits hepatocellular carcinoma cell invasion by inactivation of matrix metalloproteinase-2 and -9 and vascular endothelial growth factor. Oncol Rep. 2012;28:874-882. [PubMed] [DOI] |
| 30. | Kashat M, Azzouz L, Sarkar SH, Kong D, Li Y, Sarkar FH. Inactivation of AR and Notch-1 signaling by miR-34a attenuates prostate cancer aggressiveness. Am J Transl Res. 2012;4:432-442. [PubMed] |