修回日期: 2014-03-23
接受日期: 2014-04-03
在线出版日期: 2014-05-18
目的: 制备抗幽门螺杆菌(Helicobacter pylori, H. pylori)菌毛蛋白FlaA卵黄免疫球蛋白(yolk immunoglobulin, IgY), 并进行体外抑菌实验, 为治疗H. pylori口服药物的研发奠定基础.
方法: 采用原核表达制备的FlaA蛋白, 将重组FlaA菌毛蛋白免疫蛋鸡获取FlaA IgY, 采用间接ELISA的方法检测FlaA IgY的效价. 通过将其与肠道中常见菌群乳酸杆菌、双歧杆菌、大肠杆菌进行抗体抗原结合反应, 检测其是否与肠道中其他菌群存在交叉反应. 评价0.1、1、5 mg/mL低、中、高3种不同浓度的FlaA IgY的体外抑菌实验效果.
结果: 纯化后的FlaA蛋白浓度为2.97 mg/mL. 经重组FlaA IgY免疫制备IgY在第3次免疫1 wk后效价可达到1:12800, 特异性检测结果显示, FlaA IgY不与肠道中常见菌发生交叉反应, 与H. pylori全菌和重组FlaA反应强烈. 体外抑菌结果显示, 0.1、1、5 mg/mL的FlaA IgY处理后的H. pylori菌液浓度与对照组菌液浓度相比具有显著差异(0.324±0.033, 0.078±0.012, 0.014±0.003 vs 0.539±0.023, P<0.01), 表明低、中、高3组浓度的FlaA IgY均能一定程度的抑制H. pylori的生长. 0.1 mg/mL IgY的抑菌作用主要表现在1-6 h之间, 6 h后抑菌作用基本丧失. 1 mg/mL FlaA IgY处理组的H. pylori在1-24 h之间生长较为缓慢, 5 mg/mL FlaA IgY处理组菌液浓度在1-24 h之间基本无变化. 108 CFU/mL H. pylori经3组不同浓度FlaA IgY处理24 h后, 低IgY浓度组菌液浓度与其余2组菌液浓度相比差异显著(0.078±0.012, 0.014±0.003 vs 0.324±0.033, P<0.01), 5 mg/mL FlaA IgY在24 h内能彻底抑制H. pylori的生长.
结论: 制备的FlaA IgY效价较高, 特异性强, 不与肠道常见菌群发生交叉反应. 5 mg/mL的FlaA IgY在体外对H. pylori具有很强的抑制作用.
核心提示: 采用重组幽门螺旋杆菌(Helicobacter pylori, H. pylori)菌毛蛋白FlaA为免疫抗原制备卵黄抗体, 该卵黄抗体效价高, 特异性强, 不会与肠道常见菌群发生交叉反应, 在体外能有效抑制H. pylori的生长.
引文著录: 彭姣, 卢超, 祁振强, 张国海. 幽门螺杆菌菌毛蛋白FLaA IgY的制备及体外抑菌实验. 世界华人消化杂志 2014; 22(14): 1936-1942
Revised: March 23, 2014
Accepted: April 3, 2014
Published online: May 18, 2014
AIM: To evaluate the in vitro antibacterial activity of anti-Helicobacter pylori (H. pylori) FlaA IgY.
METHODS: Recombinant H. pylori FlaA was prepared by prokaryotic expression and used to immunize hens. Anti-FlaA IgY was purified and IgY titer was determined by ELISA. The antibody was then tested to check if there was any cross-reaction with the common intestinal flora like Lacticacid bacteria, Bifidobacterium and Escherichia coli. The antibacterial activity of different concentrations of anti-H. pylori FlaA IgY (0.1, 1 and 5 mg/mL) was finally determined.
RESULTS: The concentration of purified FlaA protein was 2.97 mg/mL, and the titer of anti-FlaA IgY was 1:12800 three weeks after immunization. Anti-FlaA IgY did not react with the common intestinal flora, but reacted well with H. pylori and FlaA protein. In vitro results showed that there were significant differences (P < 0.01) in the H. pylori concentrations between the control group and the groups treated with 0.1, 1, or 5 mg/mL FlaA IgY, indicating that FlaA IgY of various concentrations could inhibit the growth of H. pylori in a certain degree. The antibacterial activity of 0.1 mg/mL FlaA IgY was mainly present between 1 and 6 h, and was mostly lost after 6 h. The growth of H. pylori treated with 1 mg/mL FlaA IgY was relatively slow, and the bacterial concentration of the group treated with 5 mg/mL FlaA IgY did not alter significantly between 1 and 24 h. After 108 CFU/mL H. pylori was treated with three different doses (0.1, 1, 5 mg/mL) of FlaA IgY for 24 h, a significant difference in bacterial concentration was observed between the low dose group and the other two groups (P < 0.01). Anti-FlaA IgY at 5 mg/mL could completely inhibit the growth of H. pylori.
CONCLUSION: High-titer anti-FlaA IgY can specifically react with H. pylori, and has no cross-reaction with the common intestinal flora. Anti-FlaA IgY at 5 mg/mL has a strong inhibitory effect on the growth of H. pylori.
- Citation: Peng J, Lu C, Qi ZQ, Zhang GH. In vitro bacteriostatic activity of IgY against recombinant Helicobacter pylori FlaA protein. Shijie Huaren Xiaohua Zazhi 2014; 22(14): 1936-1942
- URL: https://www.wjgnet.com/1009-3079/full/v22/i14/1936.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i14.1936
幽门螺旋杆菌(Helicobacter pylori, H. pylori)是一种革兰氏阴性菌, 被证实与慢性萎缩性胃炎、十二指肠溃疡、胃腺癌和胃黏膜相关性淋巴组织淋巴瘤的发生有关, 此外, H. pylori还与全身多系统疾病的发病密切相关[1], 目前成功治疗和根除H. pylori需要复合抗生素治疗, 如甲硝唑、阿莫西林、克拉霉素、铋剂以及质子泵抑制剂(proton pump inhibitors)等[2-4]. 虽然抗生素能够成功治疗H. pylori的感染, 但耐药性H. pylori的产生使得这类治疗方案存在着一定失败几率, 患者复发率高, H. pylori耐药性日趋严重, 不同国家和地区其耐药率和耐抗生素种类常存在很大差别, 由于耐药性导致的H. pylori复发率能高达40%[5]. 有研究表明, 对小鼠模型采用特异性抗体进行H. pylori的控制和治疗能取得良好的治疗效果[6,7]. 尽管H. pylori的致病多样性机制尚未完全清楚, H. pylori的毒力因子也很多, 但H. pylori必须首先定植于人胃黏膜才能进一步发挥作用, 鞭毛在H. pylori的定植和移动中起重要作用, 并存在于所有H. pylori中. 对豚鼠模型胃黏膜H. pylori定植情况的研究表明, 鞭毛不仅是H. pylori在胃黏膜中的定植因子, 也是毒力因子[8]. 鞭毛蛋白由FlaA和FlaB 2个亚基组成, 其中FlaA具有更为重要的致病性和免疫性[9]. 采用口服特异性抗体能够有效的抑制肠道感染和多种消化系病原体[10,11]. 卵黄免疫球蛋白(yolk immunoglobulin, IgY)是一种禽类抗体, 目前已有大量应用实例证明IgY可用于疾病的预防和治疗[12]. 口服卵黄免疫球蛋白被证实能用于肠道感染的治疗, 且效果显著[13], 此外, IgY具有提取量大、廉价易获取等优点. 本研究对以重组的H. pylori FlaA菌毛蛋白为抗原免疫蛋鸡获取特异性卵黄免疫球蛋白, 对获得的重组FlaA IgY的效价、免疫原性、特异性以及体外抑菌实验进行了研究.
H. pylori标准株购自北京中原公司, pET-32a-flaA由本公司分子生物学实验室构建和保存. 低分子量蛋白Marker购自北京索莱宝科技有限公司, IPTG购自上海源叶生物科技有限公司, 布氏肉汤培养基购自上海信裕生物科技有限公司, NTA亲和层析柱购自QIAGEN, 弗氏完全佐剂及弗氏不完全佐剂购自Sigma, HRP-羊抗鸡IgY购自艾美捷科技有限公司, TMB单组份显色液购自碧云天, H. pylori检测试剂盒(脲酶法)购自上海卒瑞生物科技有限公司. SPF来亨鸡, 4只, 105日龄, 体质量1.5-1.6 kg, 由本公司自行孵化培育.
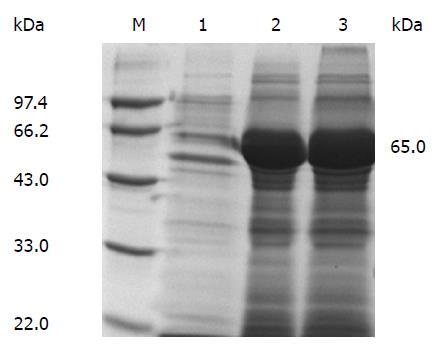
1.2.1 重组蛋白表达: 将本实验室构建并经验证的pET-32a-FlaA转化至BL21(DE3), 同时以pET-32a空质粒转化BL21(DE3)为对照, 同时用0.4 mmol/L IPTG诱导4 h. 收集菌液, 4 ℃10000 g离心5 min, 弃去上清, 沉淀用0.01 mol/L的PBS清洗3次后, 加入10 mL 0.01 mol/L PBS重悬后经超声波破碎, 12000 g离心10 min后分别取上清和沉淀, 用12%SDS-PAGE检测表达结果, 以NTA亲和层析法(BBST)按照产品说明书收集目的蛋白, 12%SDS-PAGE分析纯度, 双紫外法测定蛋白浓度, -20 ℃保存备用.
1.2.2 免疫: 选择150日龄SPF来亨蛋鸡4只, 按每只蛋鸡300 μg蛋白量接种, 将纯化的重组FlaA和等量弗氏佐剂混合乳化, 分胸肌4点注射. 首次免疫采用弗氏完全佐剂乳化抗原, 第14天进行第2次免疫, 免疫佐剂为弗氏不完全佐剂, 第30天进行第3次免疫, 免疫方式同第2次. 第3次免疫结束后1 wk收集鸡蛋, 4 ℃保存备用.
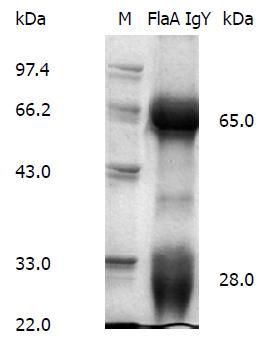
1.2.3 FlaA IgY的分离提取: 采用硫酸铵法两步法纯化提取FlaA IgY. 将卵黄无菌分离后, 以1:9的比例加入pH 5.0的醋酸-醋酸钠缓冲液, 搅拌20 min后4 ℃静置过夜. 10000 g离心20 min, 上清加入饱和硫酸铵至终浓度为40%, 静置6 h后离心, 10000 g离心20 min, 沉淀用PBS重悬, 加入饱和硫酸铵至终浓度为40%, 静置过夜后10000 g离心20 min, 沉淀用0.01 mol/L的PBS重悬后透析过夜, 经0.22 μm滤膜过滤除菌, 用双紫外法测定纯化的IgY浓度, 经SDS-PAGE检测IgY纯度, -20 ℃保存.
1.2.4 ELISA检测FlaA IgY的效价: 以方阵滴定法确定ELISA的最佳抗原包被浓度为10 μg/mL, 酶标二抗工作浓度为1:3000. 将重组FlaA用包被液稀释至为10 μg/mL, 包被96孔酶标板. 4 ℃过夜后37 ℃封闭1 h, 依次加入稀释度为1:800, 1:1600, 1:3200, 1:6400, 1:12800, 1:25600, 1:51200的IgY, 每个稀释度重复一组, 37 ℃温育1 h后加入1:3000稀释的HRP-羊抗鸡IgY, 37 ℃温育1 h后TMB显色15 min. 阴性对照为未经免疫的鸡蛋提取的IgY, 酶标仪读取A450, 检测样品A450值/阴性对照A450(P/N)大于2.1为阳性.
1.2.5 FlaA IgY特异性检测: 采用建立的间接ELISA方法检测重组FlaA IgY的特异性, 以肠胃中常见的乳酸杆菌、双歧杆菌、大肠杆菌以及H. pylori经0.4%甲醛灭活后与重组FlaA分别包被酶标板, 使得各组包被蛋白浓度为10 μg/mL, 将FlaA IgY以1:500的稀释度稀释, 同时以未经免疫的IgY为对照, 采用1.2.4中的方法进行检测.
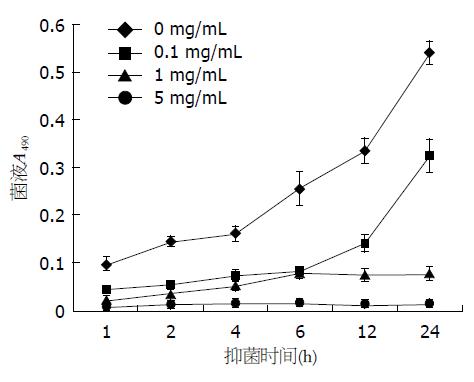
1.2.6 FlaA IgY体外抑菌实验: 调整新培养的H. pylori菌液浓度至108 CFU/mL. 取-20 ℃保存的已除菌的重组FlaA IgY, 重新测定浓度. 用无菌布氏肉汤将FlaA IgY稀释后按等体积比例加入H. pylori菌液, 使得FlaA IgY的终浓度为0.1、1、5 mg/mL. 将菌液和不同浓度的FlaA IgY混合均匀后按照H. pylori培养条件培养, 另以不加FlaA IgY为对照, 分别于1、2、4、6、12、24 h取1 mL培养液稀释至3 mL后测定培养液的A490值, 并取10 μL培养液涂布培养. 对比分析各组结果.
统计学处理 计量资料采用mean±SD表示, 采用SPSS19.0统计学软件进行统计学处理组内的比较采用单因素方差分析, 组间比较采用独立样本t检验, P<0.05为差异具有统计学意义.
构建的pET-32a-flaA-BL21(DE3)经0.4 mmol/L IPTG诱导4 h, 诱导结果采用12%SDS-PAGE检测. 电泳检测结果显示在相对分子量66 kDa处可见明显融合蛋白条带. 表达产物主要存在于超声破碎离心后的沉淀中(图1). 用NTA亲和层析法纯化目的蛋白, 经双紫外法测定的蛋白浓度为2.97 mg/mL.
将FlaA免疫蛋鸡, 经3次免疫后收集鸡蛋, 采用硫酸铵两步沉淀法制备IgY. 经双紫外法测定的IgY浓度为: 7.92 mg/mL. 12%SDS-PAGE检测IgY纯化效果. 结果如图2所示, 在66 kDa和30 kDa左右处可见蛋白带, 且无明显杂带, 纯化效果较好. 采用间接ELISA法以重组FlaA蛋白包被酶标板检测纯化后的FlaA IgY效价, 结果显示经3次免疫1 wk后的FlaA IgY效价为1:12800.
以肠道中常见的细菌为检测对象, 检测FlaA IgY是否会与肠道中的其他细菌发生交叉反应, 以H. pylori全菌和重组的FlaA为对照, 参照建立的间接ELISA方法进行检测, 以阴性对照的A450的平均值为0.080, 以P/N大于2.1计算, 当检测孔A450值大于0.169时即判断为阳性. 结果显示只有H. pylori和重组蛋白FlaA的检测结果为阳性, 其余抗原检测结果均为阴性. 这表明FlaA IgY具有很好的特异性, 不会与肠道中的某些益生菌和中性菌发生交叉反应(表1).
| 包被抗原 | 乳酸杆菌 | 双歧杆菌 | 大肠杆菌 | 幽门螺杆菌 | 重组FlaA | |
| A450 | FlaA IgY | 0.113 | 0.102 | 0.107 | 1.283 | 1.289 |
| 阴性IgY | 0.087 | 0.073 | 0.085 | 0.083 | 0.074 |
3组不同浓度FlaA IgY的抑菌结果如表2, 对抑菌结果进行分析可知, 与对照组相比, 经高、中、低3种浓度FlaA IgY 24 h处理后的H. pylori的菌液A490值存在显著差异(0.324±0.033, 0.078±0.012, 0.014±0.003 vs 0.539±0.023, P<0.01), 结果表明所有浓度的FlaA IgY均能一定程度抑制H. pylori的生长, 且这种抑制作用随着FlaA IgY浓度的增加而加强. 对高、中、低3组不同浓度FlaA IgY处理组之间的抑菌结果进行分析显示, 1、5 mg/mL IgY抑菌效果与0.1 mg/mL IgY抑菌效果存在显著差异(0.078±0.012, 0.014±0.003 vs 0.324±0.033, P<0.01), 0.1 mg/mL和1 mg/mL浓度的FlaA IgY与对照相比虽然也具有一定的抑菌效果, 但不能完全抑制H. pylori的生长. 0.1 mg/mL IgY的抑菌作用主要表现在1-6 h之间, 此时菌液浓度变化较缓慢, 6 h后H. pylori菌液浓度急剧上升, 表明6 h后0.1 mg/mL IgY的抑菌作用基本丧失, 1 mg/mL的FlaA IgY处理后的H. pylori在6 h后生长较为缓慢, 5 mg/mL FlaA IgY组的H. pylori在1-24 h之间菌液浓度基本在较低水平不变(图3). 在各监测时间点采样进行菌落培养, 结果显示当FlaA IgY浓度达到5 mg/mL时, 能完全抑制H. pylori的生长, 其在各时间段的采样培养H. pylori菌落数为0, 对H. pylori的抑制作用能表现在整个实验过程中, 而其他两个浓度组各时间段培养物均有若干菌落, 这与菌液A490检测结果相符(表3). FlaA IgY的抑菌实验结果表明FlaA IgY具有较高的抑菌活性, 能明显抑制H. pylori的生长, 其中5 mg/mL的FlaA IgY在24 h内对H. pylori的生长具有完全的抑制作用.
| FlaA IgY浓度(mg/mL) | 不同取样时间A490值 | |||||
| 1 h | 2 h | 4 h | 6 h | 12 h | 24 h | |
| 0 | 0.096 | 0.144 | 0.161 | 0.254 | 0.336 | 0.539 |
| 0.1 | 0.042 | 0.053 | 0.073 | 0.080 | 0.140 | 0.324 |
| 1 | 0.020 | 0.035 | 0.051 | 0.078 | 0.075 | 0.077 |
| 5 | 0.006 | 0.013 | 0.013 | 0.015 | 0.012 | 0.014 |
| IgY浓度(mg/mL) | 1 h | 2 h | 4 h | 6 h | 12 h | 24 h |
| 0 | >108 | >108 | >108 | >108 | >108 | >108 |
| 0.1 | 135 | 175 | 263 | 497 | 1897 | 32869 |
| 1 | 56 | 73 | 164 | 271 | 256 | 269 |
| 5 | 0 | 0 | 0 | 0 | 0 | 0 |
H. pylori的毒力因子主要包括细胞空泡毒素(vacuolating cytotoxin A, VacA)、细胞毒素相关蛋白(cytotoxin associated gene A, CagA)、黏附素、尿素酶、黏液酶、酯酶和凝脂酶、脂多糖、醇脱氢酶等7种[14]. 虽然所有的H. pylori都含有VacA基因, 但只有50%的菌株能分泌有活性的细胞毒素, 只有60%的H. pylori菌株含有CagA基因[15]. 尽管H. pylori的致病多样性机制尚未完全清楚, H. pylori的毒力因子也很多, 但H. pylori必须首先定植于人胃黏膜才能进一步发挥作用, 鞭毛在H. pylori的定植和移动中起重要作用, 并存在于所有H. pylori中, 对豚鼠模型胃黏膜H. pylori定植情况的研究表明, 鞭毛不仅是H. pylori在胃黏膜中的定植因子, 也是毒力因子, 被认为是H. pylori得以在胃内存在并致病的重要因素之一[16], 与H. pylori的定植、持续感染、诱导炎症反应有关[17,18]. FlaA基因序列高度保守, 与其他细菌鞭毛蛋白无抗原交叉, 具有重要的致病性和免疫性[19]. IgY与哺乳动物初乳中的抗体一样, 都是由母体产生, 通过特殊机制从血液中转运而来, 作为预防和治疗的药物, 卵黄抗体具有较高的免疫活性, 可直接与相应抗原产生快速免疫反应, 作为一种天然蛋白, IgY在发挥作用后即可被机体作为营养物质分解吸收, 不会残留有害物质, 没有不良作用[20,21]. 目前已有众多关于抗H. pylori IgY研究的相关报道. Yang等[22]对全菌H. pylori免疫蛋鸡制备的特异性IgY的体外和体内特性研究结果表明, 16 mg/mL的特异性IgY能彻底地抑制H. pylori的生长, 以小鼠为模型的体内试验结果表明, 采用200 mg/kg的IgY口服量可以使得H. pylori的根除率达到75%, 且能有效地缓解小鼠胃部炎症. Shin等[23]的研究也证明了采用全菌制备的抗H. pylori IgY不仅能根除沙鼠胃部H. pylori感染, 还能有效治疗由H. pylori感染导致的胃部炎症. Suzuki等[24]用抗HpU IgY对17例H. pylori阳性但未患病志愿者进行了口服治疗, 经4 wk治疗后, 接受治疗者的脲酶检测值显著下降, 与抗酸剂联合使用能有效地缓解因H. pylori感染引发的胃炎. 此外还有采用重组方法获取H. pylori其他细胞毒力因子如VacA、中性粒细胞激活蛋白(neutrophil activating protein, Nap)等进行蛋鸡免疫制备特异性IgY[25,26], 其中一定浓度的VacA-IgY被证明能完全中和H. pylori菌体蛋白的Hela细胞毒活性[25]. 此外还有将2种H. pylori毒力因子经过分子生物学手段进行融合表达并以此制备相应的IgY, 将其灌胃小鼠, 结果表明了该IgY对小鼠的H. pylori感染具有一定的预防效果[27]. 但后续的研究表明, 全菌H. pylori为抗原制备的IgY除了能特异的识别H. pylori外, 还能与人肠道其他菌群发生交叉反应, 采用H. pylori特异抗原免疫蛋鸡能获得特异性更强的H. pylori IgY[28], 采用CagA和VacA制备的IgY虽然具备特异性更强的优点, 但其只能针对CagA+和VacA+型H. pylori. H. pylori具有2种鞭毛蛋白, FlaA和FlaB, 其中以FlaA在H. pylori的黏附与定植中发挥主要作用[29]. 相较于FlaB, FlaA具有更强的免疫原性和免疫反应性[17], 此外FlaA保守性高, 对东西方H. pylori不同分离株的FlaA特征差异性进行比较结果显示, 东西方菌株间无明显特征性差异[30]. Yan等[31]采用重组的FlaA检测125例H. pylori感染患者血清中H. pylori抗体, 检出率可达98.04%, 用重组FlaA制备的兔抗血清对从98例确诊为H. pylori感染患者体内分离培养的H. pylori进行检测, 检出率为100%, 这也证明了FlaA是一种广泛的H. pylori特异性抗原, 重组FlaA具有良好的免疫原性. 本研究以重组的菌毛蛋白FlaA为抗原免疫蛋鸡获取卵黄免疫球蛋白, 经3次免疫后产生的抗体效价为1:12800. 该抗体能与FlaA以及H. pylori全菌发生免疫结合反应, 表明了FlaA融合蛋白具有较好的免疫原性, 这与Yan等的报道相符[31]. 为研究重组FlaA IgY的特异性, 检测其是否与肠道中常见菌群存在交叉反应, 本实验以肠道中常见的乳酸杆菌、双歧杆菌以及大肠杆菌为包被抗原, 采用间接ELISA检测FlaA IgY是否能与肠胃中常见菌群特别是益生菌群发生交叉反应. 检测结果显示FlaA IgY特异性好, 不会与肠道中的益生菌群以及其他常见细菌发生交叉反应, 这表明当将FlaA IgY用于口服治疗时影响肠胃菌群生态可能性小.
为验证重组FlaA IgY的体外活性, 本研究将纯化的FlaA IgY除菌后按高、中、低3种浓度梯度与H. pylori混匀后培养, 检测在24 h内FlaA IgY对H. pylori的抑菌效果. 3种不同浓度的FlaA IgY均对H. pylori的生长具有一定的抑制作用, 在高浓度时能完全抑制H. pylori的生长, 在高剂量IgY处理组培养至12 h以后出现明显的菌体沉降现象, 而其余相应处理组无此现象产生. FlaA IgY作为一种针对H. pylori鞭毛蛋白的特异性抗体, 其对H. pylori的抑制作用主要通过与H. pylori菌毛蛋白发生特异性结合体现, 在体内主要表现为抑制H. pylori的定植和转移, 但在体外同样表现出对H. pylori生长的抑制作用, 原因可能是FlaA IgY特异的与H. pylori鞭毛蛋白结合, 除了能抑制其游动和定植外, 可能还会改变H. pylori外周蛋白的疏水性或空间构象, 导致H. pylori之间发生凝集沉降从而影响H. pylori的生长, 具体的抑制机制需要进一步的研究.
本研究结果表明重组FlaA具有较强的免疫原性, 制备的FlaA IgY除了与重组FlaA结合反应强烈外, 还与H. pylori全菌特异性结合. 该FlaA IgY特异性好, 不会与肠胃中乳酸杆菌和双歧杆菌以及大肠杆菌发生交叉反应. 当H. pylori浓度达到5 mg/mL时能完全抑制H. pylori的生长, 为将来FlaA IgY应用于口服时剂量选择提供了理论依据.
由于幽门螺旋杆菌(Helicobacter pylori, H. pylori)引发胃癌和其他一些疾病, 关于H. pylori的研究已受到越来越多的关注, 但针对H. pylori的治疗目前还是采用抗生素联合治疗等方式, 造成H. pylori的耐药性越来越严重, 极大地影响了H. pylori的治疗效果. 采用抗体类药物进行H. pylori的治疗得到了众多研究者的重视. 卵黄抗体是一种禽类抗体, 具有很好的生物活性, 常用于动物疾病的口服类药物的研发和治疗, 是消化系疾病传染病的有效治疗和预防药物.
谭周进, 教授, 湖南中医药大学
目前有大量关于H. pylori卵黄免疫球蛋白(yolk immu-noglobulin, IgY)的文献报道, 主要集中在抗H. pylori IgY的制备和体内体外试验, 已证实了能有效保护和治疗鼠类模型的H. pylori感染.
近年来关于幽门螺杆菌卵黄抗体的研究已经陆续开展, Roe和Shin等报道了全菌制备的抗H. pylori IgY能有效减轻因H. pylori引发的沙鼠胃炎, 在国内, 陈翠萍等证明了全菌制备的抗H. pylori IgY能有效中和H. pylori毒素细胞毒活性以及对小鼠的保护作用. 在H. pylori毒力因子制备IgY方面也不断有新的研究进展, 毛小琴等研究了重组VacA卵黄抗体的体外活性, 黄进等制备了抗HpaA IgY, 邓颖等制备了抗Nap卵黄抗体, 目前还未见FlaA IgY的相关报道.
本文制备的FlaA IgY采用的H. pylori毒力因子FlaA存在于所有的H. pylori菌株中, 且具有高度保守性, 能对所有H. pylori分离株型作用.
制备的FlaA IgY能有效的与FlaA菌毛蛋白结合, 阻止H. pylori在细胞表面的黏附和定植, 且对所有株型H. pylori均有作用, 具有良好的应用前景.
IgY: 一种禽类抗体, 与哺乳动物IgG相似, 主要从禽蛋中分离获取, 具有良好的生物活性.
本文制备了抗幽门螺杆菌菌毛蛋白FlaA IgY, 通过体外抑菌实验证明了其特异性及效果, 为治疗H. pylori口服药物的研发打下了基础. 选题较好, 有一定的应用前景. 实验设计合理, 分析较深入.
编辑 郭鹏 电编 都珍珍
| 2. | Graham DY, Shiotani A. New concepts of resistance in the treatment of Helicobacter pylori infections. Nat Clin Pract Gastroenterol Hepatol. 2008;5:321-331. [PubMed] [DOI] |
| 3. | Malfertheiner P, Megraud F, O'Morain C, Bazzoli F, El-Omar E, Graham D, Hunt R, Rokkas T, Vakil N, Kuipers EJ. Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report. Gut. 2007;56:772-781. [PubMed] [DOI] |
| 4. | Gisbert JP, Gisbert JL, Marcos S, Jimenez-Alonso I, Moreno-Otero R, Pajares JM. Empirical rescue therapy after Helicobacter pylori treatment failure: a 10-year single-centre study of 500 patients. Aliment Pharmacol Ther. 2008;27:346-354. [PubMed] [DOI] |
| 6. | Marnila P, Rokka S, Rehnberg-Laiho L, Kärkkäinen P, Kosunen TU, Rautelin H, Hänninen ML, Syväoja EL, Korhonen H. Prevention and suppression of Helicobacter felis infection in mice using colostral preparation with specific antibodies. Helicobacter. 2003;8:192-201. [PubMed] [DOI] |
| 7. | Casswall TH, Nilsson HO, Björck L, Sjöstedt S, Xu L, Nord CK, Borén T, Wadström T, Hammarström L. Bovine anti-Helicobacter pylori antibodies for oral immunotherapy. Scand J Gastroenterol. 2002;37:1380-1385. [PubMed] [DOI] |
| 8. | Ritter G. [Health status of men aged 18--60 in West Germany]. Lebensversicher Med. 1977;29:66-72. [PubMed] |
| 10. | Carlander D, Kollberg H, Wejåker PE, Larsson A. Peroral immunotherapy with yolk antibodies for the prevention and treatment of enteric infections. Immunol Res. 2000;21:1-6. [PubMed] [DOI] |
| 11. | Tacket CO, Losonsky G, Link H, Hoang Y, Guesry P, Hilpert H, Levine MM. Protection by milk immunoglobulin concentrate against oral challenge with enterotoxigenic Escherichia coli. N Engl J Med. 1988;318:1240-1243. [PubMed] [DOI] |
| 15. | Atherton JC, Peek RM, Tham KT, Cover TL, Blaser MJ. Clinical and pathological importance of heterogeneity in vacA, the vacuolating cytotoxin gene of Helicobacter pylori. Gastroenterology. 1997;112:92-99. [PubMed] [DOI] |
| 16. | Ottemann KM, Lowenthal AC. Helicobacter pylori uses motility for initial colonization and to attain robust infection. Infect Immun. 2002;70:1984-1990. [PubMed] [DOI] |
| 17. | Eaton KA, Suerbaum S, Josenhans C, Krakowka S. Colonization of gnotobiotic piglets by Helicobacter pylori deficient in two flagellin genes. Infect Immun. 1996;64:2445-2448. [PubMed] |
| 18. | Ohta-Tada U, Takagi A, Koga Y, Kamiya S, Miwa T. Flagellin gene diversity among Helicobacter pylori strains and IL-8 secretion from gastric epithelial cells. Scand J Gastroenterol. 1997;32:455-459. [PubMed] [DOI] |
| 19. | Ji WS, Hu JL, Qiu JW, Peng DR, Shi BL, Zhou SJ, Wu KC, Fan DM. Polymorphism of flagellin A gene in Helicobacter pylori. World J Gastroenterol. 2001;7:783-787. [PubMed] |
| 21. | 李 艳, 江 晓燕. 蛋黄抗体IgY在禽病预防中的应用. 国外畜牧学: 猪与禽. 2008;31-33. |
| 22. | Yang YH, Park D, Yang G, Lee SH, Bae DK, Kyung J, Kim D, Choi EK, Son JC, Hwang SY. Anti-Helicobacter pylori effects of IgY from egg york of immunized hens. Lab Anim Res. 2012;28:55-60. [PubMed] [DOI] |
| 23. | Shin JH, Yang M, Nam SW, Kim JT, Myung NH, Bang WG, Roe IH. Use of egg yolk-derived immunoglobulin as an alternative to antibiotic treatment for control of Helicobacter pylori infection. Clin Diagn Lab Immunol. 2002;9:1061-1066. [PubMed] [DOI] |
| 24. | Suzuki H, Nomura S, Masaoka T, Goshima H, Kamata N, Kodama Y, Ishii H, Kitajima M, Nomoto K, Hibi T. Effect of dietary anti-Helicobacter pylori-urease immunoglobulin Y on Helicobacter pylori infection. Aliment Pharmacol Ther. 2004;20 Suppl 1:185-192. [PubMed] [DOI] |
| 28. | Shin JH, Nam SW, Kim JT, Yoon JB, Bang WG, Roe IH. Identification of immunodominant Helicobacter pylori proteins with reactivity to H. pylori-specific egg-yolk immunoglobulin. J Med Microbiol. 2003;52:217-222. [PubMed] [DOI] |
| 29. | Suerbaum S, Josenhans C, Labigne A. Cloning and genetic characterization of the Helicobacter pylori and Helicobacter mustelae flaB flagellin genes and construction of H. pylori flaA- and flaB-negative mutants by electroporation-mediated allelic exchange. J Bacteriol. 1993;175:3278-3288. [PubMed] |
| 31. | Yan J, Liang SH, Mao YF, Li LW, Li SP. Construction of expression systems for flaA and flaB genes of Helicobacter pylori and determination of immunoreactivity and antigenicity of recombinant proteins. World J Gastroenterol. 2003;9:2240-2250. [PubMed] |