修回日期: 2014-03-24
接受日期: 2014-03-28
在线出版日期: 2014-05-08
目的: 观察蛋白激酶Cα(protein kinase Cα, PKCα)、Annexin A2和S100A10蛋白在胃癌组织中的表达及意义, 为获取胃癌诊断相关的蛋白分子提供实验依据.
方法: Western blot分析PKCα、Annexin A2和S100A10蛋白在正常胃黏膜与胃癌组织中的表达情况; 免疫组织化学染色观察组织芯片中三者的表达情况, 并分析其临床病理学意义.
结果: (1)Western blot检测结果显示, PKCα、Annexin A2和S100A10蛋白在胃癌组织中表达较正常胃黏膜组织中高(P<0.01); (2)免疫组织化学染色结果显示, PKCα蛋白在正常胃黏膜及胃癌组织中的阳性表达率分别为8.82%(3/34)和76.54%(62/81); Annexin A2蛋白在正常胃黏膜及胃癌组织中的阳性表达率分别为5.88%(2/34)和79.01%(64/81); S100A10蛋白在正常胃黏膜及胃癌组织中的阳性表达率分别为2.94%(1/34)、59.26%(48/81); (3)PKCα、Annexin A2和S100A10蛋白在胃癌组织中的阳性表达率较正常胃黏膜组织高(P<0.01).
结论: PKCα、Annexin A2和S100A10蛋白在胃癌组织中表达较正常胃黏膜组织中表达高, 其表达与胃癌的发生及分化程度有关.
核心提示: 早期诊断对提高胃癌患者5年生存率具有十分重要的影响, 获得早期诊断的特异性分子标志则是早期确诊的关键因素. 蛋白激酶Cα(protein kinase Cα)、Annexin A2与S100A10相互关联蛋白的检测为早期诊断胃癌提供了新的思路.
引文著录: 赵强, 张志伟, 刘重元, 肖娟, 李增波, 伍石华, 吴勇军, 杨代水, 权里平, 雷明生. PKCα-Annexin A2-S100A10在胃癌组织中的表达及意义. 世界华人消化杂志 2014; 22(13): 1793-1800
Revised: March 24, 2014
Accepted: March 28, 2014
Published online: May 8, 2014
AIM: To investigate the clinical significance of expression of protein kinase C (PKC), Annexin A2 and S100A10 proteins in gastric cancer and provide valuable data for finding diagnosis related proteins in gastric cancer.
METHODS: The expression of PKCα, Annexin A2 and S100A10 proteins was detected by Western blot in normal gastric mucosa and gastric cancer tissues. Moreover, their expression was analyzed by immunohistochemistry in a tissue array containing normal gastric mucosa and gastric cancer tissues. The clinicopathologic significance of their expression was evaluated.
RESULTS: Western blot analysis showed that the expression of PKCα, Annexin A2 and S100A10 proteins was significantly higher in gastric cancer tissue than in normal gastric mucosa tissue (P < 0.01 for all). Immunohistochemistry analysis showed that the positive expression rates of PKCα, Annexin A2 and S100A10 proteins were significantly lower in normal gastric mucosa tissue than in gastric cancer tissue [8.82% (3/34) vs 76.54% (62/81), 5.88% (2/34) vs 79.01% (64/81), 2.94% (1/34) vs 59.26% (48/81); P < 0.01 for all].
CONCLUSION: The expression of PKCα, Annexin A2 and S100A10 proteins is up-regulated in gastric cancer tissue compared with normal gastric mucosa tissue and may be related with the occurrence and differentiation degree of gastric cancer.
- Citation: Zhao Q, Zhang ZW, Liu CY, Xiao J, Li ZB, Wu SH, Wu YJ, Yang DS, Quan LP, Lei MS. Significance of expression of PKCα, Annexin A2 and S100A10 proteins in gastric cancer. Shijie Huaren Xiaohua Zazhi 2014; 22(13): 1793-1800
- URL: https://www.wjgnet.com/1009-3079/full/v22/i13/1793.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i13.1793
胃癌是我国常见的恶性肿瘤之一, 是当今严重威胁人们健康与生命的重大疾病. 胃癌的发生与众多癌基因和抑癌基因等的异常表达有关. 胃癌的组织学类型、分化程度及耐药等均与不同蛋白质表达存在密切的关系[1-4]. 因此, 了解相关蛋白质在胃癌中的表达情况, 对胃癌的早期诊断、临床治疗、评估和预测患者预后, 均具有十分重要的临床意义与应用价值. 我们选取课题组前期通过蛋白质组学方法筛选的胃癌相关蛋白质蛋白激酶Cα(protein kinase Cα, PKCα)、Annexin A2和S100A10[5], 检测三者在胃癌组织中的表达情况, 以期为胃癌诊断相关蛋白的发现提供有价值的实验资料.
收集2011-01/2011-12南华大学附属第一医院胃癌手术切除标本5例(癌旁10 cm以上胃黏膜组织作为正常对照), 其中男性3例, 女性2例; 年龄34-56岁, 平均年龄42.6岁. 组织芯片由湘潭市第一人民医院吴勇军主任医师赠送. 组织芯片中收集包括2003-2009年湘潭市第一人民医院经病理确诊的胃癌手术标本81例, 其中女性25例, 男性56例, 平均年龄55.35岁(27-81岁), 肿块体积32例≤3.0 cm, 49例>3.0 cm. 81例胃癌组织中病理诊断为高分化腺癌患者5例, 中分化腺癌患者17例, 低分化腺癌患者59例. 按照TNM分期Ⅰ-Ⅱ期者32例, Ⅲ-Ⅳ期者49例. 另外, 选取34例距癌灶10 cm以上正常胃黏膜作为对照组织. 上述所有收集的病例均经病理HE切片确诊, 所有胃癌患者手术前均未进行放疗或化疗. 鼠抗人PKCα、Annexin A2和S100A10蛋白的抗体为Santa Cruz公司产品, 购自湖南科泰生物有限公司. SP免疫组织化学检测试剂盒购自福建迈新生物技术有限公司.
1.2.1 Western blot检测蛋白质的表达: 将收集组织加入组织裂解液后, 在匀浆器中研磨, 制备总蛋白液, 测定浓度后, 以各泳道50 µg的总蛋白进行10%SDS不连续聚丙烯酰胺凝胶电泳, 转膜、封闭, 一抗(1:1000)及抗β-actin单体(1: 2000)4 ℃孵育过夜, 洗膜后, HRP标记的羊抗兔二抗(1:1000)孵育、洗膜、发光、曝光、显影、定影以及分析结果.
1.2.2 免疫组织化学染色蛋白质的表达: 操作按照超敏SP试剂盒所附说明书进行, 用已知阳性片作阳性对照(福建迈新生物有限公司提供), 同时用PBS替代第一抗体作阴性对照, 实验步骤如下: (l)将制备好的石蜡切片58 ℃隔水式恒温培养箱中过夜; (2)二甲苯脱蜡2次后水化, PBS洗片3次, 每次3 min; (3)将切片浸入盛有枸椽酸盐缓冲液容器中微波炉加热进行抗原修复; (4)加3%过氧化物酶阻断液, 37 ℃ 15 min, PBS洗片3次, 每次3 min; (5)加足量非免疫性动物血清, 37 ℃ 10 min, 阻断非特异性结合位点; (6)分别滴加一抗, 置湿盒中4 ℃冰箱过夜; (7)滴加生物素标记的二抗, 37 ℃ 15 min; (8)滴加链霉菌抗生物素蛋白-过氧化物酶溶液, 37 ℃ 15 min; (9)DAB显色、苏木素复染、返蓝、脱水、透明、封片、显微镜观察、照相(结果阳性部位呈棕黄色).
1.2.3 免疫组织化学染色结果判定: 组织芯片中黄色、棕色、棕褐色部位为蛋白阳性表达. 选取5个不重复视野, 记数组织中细胞总数与阳性表达细胞数, 计算阳性表达率. 蛋白表达结果的判定, 按染色强度与阳性细胞数占细胞总数的百分比综合计分. 染色强度: 无色者为1分, 黄色者为2分, 棕褐色者为3分; 阳性细胞数: ≤总数的10%者为1分; 11%-50%者为2分; >50%者为3分. 将染色强度分值与阳性细胞数分值相乘, 1分者为阴性"-"; 2-4分者为阳性"+", ≥6分者为强阳性"+++", 其中阳性细胞数>10%者为阳性表达.
统计学处理 采用SPSS17.0统计软件对所有数据进行统计处理和分析. PKCα、Annexin A2和S100A10蛋白的表达与不同胃组织的临床资料分析时, 选用χ2检验和方差分析, 组间的相关性分析用Spearman等级相关进行比较, P<0.05为差异有统计学意义.
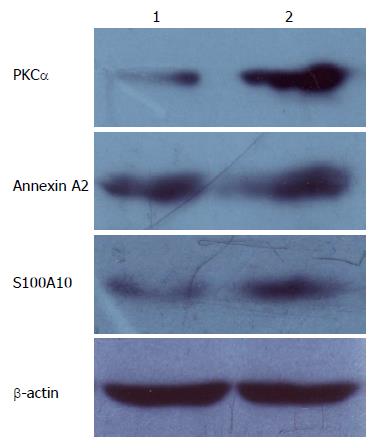
将提取的正常胃黏膜与胃癌组织总蛋白分别混合与混匀后, 通过Western blot检测PKCα、Annexin A2和S100A10蛋白在正常胃黏膜与胃癌组织中的表达. 结果显示, 在胃癌组织中PKCα、Annexin A2和S100A10蛋白表达较正常胃黏膜组织高(P<0.01)(图1).
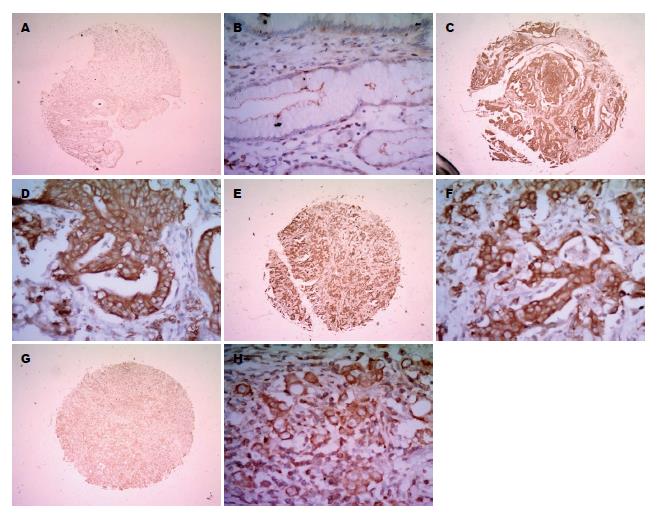
PKCα蛋白表达主要位于细胞浆(图2), PKCα蛋白在正常胃黏膜及胃癌组织中的表达率分别为8.82%(3/34)和76.54%(62/81); PKCα蛋白在胃癌组织中阳性表达率较正常胃黏膜组织高(P<0.01)(表1). PKCα蛋白在胃高、中、低分腺癌中的表达率分别为60%(3/5)、70.59%(12/17)和79.66%(47/59). 结果显示, 随着胃癌分化程度的降低, PKCα蛋白的表达逐渐升高(P<0.01)(表1).
| 分组 | n | PKCα蛋白表达 | 阳性率(%) | χ2(P)值 | |
| - | (+)-(+++) | ||||
| 正常胃黏膜 | 34 | 31 | 3 | 8.82 | |
| 胃癌组织 | |||||
| 高分化腺癌 | 5 | 2 | 3 | 60.00 | 5.28(0.01<P<0.05; WDAC vs N) |
| 中分化腺癌 | 17 | 5 | 12 | 70.59 | 20.83, 3.28(P<0.01; MDAC vs N and WDAC) |
| 低分化腺癌 | 59 | 12 | 47 | 79.66 | 43.54, 4.53, 16.29(P<0.01; PDAC vs N, WDAC and MDAC) |
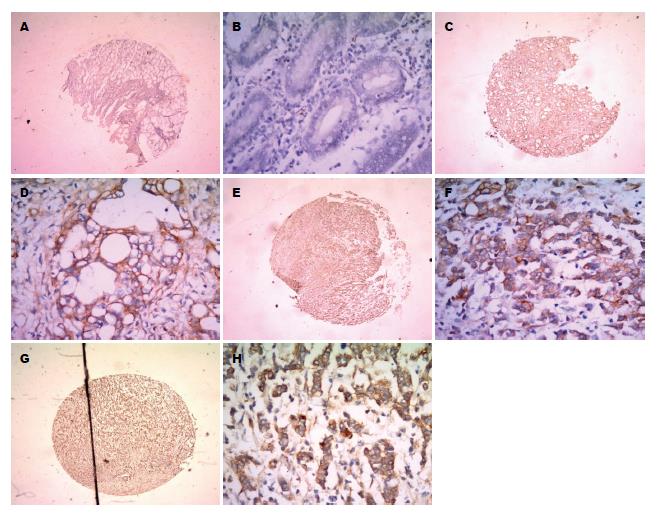
Annexin A2蛋白表达主要位于细胞浆(图3), Annexin A2蛋白在正常胃黏膜及胃癌组织中的表达率分别为5.88%(2/34)和79.01%(64/81); Annexin A2蛋白在胃癌组织中阳性表达率较正常胃黏膜组织高(P<0.01)(表2). Annexin A2蛋白在胃高、中、低分腺癌中的表达率分别为60%(3/5)、76.47%(13/17)和81.36%(48/59). 结果显示, 随着胃癌分化程度的降低, Annexin A2蛋白的表达逐渐升高(P<0.01)(表2).
| 分组 | n | Annexin A2蛋白表达 | 阳性率(%) | χ2(P)值 | |
| - | (+)-(+++) | ||||
| 正常胃黏膜 | 34 | 32 | 2 | 5.88 | |
| 胃癌组织 | |||||
| 高分化腺癌 | 5 | 2 | 3 | 60.00 | 13.88(P<0.01; WDAC vs N) |
| 中分化腺癌 | 17 | 4 | 13 | 76.47 | 27.2, 3.02(P<0.01; MDAC vs N and WDAC) |
| 低分化腺癌 | 59 | 11 | 48 | 81.36 | 49.43, 4.82, 8.31(P<0.01; PDAC vs N, WDAC and MDAC) |
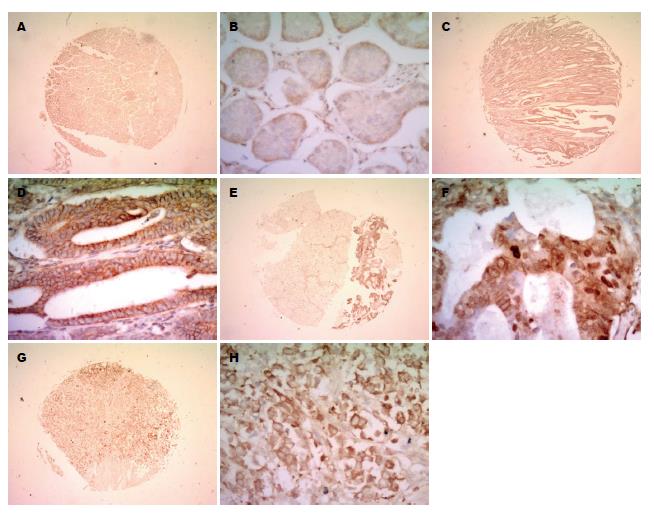
S100A10蛋白表达主要位于细胞浆(图4), S100A10蛋白在正常胃黏膜及胃癌组织中的表达率分别为2.94%(1/34)和59.26%(48/81); S100A10蛋白在胃癌组织中阳性表达率较正常胃黏膜组织高(P<0.01)(表3). S100A10蛋白在胃高、中、低分腺癌中的表达率分别为40%(2/5)、52.94%(9/17)和62.71%(37/59). 结果显示, 随着胃癌分化程度的降低, S100A10蛋白的表达逐渐升高(P<0.01)(表3).
| 分组 | n | S100A10蛋白表达 | 阳性率(%) | χ2(P)值 | |
| - | (+)-(+++) | ||||
| 正常胃黏膜 | 34 | 33 | 1 | 2.94 | |
| 胃癌组织 | |||||
| 高分化腺癌 | 5 | 3 | 2 | 40.00 | 4.02(0.01< P<0.05; WDAC vs N) |
| 中分化腺癌 | 17 | 8 | 9 | 52.94 | 14.94, 3.42(P<0.01; MDAC vs N and WDAC) |
| 低分化腺癌 | 59 | 22 | 37 | 62.71 | 31.89, 4.13, 5.14(P<0.01; PDAC vs NAHT, WDAC and MDAC) |
近年来, 由于蛋白质组学技术的不断完善, 许多科学家试图寻找胃癌相关的诊断标志物, 获取大量的蛋白信息, 但常存在各种误差, 如仪器与人为误差等, 可影响结果的准确性与真实性[6,7]. 因此, 被筛选的蛋白质的临床应用仍需后续的大量研究证实与完善. PKC、Annexin A2和S100A10分别为同一信号通路上下游蛋白分子, 相互影响表达与蛋白活性.
PKC作为信号分子, 是一类依赖于Ca2+、磷脂(phospholipid, PS)和二酞甘油(diacylglycerol, DAG)激活的Ser/Thr蛋白激酶家族, 在跨膜信号转导中起作重要作用[8-11]. 有研究发现, 整合素(integrin)的联合与PKC的激活对于结肠癌细胞的转移是必不可少的, 用PKC的激活剂PMA处理结肠癌细胞株HT29-D4后, 诱导PKC蛋白表达, 细胞的迁移与侵袭能力增加[12]. 采用特异性抑制剂Safingol抑制PKCα活性后, 可抑制立早基因c-fos和c-jun的表达, 而应用特异性激活剂PMA增加PKC活性后, 同时使两者的表达增加, 且与膀胱癌细胞的增殖能力相关[13]. 本研究发现PKCα蛋白在胃癌组织中表达较正常胃黏膜组织高, PKCα蛋白的表达随着胃癌分化程度的降低, PKCα蛋白的表达逐渐升高. 我们推测PKCα可能将成为胃癌诊断的相关蛋白, 但其临床应用仍需以后的大样本分析与临床探索.
Annexin A2蛋白为Annexins家族中的重要成员之一, 在细胞生长、增殖及分化过程中可能扮演十分重要的角色[14-16]. 在肝癌、口鳞状细胞癌、前列腺癌中, 低分化类型的肿瘤中Annexin A2呈现更高的表达[17-19]. Anneixn A2低表达与鼻咽癌细胞的淋巴结转移成正相关. Annexin A2高表达与胃癌、肝癌、乳腺癌、肾癌、胰腺癌及前列腺癌的浸润与转移能力相关, 可作为临床判断患者预后的独立指标之一[16,17]. Annexin A2高表达可促进肺癌、胰腺癌与前列腺癌细胞的增殖, 提示手术或化疗后肿瘤有复发的趋势[20,21]. 我们的结果显示, Annexin A2蛋白在胃癌组织中阳性表达率较正常胃黏膜组织高, 与以往在多种肿瘤中报道的基本一致. 另外, 我们发现随着胃癌分化程度的降低, Annexin A2蛋白的表达逐渐升高, 提示该蛋白可能成为评估临床胃癌治疗的指标之一.
S100A10蛋白(也称p11蛋白), 为钙结合蛋白家族的S100蛋白家族的成员之一. S100家族多个成员在多种肿瘤组织呈现异常表达, 且与肿瘤的发生、浸润与转移有关[22,23]. Annexin A2与S100家族成员在肿瘤发生发展过程中起相互协同作用[24]. S100A10为Annexin A2高亲和力的配体[25]. Annexin A2和S100A10表达水平在不同细胞中存在差异[26]. Annexin A2与S100A10结合可调节Annexin A2在核-质中的分布[27]. 研究表明S100A10与Annexin A2相互作用可加速组织型纤溶酶原激活物介导的纤溶酶生成, 进一步激活蛋白酶前体, 活化基质金属蛋白酶(matrix metalloproteinases, MMPs), 促进血管生成和肿瘤的浸润与转移[28]. 我们的结果显示, S100A10蛋白在胃癌组织中阳性表达率较正常胃黏膜组织高. 随着胃癌分化程度的降低, S100A10蛋白的表达逐渐升高. 实验结果提示S100A10可能参与胃癌的发生与发展.
总之, 本研究采用Western blot和免疫组织化学检测了胃癌相关蛋白PKCα、Annexin A2和S100A10在正常胃黏膜和胃癌不同分化程度组织中的表达情况, 证实了三者在胃癌组织中的表达相对正常高, 且与胃癌的分化程度密切相关, 并分析了三者表达在临床病理中的意义. 我们选取三个胃癌相关且相互调节的蛋白进行分析, 比单一分析其中一个蛋白的表达更具有临床评价意义与应用价值. 本研究为临床寻找早期诊断、临床治疗及评估患者预后的预警分子提供了非常有价值的实验资料与线索. 但由于胃癌存在遗传学个体差异以及本研究样本量有限, 因此临床应用前仍需扩大样本进行评估.
胃癌发生与发展过程中存在众多蛋白质的表达异常, 重要信号通路相关蛋白在肿瘤中常存在表达的协调性, 他们异常表达与胃癌组织学类型、分化程度、转移、临床治疗及预后相关.
张小晋, 主任医师, 北京积水潭医院
了解胃癌组织中同一信号通路相关蛋白PKCα、Annexin A2与S100A10的表达情况, 可为胃癌的早期诊断、组织学分型及预后提供实验依据.
本文通过选取课题组前期筛选的胃癌组织差异表达蛋白质PKCα、Annexin A2与S100A10, 观察相互作用蛋白间的表达情况, 分析他们表达的意义, 为胃癌的早期诊断, 疗效及预后评估等提供新的检测方法.
分析PKCα、Annexin A2与S100A10蛋白在胃癌组织中的表达及意义, 为胃癌诊断相关蛋白的发现提供有价值的实验资料.
本文设计较合理, 结果可信, 具有一定指导意义.
编辑 田滢 电编 鲁亚静
| 2. | 张 志伟, 汤 国辉, 赵 强, 刘 重元, 吴 勇军, 贺 修胜. AKT-p27Kip1-Cyclin E在胃癌组织中的表达及意义. 世界华人消化杂志. 2011;19:2233-2240. |
| 6. | Cappellani A, Zanghi A, Di Vita M, Zanet E, Veroux P, Cacopardo B, Cavallaro A, Piccolo G, Lo Menzo E, Murabito P. Clinical and biological markers in gastric cancer: update and perspectives. Front Biosci (Schol Ed). 2010;2:403-412. [PubMed] |
| 7. | Bai Z, Ye Y, Liang B, Xu F, Zhang H, Zhang Y, Peng J, Shen D, Cui Z, Zhang Z. Proteomics-based identification of a group of apoptosis-related proteins and biomarkers in gastric cancer. Int J Oncol. 2011;38:375-383. [PubMed] [DOI] |
| 8. | Bosco R, Melloni E, Celeghini C, Rimondi E, Vaccarezza M, Zauli G. Fine tuning of protein kinase C (PKC) isoforms in cancer: shortening the distance from the laboratory to the bedside. Mini Rev Med Chem. 2011;11:185-199. [PubMed] |
| 9. | Redden JM, Le AV, Singh A, Federkiewicz K, Smith S, Dodge-Kafka KL. Spatiotemporal regulation of PKC via interactions with AKAP7 isoforms. Biochem J. 2012;446:301-309. [PubMed] [DOI] |
| 10. | Farah CA, Sossin WS. The role of C2 domains in PKC signaling. Adv Exp Med Biol. 2012;740:663-683. [PubMed] [DOI] |
| 11. | Chen T, Cao L, Dong W, Luo P, Liu W, Qu Y, Fei Z. Protective effects of mGluR5 positive modulators against traumatic neuronal injury through PKC-dependent activation of MEK/ERK pathway. Neurochem Res. 2012;37:983-990. [PubMed] [DOI] |
| 12. | Lai KC, Huang AC, Hsu SC, Kuo CL, Yang JS, Wu SH, Chung JG. Benzyl isothiocyanate (BITC) inhibits migration and invasion of human colon cancer HT29 cells by inhibiting matrix metalloproteinase-2/-9 and urokinase plasminogen (uPA) through PKC and MAPK signaling pathway. J Agric Food Chem. 2010;58:2935-2942. [PubMed] [DOI] |
| 13. | Li L, She H, Yue S, Feng D, Luo Z. Vasoactive intestinal peptide induces surfactant protein A expression in ATII cells through activation of PKC/c-Fos pathway. Peptides. 2010;31:2046-2051. [PubMed] [DOI] |
| 14. | Reddy TR, Li C, Guo X, Myrvang HK, Fischer PM, Dekker LV. Design, synthesis, and structure-activity relationship exploration of 1-substituted 4-aroyl-3-hydroxy-5-phenyl-1H-pyrrol-2(5H)-one analogues as inhibitors of the annexin A2-S100A10 protein interaction. J Med Chem. 2011;54:2080-2094. [PubMed] [DOI] |
| 15. | Wang YX, Lv H, Li ZX, Li C, Wu XY. Effect of shRNA mediated down-regulation of Annexin A2 on biological behavior of human lung adencarcinoma cells A549. Pathol Oncol Res. 2012;18:183-190. [PubMed] [DOI] |
| 16. | Zhang X, Liu S, Guo C, Zong J, Sun MZ. The association of annexin A2 and cancers. Clin Transl Oncol. 2012;14:634-640. [PubMed] [DOI] |
| 17. | Pena-Alonso E, Rodrigo JP, Parra IC, Pedrero JM, Meana MV, Nieto CS, Fresno MF, Morgan RO, Fernandez MP. Annexin A2 localizes to the basal epithelial layer and is down-regulated in dysplasia and head and neck squamous cell carcinoma. Cancer Lett. 2008;263:89-98. [PubMed] [DOI] |
| 18. | Madureira PA, Hill R, Miller VA, Giacomantonio C, Lee PW, Waisman DM. Annexin A2 is a novel cellular redox regulatory protein involved in tumorigenesis. Oncotarget. 2011;2:1075-1093. [PubMed] |
| 19. | Zhang Y, Yu G, Wang Y, Zhang J, Wei S, Lee W, Zhang Y. A novel annexin A2 protein with platelet aggregation-inhibiting activity from amphibian Bombina maxima skin. Toxicon. 2010;56:458-465. [PubMed] [DOI] |
| 20. | Lokman NA, Ween MP, Oehler MK, Ricciardelli C. The role of annexin A2 in tumorigenesis and cancer progression. Cancer Microenviron. 2011;4:199-208. [PubMed] [DOI] |
| 21. | Rezvanpour A, Santamaria-Kisiel L, Shaw GS. The S100A10-annexin A2 complex provides a novel asymmetric platform for membrane repair. J Biol Chem. 2011;286:40174-40183. [PubMed] [DOI] |
| 22. | Zhang L, Su TP, Choi K, Maree W, Li CT, Chung MY, Chen YS, Bai YM, Chou YH, Barker JL. P11 (S100A10) as a potential biomarker of psychiatric patients at risk of suicide. J Psychiatr Res. 2011;45:435-441. [PubMed] [DOI] |
| 23. | Rescher U, Gerke V. S100A10/p11: family, friends and functions. Pflugers Arch. 2008;455:575-582. [PubMed] |
| 24. | Hou Y, Yang L, Mou M, Hou Y, Zhang A, Pan N, Qiang R, Wei L, Zhang N. Annexin A2 regulates the levels of plasmin, S100A10 and Fascin in L5178Y cells. Cancer Invest. 2008;26:809-815. [PubMed] [DOI] |
| 25. | Reddy TR, Li C, Fischer PM, Dekker LV. Three-dimensional pharmacophore design and biochemical screening identifies substituted 1,2,4-triazoles as inhibitors of the annexin A2-S100A10 protein interaction. ChemMedChem. 2012;7:1435-1446. [PubMed] [DOI] |
| 26. | Umbrecht-Jenck E, Demais V, Calco V, Bailly Y, Bader MF, Chasserot-Golaz S. S100A10-mediated translocation of annexin-A2 to SNARE proteins in adrenergic chromaffin cells undergoing exocytosis. Traffic. 2010;11:958-971. [PubMed] [DOI] |
| 27. | Kwon M, Yoon CS, Jeong W, Rhee SG, Waisman DM. Annexin A2-S100A10 heterotetramer, a novel substrate of thioredoxin. J Biol Chem. 2005;280:23584-23592. [PubMed] |
| 28. | He KL, Deora AB, Xiong H, Ling Q, Weksler BB, Niesvizky R, Hajjar KA. Endothelial cell annexin A2 regulates polyubiquitination and degradation of its binding partner S100A10/p11. J Biol Chem. 2008;283:19192-19200. [PubMed] [DOI] |