修回日期: 2014-03-14
接受日期: 2014-03-28
在线出版日期: 2014-04-28
目的: 观察姜黄素联合骨髓间充质干细胞(marrow mesenchymal stem cell, MSCs)对大鼠溃疡性结肠炎(ulcerative colitis, UC)的疗效, 并探讨辅助性T细胞17(T help cell 17, Th17)及调节性T细胞(regulatory T cell, Treg)平衡在其中的作用机制.
方法: 采用三硝基苯磺酸(trinitro-benzene-sulfonic acid, TNBS)灌肠制备大鼠UC模型, 将动物分为5组, 分别为正常对照组(A组)、模型组(B组), MSCs组(C组), 姜黄素组(D组), 姜黄素联合MSCs组(E组). 观察各组大鼠的行为、粪便性状及血便情况, 计算结肠大体形态评分(gross morphological score, GMS)及病理损伤评分(histopathologic damage score, HDS), 并通过流式细胞术(flow cytometer, FCM)检测各组Th17及Treg占CD4+T细胞的数量百分比; 免疫组织化学(immunohistochemistry, IHC)检测白介素-17、Foxp3在结肠组织的表达.
结果: (1)与正常组比较, 模型组大鼠GMS、HDS均明显升高(0.00±0.00 vs 4.63±0.74; 0.25±0.46 vs 4.00±0.53, P<0.01), Treg细胞在外周血及结肠组织的表达均下调, Th17的表达均上调, 差异均有统计学意义(8.01±0.29 vs 1.16±0.18; 9.50±1.60 vs 0.88±0.64; 0.63±0.13 vs 4.56±0.21; 0.88±0.64 vs 7.75±1.16, P<0.01); (2)与模型组相比, 各治疗组GMS、HDS均明显降低, 差异有统计学意义(4.63±0.74 vs 2.12±0.64, 2.00±0.53, 1.00±0.53; 4.00±0.53 vs 2.00±0.53, 1.88±0.83, 1.25±0.46, P<0.01); 各治疗组Treg细胞表达均明显上调, 而Th17细胞的表达均明显下调, 差异有统计学意义(1.16±0.18 vs 3.29±0.18, 3.19±0.20, 5.00±0.19; 0.88±0.64 vs 3.75±0.46, 4.00±0.92, 6.88±1.25; 4.56±0.21 vs 2.60±0.15, 2.59±0.23, 1.52±0.21; 0.88±0.64 vs 3.75±0.46, 4.00±0.92, 6.88±1.25, P<0.01); (3)联合治疗组GMS、HDS较单药物治疗组降低(1.00±0.53 vs 2.12±0.64, 2.00±0.53; 1.25±0.46 vs 2.00±0.53, 1.88±0.83, P<0.05), 且Treg细胞表达均显著上调, 而Th17细胞表达均显著下调, 差异有统计学意义(5.00±0.19 vs 3.29±0.18, 3.19±0.20; 6.88±1.25 vs 3.75±0.46, 4.00±0.92; 1.52±0.21 vs 2.60±0.15, 2.59±0.23; 2.38±0.92 vs 5.00±1.07, 4.62±1.19, P<0.01).
结论: 姜黄素联合MSCs能显著减轻UC大鼠的炎症反应并促进黏膜修复, 其调节免疫的机制可能与调节Treg/Th17平衡有关.
核心提示: 本文通过观察姜黄素联合骨髓间充质干细胞对大鼠溃疡性结肠炎(ulcerative colitis, UC)模型的疗效, 并探讨辅助性T细胞17(T help cell 17, Th17)及调节性T细胞(regulatory T cell, Treg)平衡在其中的作用机制. 发现联合治疗组能显著减轻UC大鼠的炎症反应并促进黏膜修复, 其调节免疫的机制可能与调节Treg/Th17平衡有关.
引文著录: 易金霞, 费素娟, 庞迅雷, 吴克俭. 姜黄素联合MSCs对大鼠溃疡性结肠炎的影响及机制. 世界华人消化杂志 2014; 22(12): 1642-1650
Revised: March 14, 2014
Accepted: March 28, 2014
Published online: April 28, 2014
AIM: To assess the therapeutic effects of curcumin combined with mesenchymal stem cells (MSCs) in the treatment of ulcerative colitis in rats and to explore the underlying mechanisms.
METHODS: Ulcerative colitis was induced in rats with 2,4,6-trinitrobenzene sulfonic acid (TNBS). 40 male Sprague-Dawley rats were randomly divided into 5 groups: a normal group, a model group, an MSCs group, a curcumin group, and a curcumin plus MSCs group. The signs and symptoms of rats in each group were observed, including vitality, diet, property of stool and bloody stool. The severity of colitis was assessed using gross morphological score (GMS) and histopathologic damage score (HDS). The percentages of Th17 and Treg lymphocytes in peripheral blood were determined by flow cytometry. Expression of IL-17 and Foxp3 in the colonic mucosa was detected by immunohistochemistry.
RESULTS: Compared with the normal group, the GMS and HDS were significantly higher in the model group (0.00 ± 0.00 vs 4.63 ± 0.74; 0.25 ± 0.46 vs 4.00 ± 0.53, P < 0.01); the levels of Treg in the peripheral blood and Foxp3 in the colon tissue were significant decreased, and the levels of Th17 in the peripheral blood and IL-17 in the colon tissue were significantly increased in the model group (8.01 ± 0.29 vs 1.16 ± 0.18; 9.50 ± 1.60 vs 0.88 ± 0.64; 0.63 ± 0.13 vs 4.56 ± 0.21; 0.88 ± 0.64 vs 7.75 ± 1.16, P < 0.01 for all). The GMS and HDS were significantly lower in the treatment groups than in the model group (4.63 ± 0.74 vs 2.12 ± 0.64, 2.00 ± 0.53, 1.00 ± 0.53; 4.00 ± 0.53 vs 2.00 ± 0.53, 1.88 ± 0.83, 1.25 ± 0.46, P < 0.01 for all). The levels of Treg and Foxp3 were significantly increased, and the levels of Th17 and IL-17 were significantly decreased in the treatment groups compared with the model group (1.16 ± 0.18 vs 3.29 ± 0.18, 3.19 ± 0.20, 5.00 ± 0.19; 0.88 ± 0.64 vs 3.75 ± 0.46, 4.00 ± 0.92, 6.88 ± 1.25; 4.56 ± 0.21 vs 2.60 ± 0.15, 2.59 ± 0.23, 1.52 ± 0.21; 0.88 ± 0.64 vs 3.75 ± 0.46, 4.00 ± 0.92, 6.88 ± 1.25, P < 0.01 for all). Compared with the MSCs group and curcumin group, the GMS and HDS were significantly decreased in the curcumin plus MSCs group (1.00 ± 0.53 vs 2.12 ± 0.64, 2.00 ± 0.53; 1.25 ± 0.46 vs 2.00 ± 0.53, 1.88 ± 0.83, P < 0.05 for all). The levels of Treg and Foxp3 in the combination treatment group were significantly increased, and the levels of Th17 and IL-17 were significantly decreased compared with monotherapy groups (5.00 ± 0.19 vs 3.29 ± 0.18, 3.19 ± 0.20; 6.88 ± 1.25 vs 3.75 ± 0.46, 4.00 ± 0.92; 1.52 ± 0.21 vs 2.60 ± 0.15, 2.59 ± 0.23; 2.38 ± 0.92 vs 5.00 ± 1.07, 4.62 ± 1.19, P < 0.01 for all).
CONCLUSION: Curcumin together with MSCs can decrease colonic mucosal damage and promote the repair of impaired mucosa in UC rats possibly via mechanisms associated with regulating the balance of Treg and Th17 1ymphocytes and the relevant cytokines in colonic tissue.
- Citation: Yi JX, Fei SJ, Pang XL, Wu KJ. Therapeutic effects of curcumin combined with MSCs against ulcerative colitis in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(12): 1642-1650
- URL: https://www.wjgnet.com/1009-3079/full/v22/i12/1642.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i12.1642
溃疡性结肠炎(ulcerative colitis, UC)是一种病因不明的结肠黏膜及黏膜下慢性非特异性炎症, 该病反复发作、经久难愈, 且与结肠癌关系密切, 被世界卫生组织列为现代难治病之一, 且近二十年来该病的发病率亦逐年升高[1,2].
近二十多年来, 溃疡性结肠炎的发病率呈上升趋势, 传统药物长期服用的不良反应大, 且复发率高, 给UC的治疗带来很大的困难, 因此探索一种新的、有效治疗方法迫在眉睫. 来源于姜科植物姜黄的干燥根茎的姜黄素, 来源广泛、价格低廉、不良反应少, 已证实其有抗肿瘤, 抗炎, 抗氧化, 抑制血小板聚集, 免疫调节等功能. 既往研究表明[3,4]其可以通过调节细胞因子的释放发挥抗炎作用. 然而, 其对辅助性T细胞17(T help cell 17, Th17)及调节性T细胞(regulatory T cell, Treg)细胞的影响国内外文献鲜有报道. 骨髓间充质干细胞(marrow mesenchymal stem cell, MSCs)因具有低免疫原型及免疫调节作用, 已被证实能改善UC大鼠症状及促进病变部位黏膜损伤的修复[5,6]. 本实验旨在研究姜黄素联合MSCs对UC模型大鼠的治疗作用, 并通过观察二者对UC大鼠Treg/Th17的影响, 探索对UC治疗的可能作用机制.
成年SPF级♂Sprague-Dawley(SD)大鼠, 体质量180-220 g, 由徐州医学院动物实验中心提供. TNBS及姜黄素购自Sigma公司; 大鼠FITC-anti rat CD29、大鼠PE-anti rat CD44, 大鼠FITC-anti rat CD34, 大鼠FITC-anti rat CD4, 大鼠PE-anti rat CD4, 大鼠FITC-anti rat 白介素-17(interleukin-17, IL-17), 大鼠APC-anti rat CD25, 大鼠PE-anti rat Foxp3均购自Biolegend公司; 免疫组织化学试剂盒购自北京中杉桥公司; Foxp3购自武汉博士德, IL-17购自Abcam公司.
1.2.1 动物分组及模型制备: 将实验大鼠随机分为5组, 每组8只, 分别为正常组(A组), 模型组(B组), MSCs组(C组), 姜黄素组(D组), 姜黄素联合MSCs组(E组). 所有大鼠禁食、不禁饮36 h, 10%水合氯醛(3.5 mL/kg)腹腔注射麻醉大鼠, 除正常组外, 余各组大鼠, 用直径2 mm的硅胶管插入大鼠结肠至距肛门约8 cm处, 用5%三硝基苯磺酸按100 mg/kg(TNBS)溶于等体积500 mL/L乙醇灌肠. 正常组大鼠按相同方法, 予以生理盐水灌肠, 之后将大鼠倒置2-3 min, 防止药物流出[7].
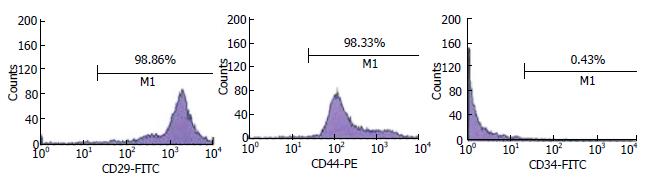
1.2.2 MSCs的分离、培养及鉴定: SD大鼠经乙醚麻醉后, 置入750 mL/L乙醇中浸泡5 min, 无菌条件下取胫骨和股骨, 清除周围肌肉, 用PBS(含10万U/L青霉素与100 mg/L链霉素)清洗3-5次; 咬骨钳将两端干骺端去除, 暴露骨髓腔, 用注射器吸取RPMI 1640培养基冲洗骨髓, 收集于在离心管中; 巴氏管反复吹打, 制成单细胞悬液, 然后1000 r/min离心5 min弃上清, 接种于培养瓶中; 置37 ℃、5%CO2培养箱中培养. 于24 h后首次更换培养基, 去除未贴壁的造血细胞, 以后每3-4 d更换培养基1次, 第3代培养后的MSCs用作试验. 应用荧光标记的抗CD29、CD44、CD34抗体, 流式细胞仪(Flow Cytometer, FCM)进行检测鉴定.
1.2.3 给药: 造模24 h后, 向C、E组大鼠尾静脉注入制备好的MSCs(分离培养鉴定参照文献[8])第3代细胞悬液1×106/mL 1次, 余各组向尾静脉注射等量的PBS溶液1次. 从造模第2天起, 每天予D、E组大鼠以50 mg/kg姜黄素的DMSO溶液灌胃, 余各组分别予等体积的DMSO溶液, 连续7 d. 第7次给药24 h后, 麻醉大鼠, 经心脏采血取大鼠外周血2 mL行FCM测定, 同时剖腹取出大鼠结肠组织, 沿肠系膜将肠组织剖开, 于冰生理盐水中洗净结肠组织, 做大体评分, 病理损伤评分, 放入甲醛固定液中, 石蜡包埋及切片, 行HE染色及免疫组织化学检测.
1.2.4 MSCs细胞鉴定: 取传代培养第3代到第5代的细胞制成细胞悬液, 按杨辉等[8]的方法取CD29、CD44阳性指标, CD34阴性表达指标, 行FCM测定鉴定细胞.
1.2.5 大鼠一般状况: 建模期间每日对大鼠进行称体质量并记录, 同时观察大鼠的精神、活动、进食、腹泻情况和粪便性状情况等临床症状.
1.2.6 结肠炎症评分: 采用王皓等[9]评分方法, 进行结肠大体形态及组织病理学损伤评分.
1.2.7 流式细胞术测定: (1)提取单个核细胞: 取新鲜抗凝血2 mL加PBS液2 mL稀释后, 沿管壁徐徐滴流叠加盛有4 mL淋巴细胞分离液的试管内(注意勿与分离液混合), 然后2000 r/min水平离心20 min, 管内分为4层, 自上而下依次为血浆, 单个核细胞, 颗粒白细胞、红细胞. 用毛细管伸至单个核细胞层中(位于细胞分离液与血浆的界面上), 沿管壁轻轻吸出全部细胞. 然后用PBS液洗涤两次, 每次2000 r/min离心10 min, 最后用RPMI l640培养液将细胞配成1×106/mL的细胞悬液; (2)Th17细胞的测定: 取1 mL细胞悬液, 在细胞培养液中加入2 μL含PMA、ionomycin、BFA的混合刺激液, 置于EP管中, 37 ℃, 5%CO2培养箱内培养4-6 h. 收集培养后的细胞悬液离心, 加入大鼠CD4避光孵育30 min, 加入固定液500 μL, 4 ℃避光孵育20 min; PBS洗涤, 离心(1200 r/min)5 min, 弃上清. 震荡混匀, 加入破膜剂1.5 mL, 避光15 min. 分别在各管中加入IL-17抗体2 μL, 轻轻混匀, 避光孵育30 min. PBS洗涤, 离心, 重悬细胞, FCM上机; (3)Treg细胞的检测: 将提取的细胞用PBS重悬, 调整细胞浓度为1×106/mL, 依次加入大鼠CD4, 大鼠CD25, 避光孵育30 min, 加入固定液500 μL, 4 ℃避光孵育20 min; PBS洗涤, 离心(1200 r/min)5 min, 弃上清. 震荡混匀, 加入破膜剂1.5 mL, 避光15 min. 加入Foxp3行核内抗体标记, 4 ℃避光孵育30 min. PBS洗涤, 离心, 重悬细胞, FCM上机.
1.2.8 结肠组织IL-17, Foxp3的表达: 用免疫组织化学SP法检测, 组织切片脱蜡; 将玻片置柠檬酸缓冲液中用医用微波炉进行抗原修复, 水洗; 滴加3%H2O2. 室温10 min阻断内源性过氧化物酶, PBS液冲洗; 正常血清在室温下封闭15 min, 清除多余血清, 分别滴加羊抗大鼠IL-17, Foxp3多克隆抗体37 ℃孵育1 h或4 ℃过夜, PBS冲洗; 滴加生物素化的羊抗大鼠抗体室温孵育15 min, PBS冲液洗; 滴加过氧化物酶标记的链酶亲和素温孵育15 min, PBS液冲洗; DAB显色2-5 min, 苏木素复染后, 封片观察. 免疫组织化学的切片在电镜下进行评分[10].
统计学处理 采用SPSS13.0软件进行统计学处理, 评分数据及定量数据均用mean±SD表示. 两组间比较用t检验, 多组间比较用单因素方差分析, P<0.05为差异有统计学意义.
正常组大鼠活动、进食正常, 无腹泻及便血; 模型组大鼠活动少, 肉眼可见黏液脓血便, 肛周污染严重, 于造模后第4天病情开始好转, 大便性状好转, 活动及进食开始增加; 与模型组相比, 治疗各组大鼠腹泻及便血情况相对较轻; 单药物治疗组大鼠可见少量脓血便及黑便, 从给药后第3天开始好转, 体质量也开始回升; 联合治疗组仅见有少量黏液便, 未见黑便及血便, 于给药后第2天活动及进食改善, 体质量开始回升.
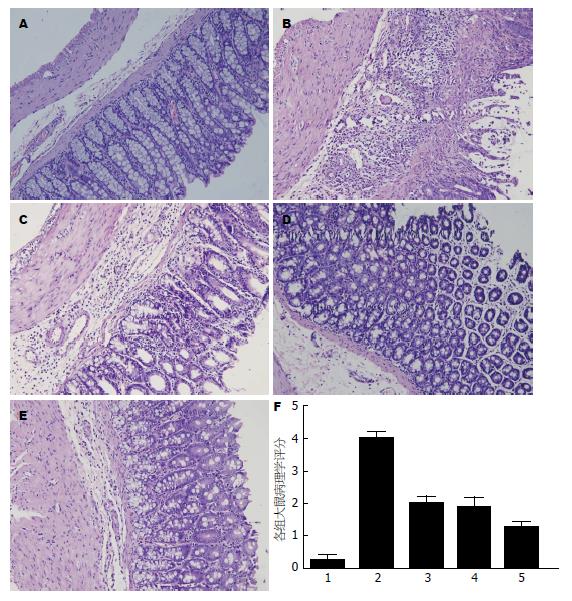
模型组大鼠结肠黏膜明显充血水肿、糜烂及浅表溃疡, 部分结肠壁增厚, 少数结肠与周围组织发生黏连. 单药物治疗组大鼠见少量糜烂, 无溃疡, 少数肠壁增厚, 无黏连. 联合治疗组大鼠结肠仅见充血水肿. 与模型组比较, 各治疗组结肠黏膜炎性病变改善, 评分降低, 差异有统计学意义(P<0.01). 与单药物治疗组比较, 联合治疗组结肠评分降低, 差异有显著意义(P<0.05). 与正常组比较, 各组结肠大体评分均升高, 差异有统计学意义(P<0.01)(表1).
正常对照组结肠组织见腺体排列整齐, 隐窝正常, 杯状细胞无减少, 未见黏膜糜烂、出血; 模型组可见腺管排列紊乱, 部分腺体缺失, 黏膜及黏膜下层血管高度扩张充血, 大量炎细胞浸润, 部分部位可见溃疡形成; 各治疗组腺体破坏较模型组轻, 炎性浸润少, 无溃疡形成. 与正常对照组比较, 余各组病理损伤评分均升高, 差异有统计学意义(P<0.01); 与模型组比较, 各治疗组病理学评分均下降, 差异有统计学意义(P<0.01); 与单药物治疗组比较, 联合治疗组病理评分下降, 差异有统计学意义(P<0.05). 病理学评分如表1, 病理图如图2.
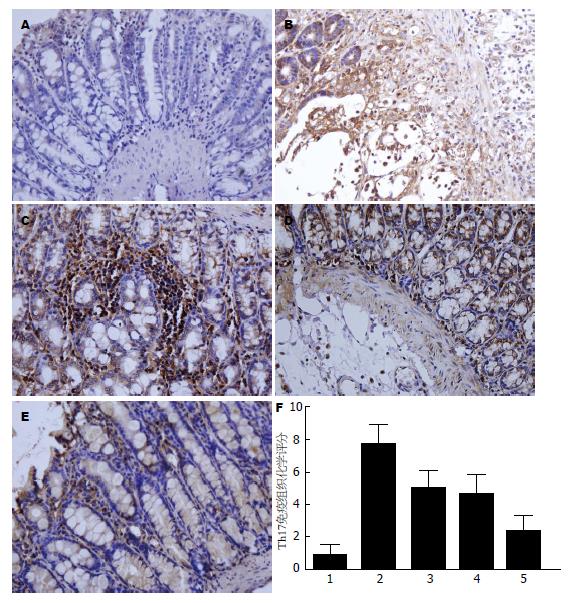
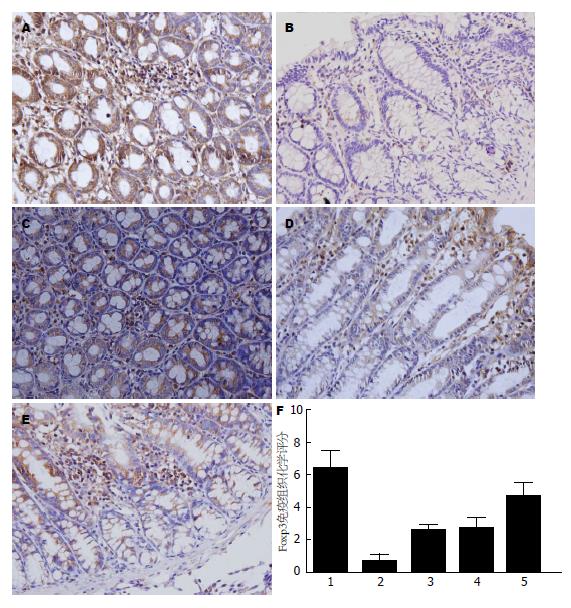
Foxp3表达的阳性细胞见于结肠黏膜固有层细胞, 黏膜下层, 以淋巴细胞细胞核表达为主, 呈棕黄色或棕褐色颗粒. IL-17主要见于黏膜上皮及固有层浸润的淋巴细胞及中性粒细胞等炎性细胞胞浆, 同时也可见于黏膜下层浸润的炎性细胞及血管内皮细胞胞浆中, 呈棕黄色或棕褐色. 实验可见, 与正常对照组比较, 余各组Foxp3阳性表达均相应减少, IL-17阳性表达均相应增加, 差异均有统计学意义(P<0.05); 与模型组比较, 各治疗组Foxp3阳性表达均相应增多, IL-17阳性表达均相应减少, 差异均有统计学意义(P<0.01); 与单药物治疗组比较, 联合治疗组Foxp3阳性表达均相应减少, IL-17阳性表达均相应增加, 差异均有统计学意义(P<0.01)(表2, 图3, 4).
与正常对照组比较, 余各组Th17细胞数量相对上升, Treg细胞百分率相对下降, 差异均有统计学意义(P<0.01); 与模型组比较, 各治疗组Th17细胞百分比均相应减少, Treg细胞百分比均相应增加, 差异均有统计学意义(P<0.01); 与单药物治疗组比较, 联合治疗组Th17细胞百分比相对增加, Treg细胞百分比相对减少, 差异均有统计学意义(P<0.01)(表2).
UC是一种病因不明的, 以腹泻、黏液脓血便、腹痛为主要症状的累及结肠黏膜及黏膜下层的慢性非特异性炎症疾病, 其发病机制与免疫因素关系密切[11,12]. 既往研究认为Th1和Th2细胞亚群失平衡在UC的发病机制中起重要作用[13,14], 近年来随着对UC发病机制的研究深入, 学者们发现在CD4+T细胞中存在一些新的细胞亚群(Treg细胞、Th17细胞)与UC有着极为紧密的联系[15,16].
Treg细胞是具有免疫调节功能的CD4+T细胞亚群之一, 其在防止自身免疫性疾病的发生、控制胃肠道炎症中发挥重要作用[17]. 而Foxp3在CD4+CD25+T细胞发育和功能发挥中均具决定性作用[18]. 目前认为, Treg细胞数量减少或功能异常, 均可导致肠黏膜损伤及UC的发生. 有研究表明, 剔除小鼠的Treg细胞会使其T细胞介导的炎性疾病(如肠炎)恶化[19], 而输注CD4+CD25+T细胞能治疗结肠炎. Eastaff-Leung等[20]发现UC患者外周血Treg细胞及结肠黏膜Foxp3 mRNA表达较正常人明显降低. 本研究通过FCM及IHC检测发现, 模型组大鼠外周血Treg细胞比例及结肠组织Foxp3阳性表达较正常组明显降低, 推测Treg细胞的数量减少和局部功能的减退可能使其免疫抑制功能减弱, 从而导致肠黏膜损伤及UC的发生.
Th17细胞为近来发现到的不同于Th1、Th2的辅助性T细胞, 因其高分泌IL-17A而被命名. 在许多自身免疫性疾病的发病中发挥重要作用[21]. 近年来Th17在IBD中的作用一直是研究热点[22,23]. 临床研究发现[18], UC患者外周血中Th17细胞比例及肠黏膜IL-17 mRNA表达较正常人明显升高. 本实验结果正好与以上研究相符, 表明Th17细胞在机体功能过分活跃可能参与炎症性肠病的发生与发展.
姜黄素因具有免疫调节的作用[24,25], 其应用于治疗UC受到国内外的广泛关注, 研究表明[26,27]姜黄素可以通过调节细胞因子的释放, 抑制核因子κB(nuclear factor-κB, NF-κB)的活化, 激活过氧化物酶增殖剂激活受体(peroxisome proliferator-activated receptor γ, PPARγ)的表达及下调环氧化酶-2(cyclooxygenase-2, COX-2), 诱导型一氧化氮合成酶(inducible nitric oxide synthase, iNOS)的表达等多种途径发挥抗炎作用, 在UC的治疗中具有重要作用. 本研究从CD4+T细胞亚群的角度对其研究, 发现姜黄素治疗组大鼠外周血及结肠组织Treg数量较模型组大鼠明显增加, 相反Th17细胞数量相对减少, 可见姜黄素可通过调节Treg及Th17的分化及转化, 从而维持Treg/Th17平衡, 减轻UC大鼠炎症反应, 促进黏膜修复.
MSCs因具有低免疫原性及免疫调节作用而广泛用于免疫性疾病的治疗中[28-30]. 近年来, 许多研究证实MSCs可以治疗UC[31,32]. 但目前MSCs移植治疗UC的机制尚不十分明确, 其可能的机制有: (1)MSCs移植可归巢至肠道, 增强了肠道上皮修复能力; (2)MSCs具有免疫调节作用, 通过调节免疫细胞作用, 从而控制肠道异常免疫反应. 本实验研究发现MSCs治疗组大鼠结肠黏膜损伤较模型组轻, 一般情况改善及体质量回升快, 治疗组Th17细胞数量及结肠组织相应的促炎细胞因子IL-17减少, 而Treg细胞数量及结肠组织Foxp3表达增多, 由此我们可以推断, MSCs可能通过调节炎性因子, 进而促进Treg/Th17平衡, 从而纠正大鼠肠道黏膜异常免疫状态. 另外MSCs有向损伤组织趋化的特性, 可归巢至炎症明显的肠道, 分化为肠道各种细胞, 促进肠道黏膜修复.
目前国内外的研究多是单纯的姜黄素或MSCs作用于UC, 既然二者各自具有抗炎和免疫调节作用, 联合作用能否减轻UC结肠黏膜的炎症反应, 促进其修复呢? 本实验选择姜黄素联合MSCs共同作用于TNBS诱导的大鼠UC模型, 通过观察结肠黏膜损伤变化及检测外周血Treg、Th17细胞及其在肠黏膜中分泌的相关细胞因子的表达, 探讨姜黄素及MSCs对UC大鼠肠黏膜的保护作用及机制. 本研究结果显示: 姜黄素联合MSCs治疗组大鼠一般状况, 结肠病理损伤等方面得到了明显改善, 且较单用姜黄素或MSCs效果更显著. 同时与单独用药组比较, 联合组外周血Treg细胞数量及结肠局部Foxp3表达上调, 而外周血Th17细胞数量及结肠组织IL-17表达下调; 由此可见两者的共同作用机制可能为通过调节炎性因子的表达, 进而促进Treg/Th17平衡, 从而发挥抗炎及免疫调节作用, 且两者共同作用效果更佳.
总之, UC的发病与Treg/Th17失衡相关, 同时姜黄素及MSCs可通过调节Treg/Th17及其相关细胞因子之间的平衡发挥治疗作用, 且两者共同作用较单用效果显著, 但姜黄素联合MSCs治疗UC的共同机制还需进一步研究. 此研究在中药联合免疫治疗UC上提供了新的思路, 为进一步的临床研究提供了理论基础.
近二十多年来, 溃疡性结肠炎(ulcerative colitis, UC)在亚洲地区发病率逐年上升,其治愈难, 易复发, 严重影响广大患者的生活质量及生命健康, 传统药物不良反应大且易产生耐药性. 因此寻找一种安全、有效的治疗方法刻不容缓.
杨柏霖, 副主任医师, 南京中医药大学附属医院
近年来随着细胞分子生物学和免疫学的迅速发展, UC治疗研究主要表现在免疫学方面. 姜黄素及骨髓间充质干细胞(marrow mesenchymal stem cell, MSCs)因具有免疫调节作用成为治疗UC的热点, 但两者的具体治疗机制尚未完全明确, 同时从对辅助性T细胞17(T help cell 17, Th17)及调节性T细胞(regulatory T cell, Treg)平衡角度研究治疗机制鲜有报道.
既往研究认为姜黄素可通过抑制MAPK p38信号途径下调COX-2和iNOS水平通过调节各种细胞因子来发挥抗炎的作用. MSCs可归巢至肠道, 增强了肠道上皮修复能力, 同时其还具有免疫调节作用.
本研究紧跟现代免疫学研究前沿, 基于重要的免疫细胞CD4+T细胞的新认知, 首次研究姜黄素联合MSCs从调节CD4+T细胞亚群平衡等免疫角度治疗大鼠UC, 分析姜黄素联合MSCs在治疗UC中对Treg和Th17间的调控关系及其可能的机制.
UC治愈难, 易复发, 被世界卫生组织列为现代难治病之一. 此研究从Treg/Th17平衡角度, 研究姜黄素联合MSCs对UC的治疗及免疫调节机制, 为中药联合免疫治疗UC上提供了新的思路, 为进一步的临床研究提供理论基础.
本文立意新颖, 在前期相关研究基础上提出了新的切入点, 研究设计具有科学性,结果客观、可信, 对指导临床诊断与治疗UC有一定意义.
编辑: 田滢 电编:鲁亚静
| 1. | Thia KT, Loftus EV, Sandborn WJ, Yang SK. An update on the epidemiology of inflammatory bowel disease in Asia. Am J Gastroenterol. 2008;103:3167-3182. [PubMed] [DOI] |
| 2. | Molodecky NA, Soon IS, Rabi DM, Ghali WA, Ferris M, Chernoff G, Benchimol EI, Panaccione R, Ghosh S, Barkema HW. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. Gastroenterology. 2012;142:46-54. e42; quiz e30. [PubMed] [DOI] |
| 3. | Zhou H, Beevers CS, Huang S. The targets of curcumin. Curr Drug Targets. 2011;12:332-347. [PubMed] |
| 4. | Srivastava RM, Singh S, Dubey SK, Misra K, Khar A. Immunomodulatory and therapeutic activity of curcumin. Int Immunopharmacol. 2011;11:331-341. [PubMed] [DOI] |
| 5. | Kaplan JM, Youd ME, Lodie TA. Immunomodulatory activity of mesenchymal stem cells. Curr Stem Cell Res Ther. 2011;6:297-316. [PubMed] |
| 6. | Wei Y, Nie Y, Lai J, Wan YJ, Li Y. Comparison of the population capacity of hematopoietic and mesenchymal stem cells in experimental colitis rat model. Transplantation. 2009;88:42-48. [PubMed] [DOI] |
| 7. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] |
| 8. | 杨 辉, 蔡 光, 刘 柏炎, 蔡 营, 谢 勇. 首次换液时间对贴壁法培养骨髓间充质干细胞纯度及增殖的影响. 中国组织工程研究与临床康复. 2007;11:3868-3871. |
| 10. | Koga H, Sakisaka S, Ohishi M, Kawaguchi T, Taniguchi E, Sasatomi K, Harada M, Kusaba T, Tanaka M, Kimura R. Expression of cyclooxygenase-2 in human hepatocellular carcinoma: relevance to tumor dedifferentiation. Hepatology. 1999;29:688-696. [PubMed] |
| 11. | Endo K, Shiga H, Kinouchi Y, Shimosegawa T. [Inflammatory bowel disease: IBD]. Rinsho Byori. 2009;57:527-532. [PubMed] |
| 12. | Wallace KL, Zheng LB, Kanazawa Y, Shih DQ. Immunopathology of inflammatory bowel disease. World J Gastroenterol. 2014;20:6-21. [PubMed] [DOI] |
| 13. | Van Damme N, De Keyser F, Demetter P, Baeten D, Mielants H, Verbruggen G, Cuvelier C, Veys EM, De Vos M. The proportion of Th1 cells, which prevail in gut mucosa, is decreased in inflammatory bowel syndrome. Clin Exp Immunol. 2001;125:383-390. [PubMed] |
| 14. | MacDonald TT, Monteleone G, Pender SL. Recent developments in the immunology of inflammatory bowel disease. Scand J Immunol. 2000;51:2-9. [PubMed] |
| 15. | Hovhannisyan Z, Treatman J, Littman DR, Mayer L. Characterization of interleukin-17-producing regulatory T cells in inflamed intestinal mucosa from patients with inflammatory bowel diseases. Gastroenterology. 2011;140:957-965. [PubMed] [DOI] |
| 16. | Huang Z, Jiang Y, Yang Y, Shao J, Sun X, Chen J, Dong L, Zhang J. 3,3'-Diindolylmethane alleviates oxazolone-induced colitis through Th2/Th17 suppression and Treg induction. Mol Immunol. 2013;53:335-344. [PubMed] [DOI] |
| 17. | Li Z, Arijs I, De Hertogh G, Vermeire S, Noman M, Bullens D, Coorevits L, Sagaert X, Schuit F, Rutgeerts P. Reciprocal changes of Foxp3 expression in blood and intestinal mucosa in IBD patients responding to infliximab. Inflamm Bowel Dis. 2010;16:1299-1310. [PubMed] [DOI] |
| 18. | Chen Z, Lin F, Gao Y, Li Z, Zhang J, Xing Y, Deng Z, Yao Z, Tsun A, Li B. FOXP3 and RORγt: transcriptional regulation of Treg and Th17. Int Immunopharmacol. 2011;11:536-542. [PubMed] [DOI] |
| 19. | Veltkamp C, Ruhwald R, Giesem T, Autschbach F, Kaden I, Veltkamp R, Sartor RB, Stremmel W. CD4+CD25+ cell depletion from the normal CD4+ T cell pool prevents tolerance toward the intestinal flora and leads to chronic colitis in immunodeficient mice. Inflamm Bowel Dis. 2006;12:437-446. [PubMed] |
| 20. | Eastaff-Leung N, Mabarrack N, Barbour A, Cummins A, Barry S. Foxp3+ regulatory T cells, Th17 effector cells, and cytokine environment in inflammatory bowel disease. J Clin Immunol. 2010;30:80-89. [PubMed] [DOI] |
| 21. | Chen Z, Laurence A, Kanno Y, Pacher-Zavisin M, Zhu BM, Tato C, Yoshimura A, Hennighausen L, O'Shea JJ. Selective regulatory function of Socs3 in the formation of IL-17-secreting T cells. Proc Natl Acad Sci U S A. 2006;103:8137-8142. [PubMed] |
| 22. | Dai J, Zhang GB, Gao N, Xi QH, Li YQ, Pang Z, Zhao Y, Zhao JM, Nie JS, Chen WC. [The expression of peripheral Th1 and Th17 cells in inflammatory bowel disease and its potential clinical value]. Zhonghua Neike Zazhi. 2013;52:375-378. [PubMed] |
| 23. | Song L, Zhou R, Huang S, Zhou F, Xu S, Wang W, Yi F, Wang X, Xia B. High intestinal and systemic levels of interleukin-23/T-helper 17 pathway in Chinese patients with inflammatory bowel disease. Mediators Inflamm. 2013;2013:425915. [PubMed] |
| 24. | Sharma S, Chopra K, Kulkarni SK, Agrewala JN. Resveratrol and curcumin suppress immune response through CD28/CTLA-4 and CD80 co-stimulatory pathway. Clin Exp Immunol. 2007;147:155-163. [PubMed] |
| 25. | Huang J, Huang K, Lan T, Xie X, Shen X, Liu P, Huang H. Curcumin ameliorates diabetic nephropathy by inhibiting the activation of the SphK1-S1P signaling pathway. Mol Cell Endocrinol. 2013;365:231-240. [PubMed] [DOI] |
| 26. | Deguchi Y, Andoh A, Inatomi O, Yagi Y, Bamba S, Araki Y, Hata K, Tsujikawa T, Fujiyama Y. Curcumin prevents the development of dextran sulfate Sodium (DSS)-induced experimental colitis. Dig Dis Sci. 2007;52:2993-2998. [PubMed] |
| 27. | Jacob A, Wu R, Zhou M, Wang P. Mechanism of the Anti-inflammatory Effect of Curcumin: PPAR-gamma Activation. PPAR Res. 2007;2007:89369. [PubMed] [DOI] |
| 28. | Chang JW, Hung SP, Wu HH, Wu WM, Yang AH, Tsai HL, Yang LY, Lee OK. Therapeutic effects of umbilical cord blood-derived mesenchymal stem cell transplantation in experimental lupus nephritis. Cell Transplant. 2011;20:245-257. [PubMed] [DOI] |
| 29. | Holzer U, van Royen-Kerkhof A, van der Torre P, Kuemmerle-Deschner J, Well C, Handgretinger R, Mueller I, Wulffraat N. Successful autologous stem cell transplantation in two patients with juvenile dermatomyositis. Scand J Rheumatol. 2010;39:88-92. [PubMed] [DOI] |
| 30. | Zhou H, Guo M, Bian C, Sun Z, Yang Z, Zeng Y, Ai H, Zhao RC. Efficacy of bone marrow-derived mesenchymal stem cells in the treatment of sclerodermatous chronic graft-versus-host disease: clinical report. Biol Blood Marrow Transplant. 2010;16:403-412. [PubMed] [DOI] |
| 31. | He XW, He XS, Lian L, Wu XJ, Lan P. Systemic infusion of bone marrow-derived mesenchymal stem cells for treatment of experimental colitis in mice. Dig Dis Sci. 2012;57:3136-3144. [PubMed] [DOI] |