修回日期: 2014-03-17
接受日期: 2014-03-18
在线出版日期: 2014-04-18
目的: 检测活动期克罗恩病(Crohn's disease, CD)患者病变肠道黏膜组织中microRNA-124 (miR-124)的表达情况并确定其靶基因.
方法: 采用定量PCR技术检测活动期CD患者及健康对照者肠道黏膜组织中miR-124的表达情况, 使用Targetscan等多种软件预测得出芳香烃受体(aryl hydrocarbon receptor, AHR)是miR-124的靶基因之一, 利用荧光素酶报告基因实验验证miR-124和AHR的靶点关系, 并通过在Caco-2细胞中过表达或抑制表达miR-124进一步检测AHR的变化.
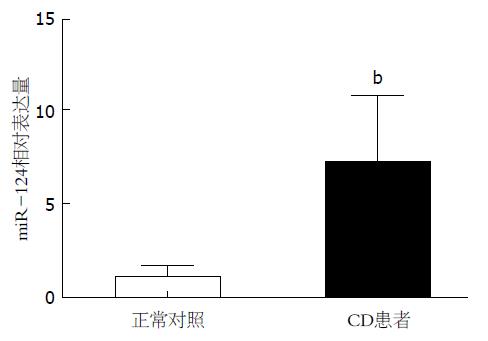
结果: 与健康对照者相比, miR-124在活动期CD患者病变肠道黏膜组织中明显升高, 其相对表达量为7.19±3.54(P<0.01). 荧光素酶报告基因结果提示在Caco-2细胞中miR-124可与AHR的3'端非翻译区特异性结合. 在Caco-2细胞中过表达或抑制表达miR-124, 可分别使AHR蛋白水平下降或升高, 而AHR mRNA水平不受影响.
结论: miR-124在活动期CD患者病变肠道黏膜组织中表达明显升高, AHR是其靶点之一.
核心提示: 本研究发现microRNA-124(miR-124)在克罗恩病(Crohn's disease, CD)患者病变肠道黏膜组织中表达上调, 其通过与芳香烃受体(aryl hydrocarbon receptor, AHR)的3'端非翻译区结合在转录后水平调节AHR蛋白的表达. 本实验证实了AHR是miR-124的靶点之一, 为miR-124用于CD的诊断及治疗提供了初步的理论依据.
引文著录: 陈玮煦, 任丽华, 施瑞华. MiR-124在克罗恩病中的表达及其靶基因的确定. 世界华人消化杂志 2014; 22(11): 1622-1627
Revised: March 17, 2014
Accepted: March 18, 2014
Published online: April 18, 2014
AIM: To detect the expression of miR-124 in active Crohn's disease (CD) and to validate aryl hydrocarbon receptor (AHR) as its target gene.
METHODS: Levels of miR-124 in intestinal tissues of active CD patients and healthy controls were assessed by qRT-PCR. AHR was predicted to be a target of miR-124 by bioinformatics analysis. Luciferase reporter assay and Western blot analysis in combination with overexpression or knockdown of miR-124 were performed to experimentally validate if AHR is the genuine target of miR-124.
RESULTS: The expression of miR-124 was significantly increased in active CD patients compared with healthy controls (fold change > 7, P < 0.01). The luciferase reporter assay confirmed that miR-124 directly combined with the 3'UTR of AHR. In vitro, over-expression of miR-124 led to decreased AHR expression, while knockdown of miR-124 resulted in increased AHR expression, although AHR mRNA expression was not altered.
CONCLUSION: Levels of miR-124 are increased in active CD patients and AHR is a target of miR-124.
- Citation: Chen WX, Ren LH, Shi RH. Expression of miR-124 in active Crohn's disease and validation of aryl hydrocarbon receptor as its target gene. Shijie Huaren Xiaohua Zazhi 2014; 22(11): 1622-1627
- URL: https://www.wjgnet.com/1009-3079/full/v22/i11/1622.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i11.1622
炎症性肠病(inflammatory bowel disease, IBD)是一种慢性复发性炎症性疾病, 主要包括克罗恩病(Crohn's disease, CD)及溃疡性结肠炎(ulcerative colitis, UC)[1]. CD的病变可以累及整个消化系, 常表现为腹痛、腹泻、发热及肠梗阻. CD发病率及患病率均呈逐年上升趋势, 其病因及发病机制尚不清楚, 目前普遍认为是由遗传、免疫、环境等因素共同作用所致[2,3]. MicroRNAs(miRNAs)是一类长约20-23个核苷酸的内源性小分子单链RNA, 通过和靶mRNA的3'端非翻译区(3' untranslated region, 3'UTR)特异性序列结合, 引起mRNA的降解或翻译抑制, 从而转录后调节基因表达[4,5]. miRNAs在许多生物学过程中起着重要作用, 如细胞的增殖、成熟及凋亡, 其可诱导炎症及免疫系统紊乱, 影响肿瘤及自身免疫性疾病的发生发展[6]. 很多自身免疫性疾病中都有miRNA表达水平的变化, 包括系统性红斑狼疮、类风湿性关节炎、银屑病及IBD[7]. 近期研究表明, 某些miRNA在CD患者中表达异常并且在CD的发病机制中起重要作用[8]. Maharshak等[9]发现miR-132在IBD患者病变肠道组织中上调, 通过减少局部乙酰胆碱酯酶(acetylcholine esterase)的表达起到抗炎作用. 肠道纤维化是CD常见的并发症, Chen等[10]发现在体外试验中miR-200b通过作用于E盒结合锌指蛋白1(zinc finger E-box binding protein 1, ZEB1)及ZEB2抑制肠道纤维化. Chen等[11]发现miR-122通过靶作用于核苷酸结合寡聚化结构域2减少CD患者肠上皮细胞损伤.
通过前期对3对CD患者病变肠道黏膜组织样本进行基因芯片筛查, 我们发现与正常对照组相比miR-124高表达于CD患者病变肠道组织. miR-124在CD中的作用尚未明确, 本研究的目的主要是检测miR-124在CD中的表达情况及确定其可能的靶点.
肠道黏膜组织活检标本收集自江苏省人民医院(2011-09/2013-09)通过结肠镜及病理学检查确诊为活动期CD的患者10例以及接受肠镜检查的正常对照10例. 人结肠腺癌细胞株Caco-2购自上海细胞研究所; pre-miR-124、pre-scramble、anti-miR-124、anti-scramble及PCR引物均购自上海吉玛公司; 胎牛血清及DMEM培养基购自美国GIBCO公司; TRIzol及Lipofectamine 2000购自美国Invitrogen公司; AMV逆转录酶购自日本TaKaRa公司; miR-124及U6探针购自美国Applied Biosystems公司; p-miR-reporter质粒及β-gal质粒购自美国Ambion公司; 荧光素酶检测试剂盒购自美国Promega公司; BCA蛋白检测试剂盒购自美国Thermo公司; 芳香烃受体(aryl hydrocarbon receptor, AHR)抗体购自美国Abcam公司; Tubulin抗体及二抗均购自美国Santa Cruz公司.
1.2.1 细胞培养: Caco-2细胞用含10%小牛血清及1%双抗的DMEM, 于37 ℃ 5%CO2培养箱中培养.
1.2.2 RNA提取及实时定量PCR: 用TRIzol提取组织总RNA. 使用AMV逆转录酶及茎环RT引物将1 μg总RNA逆转录为cDNA, 反应条件为16 ℃, 30 min; 42 ℃, 30 min; 85 ℃, 5 min. 使用TaqMan miRNA探针定量检测miR-124表达, 以U6为内参. 采用TaqMan PCR kit PCR-system-7500进行实时定量荧光PCR, 反应在96孔板中进行, 反应条件为95 ℃, 5 min; 95 ℃, 15 s; 60 ℃, 1 min共40个循环. 使用SYBR green法定量检测AHR mRNA表达, 反应条件为95 ℃, 5 min; 95 ℃, 15 s; 55 ℃, 30 s; 72 ℃, 1 min共40个循环. AHR上游引物为5'-CAAATCCTTCCAAGCGGCATA-3', 下游引物为5'-CGCTGAGCCTAAGAACTGAAAG-3'. 以β-actin为内参, 其上游引物为 5'-AGGGAAATCGTGCGTGAC-3', 下游引物为5'-CGCTCATTGCCGATAGTG-3'. 实验均重复3次. PCR反应后, Ct值通过设置固定阈值确定, 取3次PCR的结果求平均Ct值. miRNA相对水平通过U6校正, mRNA相对水平通过β-actin校正, 得出的Ct值通过公式2-∆∆Ct求出基因表达的相对变化.
1.2.3 细胞转染: 通过转染试剂Lipofectamine 2000, 将miR-124类似物(pre-miR-124)及其阴性对照(pre-scramble)、miR-124抑制物(anti-miR-124)及其阴性对照(anti-scramble)转染入Caco-2细胞中, 转染前将Caco-2细胞按2×105个/孔种植于6孔板中, 待细胞达到70%融合时按说明书进行转染.
1.2.4 荧光素酶报告基因实验: 以人类基因组DNA作为模版对AHR的3'UTR进行PCR扩增, 将得到的PCR产物插入p-miR-reporter质粒, 构建荧光素酶报告基因质粒, 通过测序确定质粒构建成功. 使用Caco-2细胞进行荧光素酶报告基因实验, Caco-2细胞培养于24孔板中, 通过Lipofectamine 2000每孔转染1 μg荧光素酶报告基因质粒、1 μg β-gal质粒以及等量的(100 pmol)pre-miR-124、anti-miR-124或阴性对照RNA. β-gal质粒作为转染对照使用. 转染后24 h, 用荧光素酶检测试剂盒检测荧光素酶活性.
1.2.5 Western blot检测AHR: 转染48 h后提取细胞蛋白, 使用BCA蛋白检测试剂盒测定蛋白浓度, 80 mg蛋白加入10%SDS-PAGE中电泳, 结束后转印至PVDF膜上, 用5%脱脂牛奶室温封闭1 h, 一抗AHR(1:1000)、Tubulin(1:1000), 4 ℃孵育过夜, 二抗(1:4000)室温孵育1 h, 曝光.
1.2.6 靶基因预测: 使用TargetScan、miRanda及PicTar等miRNA靶基因预测数据库搜索3'UTR存在miR-124保守结合位点的靶基因, 并整合分析生物学信息.
统计学处理 所有结果均以mean±SD表示, 两组间比较用独立样本t检验. 所有数据都运用SPSS17.0统计软件进行分析, P<0.05为差异有统计学意义.
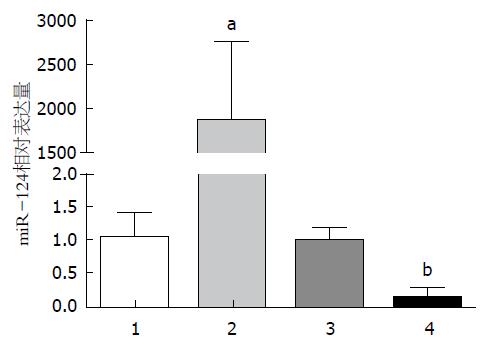
用定量PCR方法检测10例活动期CD患者病变肠道黏膜组织标本及10例正常对照标本中miR-124的表达水平, 发现miR-124在活动期CD患者病变肠道黏膜组织中明显升高, 其相对表达量为7.19±3.54(P<0.01)(图1).
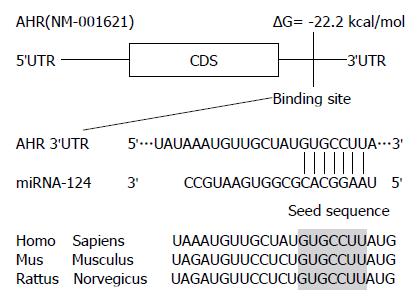
通过TargetScan、miRanda及PicTar等生物学信息预测网站预测, 显示AHR可能是miR-124调控的靶基因之一. miR-124与AHR的3'-UTR互补, 可干扰其转录后翻译(图2).
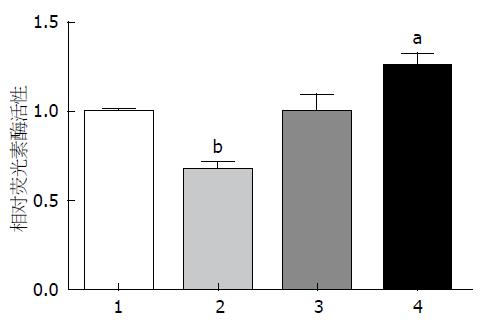
将含有AHR 3'UTR的荧光素酶报告基因质粒、对照质粒β-gal、pre-miR-124、pre-scramble、anti-miR-124及anti-scramble共转染Caco-2细胞, 转染pre-miR-124组荧光素酶活性较对照组明显降低(P<0.01), 而转染anti-miR-124组荧光素酶活性明显升高(P<0.05)(图3).
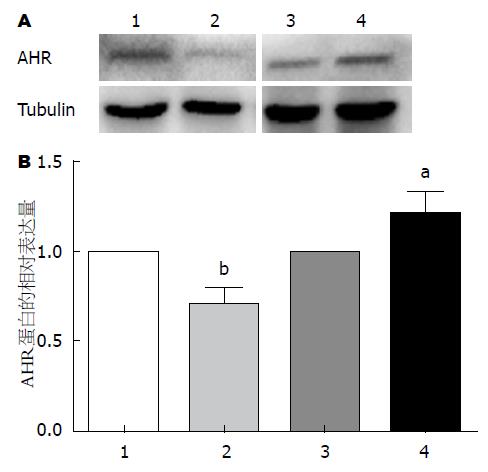
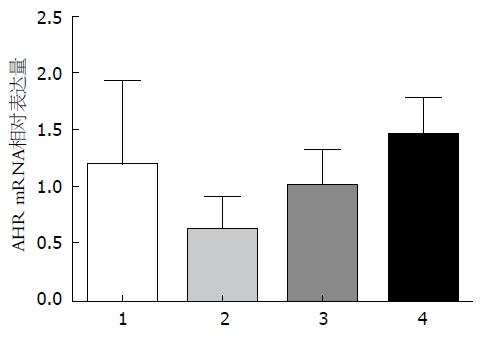
用pre-miR-124、pre-scramble、anti-miR-124及anti-scramble分别转染Caco-2细胞, 与对照组相比, 转染pre-miR-124组miR-124表达升高(P<0.05)而AHR蛋白表达明显降低, 转染anti-miR-124组miR-124表达降低(P<0.01)而AHR蛋白明显升高(图4, 5). 同时, AHR mRNA的表达水平在各组均未发生明显改变(图6).
miRNAs作为一类在转录后调节靶基因表达的小分子RNA, 在固有免疫及适应性免疫系统中都起着重要的调节作用, 近期关于miRNAs在自身免疫性疾病中的研究成为热点. miR-124在大脑中高表达, 主要参与中枢神经系统发育过程中神经元分化的调节[12]. 研究表明, miR-124与自身免疫性疾病也密切相关. 实验性变态反应性脑脊髓炎是人类多发性硬化的动物模型, Ponomarev等[13]发现miR-124在调节中枢神经系统小神经胶质细胞静止状态中起重要作用, miR-124通过调节转录因子CCAAT/增强子结合蛋白α-转录因子PU.1(CCAAT/enhancer-binding protein α-transcription factor PU.1, C/EBP-α-PU.1)通路使巨噬细胞失活, 从而抑制实验性变态反应性脑脊髓炎. 另一项研究指出, 在类风湿性关节炎患者中, miR-124可调节其成纤维样滑膜细胞的增殖及产生趋化因子的能力[14]. 此外, Koukos等[15]发现miR-124在儿童UC患者的病变肠组织中下调, 其通过靶作用于信号传导与转录激活因子3调节肠道炎症的发生发展. 目前, 对于miR-124在CD中的作用仍不明确.
AHR是一种配体依赖性激活的转录因子, 他在进化上高度保守, 且在多种细胞中表达. 在非激活状态时, AHR存在于胞浆中, 当配体和他结合并使其激活时, AHR从胞浆进入胞核, 与芳香烃受体核转位子结合形成二聚体, 促进启动子区含有外源性生物反应元件的基因转录[16,17]. AHR有多种配体, 包括芳香烃类、色氨酸衍生物及类黄酮类等[18]. AHR参与宿主对环境刺激做出的免疫应答, 其对调节免疫应答和维持免疫内稳态有重要作用. 适度的AHR的激活对宿主有保护性作用, 而过度的激活则会导致免疫内稳态失调并促进炎症的发生发展[19]. AHR参与Th17及调节性T细胞(regulatery T cell, Treg细胞)的分化, AHR的异常表达会打破Th17及Treg细胞之间的平衡状态, 在一些自身免疫性疾病动物模型, 包括实验性变态反应性脑脊髓炎、关节炎及结肠炎等的发病中起重要作用. 近期研究发现, AHR在IBD患者肠道组织中低表达, 其细胞通路可以通过白介素-22抑制实验性结肠炎小鼠的肠道炎症[20]. AHR还可以通过影响Th17及Treg细胞的分化减轻硫酸葡聚糖钠诱导的小鼠实验性结肠炎[21]. 这些研究表明AHR在CD的发病中起到重要的调控作用. 但是到目前为止, 关于慢性炎症状态下AHR如何被调节的研究仍然很少.
本研究通过定量PCR检测活动期CD患者病变肠道黏膜组织中miR-124的表达情况, 发现其明显高于正常对照组. 利用生物信息学预测软件, 我们得出AHR可能是miR-124的靶点之一, 并通过在Caco-2细胞中过表达或抑制表达miR-124及荧光素酶报告基因实验进一步验证: 转染pre-miR-124后AHR蛋白表达水平降低, 荧光素酶活性下降; 转染anti-miR-124后AHR蛋白表达水平升高, 荧光素酶活性上升. 充分证明在CD中miR-124靶作用于AHR, 并转录后水平调节AHR蛋白表达.
这一发现不仅为研究miR-124调控CD的发病机制提供证据, 同时miR-124和AHR也有望成为诊断CD的生物学标志及治疗靶点. 然而, miR-124通过调控AHR进一步影响肠道炎症发生发展的机制仍待进一步研究.
克罗恩病(Crohn's disease, CD)是一种慢性复发性炎症性疾病, 其发病率及患病率逐年升高, 加强其发病机制的研究有助于指导诊断和治疗. microRNAs(mi-RNAs)参与调控多种生物学功能, 在CD的发病机制中起重要作用.
江学良, 教授, 主任医师, 中国人民解放军济南军区总医院消化科
研究发现, 多种自身免疫性疾病中都有miRNAs的表达改变, 探索miRNAs的作用靶点及其调控机制是当前亟待研究的问题.
Ponomarev等发现miR-124可抑制实验性变态反应性脑脊髓炎. Nakamachi等发现miR-124调节类风湿性关节炎患者成纤维样滑膜细胞的增殖及产生趋化因子的能力. Koukos等发现miR-124在儿童溃疡性结肠炎患者中表达下降, 通过靶作用于转录激活因子3调节肠道炎症的发生发展.
本文检测了miR-124在CD患者病变肠道黏膜组织中的变化情况, 并进一步在体外试验中证实了芳香烃受体(aryl hydrocarbon receptor, AHR)可能是miR-124的直接作用靶点.
本实验为CD发病机制研究提供了新的靶点, 为miR-124用于CD的诊断及治疗提供了初步的理论依据.
AHR: 一种配体依赖性转录因子, 存在于多种细胞中, 参与调节Th17及调节性T细胞的分化, 有助于维持机体的免疫内稳态.
实验设计合理, 为研究miR-124调控克罗恩病的发病机制提供了证据, 其在CD炎症反应瀑布链中的作用还需要进一步探讨.
编辑 郭鹏 电编 鲁亚静
| 1. | Khor B, Gardet A, Xavier RJ. Genetics and pathogenesis of inflammatory bowel disease. Nature. 2011;474:307-317. [PubMed] [DOI] |
| 3. | Molodecky NA, Soon IS, Rabi DM, Ghali WA, Ferris M, Chernoff G, Benchimol EI, Panaccione R, Ghosh S, Barkema HW. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. Gastroenterology. 2012;142:46-54.e42; quiz e30. [PubMed] [DOI] |
| 4. | Niwa R, Slack FJ. The evolution of animal microRNA function. Curr Opin Genet Dev. 2007;17:145-150. [PubMed] [DOI] |
| 5. | Lee HC, Li L, Gu W, Xue Z, Crosthwaite SK, Pertsemlidis A, Lewis ZA, Freitag M, Selker EU, Mello CC. Diverse pathways generate microRNA-like RNAs and Dicer-independent small interfering RNAs in fungi. Mol Cell. 2010;38:803-814. [PubMed] [DOI] |
| 6. | Iborra M, Bernuzzi F, Invernizzi P, Danese S. MicroRNAs in autoimmunity and inflammatory bowel disease: crucial regulators in immune response. Autoimmun Rev. 2012;11:305-314. [PubMed] [DOI] |
| 7. | Ceribelli A, Satoh M, Chan EK. MicroRNAs and autoimmunity. Curr Opin Immunol. 2012;24:686-691. [PubMed] [DOI] |
| 8. | Dalal SR, Kwon JH. The Role of MicroRNA in Inflammatory Bowel Disease. Gastroenterol Hepatol (N Y). 2010;6:714-722. [PubMed] |
| 9. | Maharshak N, Shenhar-Tsarfaty S, Aroyo N, Orpaz N, Guberman I, Canaani J, Halpern Z, Dotan I, Berliner S, Soreq H. MicroRNA-132 modulates cholinergic signaling and inflammation in human inflammatory bowel disease. Inflamm Bowel Dis. 2013;19:1346-1353. [PubMed] [DOI] |
| 10. | Chen Y, Xiao Y, Ge W, Zhou K, Wen J, Yan W, Wang Y, Wang B, Qu C, Wu J. miR-200b inhibits TGF-β1-induced epithelial-mesenchymal transition and promotes growth of intestinal epithelial cells. Cell Death Dis. 2013;4:e541. [PubMed] [DOI] |
| 11. | Chen Y, Wang C, Liu Y, Tang L, Zheng M, Xu C, Song J, Meng X. miR-122 targets NOD2 to decrease intestinal epithelial cell injury in Crohn's disease. Biochem. Biophys Res Commun. 2013;438:133-139. [PubMed] [DOI] |
| 12. | Visvanathan J, Lee S, Lee B, Lee JW, Lee SK. The microRNA miR-124 antagonizes the anti-neural REST/SCP1 pathway during embryonic CNS development. Genes Dev. 2007;21:744-749. [PubMed] [DOI] |
| 13. | Ponomarev ED, Veremeyko T, Barteneva N, Krichevsky AM, Weiner HL. MicroRNA-124 promotes microglia quiescence and suppresses EAE by deactivating macrophages via the C/EBP-α-PU.1 pathway. Nat Med. 2011;17:64-70. [PubMed] [DOI] |
| 14. | Nakamachi Y, Kawano S, Takenokuchi M, Nishimura K, Sakai Y, Chin T, Saura R, Kurosaka M, Kumagai S. MicroRNA-124a is a key regulator of proliferation and monocyte chemoattractant protein 1 secretion in fibroblast-like synoviocytes from patients with rheumatoid arthritis. Arthritis Rheum. 2009;60:1294-1304. [PubMed] [DOI] |
| 15. | Koukos G, Polytarchou C, Kaplan JL, Morley-Fletcher A, Gras-Miralles B, Kokkotou E, Baril-Dore M, Pothoulakis C, Winter HS, Iliopoulos D. MicroRNA-124 regulates STAT3 expression and is down-regulated in colon tissues of pediatric patients with ulcerative colitis. Gastroenterology. 2013;145:842-852.e2. [PubMed] [DOI] |
| 16. | Barouki R, Coumoul X, Fernandez-Salguero PM. The aryl hydrocarbon receptor, more than a xenobiotic-interacting protein. FEBS Lett. 2007;581:3608-3615. [PubMed] [DOI] |
| 17. | Esser C, Rannug A, Stockinger B. The aryl hydrocarbon receptor in immunity. Trends Immunol. 2009;30:447-454. [PubMed] [DOI] |
| 18. | Monteleone I, MacDonald TT, Pallone F, Monteleone G. The aryl hydrocarbon receptor in inflammatory bowel disease: linking the environment to disease pathogenesis. Curr Opin Gastroenterol. 2012;28:310-313. [PubMed] [DOI] |
| 19. | Arsenescu R, Arsenescu V, Zhong J, Nasser M, Melinte R, Dingle RW, Swanson H, de Villiers WJ. Role of the xenobiotic receptor in inflammatory bowel disease. Inflamm Bowel Dis. 2011;17:1149-1162. [PubMed] [DOI] |
| 20. | Monteleone I, Rizzo A, Sarra M, Sica G, Sileri P, Biancone L, MacDonald TT, Pallone F, Monteleone G. Aryl hydrocarbon receptor-induced signals up-regulate IL-22 production and inhibit inflammation in the gastrointestinal tract. Gastroenterology. 2011;141:237-248, 248.e1. [PubMed] [DOI] |