修回日期: 2014-03-09
接受日期: 2014-03-13
在线出版日期: 2014-04-18
目的: 超声观察肝癌性质及其血流情况, 并探讨缺氧诱导因子-1α(hypoxia inducible factor-1 alpha, HIF-1α)与微血管密度(microvessel density, MVD)在肝癌组织中的表达情况及二者间关系.
方法: 对60例经病理证实的原发性肝癌手术切除术前进行二维及彩色多普勒超声检查, 进行血流分级, 通过实验室免疫组织化学的方法检测HIF-1α、MVD在肝癌组织中的表达.
结果: 血流等级和HIF-1α、MVD相关, 在肝癌组织中当血流分级为Ⅲ级时HIF-1α、MVD表达率最高, 分别为81.6%(92.61%±3.10%)、80.1%(85.16%±2.33%), 在正常肝组织中HIF-1a、MVD表达率分别为12.28%±7.21%, 为11.33%±7.21%, 二者比较具有显著性差异(P<0.05). HIF-1α的表达与肝癌新生血管的生成密切相关, MVD高表达、HIF-1α表达越高, 彩色多普勒显示血流越丰富.
结论: 彩色多普勒超声结合上述指标可从不同方面反映肝癌血管生成的特性, 有利于对肝癌血管生成进行评估.
核心提示: 彩色多普勒超声检测肝癌内血流可分0、Ⅰ、Ⅱ、Ⅲ级, 通过免疫组织化学验证微血管密度(microvessel density, MVD)、缺氧诱导因-1α(hypoxia inducible factor-1 alpha, HIF-1α)在肝癌组织中呈阳性表达, Ⅲ级血流信号组织中MVD、HIF-1α表达最高; 血流信号Ⅰ级表达相应减低, 故解释了恶性肿瘤的侵袭性.
引文著录: 张璟卓, 刘颖, 马艳艳. 超声检测肝癌血流分级及其与HIF-1α、MVD表达的关系. 世界华人消化杂志 2014; 22(11): 1587-1591
Revised: March 9, 2014
Accepted: March 13, 2014
Published online: April 18, 2014
AIM: To investigate the ultrasonic signs of hepatocellular carcinoma (HCC), the expression of hypoxia inducible factor-1 alpha (HIF-1α) and microvessel density (MVD), and to analyze their correlations.
METHODS: Sixty patients who underwent duplex sonography and color Doppler ultrasonography before surgery and were surgically proved to have HCC were included. Immunohistochemical method was used to detect the expression of HIF-1α and MVD in HCC.
RESULTS: There was a correlation between blood flow grade and MVD. In liver cancer tissues when blood flow classification was grade Ⅲ, the rates of HIF-1α and MVD expression were highest [81.6% (92.61% ± 3.10%), 80.1% (85.16% ± 2.33%)], significantly higher than those in normal liver tissues (12.28% ± 7.21%, 11.33%±7.21%, P < 0.05 for both). The expression of HIF-1α is related closely to hepatocellular carcinoma angiogenesis; higher expression of MVD was associated with higher expression of HIF-1α and more abundant blood flow.
CONCLUSION: Combination of color Doppler flow imaging and immunohistochemical parameters is useful for evaluating the angiogensis of HCC.
- Citation: Zhang JZ, Liu Y, Ma YY. Relationship between blood flow assessed by ultrasound, MVD and expression of HIF-1α in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(11): 1587-1591
- URL: https://www.wjgnet.com/1009-3079/full/v22/i11/1587.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i11.1587
原发性肝癌是当前最常见的恶性肿瘤之一, 初期诊断及治疗预后效果的评价成为探究重心. 肝癌肿瘤生长转移, 普遍认为依赖于形成的新生血管, 新生肿瘤血管是肿瘤快速生长的根本和形态学依据, 肿瘤血管生成与实体肿瘤的生长和转移密切相关, 新生血管以其独有特性协同抑制因子产生共性从而调控肝癌血管生成[1]. 缺氧诱导因-1α(hypoxia inducible factor-1 alpha, HIF-1α)为特异性低氧状况下发挥活性的转录因子, 表达广泛, 是必要正向调控因子, 在多种恶性肿瘤中介入肿瘤血管生成, 发展并形成新生血管. 微血管密度(microvessel density, MVD)是血管形成的固有指标, 用CD31单克隆抗体标记肿瘤血管内皮细胞, 计数其肿瘤微血管密度能较准的反映血管生成活性, 与肿瘤的预后密切相关[2]. 本文利用彩色多普勒血流成像技术, 结合免疫组织化学方法检测肝癌血管生成活性相关的指标, 从微观与宏观两方面深入研究并探讨肝癌血管生成的特性.
超声彩色多普勒诊断仪为HITACHI EUB-7500型(日立公司), 探头频率3.5-4.0 MHz. 收用大连医科大学附属第二医院2006年以来两年间诊断为原发性肝癌病例, 男50例, 女10例, 共60例, 平均年龄51岁±13岁. 60例肝癌根据直径范围分为小肝癌型(直径<3 cm)9例、结节型(直径>3 cm且<10 cm)43例、巨块型(直径>10 cm)8例. 弥漫型肝癌不被选为研究对象, 全部病例无干预治疗, 术前需超声检查, 术后石蜡切片, 最后利用免疫组织化学法行实验室检察.
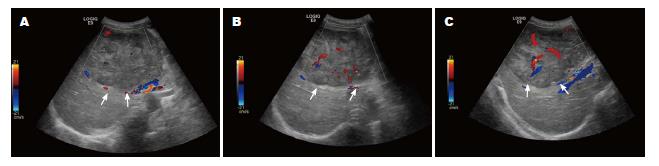
1.2.1 超声检查及分级: 患者取仰卧位及左侧卧位, 先于二维超声下观察肝脏内肿块位置再确定其大小、形态、内部回声. 继而行彩色多普勒观测肿块内部及周边血流情况, 将肿块血流进行分级[3]: 0级, 肿瘤内无明显血流; Ⅰ级, 肿瘤内有血流, 但较少, 呈点状; Ⅱ级, 肿瘤内有较丰富的血供, 显示为条状血流信号; Ⅲ级, 肿瘤内血流丰富, 多条粗大血管穿行. 脉冲多普勒评估瘤体内血流的性质.
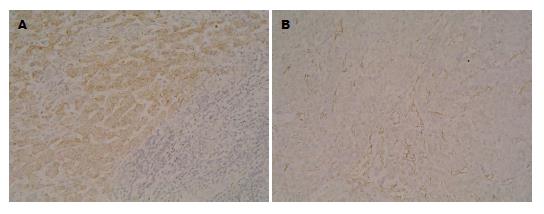
1.2.2 免疫组织化学检测HIF-1α的表达: HIF-1α抗体(兔抗人, 配比1:200) CD31抗体(鼠抗人, 配比1:150)(北京中山试剂公司), 二抗即用型SP免疫组织化学试剂盒、DAB显色试剂盒, 用 PBS代替各种-抗作为阴性对照. (1)将肿瘤组织石蜡包埋标本24 h; (2)连续切片; (3)脱蜡至水, PBS缓冲液冲洗3次; (4)3%过氧化氢封闭10-15 min, 灭活其内部过氧化酶; (5)100 ℃高压修复抗原, 自然冷却至室温后清水冲洗; (6)山羊血清封闭, 室温孵育10-15 min; (7)滴加一抗37 ℃水箱孵育2 h(4 ℃过夜)后PBS冲洗3次; (8)滴加二抗, 室温放置10-15 min后PBS冲洗3次; (9)滴加SP溶液, 室温放置10-15 min, PBS冲洗3次, 拭干; (10)DAB显色, 镜下观察组织呈金黄色后立即蒸馏水冲洗, 停止显色, 苏木复染30 s, 流水冲洗, 梯度酒精脱水, 烤片, 中性树胶封片.
1.2.3 免疫结果判定: HIF-1α判定标准: 镜下主要位于肿瘤细胞胞质内, 以橙黄色细颗粒为阳性细胞, 按Birner[4]的方法判断, 连续观察以阳性细胞占总细胞数的百分比进行半定量处理, 1分: 阳性细胞数<10%, 2分: 阳性细胞数在10%-50%, 3分: 阳性细胞数在51%-80%间, 4分: 阳性细胞数>80%. 综合染色强度: 1分: 染色弱且非阴性对照者, 2分: 染色清晰者, 3分: 染色强者. 上述两项评分相加: <3分为(-), 3分为(+), 4-5分(++), 6-7分(+++). CD31判定标准: 位于肿瘤间质血管内皮细胞质内的棕色颗粒为阳性, 在高倍镜下选择几个不同视野计数, 计算每个单一视野平均血管数, 取其均数即MVD[4]. Weidner微血管密度计算方法[5], 在肿瘤细胞组织和肿瘤细胞相邻的毛细血管, 肿瘤细胞之间的一个明确的界定, 并染成棕色的新肿瘤血管内皮细胞团. 先在低倍镜下选择新生血管最密集区, 再在高倍镜下计数, 取其均数为该例的微血管密度.
统计学处理 所有数据以mean±SD表示, 均数间使用SPSS16.0统计软件进行比较. 应用方差分析MVD与HIF-1α组间关系. 应用Spearman分析血流等级与MVD、HIF-1α双变量表达相关关系. P<0.05为差异有统计学意义.
在60例肝癌组织中随着肝癌血流分级的增高, MVD、HIF-1α表达增高, 当血流分级为Ⅲ级时HIF-1α表达率最高, 为81.6%(92.61%±3.10%); MVD表达率为80.1%(85.16%±2.33%), 在正常肝组织中HIF-1α表达率为12.28%±7.21%, MVD为11.33%±7.21%, 二者比较具有显著性差异(P<0.05). 肝癌组织中MVD、HIF-1α阳性表达率均为71%以上, 且肝癌组织中HIF-1α的表达与MVD间均具有显著的正相关性(P<0.05). 肝癌血流分级组间比较, 具有明显差异, 血流等级高组HIF-1α阳性表达高于血流等级低组, 肝癌血流等级与HIF-1α阳性表达呈正相关. 将肝癌彩色血流参数、血流等级与HIF-1α、MVD阳性表达率相关性分析, MVD阳性表达率与血流等级相关, HIF-1α阳性表达率和血流等级正相关(P<0.05, 表1, 图1, 2).
| 血运分级 | n | HIF-1α阳性 | MVD阳性 |
| 0 | 15 | 41.50±3.21 | 20.57±2.26 |
| I | 20 | 64.37±3.02 | 39.32±3.71 |
| II | 15 | 79.94±2.97 | 62.25±3.80 |
| III | 10 | 92.61±3.10 | 85.16±2.33 |
| P值 | <0.05 | <0.05 |
肝癌的死亡率高, 容易并发转移, 一般发现多半为晚期, 因此寻找一种无创而又准确、快捷的影像学检查方法对患者进行诊治, 并通过该方法来检测肝癌的发生、发展以及转移是具有极其重要的作用. 彩色多普勒超声是目前观察血管生成最先进、最方便的技术, 对肿瘤血管的生长程度、分布、血流性质、数量、血流动力学参数等提供重要信息. 肝癌是高血管实性肿瘤, 彩超可检测肝癌的供血小动脉血流信号[6]. 对肝脏肿瘤彩色多普勒血流与血管生成关系深入研究, 有助于进一步了解肿瘤发生程度.
肿瘤血管新生因子HIF-1α、MVD是目前常用的评价血管生成的免疫组织化学指标. 通过计数肿瘤微血管密度, 可对肿瘤血管进行定量研究, 还可区分血管种类[7,8]. 恶性肿瘤的新生血管分为无血管的侵袭前期和有血管的侵袭期, 也就是说是重要部分为血管生成的侵袭期, 是一种新的肿瘤生物学特征. 在初期, 肿瘤并不会诱发血管生成, 增殖的单细胞, 依靠周边组织来提供养料, 体积有限, 所以不会发生转移; 当肿瘤进一步增大时, 促进肿瘤增殖, 便进入血管的生成期, 肿瘤细胞迅速增大, 便具有转移能力. 随着肿瘤内大量微血管生成, 获得大量营养, 肿瘤细胞游离出血管的能力增大, 最终肝癌细胞血管生成[9], 因而导致转移和浸润的机动性增加. HIF-1α的靶基因是实体肿瘤适应缺氧, 糖酵解增加, 新的血管生成, 调控MVD基因和糖酵解中多种关键酶基因[10]. 在肿瘤向血管生成型发生改变的初期过程中, 肝癌细胞株中HIF-1α阳性率上调, 引领肝癌细胞株表达MVD等基因[11]. HIF-1α在肝癌中广泛表达, 与其肝转移呈正相关, 与肝癌的分化程度呈负相关[12]. 而MVD的异常改变是肝癌发生转移的重要标志, 在肝癌血管新生与恶性生长中发挥重要的作用, 对预测肝癌术后有无复发有重要的意义[13].
本研究对肝癌MVD及HIF-1α表达与超声参数研究发现, 在MVD高表达组中, 其血流分级均高于MVD低表达组, MVD血流分级具有相关性. 60例肝癌组织中MVD、HIF-1α阳性表达率均为71%以上, 且肝癌组织中HIF-1α的表达与MVD间均具有显著的正相关性(P<0.05). 故新生血管系统在肿瘤中分布是不均的[14], Ⅲ级血流信号组织中, 新生血管活跃度最高, MVD表达最高; 血流信号Ⅰ级, MVD表达相应减低, 故解释了恶性肿瘤的侵袭性. 其机制: 间质内的微血管被大量的肿瘤细胞增生挤压, 以致缺氧, 从而启动癌细胞分泌血管因子促使血管内皮细胞增生, 使微血管密度增加, 补充肿瘤细胞对氧气及营养的需要, 增生的内皮细胞能大批的分泄出生长因子, 直接促成肿瘤细胞的增殖[15]. 在HIF-1α与MVD表达阳性组间血流无明显统计学差异, HIF-1α可能只是其中之一, 并没有起到决定性作用; 其次, HIF-1α通过提高肿瘤血管的通透能力来影响肿瘤内血流, 而MVD直接反映肿瘤血管增生程度; 免疫组织化学检测在组织取材方面仅能反映肿瘤局部区域的表达, 不能全面显示整个肿瘤的情况[16]. 因此, 本研究表明MVD、HIF-1α均只可作为间接评价活体内肝癌肿瘤组织内的血管生成情况的指标.
总之, 在肝癌的影像学诊断上超声发挥了极其重要作用, 血流分级是体现肿瘤血流丰富程度的重要指标, 在超声图象上可宏观表现, 正确判断血流情况. 而MVD、HIF-1α阳性表达数据可微观地反映血管丰富程度, 结构异常变化的病理过程, 缺氧诱导因子被激活, 促使肝癌新生血管体系的形成, HIF-1α蛋白表达过度, MVD调控转录, 从而肿瘤细胞发生增殖. 所以将肝癌组织超声血流分级与免疫组织化学染色相结合对临床评估肝癌治疗效果提供理论依据.
肝癌的死亡率高, 容易并发转移, 一般发现多半为晚期; 因此以无创、准确、快捷的影像学检查对患者进行诊断成为重中之重, 并能通过该方法来检测肝癌的发生、发展以及转移从而赢得有效治疗时间.
李健丁, 教授, 山西医科大学第一医院放射科CT室
肝癌是高血管实性肿瘤, 彩色多普勒超声是目前观察肝癌血管生成最优便的技术, 新生肿瘤血管是肿瘤快速生长的根本, 微血管密度(microvessel density, MVD)、缺氧诱导因-1α(hypoxia inducible factor-1 alpha, HIF-1α)在多种恶性肿瘤中介入肿瘤血管生成, 将超声与免疫组织化学方法结合对诊断肝癌的发生、发展起到更加重要的作用.
肖际东等采用彩色多普勒超声检测45例肝癌肿瘤血流信号, 计测阻力指数、相对灌注率、血流分级, 并采用免疫组织化学技术检测肿瘤MVD及VEGF表达, 彩色多普勒超声联合免疫组织化学指标可从不同角度反映肝癌血管生成特征.
本文回顾对60例经病理证实的原发性肝癌手术切除术前进行二维及彩色多普勒超声检查, 进行血流分级, 并通过实验室免疫组织化学的方法检测HIF-1α、MVD在肝癌组织中的表达.从微观与宏观两方面深入研究并探讨肝癌血管生成的特性.
目前在国内外文献中, 研究HIF-1α、MVD在肝癌中的表达的较多, 但将HIF-1α、MVD与超声血流分级结合在一起的较少. 本文研究讨论超声在肝癌血流分级判定中的作用, 并证明了其与HIF-1α、MVD表达相关性.
编辑 郭鹏 电编 鲁亚静
| 1. | Luo SR, Duan YY, Zhao BS, Yuan LJ. Hemodynamic changes in hepatic cancer before and after cluster electrode radio-frequency ablation. Hepatobiliary Pancreat Dis Int. 2002;1:215-218. [PubMed] |
| 3. | Kudo K, Arao T, Tanaka K, Nagai T, Furuta K, Sakai K, Kaneda H, Matsumoto K, Tamura D, Aomatsu K. Antitumor activity of BIBF 1120, a triple angiokinase inhibitor, and use of VEGFR2+pTyr+ peripheral blood leukocytes as a pharmacodynamic biomarker in vivo. Clin Cancer Res. 2011;17:1373-1381. [PubMed] [DOI] |
| 4. | Yoshiji H, Kuriyama S, Noguchi R, Yoshii J, Ikenaka Y, Yanase K, Namisaki T, Kitade M, Yamazaki M, Akahane T. Amelioration of carcinogenesis and tumor growth in the rat liver by combination of vitamin K2 and angiotensin-converting enzyme inhibitor via anti-angiogenic activities. Oncol Rep. 2006;15:155-159. [PubMed] |
| 7. | 刘 延, 李 湘竑, 杨 定华, 刘 萧, 钟 克波, 毕 民平, 李 光辉, 廖 晓明. SENP-1和HIF-1a在肝细胞肝癌中的表达及临床意义. 中山大学学报(医学科学版). 2012;33:465-470. |
| 8. | 穆 四清, 张 峰. 缺氧诱导因子-1a的表达与肝癌血管生成的关系. 南京医科大学学报(自然科学版). 2006;26:172-175. |
| 9. | Safarova AF, Iurtaeva VR, Kotovskaia IuV, Kobalava ZhD. [The state of carotid arteries in young men with arterial hypertension]. Kardiologiia. 2012;52:22-25. [PubMed] |
| 13. | Pertovaara M, Kähönen M, Juonala M, Laitinen T, Taittonen L, Lehtimäki T, Viikari JS, Raitakari OT, Hurme M. Autoimmunity and atherosclerosis: the presence of antinuclear antibodies is associated with decreased carotid elasticity in young women. The Cardiovascular Risk in Young Finns Study. Rheumatology (Oxford). 2009;48:1553-1556. [PubMed] [DOI] |
| 14. | Ho JW, Man K, Sun CK, Lee TK, Poon RT, Fan ST. Effects of a novel immunomodulating agent, FTY720, on tumor growth and angiogenesis in hepatocellular carcinoma. Mol Cancer Ther. 2005;4:1430-1438. [PubMed] [DOI] |
| 15. | Yoysungnoen P, Wirachwong P, Bhattarakosol P, Niimi H, Patumraj S. Antiangiogenic activity of curcumin in hepatocellular carcinoma cells implanted nude mice. Clin Hemorheol Microcirc. 2005;33:127-135. [PubMed] |