修回日期: 2014-02-23
接受日期: 2014-02-28
在线出版日期: 2014-04-18
目的: 观察溃疡性结肠炎(ulcerative colitis, UC)大鼠Treg/Th17细胞的变化特点及薏苡附子败酱散对Treg/Th17的影响.
方法: 采用2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzenesulfonic acid solution, TNBS)法制作UC大鼠模型, 随机分为4组: 正常组、模型组、薏苡附子败酱散(Fuzi Baijiang powder, YFB)组、阳性药美沙拉嗪缓释颗粒(positive drug mesalazine SR Granules, 5-ASA)组. 治疗14 d后取标本, 观察肉眼形态学改变及显微镜下黏膜损伤情况, 采用ELISA法测定血清中白介素-17(interleukin-17, IL-17)、IL-10活性; 采用实时荧光定量PCR法检测结肠组织中RORγt、Foxp3 mRNA的表达.
结果: 与正常组相比, 模型组大鼠结肠黏连伴肠腔扩张, 肠壁增厚, 组织水肿、充血, 有溃疡形成. 病理切片HE染色后在光镜下观察, 部分黏膜出现充血坏死, 肉芽组织形成, 隐窝丢失, 炎症细胞浸润. 与模型组相比, YFB组及5-ASA组镜下病理组织评分明显降低(3.00±0.82 vs 8.00±0.82 vs 12.50±1.29, 均P<0.05), 血清IL-17、IL-10含量有显著差异(22.26±3.95 vs 39.62±4.26 vs 53.86±2.51, 48.72±1.05 vs 44.16±1.90 vs 38.88±0.80, 均P<0.05), YFB及5-ASA组间比较, YFB能显著降低IL-17含量, 增加IL-10含量(均P<0.05). YFB及5-ASA组结肠组织RORγt、Foxp3 mRNA含量与模型组对比有显著差异(1.29±0.05 vs 1.32±0.87 vs 1.80±0.54; 2.81±0.17 vs 2.00±0.20 vs 0.47±0.04, 均P<0.05), 且与5-ASA组比较, YFB组RORγt mRNA含量明显下降(P<0.05), Foxp3 mRNA含量显著增加(P<0.05).
结论: 应用TNBS法成功建立了UC的大鼠模型. YFB能改善UC模型大鼠的炎症症状, 能明显的降低结肠组织中RORγt mRNA的表达, 降低血清IL-17的含量, 提高Foxp3 mRNA的表达, 增加IL-10的含量, YFB影响Treg/Th17细胞数量及功能是其发挥治疗溃疡性结肠炎大鼠炎症作用的机制之一.
核心提示: 溃疡性结肠炎多属本虚标实、寒热错杂之证, 薏苡附子败酱散方证兼顾了寒、湿、热、瘀、阳虚、脾虚等多种证候要素, 具有补虚泻实、寒热同调之功效, 与溃疡性结肠炎之矛盾病机特点相适应, 正是其能够临床用来治疗溃疡性结肠炎并取得良效的原因.
引文著录: 张双喜, 史仁杰. 薏苡附子败酱散对TNBS结肠炎模型大鼠Treg/Th17的影响. 世界华人消化杂志 2014; 22(11): 1542-1546
Revised: February 23, 2014
Accepted: February 28, 2014
Published online: April 18, 2014
AIM: To observe the changes of Treg/Th17 in rats with ulcerative colitis (UC) and the effects of Yiyi Fuzi Baijiang powder (YFB) on Treg/Th17.
METHODS: UC was induced in rats with trinitrobenzene sulfonic acid (TNBS). The rats were randomly divided into four groups: a normal group, a model group, a YFB group, and a mesalazine SR granules (5-ASA) group. Fourteen days after treatment, the rats were killed to take colonic and serum samples. Mucosal injury and microscopic morphological changes were measured. The levels of IL-17 and IL-10 in serum were determined by ELISA, and the mRNA expression of RORγt and Foxp3 was determined by RT-PCR.
RESULTS: Compared with the normal group, the model group showed significant adhesion, expansion, edema, hyperemia and ulceration. Light microscopic analysis showed mucosal congestion, necrosis, granulation tissue formation, crypt loss and inflammatory cell infiltration in the model group. Compared with the model group, the microscopic pathology scores in the YFB group and 5-ASA group were significantly lower (3.00 ± 0.82, 8.00 ± 0.82 vs 12.50 ± 1.29, P < 0.05 for both) and serum levels of IL-17 and IL-10 were significantly altered (22.26 ± 3.95, 39.62 ± 4.26 vs 53.86 ± 2.51, 48.72 ± 1.05, 44.16 ± 1.90 vs 38.88 ± 0.80, P < 0.05 for all). YFB significantly reduced the levels of IL-17 and increased the levels of IL-10 compared with the 5-ASA group (P < 0.05 for both). The mRNA expressions of RORγt and Foxp3 in the YFB group and 5-ASA group were significantly different compared with the model group (1.29 ± 0.05, 1.32 ± 0.87 vs 1.80 ± 0.54; 2.81 ± 0.17, 2.00 ± 0.20 vs 0.47 ± 0.04, P < 0.05 for all). Compared with the 5-ASA group, RORγt mRNA level decreased significantly (P < 0.05) and Foxp3 mRNA level increased significantly (P < 0.05) in the YFB group.
CONCLUSION: YFB can improve the symptoms of inflammation and reduce the expression of RORγt mRNA in colon tissue and the level of IL-17 in serum in rats with UC. In addition, YFB can increase the expression of Foxp3 mRNA and IL-10 and affect the number and function of Treg and Th17, which may be one of the mechanisms responsible for the therapeutic effects of YFB against UC.
- Citation: Zhang SX, Shi RJ. Effect of Yiyi Fuzi Baijiang powder on Treg/Th17 in rats with TNBS-induced colitis. Shijie Huaren Xiaohua Zazhi 2014; 22(11): 1542-1546
- URL: https://www.wjgnet.com/1009-3079/full/v22/i11/1542.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i11.1542
溃疡性结肠炎(ulcerative colitis, UC)是一种原因不明的非特异性的炎症性肠病, 病程漫长、易复发, 预后较差, 同时与大肠癌的发病存在一定关系, 被世界卫生组织列为现代难治病之一. 目前UC病因尚不明确, 免疫因素是临床及实验研究共同关注的焦点. 临床治疗UC的药物普遍存在副作用较大、疗效不肯定的特点, 具有免疫调节功效的中药方剂是临床研究的热点. 薏苡附子败酱散出自《金匮要略·疮痈肠痈浸淫病脉证并治第十八》, "肠痈之为病, 其身甲错, 腹皮急, 按之濡, 如肿状, 腹无积聚, 身无热, 脉数, 此为腹内有痈脓, 薏苡附子败酱散主之." 研究显示[1-4], 薏苡附子败酱散具有良好的抗炎, 抗肿瘤疗效, 也被广泛用于UC的治疗, 但缺乏具体作用机制的研究. 基于以上研究基础, 本实验将观察薏苡附子败酱散(Fuzi Baijiang powder, YFB)对UC模型大鼠Treg/Thl7细胞的影响, 并探讨其可能的作用机制.
Wistar大鼠, SPF级, 体质量200 g±20 g, 雌雄各半, 济宁鲁抗医药公司; 薏苡附子败酱散(薏苡仁30 g、附子6 g、败酱草15 g), 由河南中医学院第一附属医院药剂科提供; 美沙拉嗪缓释颗粒, 500 mg/袋, 10袋/盒, 法国爱的发制药公司; TNBS, Sigma公司; 大鼠白介素-17(interleukin-17, IL-17)、IL-10 ELISA试剂盒, RNA柱式提取试剂盒、逆转录试剂盒, 上海生工生物有限公司, SYBR GreenⅠ, 北京康为世纪公司; 引物合成: 上海生工生物工程技术公司.
1.2.1 实验动物模型的制备: 采用TNBS/乙醇法构建结肠炎大鼠模型. 大鼠适应性饲养1 wk后, 禁食不禁水24 h, 100 g/L水合氯醛3 mL/kg腹腔注射, 麻醉后, 倒悬位, 取12 cm长聚丙烯管(直径2 mm), 剪侧孔数处, 并由肛门插入8 cm达结肠部位, 快速注入药液(100 mg TNBS/kg+50%乙醇0.25 mL)后, 再注入约0.4 mL的空气, 以使聚丙烯管中的药液全部注入肠腔, 捏紧肛门, 提取大鼠尾巴保持倒立1 min, 以防注入液倒流, 并使药液与结肠充分接触, 待麻醉清醒后正常喂养. 以大便带血(或隐血阳性)、稀便或体质量减轻之一作为造模成功的标志.
1.2.2 实验药物配制: 薏苡附子败酱散: 先将药物浸泡30 min, 按照常规中草药煎煮方法, 煎煮提取2次, 过滤后合并提取液, 浓缩为生药浓度为0.6 g/mL的中药原液, 冷却后装入灭菌玻璃药瓶, 置于4 ℃冰箱保存备用. 美沙拉嗪缓释颗粒: 100袋溶于500 mL蒸馏水中, 配成浓度为0.l g/mL的混悬液备用.
1.2.3 实验分组及给药方式: 实验分组: 造模24 h后开始药物干预, 治疗组按成人剂量的7倍为有效剂量. 正常组: 生理盐水2 mL灌胃; 模型组: 生理盐水2 mL灌胃; YFB组: 6 g/(kg·d)灌胃; 阳性药美沙拉嗪缓释颗粒(positive drug mesalazine SR Granules, 5-ASA)组: 美沙拉嗪0.5 g/(kg·d)灌胃.
1.2.4 标本采集: 各组大鼠于造模14 d末, 禁食不禁水24 h, 腹腔注射100 g/L水合氯醛3 mL/kg, 麻醉后, 剖腹暴露腹主动脉, 负压管采取血液, 2000 r/min, 离心5 min后, 取血清, -80 ℃保存. 游离结肠组织, 沿肠系膜纵轴剖开, 冰生理盐水清洗, 取距肛门8 cm处组织, 一部分用10%甲醛固定, 常规石蜡包埋, 切片, 用于观察结肠组织病理学变化, 另一部分迅速投入液氮中, 后转入-80 ℃冰箱中保存.
1.2.5 结肠组织病理观察: 取全段结肠, 剪开, 生理盐水洗净, 平铺于白板上置于放大镜下肉眼观察结肠大体形态、结肠黏膜损伤情况; 将取出的新鲜结肠组织用4%中性甲醛固定、石蜡包埋、HE染色, 在显微镜下观察结肠组织的结构变化、炎症活动情况. 参照Iba等[5]的标准(表1)并作适当修改进行结肠组织病理学评分.
| 项目 | 0 | 1 | 2 | 3 |
| 上皮损伤 | 无 | 0-5% | 5%-10% | >10% |
| 腺体损伤 | 无 | 0-10% | 10%-20% | >20% |
| 杯状细胞破坏 | 无 | 轻度 | 中度 | 重度 |
| 炎细胞浸润 | 无 | 黏膜层 | 黏膜下层 | 结肠全层 |
| 溃疡深度 | 无 | 上皮层 | 黏膜固有层 | 黏膜肌层 |
1.2.6 ELISA法测定血清中IL-17、IL-10活性: 具体操作方法按照试剂盒说明书进行.
1.2.7 实时荧光定量PCR检测结肠组织中RORγt、Foxp3 mRNA的表达: 按RNA柱式提取试剂盒说明书提取结肠组织中的总RNA, 测定RNA 的浓度及纯度. 将提取的总mRNA逆转录为cDNA, 收集数据, 确定每个样品管中荧光强度增加到某一特定阈值时的扩增循环数(Ct值), 进行分析绘制每一反应管的扩增动力学曲线, 根据Ct值与标准模板初始拷贝的对数值作图, 得到该样品的标准曲线. rat actin上游引物: 5'-TTTAATGTCACGCACGATTTC-3', 下游引物: 5'- TGACGTGGACATCCGCAAAG-3'. Foxp3上游引物: 5'-TTCACCTATGCCACCCTCAT-3', 下游引物: 5'-ACTGCTCCCTTCTCACTCTCC-3'. RORγt上游引物: 5'-TACTGAAAGCAGGAGCAATGG-3', 下游引物: 5'-GCTGAGGAAGTGGGAAAAGTC-3'. 扩增条件为: 94 ℃ 2 min, 94 ℃ 20 s, 54 ℃ 20 s, 74 ℃ 20 s, 共45个循环.
统计学处理 数据以mean±SD表示, 运用SPSS19.0统计分析软件, 采用单因素方差分析, P<0.05为差异有统计学意义.
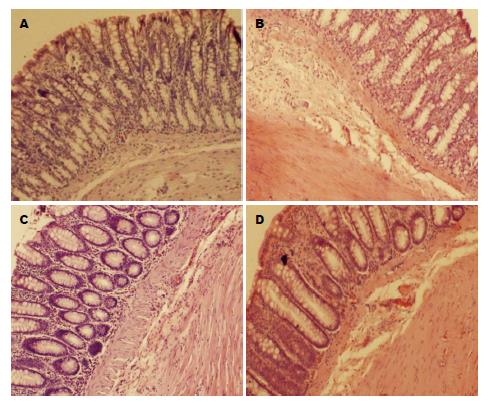
正常组肠壁黏膜及杯状细胞存在, 腺体结构正常, 无炎性细胞浸润; 模型组肠壁增厚水肿, 溃疡灶形成, 黏膜缺失, 腺体中断、破坏, 杯状细胞消失, 大量炎性细胞浸润至肌层, 肉芽肿形成; YFB组及5-ASA组肠壁稍水肿, 黏膜腺体未见明显破坏, 仅见散在的炎性细胞浸润, 无明显肉芽肿形成(图1). 模型组组织病理学评分显著高于正常组(P<0.01), YFB组及5-ASA组结肠组织病理学评分显著低于模型组(P<0.05)(表2).
YFB及5-ASA组血清IL-17含量显著低于模型组(P<0.05), 但与正常组相比均无明显差异; IL-10含量显著高于模型组和正常组(P<0.05); YFB及5-ASA组间比较, YFB能显著降低IL-17含量, 增加IL-10含量, 差异均有统计学意义(P<0.05)(表2).
YFB及5-ASA组结肠组织RORγt、Foxp3 mRNA含量与模型组对比有显著差异(P<0.05), 且与5-ASA组比较, YFB组RORγt mRNA含量明显下降(P<0.05), Foxp3 mRNA含量显著增加(P<0.05)(表2).
黏膜免疫系统的功能紊乱在UC的发病机制中发挥了重要的作用. 黏膜CD4+ T细胞通过释放前体炎症细胞因子在慢性炎症的持续和效应阶段起主导作用, 其在UC中的作用已得到公认. 传统的CD4+辅助性T细胞主要分为两个亚群: Th1细胞亚群和Th2细胞亚群. 既往认为Th1细胞和Th2细胞失衡是造成UC发病的主要原因[6-8], 但是还是有许多令人无法解释的现象. Thl7细胞亚群是近几年获广泛肯定的一类CD4+ T细胞亚群, 调节T细胞(regulatory T cell, Treg)是功能强大的专职抑制性T细胞, Th17和Treg细胞的分化相互抑制, 并且在功能上负性调节, 其动态平衡是维持免疫稳定的重要机制, 纠正Th17/Treg失衡将对肠道炎症起到抑制作用[9].
正常结肠黏膜结构完整, 黏膜壁及杯状细胞存在, 腺体结构正常, 无炎性细胞; 而UC黏膜缺失, 腺体中断, 杯状细胞消失, 大量炎性细胞浸润, 和本研究结果一致. TNBS大鼠出现便血、稀便等一系列症状, 显微镜下观察大量炎细胞浸润, 溃疡形成, 病理积分和正常组相比差异显著, 提示TNBS是UC大鼠造模的有效方法. 实验表明YFB可显著改善病理积分, 抑制炎症反应, 促进结肠黏膜损伤修复, 恢复结肠黏膜的分泌功能.
Th17细胞以分泌IL-17而得名, Fujino等[10]发现相对于正常人结肠黏膜或缺血性结肠炎患者的结肠黏膜, UC患者的炎性肠黏膜含有较高水平的Th17细胞及IL-17. RORγt是控制Th17细胞分化的特异性转录因子. 在动物实验中发现, 缺乏RORγt转录因子的小鼠体内几乎没有Th17细胞的存在, 这些资料暗示了RORγt转录因子对Th17细胞分化的重要性[11]. 本实验发现, 模型组同正常组相比, IL-17蛋白及RORγt mRNA显著升高, 推测可能由于转录因子RORγt的作用, 进而影响到Th17细胞的分化, 从而促进细胞因子IL-17的分泌, 引起炎性浸润, 溃疡形成. 而YFB组能明显改善RORγt mRNA的表达, 抑制IL-17的产生, 从而改善免疫损伤, 促进结肠黏膜的修复.
Foxp3是CD4+CD25+ Treg细胞的特异性转录因子和表面标记[12], Hori等[13]证实正常人类和小鼠胸腺及外周血中CD4+CD25+ T调节细胞特异性表达Foxp3, 逆转录该基因可以转化初始型T细胞, 使其成为具有调节功能的T调节细胞. Maul等[14]采用流式细胞术和real-time PCR分析CD4+CD25+ T调节细胞、Foxp3表达水平, 结果表明炎症性肠病患者外周血中CD4+CD25+ T调节细胞保持了他们的抑制活性, 疾病活动期CD4+CD25+调节细胞和Foxp3下降. IL-10是公认的抗炎因子, Treg细胞可通过细胞-细胞间直接接触并释放细胞因子如IL-10等抑制自身反应性T细胞的增值活化[15], 本实验发现YFB组Foxp3 mRNA及IL-10表达水平均上升, 而RORγt mRNA及IL-17表达水平下降, 从TH17和Treg细胞相互制衡的关系推断, YFB有可能是通过上调转录因子Foxp3的基因表达, 抑制RORγt mRNA的产生, 从而释放抑炎因子IL-10对抗促炎因子IL-17, 减轻黏膜的损伤.
本研究中, 证实YFB能够改善UC模型的黏膜损伤, 促进溃疡修复, 纠正Treg/Th17的失衡状态, 其机制可能与上调Foxp3基因表达及IL-10蛋白表达, 抑制RORγt mRNA及IL-17蛋白表达水平有关. 从YFB对UC模型大鼠的黏膜病理学影响、调控相关转录因子及细胞因子方面, 为临床应用薏苡附子败酱散治疗溃疡性结肠炎提供了客观的实验依据.
溃疡性结肠炎(ulcerative colitis, UC)是一种原因不明的非特异性的炎症性肠病, 病程漫长、易复发, 预后较差, 同时与大肠癌的发病存在一定关系, 被世界卫生组织列为现代难治病之一. 目前UC病因尚不明确, 免疫因素是临床及实验研究共同关注的焦点.
李康, 副教授, 广东药学院药科学院药物分析教研室
溃疡性结肠炎传统药物包括SASP、糖皮质激素和免疫抑制剂等, 虽然有效, 但存在不良反应多和患者依从性差等缺点. 生物制剂如英夫利昔单抗等治疗IBD有效, 但价格昂贵, 难以推广应用.
《金匮要略》:"肠痈之为病, 其身甲错, 腹皮急, 按之濡, ......此为腹内有痈脓, 薏苡附子败酱散主之." 研究显示, 薏苡附子败酱散具有良好的抗炎, 抗肿瘤疗效, 也被广泛用于UC的治疗, 但缺乏具体作用机制的研究.
本文在实验性结肠炎的基础上, 应用薏苡附子败酱散进行干预, 并与5-ASA作比较, 选取Th17及Treg细胞相关细胞因子IL-17、IL-10及转录因子RORγt和Foxp3等指标, 从免疫学角度评价薏苡附子败酱散的疗效, 更具有科学性.
本文设计合理, 数据可靠, 统计方法准确, 对溃疡性结肠炎的致病机制及防治有一定的指导意义.
编辑 田滢 电编 鲁亚静
| 5. | Iba Y, Sugimoto Y, Kamei C, Masukawa T. Possible role of mucosal mast cells in the recovery process of colitis induced by dextran sulfate sodium in rats. Int Immunopharmacol. 2003;3:485-491. [PubMed] |
| 6. | Berrebi D, Besnard M, Fromont-Hankard G, Paris R, Mougenot JF, De Lagausie P, Emilie D, Cezard JP, Navarro J, Peuchmaur M. Interleukin-12 expression is focally enhanced in the gastric mucosa of pediatric patients with Crohn's disease. Am J Pathol. 1998;152:667-672. [PubMed] |
| 7. | Parronchi P, Romagnani P, Annunziato F, Sampognaro S, Becchio A, Giannarini L, Maggi E, Pupilli C, Tonelli F, Romagnani S. Type 1 T-helper cell predominance and interleukin-12 expression in the gut of patients with Crohn's disease. Am J Pathol. 1997;150:823-832. [PubMed] |
| 8. | Heller F, Florian P, Bojarski C, Richter J, Christ M, Hillenbrand B, Mankertz J, Gitter AH, Bürgel N, Fromm M. Interleukin-13 is the key effector Th2 cytokine in ulcerative colitis that affects epithelial tight junctions, apoptosis, and cell restitution. Gastroenterology. 2005;129:550-564. [PubMed] |
| 9. | Dang EV, Barbi J, Yang HY, Jinasena D, Yu H, Zheng Y, Bordman Z, Fu J, Kim Y, Yen HR. Control of T(H)17/T(reg) balance by hypoxia-inducible factor 1. Cell. 2011;146:772-784. [PubMed] [DOI] |
| 10. | Fujino S, Andoh A, Bamba S, Ogawa A, Hata K, Araki Y, Bamba T, Fujiyama Y. Increased expression of interleukin 17 in inflammatory bowel disease. Gut. 2003;52:65-70. [PubMed] |
| 11. | Ivanov II, McKenzie BS, Zhou L, Tadokoro CE, Lepelley A, Lafaille JJ, Cua DJ, Littman DR. The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+ T helper cells. Cell. 2006;126:1121-1133. [PubMed] |
| 12. | Ramsdell F. Foxp3 and natural regulatory T cells: key to a cell lineage? Immunity. 2003;19:165-168. [PubMed] |
| 13. | Hori S, Nomura T, Sakaguchi S. Control of regulatory T cell development by the transcription factor Foxp3. Science. 2003;299:1057-1061. [PubMed] |
| 14. | Maul J, Loddenkemper C, Mundt P, Berg E, Giese T, Stallmach A, Zeitz M, Duchmann R. Peripheral and intestinal regulatory CD4+ CD25(high) T cells in inflammatory bowel disease. Gastroenterology. 2005;128:1868-1878. [PubMed] |
| 15. | Quentin J, Vicente R, Martire D, Mausset-Bonnefont AL, Jorgensen C, Louis-Plence P. A8.26 Inducible IL-10 secreting CD49b+Treg cells as cell based-therapy for rheumatoid arthritis. Ann Rheum Dis. 2014;73 Suppl 1:A86. [PubMed] [DOI] |