修回日期: 2014-02-26
接受日期: 2014-02-28
在线出版日期: 2014-04-18
目的: 探讨胃癌细胞的无血清悬浮培养与初步鉴定.
方法: 应用无血清DMEM/F12培养基悬浮培养胃癌细胞系SGC7901, 通过随机计数法计数不同时间窗形成的肿瘤细胞球数. 应用流式细胞技术检测肿瘤细胞球中CD24+、CD44+和Snail+细胞的含量及Western blot技术检测Snail蛋白在肿瘤细胞球中的表达.
结果: 胃癌细胞系SGC7901在无血清悬浮培养大约1 wk时形成肿瘤细胞球且数量最多, 肿瘤细胞球中CD24+、CD44+和Snail+细胞含量明显高于对照组的贴壁培养细胞(P<0.05), 并且Snail蛋白在肿瘤细胞球中高表达.
结论: 胃癌细胞在无血清悬浮培养下可形成肿瘤细胞球, 这类CD24+/CD44+细胞含量明显增多的肿瘤细胞球中Snail+细胞的含量及其Snail蛋白的表达较对照细胞均有显著升高.
核心提示: 应用无血清培养基以及超低吸附培养皿悬浮培养胃癌细胞, 可以稳定有效的获得高表达CD24/CD44及Snail的肿瘤细胞球.
引文著录: 吴丽霞, 王绪明, 张尚昆, 刘丽江. 胃癌细胞的无血清悬浮培养与初步鉴定. 世界华人消化杂志 2014; 22(11): 1531-1536
Revised: February 26, 2014
Accepted: February 28, 2014
Published online: April 18, 2014
AIM: To conduct the serum-free culture and preliminary identification of gastric cancer cells.
METHODS: We used serum-free DMEM/F12 medium to culture gastric cancer cell line SGC7901 and screened the stem cells of gastric cancer cell line. Tumorospheres were counted by random counting method. CD24+, CD44+ and Snail+ cells in tumorosphere were detected by flow cytometry, and expression of Snail protein in tumorospheres was detected by Western blot.
RESULTS: After gastric cancer cell line SGC7901 was maintained in serum-free medium for about a week, the largest number of tumorospheres formed. The numbers of CD24+, CD44+ and Snail+ cells in tumorospheres were significantly more than those in the control cells (P < 0.05). Snail protein was highly expressed in tumorospheres.
CONCLUSION: Serum-free suspension culture method allows to obtain gastric tumorospheres. Snail+ cells and expression of Snail significantly increased in tumorospheres in which the number of CD24+/CD44+ cells has a remarkable increase.
- Citation: Wu LX, Wang XM, Zhang SK, Liu LJ. Serum-free culture and preliminary identification of gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2014; 22(11): 1531-1536
- URL: https://www.wjgnet.com/1009-3079/full/v22/i11/1531.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i11.1531
胃癌为我国消化系最常见的恶性肿瘤之一, 一经发现多为进展期, 常伴有淋巴结及远处转移, 5年生存率低[1]. 肿瘤干细胞(cancer stem cells, CSCs)是指具有自我更新能力且可不定向分化的肿瘤细胞[2], 是存在于肿瘤组织中的少量恶性细胞, 与干细胞有着许多相似的特征[3]. 最近的研究证实, 形成球型集落的肿瘤干细胞具有更强的转移及侵袭能力[4]. Mani等[5]研究发现高表达Snail的细胞可通过促进上皮间质转化(epithelial-mesenchymal transition, EMT), 使肿瘤细胞具有更强的致瘤性、并表现出干细胞样的特性. 近年研究发现, 人胃癌细胞株(MKN-45、MKN-74、NCI-87、AGS、HGC-27、MGC-803)中存在胃癌干细胞[6-8]. 但是, 如何获得更多的胃癌干细胞, 如何鉴定胃癌干细胞仍是实验研究所面临的问题. 为进一步探索胃癌的侵袭和转移以及肿瘤干细胞的作用机制, 我们应用无血清悬浮培养的方法, 并对肿瘤细胞球进行鉴定, 以期在体外得到比较多的具有胃癌干细胞特性的肿瘤细胞, 为深入研究打下基础.
人胃癌细胞系SGC7901(由华中科技大学同济医学院免疫学教研室馈赠). 优质胎牛血清、DMEM和DMEM/F12培养基均购自Hyclone公司; EGF购自Gali-Bio公司; 碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)购自PeproTech公司; B27购自Gibco公司; 氢化可的松购自Sigma公司; 超低吸附培养皿100 mm购自Corning公司; Snail抗体购自Abcam公司; CD24、CD44购自BD公司; FITC-标记山羊抗兔购自Thermo公司; β-actin购自Santa Cruz公司; 山羊抗小鼠IgG/辣根酶和山羊抗兔IgG/辣根酶购自Jackson公司.
1.2.1 细胞系和培养基: 细胞系为人胃癌细胞系SGC7901. 含血清培养基(Serum containing medium, SSM)为含有10%胎牛血清的DMEM. 无血清培养基(serum free medium, SFM)为含有2%B27、0.5 µg/mL氢化可的松, 20 ng/mL的EGF和20 ng/mL bFGF的DMEM/F12(1:1).
1.2.2 肿瘤细胞球培养: 取长至培养瓶80%的SSM中培养的SGC-7901细胞, 用1×PBS洗涤2次后, 经胰酶-EDTA消化至轻轻晃动细胞可完全脱落再放置1 min后, 加入SSM终止消化, 机械吹打数次收集细胞1200 r/min离心3 min, 去上清后加入SFM轻轻吹打成单细胞悬液. 取100 μL细胞悬液加900 μL 1×PBS稀释, 用血球计数板计数后重悬于SFM中, 以5×103/mL接种于100 mm超低吸附培养皿中, 补充SFM至总培养液体积为10 mL. 放入37 ℃、5%CO2、95%湿度的培养箱中培养至第4天换液.
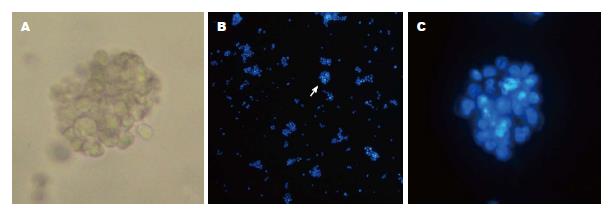
1.2.3 肿瘤细胞球的收集与鉴定: 当培养皿中形成肿瘤细胞球后, 计数并在倒置显微镜下拍照. 收集细胞球, 低速离心去上清液, 加入新鲜配制的4%多聚甲醛固定30 min, 涂在事先用0.5%明胶处理好的载玻片上, 自然晾干. 滴加适量hoechst33258(Beyotime)染色10 min, 1×PBS洗3遍, 每次5 min后于荧光显微镜下拍照.
1.2.4 流式细胞仪检测肿瘤细胞球的干细胞标志物: 无血清悬浮培养1 wk的肿瘤细胞球收集后经胰酶-EDTA消化成单细胞悬液, 以106个/100 μL浓度准备5组细胞样品. 于空白管和同型对照管加入20 μL细胞洗液(含2%BSA的PBS), 待测管分别加入浓度为20 μL/mL的CD24、CD44和Snail抗体, 4 ℃孵育30 min, 加入细胞洗液, 1200 r/min离心10 min, 反复洗涤2次. 于空白管加入细胞洗液, 同型对照管及待测管中加入浓度为20 μL/mL的荧光素FITC标记的二抗, 4 ℃避光孵育30 min后洗涤2次, 控干后加入1%多聚甲醛的PBS混匀后上流式细胞仪检测. 取对照的贴壁培养细胞, 用同样的方法检测CD24+、CD44+和Snail+细胞含量.
1.2.5 Western blot检测肿瘤细胞球中Snail的表达: 无血清悬浮培养1 wk的肿瘤细胞球收集后, 使用含1%PMSF的细胞裂解液(Thermo)冰上提取蛋白. 使用BCA蛋白浓度试剂盒(Thermo), 酶标仪A492波长测定蛋白浓度, 加入6×Loading buffer, 混匀煮沸8 min. 将蛋白上样于10%SDS-PAGE胶孔中, 每孔上样60 μg, 边缘孔中加入1×Loading buffer. 40 V电泳30 min后120 V电泳1 h. PVDF膜450 mA转膜, 70 min. 5%脱脂奶粉37 ℃封闭1 h. 由牛奶封闭液稀释的一抗(Snail 1:500; β-actin 1:1000)4 ℃孵育过夜. 牛奶封闭液稀释的二抗(1:1000), 37 ℃孵育1 h. 显影液(TianGEN)于暗室中显影. 采用Biostep Photoimpact凝胶分析系统软件测量各组Snail与β-actin条带的平均光密度值, 计算两者的比值, 进行相对定量.
统计学处理 采用SPSS17.0统计软件对全部数据进行统计分析, P<0.05为差异有统计学意义.
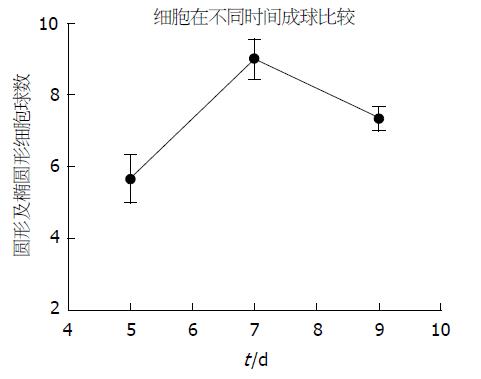
利用随机计数法计数第5、7、9天肿瘤细胞成球情况. 肿瘤细胞球为约50-100个细胞聚集成球型, 边界清楚(图1). 悬浮培养后第7天的肿瘤细胞球数量最多(图2).
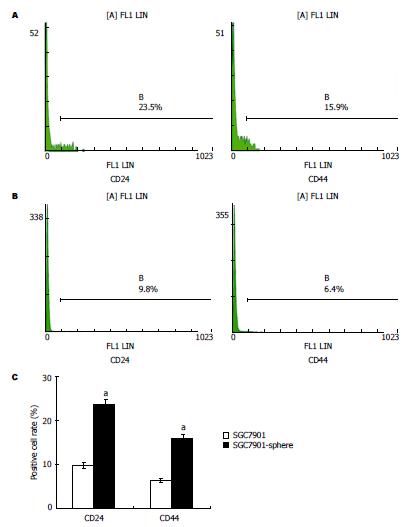
取SFM悬浮培养1 wk的肿瘤细胞球, 检测CD24+、CD44+细胞含量, 分别为23.5%和15.9%(图3A), 明显高于对照的贴壁培养的细胞(9.8%和6.4%)(P<0.05)(图3B, C).
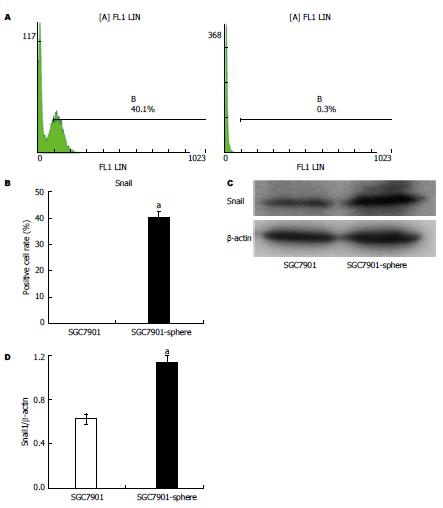
应用流式细胞仪检测中无血清悬浮培养的细胞和对照的贴壁培养的肿瘤细胞中Snail+细胞含量, 发现悬浮培养中的Snail+细胞数量为40.1%, 明显高于对照的贴壁培养的细胞(0.3%)(图4A, B), 两者比较差异有统计学意义(P<0.05)(图4B). 提取悬浮培养和对照的贴壁培养的细胞, 应用Western blot技术检测发现, 悬浮培养的肿瘤细胞球中Snail蛋白的表达, 明显高于对照的贴壁培养的细胞(P<0.05)(图4C, D).
1959年Makino等[9]首次指出肿瘤可能由肿瘤干细胞产生, 提出了肿瘤干细胞的假说. 1997年Bonnet等[10]首次在人急性髓性白血病的细胞中证实了CSCs的存在. 之后, 在许多实体肿瘤中也证实了CSCs的存在. 近年胃癌干细胞的研究也取得了一定进展, Takaishi等[6]发现在人胃癌细胞株(MKN-45、MKN-74、NCI-87)中存在干细胞特性的胃癌干细胞. 然而, 在体外如何获得更多的胃癌干细胞, 是研究胃癌重要生物学行为所面临的实际问题.
我们在乳腺癌MCF7细胞中获得肿瘤干细胞样细胞培养的经验[11], 应用无血清以及超低吸附培养皿悬浮培养胃癌细胞系SGC7901, 形成肿瘤细胞球的成球最佳时间大约在1 wk左右. 通过对肿瘤细胞球的检测发现, 肿瘤细胞球中CD24+、CD44+细胞含量与对照的贴壁细胞中CD24+、CD44+细胞含量比较差异有统计学意义.
Zheng等[12]同样用无血清培养法在胃癌细胞系SGC7901中分选出悬浮细胞, 检测结果发现CD44在悬浮细胞与贴壁细胞中的表达没有明显的统计学差异. 而Zhang等[7]在胃癌细胞系AGS中证实CD24+/CD44+细胞植入NOD/SCID鼠体内具有较强的致瘤性以及Song等[8]在HGC-27、MGC-803和MKN-45这3种细胞系中的研究, 结果发现CD24+/CD44+在悬浮细胞球中高表达. 与此相一致, 我们的结果显示, 胃癌肿瘤细胞球中CD24+和CD44+的细胞数量明显高于对照的贴壁生长的细胞. 与乳腺癌不同(CD24-/CD44+)[11]. 因此, 我们认为CD24+和CD44+可作为鉴定胃癌肿瘤干细胞的标志之一.
另外, 我们还应用流式细胞仪检测胃癌肿瘤细胞球中的Snail, 发现Snail+细胞含量明显增高, 与贴壁细胞中Snail+细胞含量比较具有差异性. 同时, 我们检测两者中Snail蛋白的表达, 也存在统计学差异. Snail为锌指蛋白超家族的第一个成员, 在转录调控、形成抑制性染色质结构、细胞信号和发育过程中发挥积极作用. 同时, Snail可促使EMT及E-cadherin和桥粒芯糖蛋白的降解[13,14], 被认为是促进肿瘤侵袭转移的重要因素之一[15]. 有研究发现Snail通过调节IL-8和其他基因的表达, 以诱导肿瘤干细胞的活性[16]. 由此我们推测, Snail可能也可作为胃癌肿瘤干细胞的标志物, 与CD24/CD44一起鉴定肿瘤细胞球细胞. Snail蛋白作为参与肿瘤侵袭与转移的重要分子, 其在胃癌细胞中的侵袭与转移中的作用及机制有待进一步研究.
胃癌是我国消化系最常见的恶性肿瘤之一, 预后差. 近年有关胃癌肿瘤干细胞的研究虽有报道, 但如何获得和鉴定胃癌干细胞及胃癌肿瘤细胞球仍是实验研究所面临的问题.
唐世刚, 教授, 湖南省人民医院
在体外更好的培养和分离纯化胃癌肿瘤细胞球是进行肿瘤干细胞研究的主要步骤, 将为进一步探索胃癌侵袭转移的机制提供帮助.
从胃癌细胞AGS中获取CD24+、CD44+细胞, 并将其接种到裸鼠体内, 发现具有较强的致瘤性.
本研究应用无血清超低吸附悬浮培养的方法, 可稳定获得胃癌肿瘤细胞球. 联合应用CD24/CD44/Snail鉴定肿瘤细胞球, 未见相关文献的报道.
本文在肿瘤的发生机制的研究方面有一定的实际意义.
编辑 田滢 电编 鲁亚静
| 1. | Siegel R, Naishadham D, Jemal A. Cancer statistics, 2013. CA Cancer J Clin. 2013;63:11-30. [PubMed] [DOI] |
| 2. | Clarke MF, Dick JE, Dirks PB, Eaves CJ, Jamieson CH, Jones DL, Visvader J, Weissman IL, Wahl GM. Cancer stem cells--perspectives on current status and future directions: AACR Workshop on cancer stem cells. Cancer Res. 2006;66:9339-9344. [PubMed] [DOI] |
| 5. | Mani SA, Guo W, Liao MJ, Eaton EN, Ayyanan A, Zhou AY, Brooks M, Reinhard F, Zhang CC, Shipitsin M. The epithelial-mesenchymal transition generates cells with properties of stem cells. Cell. 2008;133:704-715. [PubMed] [DOI] |
| 6. | Takaishi S, Okumura T, Tu S, Wang SS, Shibata W, Vigneshwaran R, Gordon SA, Shimada Y, Wang TC. Identification of gastric cancer stem cells using the cell surface marker CD44. Stem Cells. 2009;27:1006-1020. [PubMed] [DOI] |
| 7. | Zhang C, Li C, He F, Cai Y, Yang H. Identification of CD44+CD24+ gastric cancer stem cells. J Cancer Res Clin Oncol. 2011;137:1679-1686. [PubMed] [DOI] |
| 8. | Song Z, Yue W, Wei B, Wang N, Li T, Guan L, Shi S, Zeng Q, Pei X, Chen L. Sonic hedgehog pathway is essential for maintenance of cancer stem-like cells in human gastric cancer. PLoS One. 2011;6:e17687. [PubMed] [DOI] |
| 9. | Makino S. The role of tumor stem-cells in regrowth of the tumor following drastic applications. Acta Unio Int Contra Cancrum. 1959;15:196-198. [PubMed] |
| 10. | Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat Med. 1997;3:730-737. [PubMed] [DOI] |
| 12. | Zheng Q, Gong F, Xu Y, Zheng T, Ying M. Floating cells with stem cell properties in gastric cell line SGC-7901. Tumori. 2011;97:393-399. [PubMed] [DOI] |
| 13. | Wu Y, Zhou BP. Snail: More than EMT. Cell Adh Migr. 2010;4:199-203. [PubMed] [DOI] |
| 14. | Kume K, Haraguchi M, Hijioka H, Ishida T, Miyawaki A, Nakamura N, Ozawa M. The transcription factor Snail enhanced the degradation of E-cadherin and desmoglein 2 in oral squamous cell carcinoma cells. Biochem Biophys Res Commun. 2013;430:889-894. [PubMed] [DOI] |
| 15. | Naber HP, Drabsch Y, Snaar-Jagalska BE, ten Dijke P, van Laar T. Snail and Slug, key regulators of TGF-β-induced EMT, are sufficient for the induction of single-cell invasion. Biochem Biophys Res Commun. 2013;435:58-63. [PubMed] [DOI] |
| 16. | Hwang WL, Yang MH, Tsai ML, Lan HY, Su SH, Chang SC, Teng HW, Yang SH, Lan YT, Chiou SH. SNAIL regulates interleukin-8 expression, stem cell-like activity, and tumorigenicity of human colorectal carcinoma cells. Gastroenterology. 2011;141:279-291, 291.e1-e5. [PubMed] [DOI] |