修回日期: 2014-02-24
接受日期: 2014-03-04
在线出版日期: 2014-04-18
目的: 检测肝细胞癌(hepatocellular carcinoma, HCC)患者血浆中周期素依赖性激酶5(cyclin-dependent kinase 5, CDK5)蛋白及mRNA水平, 研究CDK5与HCC的相关性, 探索其临床诊断价值.
方法: 收集40例健康人和60例HCC患者血浆, 应用ELISA及荧光定量PCR技术测定血浆中CDK5蛋白及mRNA含量. 数据采用SPSS17.0软件统计分析.
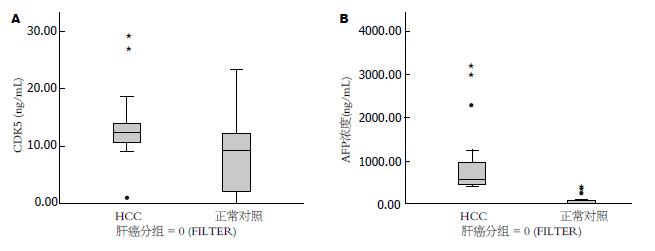
结果: CDK5蛋白在HCC患者血浆的中位数为12.21 ng/mL(1.03-29.26 ng/mL), 与正常对照组1.83 ng/mL(0.10-10.26 ng/mL)相比呈明显升高(Z = -6.695, P<0.05); CDK5 mRNA在HCC与正常人血浆中表达差异也有统计学意义(χ2 = 11.247, P<0.05). HCC甲胎蛋白(alpha-fetoprotein, AFP)<200 ng/mL患者血浆中CDK5蛋白中位数为17.095 ng/ mL(7.40-28.37 ng/mL), 与正常对照组相比有显著升高(Z = -7.363, P<0.05). CDK5表达与性别、年龄、病毒感染情况、肿瘤大小、HCC组织的分化程度无关(P>0.05), 与TNM分期呈现显著相关(P<0.05).
结论: CDK5在HCC患者血浆中显著升高, 其幅度与HCC TNM分期相关; CDK5蛋白在AFP<200 ng/mL的HCC患者血浆中明显升高, 提示CDK5可能作为AFP阴性HCC辅助诊断的血浆中的标志物.
核心提示: 通过对肝癌患者周期素依赖性激酶5(cyclin-dependent kinase 5, CDK5)表达的研究, 对照甲胎蛋白(alpha-fetoprotein, AFP)表达水平, 发现AFP阴性肝癌患者血清中CDK5可作为肝癌早期诊断的重要指标, 可作为AFP假阴性时早期肝细胞癌的辅助诊断方法, 并且对比CDK5与其他相关因子的相关性, 发现其较不易受年龄、性别等因素影响.
引文著录: 吴晨, 杨玉秀, 白阳秋, 张立达. 肝细胞癌患者血浆CDK5测定的临床意义. 世界华人消化杂志 2014; 22(11): 1518-1524
Revised: February 24, 2014
Accepted: March 4, 2014
Published online: April 18, 2014
AIM: To detect the plasma contents of cyclin-dependent kinase 5 (CDK5) protein and mRNA in patients with hepatocellular carcinoma (HCC), and to analyze the association between CDK5 and HCC, as well as the diagnostic value of CDK5.
METHODS: Plasma samples were collected from 60 patients with HCC and 40 healthy controls. Enzyme linked immunosorbent assay (ELISA) and real-time fluorescence quantitative PCR were used to measure the expression levels of CDK5 protein and mRNA in plasma, respectively.
RESULTS: The median content of CDK5 protein in plasma of HCC patients was significantly higher than that in healthy controls [12.21 ng/mL (1.03-29.26 ng/mL) vs 1.83 ng/mL (0.26-10.26 ng/mL), P < 0.05). Plasma levels of CDK5 mRNA also differed significantly between the two groups (χ2 = 11.247, P < 0.05). The median content of CDK5 protein in plasma of HCC patients with AFP < 200 ng/mL [17.095 ng/mL (7.40-28.37 ng/mL)] was also significantly than that in healthy controls (Z = -7.363, P < 0.05). CDK5 expression was significantly correlated with TNM stage (P < 0.05), but not with sex, age, hepatitis virus infection status, differentiation degree, or tumor size (P > 0.05 for all).
CONCLUSION: CDK5 showed a high corrleation with HCC and TNM stage. CDK5 protein had a significant increase in HCC patients with AFP < 200 ng/mL, suggesting that CDK5 may be used as an auxiliary index for diagnosis of AFP-negative HCC.
- Citation: Wu C, Yang YX, Bai YQ, Zhang LD. Clinical significance of detection of plasma CDK5 in patients with hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(11): 1518-1524
- URL: https://www.wjgnet.com/1009-3079/full/v22/i11/1518.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i11.1518
肝细胞癌(hepatocellular carcinoma, HCC), 简称肝癌, 是世界第6大常见肿瘤, 全世界每年新发病例749000例, 占所有恶性肿瘤的7%, 因肝癌死亡病例每年约692000例, 被列为最常见的癌症死因第3位[1]. 肝癌发生的主要危险因素包括慢性乙型或丙型肝炎病毒感染、大量饮酒、黄曲霉毒素暴露以及遗传性疾病如Wilson病、血色病等[2]. 肝癌的发生与抑癌基因失活、癌基因的异常扩增表达、多基因网络式调控异常等明显相关[3]. 就目前情况看, 外科切除仍是较好的治疗肝细胞癌的方法, 但大多临床确诊的肝癌患者已失去手术的机会, 能接受手术的不超过30%[4]. 即使行根治性手术切除, 中晚期肝癌的肝内和肝外复发仍然频繁出现[5]. 甲胎蛋白(alpha-fetoprotein, AFP)作为肝癌的肿瘤标志物, 联合腹部超声已广泛使用在临床实践中. 在肝癌患者中AFP存在高达30%-40%的假阴性[6], 迫切需要其他辅助的肿瘤标志物以更早的做出诊断. 在前期相关实验中我们已应用含有19378个已知基因的寡核苷酸芯片筛选出肝癌差异基因表达谱, 发现周期素依赖性激酶5(cyclin-dependent kinase 5, CDK5)是一个明显高表达的基因[7], 并与肝癌病理分级、分化程度有着密切的关系[8]. 从各种人癌组织如乳腺癌[9]、结直肠癌[10]和多发性骨髓瘤[11]等的研究中获得很多关于CDK5肿瘤细胞生物学的相关信息. 而现有的文献中关于肝癌患者血浆CDK5的表达情况鲜有报道. 本研究应用ELISA以及荧光定量PCR技术, 检测CDK5蛋白及mRNA在肝癌及正常人群血浆中的浓度变化, 探讨其对肝癌的诊断价值.
2012-03/2012-11河南省人民医院肝胆外科60例住院肝癌患者为研究组, 男性39例, 女性21例, 年龄35-78岁, 收集样本前未经相关治疗, 患者均经血液生化检查、腹部超声, 并行肝脏细针穿刺活检或手术后病理证实. 随机选择河南省人民医院体检中心经体检后未发现任何相关疾病的体检人员40例作为正常对照组. 本试验经医院伦理委员会批准, 所有患者均签署知情同意书.
1.2.1 标本采集: 抽取受试者晨起空腹外周静脉血3 mL, 置于EDTA抗凝的无菌试管中, 室温3500 r/min离心15 min, 收集血浆, 置于-80 ℃保存待测定.
1.2.2 CDK5蛋白浓度测定: CDK5蛋白浓度测定应用人CDK5 ELISA试剂盒(BIO-RAD公司), 按照制造商说明书操作. 应用96孔酶标仪(Bio-Rad公司)于波长450 nm检测蛋白质水平. CDK5蛋白的浓度通过计算比较样品的光密度值(A), 应用Excel软件绘制标准曲线. 实验重复进行2次, 得出CDK5蛋白的平均水平. 血浆AFP水平的测定, 采用市售的人AFP ELISA试剂盒(BIO-RAD公司).
1.2.3 CDK5 mRNA水平测定: (1)总RNA的提取及纯度检测: 按照TRIzol(Invitrogen)说明书提取血浆中总RNA, 注入20 μL无核酶去离子水溶解后, 应用1%琼脂糖凝胶电泳(150 V, 15 min)检测总RNA 28S和18S比例, 评估总RNA的完整性, 并用紫外分光光度计以A260/280测定总RNA吸光度, 计算总RNA的纯度; (2)引物的设计与合成: 目的基因引物由上海生物工程有限公司设计合成(表1), 应用GAPDH作为内参基因, 由宝生物工程(大连)有限公司购得, 其产物长度为138 bp; (3)逆转录合成cDNA: 按照逆转录试剂盒(大连宝生物公司, code No. DRR047A)说明书步骤进行, 分别行基因组DNA的除去反应和逆转录反应. 反应体系分别为10 μL和20 μL, 反应条件分别为42 ℃ 2 min和37 ℃ 15 min, 85 ℃ 5 s; (4)荧光定量PCR: 按照RT-PCR试剂盒(大连宝生物公司, code No. RR820A)说明书操作, PCR反应体系为20 μL. PCR扩增条件为95 ℃ 30 s, 95 ℃ 5 s, 60 ℃ 31 s; 进行40个PCR循环. 所用扩增仪型号为ABI7300(美国Applied Biosystems公司); (5)mRNA扩增结果分析: 应用BIO-RAD Gel Doc XR凝胶成像系统(美国BIO-RAD公司)进行扫描和分析, 比较4%琼脂糖凝胶电泳(150 V, 45 min)检测CDK5 DNA扩增产物的正确性, 计算PCR 2-∆∆Ct表示样品中CDK5初始cDNA的相对表达量. 重复3遍取平均值. [∆Ct = 样品Ct-内参Ct, ∆∆Ct = ∆Ct-(随机阴性对照样品Ct均值-该样品的内参Ct均值)].
| 目的基因 | 序列 | 产物长度(bp) |
| CDK5 | 上游引物5'-GATGACGATGATGAGGGTGTG-3' | 90 |
| GAPDH | 下游引物5'-ATGAAGCCTGACGATGTTCTTGT-3' | 138 |
统计学处理 使用SPSS17.0软件, 采用Kruskal-Wallis、Mann-Whitney、Spearman、χ2检验、Fisher's精确概率检验、非参数检验等统计学方法处理, P<0.05为差异有统计学意义.
肝癌患者血浆中CDK5蛋白和AFP含量与正常对照组相比均升高, 与健康对照组表达均有明显差异(ZCDK5 = -6.695; ZAFP = -7.944; P<0.05). 肝癌组血浆中CDK5蛋白浓度中位数为12.21 ng/mL(1.03-29.26 ng/mL), AFP血浆中浓度中位数为89.46 ng/mL(5.98-3214.3 ng/mL); 正常对照组CDK5血浆中浓度中位数为1.83 ng/mL(0.10-10.26 ng/mL), AFP血浆中浓度中位数为14.84 ng/mL(2.98-87.94 ng/mL)(图1).
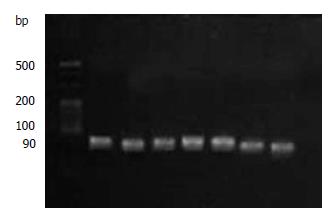
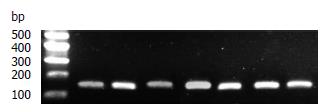
1%琼脂糖电泳结果可见28S、18S二条清晰的条带和稍欠清晰的5S条带, 证实提取的是完整的RNA; 总RNA的吸光度A260/280值均在1.6-2.0, 证明符合纯度要求. 样本中内参基因扩增曲线均呈典型S型, 融解曲线分析可见单峰, 可见cDNA较完整. 各组Ct≤32时, CDK5扩增曲线均为S型, 融解曲线为单峰, 融解温度与目的基因产物相一致, 排除二聚体及其他产物. Ct>32时, 为一条不规则波浪线, 故以Ct≤32表示CDK5 mRNA阳性表达. 4%琼脂糖电泳证实CDK5 DNA及GAPDH DNA扩增产物单一, 且符合目的基因DNA大小, 分别为90 bp及138 bp. 扩增产物条带清晰(图2, 3).
肝癌组CDK5 mRNA扩增阳性率为72%(40/60), 健康对照组为21.7%(13/40). 两组间差异有统计学意义(χ2 = 11.247, P<0.05).
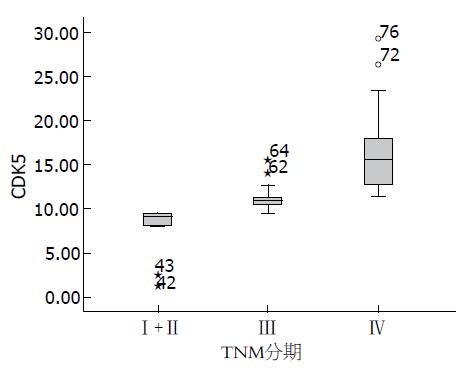
肝癌患者血浆中CDK5蛋白、mRNA的表达与年龄、性别、病毒感染情况、肿瘤大小、肿瘤分化程度无明显相关(表2), 与肝细胞癌TNM分期明显相关(P<0.05)(图4).
| 影响因子 | n | CDK5蛋白浓度中位数(ng/mL) | CDK5蛋白浓度范围(ng/mL) | P值 | CDK5 mRNA扩增阳性例数 | CDK5 mRNA扩增阳性率(%) | P值 |
| 年龄(岁) | 0.6161 | 0.575 | |||||
| ≤50 | 37 | 12.15 | 1.03-26.35 | 26/37 | 70.27 | ||
| >50 | 23 | 12.43 | 7.99-29.26 | 14/23 | 60.86 | ||
| 性别 | 0.8101 | 0.775 | |||||
| 男 | 39 | 12.15 | 7.99-26.35 | 27/39 | 69.23 | ||
| 女 | 21 | 12.27 | 1.03-29.26 | 13/21 | 61.90 | ||
| 肝炎病毒感染 | 0.3332 | 0.420 | |||||
| HBV | 30 | 12.68 | 2.40-29.26 | 22/30 | 73.33 | ||
| HCV | 19 | 11.74 | 8.20-26.35 | 11/19 | 57.89 | ||
| 无 | 11 | 10.35 | 1.03-18.03 | 7/11 | 63.63 | ||
| 肿瘤大小(cm) | 0.5841 | 0.783 | |||||
| ≤5 | 37 | 12.71 | 1.03-26.35 | 24/37 | 64.86 | ||
| >5 | 23 | 11.44 | 2.40-29.26 | 16/23 | 69.56 | ||
| 分化程度 | 0.5632 | 0.165 | |||||
| 高 | 17 | 11.31 | 7.99-23.37 | 13/17 | 76.47 | ||
| 中 | 18 | 11.56 | 8.20-26.35 | 11/18 | 61.11 | ||
| 低 | 25 | 13.49 | 1.03-29.26 | 16/25 | 64.00 | ||
| TNM分期 | <0.012 | 0.019 | |||||
| I +II | 11 | 9.16 | 1.03-9.43 | 5/11 | 45.45 | ||
| III | 17 | 10.97 | 9.53-15.43 | 10/17 | 58.82 | ||
| IV | 32 | 15.55 | 11.44-29.26 | 25/32 | 78.13 |
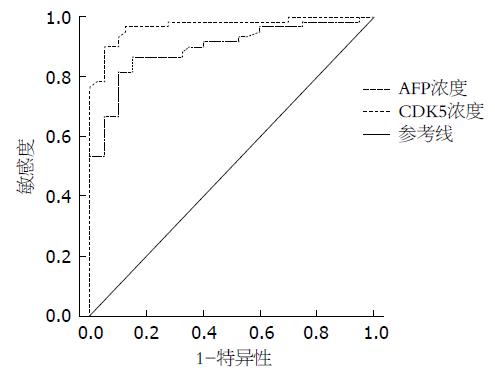
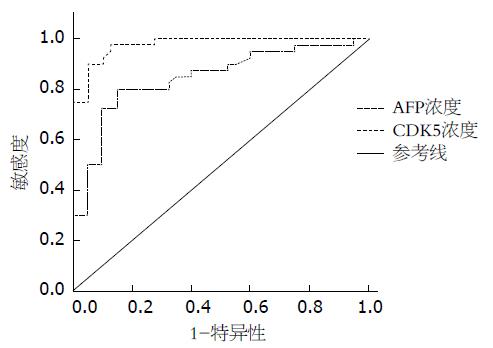
对所有样本血浆中CDK5蛋白与AFP水平ROC曲线进行比较分析, 发现CDK5蛋白曲线下面积为0.970、AFP曲线下面积为0.896, 具有统计学意义, 表明在所有样本中CDK5的诊断效果要好于AFP诊断效果(图5). 对AFP<200 ng/mL样本血浆中CDK5蛋白与AFP水平应用ROC曲线分析, 发现CDK5蛋白曲线下面积为0.977、AFP曲线下面积为0.845, 具有统计学意义, 表明在AFP<200 ng/mL情况下, CDK5的肝癌检出效果较明显(图6). 若将肝癌组AFP<200 ng/mL样本设为AFP阴性组, 200 ng/mL≤AFP<400 ng/mL为AFP疑似阳性组, AFP≥400 ng/mL为阳性组, 对其各组CDK5蛋白浓度进行分析统计, 进行两两组间比较发现HCC AFP阴性组血浆中CDK5蛋白与正常对照组相比有明显差异(Z = -7.363, P<0.05). HCC AFP阴性组中HCC患者血浆中CDK5蛋白中位数为17.095 ng/mL(7.40-28.37 ng/mL), 显著高于正常对照组.
肝癌在中国的发病率约35例/10万, 每年大致40%的全球新发肝癌确诊病例来自我国[12]. 美国胃肠病协会的报告估计肝癌后期总成本为1.3亿美元, 包括每年14000个住院日和98000 d的护理[13]. 肝癌已成为严重危害人民健康及社会经济发展的重要疾病. CDK家族的表达及活性改变常决定着细胞周期进程, 调控细胞生长、分化、运动、凋亡等机制[14-16].
CDK5基因长3.95 kb, 位于7q36的DNA序列, 含外显子12个, 调控987 bp转录, 蛋白分子量为33 kDa[17]. 其基因序列在不同种属之间高度保守, 是一种以在其上游特定区域对脯氨酸残基进行磷酸化为目的的丝氨酸/苏氨酸激酶. 他包含有CDK家族所共有的PSTAIRE结构域, 虽与Cdc2和CDK2同源性高达60%[18], 但由其他非细胞周期蛋白活化剂激活, 不需要磷酸化激活循环的参与, 在功能和调控上具有与其他细胞周期素依赖性激酶家族成员不同的特殊性. 在CDK5研究最广泛的神经系统中, 其功能表现为控制神经元迁移、细胞黏附、轴突引导、突触结构、内吞作用及细胞凋亡等. 研究发现, 在一些病理条件中, CDK5不再与p35、p39等其正常情况下的激活因子结合以发挥正常生理作用, p35和p39会被某些蛋白水解酶剪切, 使p25和p29这种半衰期更长更稳定的激活因子过度表达, 引起CDK5活动增强, 进而导致其活动失常, 引起相关疾病发生[18-20]. CDK5也与一些肿瘤细胞的生物学行为有关. 在浸润性乳腺癌细胞中CDK5蛋白可以调控其癌细胞增殖[21]. 在Hela细胞和人成胶质细胞瘤细胞系(H4)中, CDK5使在调控包括胞吞和自噬的膜转运中起重要作用的Vps34在Thr159位点磷酸化, 在有丝分裂过程中与自噬基因Beclin-1相互作用, 进而解除自噬[22]. 推测CDK5可能主要通过在细胞增殖和凋亡过程中发挥作用.
有研究认为HCC发生的早期事件可能与信号转导和转录激活因子3(signal transducer and activator of transcription 3, STAT3)的激活和丝裂原活化蛋白激酶(mitogenactivated protein kinases, MAPK)相关[23-25]. 已证实CDK5被激活后, 使STAT-3在Ser727磷酸化. 通过选择性抑制剂降低CDK5/p35的核分布, 发现磷酸化STAT-3的水平降低, 使小鼠模型中肿瘤细胞生长受限[26]. 多方面研究均验证指出, CDK5/STAT-3致癌通路在DNA修复基因的表达中起核心作用[27]. 有报告称在诱导肝细胞癌变中, Ras的激活通过Ras-Raf-MAPKK-MAPK通路传递, 该通路异常激活所导致的细胞增殖与肝癌的发生、进展及预后密切相关[25]. CDK5在Ras下游被认定为一个重要的中间信号, 抑制CDK5而使被激活的RalA-和RalB-GTP明显减少, 同时体外肿瘤细胞的迁移及生长和异种移植模型形成均减少[28]. 也有研究称, CDK5通过抑制NOXA磷酸化以抑制肿瘤细胞的凋亡[29]. NOXA是Bcl-2家族的一员, 被认为具有强大的促细胞凋亡作用. 另有研究发现CDK5在肿瘤细胞DNA损伤应答中起重要作用[30]. CDK5对于DNA损伤S和G2/M期的插入点起重要作用, 在DNA损伤和自发形成的DNA双链断裂(double-strand breaks, DSB)后被激活, 但对于DSB修复并不被需要.
本次实验中发现CDK5在肝癌患者血浆中呈现高表达, 与肝癌TNM分期具有相关性. 这与我们前期的研究结果相一致. 对这种现象的机制尚不明确, 可能由于CDK5基因发生突变导致其表达异常, 在细胞内堆积, 经由特殊机制释放入血. 临床上常用AFP>400 ng/mL或者AFP>200 ng/mL持续8 wk作为肝癌的血清学诊断指标. 本次实验通过对CDK5蛋白与AFP在<200 ng/mL、>400 ng/mL的分层样本进行检测分析, 发现CDK5在AFP<200 ng/mL时有显著表达, 对于AFP不能确诊的肝癌患者, CDK5有可能作为对肝癌诊断的辅助标志物. 但其实际应用价值还需行大规模临床验证.
肝细胞癌(hepatocellular carcinoma, HCC)今年来成为世界范围, 特别是我国的常见肿瘤类型, 并以其发现较晚、难以根治、预后较差为主要特点. 现在临床常通过检测甲胎蛋白(alpha-fetoprotein, AFP)及影像学检查来早期诊断HCC, 但仍有较高的假阴性率.
孙星, 副教授, 副主任医师, 上海交通大学附属第一人民医院普外科
HCC早期事件可能与某些信号转导通路和相关因子及激酶的激活有关. 通过小鼠肿瘤模型试验, 发现Ras-Raf-MAPKK-MAPK通路与HCC早期发生、增殖等有密切联系.
近年来多项研究表明, 周期素依赖性激酶5(cyclin-dependent kinase 5, CDK5)在多种肿瘤如前列腺癌、甲状腺癌、乳腺癌等的发生发展治疗机制的研究中起重要作用.
本文从蛋白水平和mRNA水平上, 对CDK5的表达进行测量评估, 对AFP的应用与CDK5的应用范围进行比较, 并对CDK5表达与各种相关因子的相关性进行对比, 明确CDK5的应用前景和价值.
CDK5在肝癌发生发展中其相当重要的作用, 且在AFP阴性肝癌患者血清中CDK5显著表达, 可考虑作为肝细胞癌早期诊断的血清学标志物, 辅助进行AFP阴性肝癌患者的筛查.
本文通过CDK5及其mRNA的测定, 证实CDK5在肝癌的早期诊断, 尤其是AFP阴性的肝癌中具有一定的临床价值, 且其不受年龄、病毒感染、肿瘤大小、分化程度影响, 但还需进行更大样本研究.
编辑 郭鹏 电编 鲁亚静
| 1. | Eggert T, McGlynn KA, Duffy A, Manns MP, Greten TF, Altekruse SF. Epidemiology of fibrolamellar hepatocellular carcinoma in the USA, 2000-10. Gut. 2013;62:1667-1668. [PubMed] [DOI] |
| 2. | Farazi PA, DePinho RA. Hepatocellular carcinoma pathogenesis: from genes to environment. Nat Rev Cancer. 2006;6:674-687. [PubMed] [DOI] |
| 3. | Lemmer ER, Friedman SL, Llovet JM. Molecular diagnosis of chronic liver disease and hepatocellular carcinoma: the potential of gene expression profiling. Semin Liver Dis. 2006;26:373-384. [PubMed] [DOI] |
| 4. | Bruemmer D, Yin F, Liu J, Berger JP, Sakai T, Blaschke F, Fleck E, Van Herle AJ, Forman BM, Law RE. Regulation of the growth arrest and DNA damage-inducible gene 45 (GADD45) by peroxisome proliferator-activated receptor gamma in vascular smooth muscle cells. Circ Res. 2003;93:e38-e47. [PubMed] [DOI] |
| 5. | Masuda T, Beppu T, Ishiko T, Horino K, Baba Y, Mizumoto T, Hayashi H, Okabe H, Horlad H, Doi K. Intrahepatic dissemination of hepatocellular carcinoma after local ablation therapy. J Hepatobiliary Pancreat Surg. 2008;15:589-595. [PubMed] [DOI] |
| 6. | Farinati F, Marino D, De Giorgio M, Baldan A, Cantarini M, Cursaro C, Rapaccini G, Del Poggio P, Di Nolfo MA, Benvegnù L. Diagnostic and prognostic role of alpha-fetoprotein in hepatocellular carcinoma: both or neither? Am J Gastroenterol. 2006;101:524-532. [PubMed] [DOI] |
| 9. | Chin K, DeVries S, Fridlyand J, Spellman PT, Roydasgupta R, Kuo WL, Lapuk A, Neve RM, Qian Z, Ryder T. Genomic and transcriptional aberrations linked to breast cancer pathophysiologies. Cancer Cell. 2006;10:529-541. [PubMed] [DOI] |
| 10. | Martinez-Cardús A, Martinez-Balibrea E, Bandrés E, Malumbres R, Ginés A, Manzano JL, Taron M, Garcia-Foncillas J, Abad A. Pharmacogenomic approach for the identification of novel determinants of acquired resistance to oxaliplatin in colorectal cancer. Mol Cancer Ther. 2009;8:194-202. [PubMed] [DOI] |
| 11. | Zhu YX, Tiedemann R, Shi CX, Yin H, Schmidt JE, Bruins LA, Keats JJ, Braggio E, Sereduk C, Mousses S. RNAi screen of the druggable genome identifies modulators of proteasome inhibitor sensitivity in myeloma including CDK5. Blood. 2011;117:3847-3857. [PubMed] [DOI] |
| 12. | Parkin DM. Global cancer statistics in the year 2000. Lancet Oncol. 2001;2:533-543. [PubMed] [DOI] |
| 13. | Kim WR, Brown RS, Terrault NA, El-Serag H. Burden of liver disease in the United States: summary of a workshop. Hepatology. 2002;36:227-242. [PubMed] [DOI] |
| 14. | Liu L, Schwartz B, Tsubota Y, Raines E, Kiyokawa H, Yonekawa K, Harlan JM, Schnapp LM. Cyclin-dependent kinase inhibitors block leukocyte adhesion and migration. J Immunol. 2008;180:1808-1817. [PubMed] |
| 15. | Shapiro GI. Cyclin-dependent kinase pathways as targets for cancer treatment. J Clin Oncol. 2006;24:1770-1783. [PubMed] [DOI] |
| 16. | Cai D, Latham VM, Zhang X, Shapiro GI. Combined depletion of cell cycle and transcriptional cyclin-dependent kinase activities induces apoptosis in cancer cells. Cancer Res. 2006;66:9270-9280. [PubMed] [DOI] |
| 17. | Dhariwala FA, Rajadhyaksha MS. An unusual member of the Cdk family: Cdk5. Cell Mol Neurobiol. 2008;28:351-369. [PubMed] [DOI] |
| 18. | Tarricone C, Dhavan R, Peng J, Areces LB, Tsai LH, Musacchio A. Structure and regulation of the CDK5-p25(nck5a) complex. Mol Cell. 2001;8:657-669. [PubMed] [DOI] |
| 19. | Lee MS, Kwon YT, Li M, Peng J, Friedlander RM, Tsai LH. Neurotoxicity induces cleavage of p35 to p25 by calpain. Nature. 2000;405:360-364. [PubMed] [DOI] |
| 20. | Mazanetz MP, Fischer PM. Untangling tau hyperphosphorylation in drug design for neurodegenerative diseases. Nat Rev Drug Discov. 2007;6:464-479. [PubMed] [DOI] |
| 21. | Goodyear S, Sharma MC. Roscovitine regulates invasive breast cancer cell (MDA-MB231) proliferation and survival through cell cycle regulatory protein cdk5. Exp Mol Pathol. 2007;82:25-32. [PubMed] [DOI] |
| 22. | Furuya T, Kim M, Lipinski M, Li J, Kim D, Lu T, Shen Y, Rameh L, Yankner B, Tsai LH. Negative regulation of Vps34 by Cdk mediated phosphorylation. Mol Cell. 2010;38:500-511. [PubMed] [DOI] |
| 23. | Yu XT, Zhu SN, Xu ZD, Hu XQ, Zhu TF, Chen JQ, Lu SL. Roles of EGFR-Stat3 signal pathway in carcinogenesis of experimental hepatoma in rats. J Cancer Res Clin Oncol. 2007;133:145-152. [PubMed] [DOI] |
| 24. | Feng DY, Zheng H, Tan Y, Cheng RX. Effect of phosphorylation of MAPK and Stat3 and expression of c-fos and c-jun proteins on hepatocarcinogenesis and their clinical significance. World J Gastroenterol. 2001;7:33-36. [PubMed] |
| 26. | Lin H, Chen MC, Chiu CY, Song YM, Lin SY. Cdk5 regulates STAT3 activation and cell proliferation in medullary thyroid carcinoma cells. J Biol Chem. 2007;282:2776-2784. [PubMed] |
| 27. | Courapied S, Sellier H, de Carné Trécesson S, Vigneron A, Bernard AC, Gamelin E, Barré B, Coqueret O. The cdk5 kinase regulates the STAT3 transcription factor to prevent DNA damage upon topoisomerase I inhibition. J Biol Chem. 2010;285:26765-26778. [PubMed] [DOI] |
| 28. | Liebl J, Fürst R, Vollmar AM, Zahler S. Twice switched at birth: cell cycle-independent roles of the "neuron-specific" cyclin-dependent kinase 5 (Cdk5) in non-neuronal cells. Cell Signal. 2011;23:1698-1707. [PubMed] [DOI] |
| 29. | Lin H, Juang JL, Wang PS. Involvement of Cdk5/p25 in digoxin-triggered prostate cancer cell apoptosis. J Biol Chem. 2004;279:29302-29307. [PubMed] |