修回日期: 2014-03-04
接受日期: 2014-03-18
在线出版日期: 2014-04-18
目的: 研究黄芩苷对大鼠肠缺血再灌注(intestinal ischemia-reperfusion, IIR)损伤的保护作用及机制.
方法: ♂ Wistar大鼠32只, 随机分为假手术(sham-operated, SO)组、黄芩苷(baicalin, BA)组、肠缺血再灌注(IIR)组、黄芩苷+肠缺血再灌注(BA+IIR)组. BA组和BA+IIR组于造模前30 min腹腔注射黄芩苷100 mg/kg体质量, SO组和IIR组注射等量生理盐水. 再灌注2 h后取材, HE染色观察小肠组织损伤程度, 水溶性四唑盐1(water soluble tetrazolium salt 1, WST-1)法测定血清超氧化物歧化酶(superoxide dismutase, SOD)活性, 硫代巴比妥酸法测定血清丙二醛(malondialdehyde, MDA)含量, ELISA法检测血浆D-乳酸含量, 免疫组织化学(immunohistochemistry, IHC)和Western blot法检测核因子相关因子2(NF-E2-related factor 2, Nrf2)、血红素加氧酶1(heme oxygenase 1, HO-1)蛋白表达.
结果: IIR组与SO组比较, 小肠黏膜损伤Chiu氏评分升高(3.99±0.24 vs 0.30±0.08, P<0.01), 血清SOD活性降低(100.08 U/mL±3.20 U/mL vs 136.88 U/mL±5.93 U/mL, P<0.01), MDA含量增加(3.41 nmol/mL±0.23 nmol/mL vs 1.59 nmol/mL±0.25 nmol/mL, P<0.01), 血浆D-乳酸含量增多(174.27 ng/mL±33.84 ng/mL vs 52.40 ng/mL±12.12 ng/mL, P<0.01), 小肠组织中Nrf2、HO-1表达增加(IHC: 0.326±0.024 vs 0.289±0.041, 0.298±0.025 vs 0.258±0.027, P<0.05; WB: 1.062±0.056 vs 0.584±0.048, 1.019±0.041 vs 0.592±0.037, P<0.01). BA组小肠组织Nrf2、HO-1表达比SO组显著增加(IHC: 0.322±0.028 vs 0.289±0.041, 0.284±0.009 vs 0.258±0.027, P<0.05; WB: 1.077±0.038 vs 0.584±0.048, 1.027±0.042 vs 0.592±0.037, P<0.01). BA+IIR组与IIR组相比, 小肠黏膜损伤Chiu氏评分降低(2.95±0.26 vs 3.99±0.24, P<0.01), 血清SOD活性升高(116.11 U/mL±4.12 U/mL vs 100.08 U/mL±3.20 U/mL, P<0.01), MDA含量减少(3.09 nmol/mL±0.15 nmol/mL vs 3.41 nmol/mL±0.23 nmol/mL, P<0.01), 血浆D-乳酸含量减少(108.04 ng/mL±20.19 ng/mL vs 174.27 ng/mL±33.84 ng/mL, P<0.01), 小肠组织Nrf2、HO-1表达增加(IHC: 0.371±0.024 vs 0.326±0.024, 0.336±0.031 vs 0.298±0.025, P<0.01; WB: 1.541±0.100 vs 1.062±0.056, 1.458±0.071 vs 1.019±0.041, P<0.01).
结论: 黄芩苷对大鼠肠缺血再灌注损伤有良好的保护作用, 其机制可能是通过激活核因子相关因子2-抗氧化反应元件(NF-E2-related factor 2-antioxidant response element, Nrf2-ARE)通路进而增加抗氧化酶SOD、HO-1表达实现的.
核心提示: 大鼠肠缺血再灌注过程中存在氧化应激损伤, 黄芩苷可以通过激活核因子相关因子2-抗氧化反应元件(NF-E2-related factor 2-antioxidant response element)信号通路, 诱导抗氧化酶超氧化物歧化酶(superoxide dismutase)、血红素加氧酶1(heme oxygenase 1)表达, 提高机体清除氧自由基的能力, 减轻大鼠肠缺血再灌注损伤.
引文著录: 程风春, 耿磊, 李丽, 刘希杰, 郑步峰, 冯文玉, 张兴元, 傅廷亮. 黄芩苷减轻大鼠肠缺血再灌注损伤及对Nrf2、HO-1表达的影响. 世界华人消化杂志 2014; 22(11): 1510-1517
Revised: March 4, 2014
Accepted: March 18, 2014
Published online: April 18, 2014
AIM: To investigate the protective effects of baicalin against intestinal ischemia-reperfusion (IIR) injury in rats.
METHODS: Thirty-two male Wistar rats were randomly and equally divided into four groups: control (SO), baicalin (BA), IIR, and baicalin + IIR (BA + IIR). IIR was induced by clamping the superior mesenteric artery (SMA) for 60 min and restoring blood supply for two hours. The rats in the SO and BA groups underwent a laparotomy, and the SMA was separated without occlusion. The rats in the BA and BA + IIR groups were given baicalin (100 mg/kg, 1 mL) by introperitoneal injection 30 min before model creation. The rats in the SO and IIR groups were given normal saline (1 mL). Intestinal histopathologic changes were examined. Serum superoxide dismutase (SOD) and malondialdehyde (MDA) levels were determined by WST and thiobarbituric acid method, respectively, and plasma D-lactic acid level was assayed by ELISA. The expression of NF-E2-related factor 2 (Nrf2) and heme oxygenase 1 (HO-1) in intestinal tissues was determined by immunohistochemistry (IHC) and Western blot (WB).
RESULTS: In the IIR group, the Chiu's score (3.99 ± 0.24 vs 0.30 ± 0.08, P < 0.01), serum MDA level (3.41 ± 0.23 vs 1.59 ± 0.25, P < 0.01) and plasma D-lactic acid level (174.27 ± 33.84 vs 52.40 ± 12.12, P < 0.01) were significantly higher than those in the SO group. Nrf2 and HO-1 expression in intestinal tissues in the IIR group was significantly higher than that in the SO group (IHC: 0.326 ± 0.024 vs 0.289 ± 0.041, 0.298 ± 0.025 vs 0.258 ± 0.027, P < 0.05; WB: 1.062 ± 0.056 vs 0.584 ± 0.048, 1.019 ± 0.041 vs 0.592 ± 0.037, P < 0.01). In the IIR group, serum SOD activity decreased significantly compared with the SO group (100.08 ± 3.20 vs 136.88 ± 5.93, P < 0.01). In the BA group, Nrf2 and HO-1 expression in intestinal tissues increased significantly in comparison with the SO group (IHC: 0.322 ± 0.028 vs 0.289 ± 0.041, 0.284 ± 0.009 vs 0.258 ± 0.027, P < 0.05; WB: 1.077 ± 0.038 vs 0.584 ± 0.048, 1.027 ± 0.042 vs 0.592 ± 0.037, P < 0.01). Compared with the IIR group, intestinal tissue injury was significantly reduced (2.95 ± 0.26 vs 3.99 ± 0.24, P < 0.01), serum MDA level (3.09 ± 0.15 vs 3.41 ± 0.23, P < 0.01) and plasma D-lactic acid decreased significantly (108.04 ± 20.19 vs 174.27 ± 33.84, P < 0.01), and serum SOD activity (116.11 ± 4.12 vs 100.08 ± 3.20, P < 0.01) and expression of Nrf2 and HO-1 in intestinal tissues increased significantly (IHC: 0.371 ± 0.024 vs 0.326 ± 0.024, 0.336 ± 0.031 vs 0.298 ± 0.025, P < 0.01; WB: 1.541 ± 0.100 vs 1.062 ± 0.056, 1.458 ± 0.071 vs 1.019 ± 0.041, P < 0.01) in the IIR + BA group.
CONCLUSION: Our data suggest that baicalin alleviates IIR injury possibly by activating the Nrf2-ARE pathway.
- Citation: Cheng FC, Geng L, Li L, Liu XJ, Zheng BF, Feng WY, Zhang XY, Fu TL. Baicalin attenuates intestinal ischemia/reperfusion injury and alters intestinal expression of Nrf2 and HO-1 in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(11): 1510-1517
- URL: https://www.wjgnet.com/1009-3079/full/v22/i11/1510.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i11.1510
肠缺血再灌注损伤(intestinal ischemia reperfusion injury, IIRI)是临床上许多疾病共同的病理生理过程, 他不仅引起肠屏障功能障碍, 还可以导致远隔器官损伤、全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)和多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS)[1]. 在IIRI发病机制中, 氧自由基可以引起肠道损伤, 与白细胞浸润、炎症介质的释放密切相关[2]. 研究发现, 核因子相关因子2(NF-E2-related factor 2, Nrf2)是一种重要的内源性抗氧化应激的调控因子. 当受到氧自由基和抗氧化剂等信号激活后, Nrf2诱导超氧化物歧化酶(superoxide dismutase, SOD)、血红素加氧酶1(heme oxygenase 1, HO-1)等抗氧化酶表达增加, 从而对抗氧自由基引起的氧化应激[3,4]. 黄芩苷(baicalin, BA)具有抗氧化、清除氧自由基等药理活性, 可有效减轻脏器的缺血再灌注损伤[5]. 本研究建立肠缺血再灌注模型, 观察黄芩苷对大鼠肠缺血再灌注损伤的作用及对Nrf2-ARE信号通路相关信号因子Nrf2、SOD、HO-1的影响, 旨在探讨黄芩苷对大鼠肠缺血再灌注损伤的保护作用及其机制.
清洁级Wistar大鼠32只, 体质量250-300 g, 由山东大学实验动物中心[许可证号: SCXK(鲁)20090001]提供; 黄芩苷, 纯度≥98%, 购自上海博耀生物科技公司; Nrf2、HO-1抗体购自北京博奥森生物技术有限公司; 血清SOD、MDA检测试剂盒购自南京建成生物工程研究所; 血浆D-乳酸ELISA试剂盒购自武汉华美生物工程有限公司, Western blot检测试剂购自碧云天生物技术研究所. 石蜡切片机(MICROW Gmbh HM315R, 德国); 显微镜照像系统(OLYMPUS BX51T-32F01, 日本); 自动酶标仪(Bio-rad iMark, 美国); 垂直电泳仪(Bio-rad, 美国), 转膜仪(Bio-rad, 美国).
1.2.1 动物分组及给药: 将大鼠随机分为假手术(sham-operated, SO)组、BA组、肠缺血再灌注(IIR)组、黄芩苷+肠缺血再灌注(BA+IIR)组, 每组8只. 将黄芩苷溶于生理盐水中, 浓度为50 mg/mL, 超滤除菌. BA组和BA+IIR组术前30 min腹腔注射黄芩苷100 mg/kg体质量. SO组和IIR组注射等量的生理盐水.
1.2.2 模型的建立: 大鼠术前禁食12 h, 自由饮水, 10%水合氯醛腹腔注射麻醉(3 mL/kg体质量). IIR组和BA+IIR组采用Megison[6]法建立肠缺血再灌注模型. 取上腹正中切口, 长约3.0 cm, 用温盐水纱布将肠管推向左侧腹, 暴露右肾内上方的肠系膜根部, 找到肠系膜上动脉(superior mesenteric artery, SMA)从根部用无创血管夹夹闭, 闭合腹部切口. SMA夹闭60 min后从原切口入腹, 松开无创血管夹再灌注2 h. SO组和BA组只分离SMA, 不夹闭. 大鼠在麻醉期间用加热灯维持体温, 并用肛温计监测体温. 再灌注2 h后, 经腹主动脉取血留样, 距回盲部5 cm处取回肠, 部分用4%甲醛固定, 其余部分-80 ℃冻存.
1.2.3 小肠黏膜损伤病理检查: 大鼠小肠组织经甲醛固定、脱水、透明、石蜡包埋后, 制成4 μm组织切片, 进行HE染色, 在显微镜下观察组织病理学改变, 用Chiu氏分级标准对小肠黏膜损伤进行评分[7].
1.2.4 血清中SOD与MDA检测: 血液标本静置后离心(4000 r/min)10 min, 取上层血清-80 ℃保存. 采用WST-1法测定SOD, 采用硫代巴比妥酸法进行MDA的测定. 按照试剂盒说明书操作步骤进行测定.
1.2.5 血浆D-乳酸含量测定: 血液标本用肝素钠抗凝离心(4000 r/min)10 min, 取上层血浆. 采用Elisa法测定血浆中D-乳酸含量, 按照试剂盒说明书操作步骤进行测定.
1.2.6 免疫组织化学检测小肠组织Nrf2、HO-1表达: 大鼠小肠组织经甲醛固定、脱水、透明、石蜡包埋后, 制成3 μm组织切片. 切片经二甲苯脱蜡、至水后, 3%过氧化氢室温孵育20 min, 去除内源性过氧化物酶, PBS洗涤5 min, 共3次, 枸橼酸盐缓冲液(pH 6.0)微波炉加热20 min抗原修复, 自然凉至室温, PBS洗涤5 min共3次, 滴加正常山羊血清封闭液, 室温孵育20 min, 倾去封闭液, 滴加Nrf2(PBS稀释浓度1:100)和HO-1(PBS稀释浓度1:100)一抗, 4 ℃过夜, PBS洗涤5 min共3次, 滴加生物素标记的二抗工作液37 ℃孵育20 min, PBS洗涤5 min共3次, 滴加辣根酶标记链霉卵白素工作液37 ℃孵育20 min, PBS洗涤5 min共3次, DAB显色, 苏木素复染、脱水、透明、封片. 阳性结果的判定: Nrf2在胞核和胞浆可见大量棕黄色颗粒, HO-1在胞浆中可见大量综黄色颗粒, 用平均光密度来表示表达结果, 平均光密度越大表示蛋白表达越强.
1.2.7 Western blot检测小肠组织中Nrf2、HO-1的表达: 取小肠组织按蛋白提取试剂盒说明书操作, 提取小肠组织总蛋白. 用BCA法测定蛋白浓度. 取40 μg蛋白在5%的浓缩胶和10%的分离胶中电泳, 然后采用湿法转膜, 使蛋白转到硝酸纤维素(NC)膜上, 加入Western封闭液室温封闭90 min, 加入Nrf2(1:100)、HO-1(1:100)和β-actin(1:4000)一抗, 4 ℃孵育过夜, TBST洗涤10 min共3次, 加入IgG-HRP二抗(1:10000), 室温孵育1 h, TBST洗涤10 min共3次, 加ECL曝光成像. QuantityOne软件分析测定结果, 目的蛋白相对含量 = 目的蛋白灰度值/β-actin灰度值.
统计学处理 采用SPSS19.0软件进行统计学分析, 计量结果采用mean±SD表示, 各组之间采用单因素方差分析(ANOVA)进行比较, P<0.05为差异具有统计学意义.
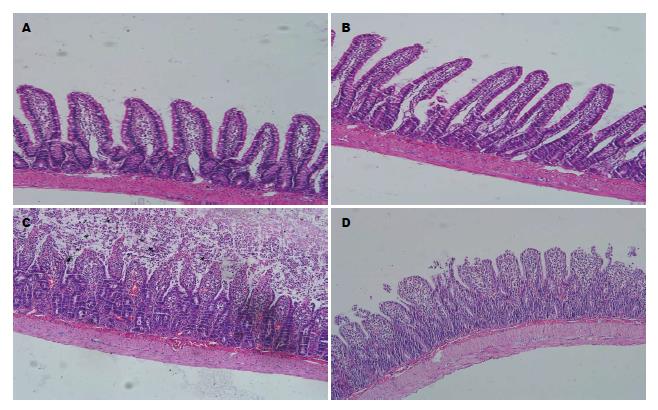
大体标本观察: SO组和BA组小肠组织未见明显改变; IIR组小肠明显扩张, 呈暗红色, 存在散在的出血点; BA+IIR组小肠组织轻度扩张, 暗红色, 偶见散在出血点. HE染色镜下观察: SO组和BA组小肠黏膜结构正常, 未见明显损伤; IIR组小肠黏膜损伤严重, 上皮细胞脱落, 黏膜出现水肿、出血、炎症细胞浸润、缺损断裂; BA+IIR组小肠黏膜损伤相对较轻, 可见轻度充血水肿, 偶见黏膜上皮坏死脱落. IIR组大鼠小肠黏膜Chiu氏评分明显高于SO组, 差异具有统计学意义(P<0.01); BA+IIR组评分低于IIR组, 差异具有统计学意义(P<0.01), BA组与SO组比较, 差异无显著性(图1, 表1).
| 分组 | Chiu氏评分 | 血清SOD(U/mL) | 血清MDA(nmol/mL) | 血浆D-乳酸(ng/mL) |
| SO组 | 0.30±0.08 | 136.88±5.93 | 1.59±0.25 | 52.40±12.12 |
| BA组 | 0.28±0.15 | 134.09±7.05 | 1.75±0.26 | 55.35±11.73 |
| IIR组 | 3.99±0.24b | 100.08±3.20b | 3.41±0.23b | 174.27±33.84b |
| BA+IIR组 | 2.95±0.26bd | 116.11±4.12bd | 3.09±0.15bd | 108.04±20.19bd |
| F值 | 764.22 | 84.00 | 131.53 | 56.97 |
| P值 | 0.00 | 0.00 | 0.00 | 0.00 |
与SO组相比, IIR组血清SOD、MDA含量分别出现明显下降和升高, 差异具有统计学意义(均P<0.01); BA组血清SOD、MDA水平与SO组相比无显著差异; BA+IIR组血清SOD、MDA水平分别高于低于IIR组, 差异具有统计学意义(均P<0.01)(表1).
IIR组血浆D-乳酸含量与SO组相比明显升高, 差异具有统计学意义(P<0.01); 与IIR组相比, BA+IIR组血浆D-乳酸含量降低, 差异具有统计学意义(P<0.01); BA组与SO组相比无显著差异(表1).
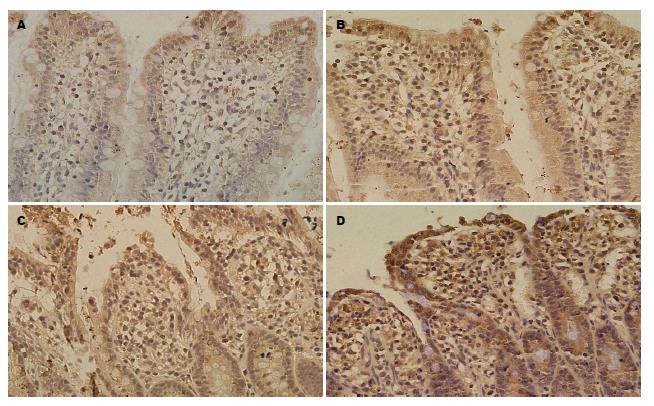
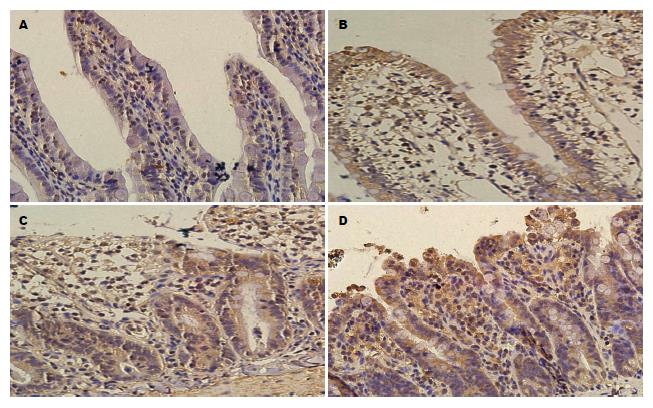
SO组大鼠小肠组织Nrf2在细胞核中表达很少或不表达; BA组和IIR组Nrf2表达呈阳性, 胞浆及胞核中均可见棕黄色颗粒, 与SO组相比差异具有统计学意义(P<0.05); BA+IIR组Nrf2表达呈强阳性, 胞浆和胞核中均可见大量棕黄色和褐色颗粒, 与IIR组相比差异具有统计学意义(P<0.01). HO-1在SO组表达为阴性或弱阳性, 胞浆呈淡黄色; BA组和IIR组HO-1表达为阳性, 胞浆中可见棕黄色颗粒, 与SO组相比差异具有统计学意义(P<0.05); BA+IIR组HO-1表达为强阳性, 胞浆中可见大量棕黄色颗粒, 与IIR组相比差异具有统计学意义(P<0.01), (表2, 图2, 3).
| 分组 | Nrf2(IHC) | HO-1(IHC) | Nrf2 (WB) | HO-1(WB) |
| SO组 | 0.289±0.041 | 0.258±0.027 | 0.584±0.048 | 0.592±0.037 |
| BA组 | 0.322±0.028a | 0.284±0.009a | 1.077±0.038b | 1.027±0.042b |
| IIR组 | 0.326±0.024a | 0.298±0.025a | 1.062±0.056b | 1.019±0.041b |
| BA+IIR组 | 0.371±0.024d | 0.336±0.031d | 1.541±0.100d | 1.458±0.071d |
| F值 | 10.195 | 14.064 | 286.315 | 403.491 |
| P值 | 0.000 | 0.000 | 0.000 | 0.000 |
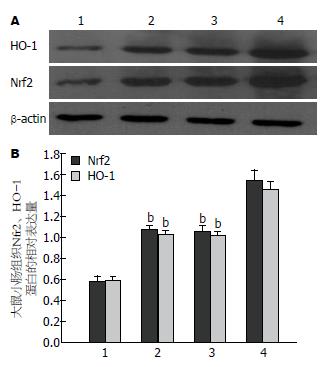
Western blot检测结果显示, BA组和IIR组与SO组比较, 肠组织Nrf2表达量明显增加, 差异具有统计学意义(均P<0.01); BA+IIR组Nrf2表达量明显高于IIR组, 差异具有统计学意义(P<0.01). 与SO组比较, BA组和IIR组肠组织HO-1表达明显增多, 差异具有统计学意义(P<0.01), BA+IIR组肠组织HO-1表达量比IIR组明显增加, 差异具有统计学意义(P<0.01)(表2, 图4).
临床上, IRII是危急重症患者常见的病理生理过程之一, 见于各种类型的休克复苏治疗后及各种原因的急性肠缺血灌流恢复后[8]. IIRI造成肠黏膜屏障结构的完整性破坏, 导致肠屏障功能障碍, 肠道细菌及内毒素移位, 严重者导致多器官功能障碍综合征[9,10].
黄芩苷是从黄芩根中提取分离出来的一种黄酮类化合物, 具有抗氧化、抗炎、抗病毒、抗肿瘤及免疫调节等生物学活性[5]. 研究表明, 黄芩苷通过抗氧化、抗炎和抗凋亡作用减轻大鼠肝脏[11]、脑[12]、心肌、肾脏等重要器官的缺血再灌注损伤[11-14]. 本实验结果显示IIR组Chiu氏肠黏膜损伤评分明显高于SO组, BA+IIR组Chiu评分明显低于IIR组评分, 表明黄芩苷可以显著减轻肠缺血再灌注损伤, 对肠黏膜结构具有保护作用.
IIRI过程中肠黏膜屏障损害导致肠道通透性增加, 肠道内细菌产生的D-乳酸可通过受损黏膜进入血液. Murray等[15]报道大鼠肠缺血5 min时, 循环血液中D-乳酸水平开始升高, 随肠缺血时间延长, D-乳酸水平持续升高. 本实验结果显示IIR组血浆D-乳酸水平明显升高, BA+IIR组血浆D-乳酸水平明显降低, 表明黄芩苷可以减轻大鼠IIRI导致的肠黏膜损伤, 从而抑制IIRI导致的肠道通透性增加.
研究表明IIRI过程中通过黄嘌呤氧化酶途径产生大量活性氧[16-18], 引起脂质过氧化、蛋白氧化失活、DNA断裂, 细胞发生凋亡和坏死[19]. SOD将机体内产生的氧自由基转化成活性低的H2O2, H2O2再经过过氧化氢酶或谷胱甘肽过氧化物酶转化成O2和H2O. 在肠缺血及再灌注期产生的氧自由基消耗机体内大量的SOD, 作为氧自由基诱导的脂质过氧化产物MDA含量增多[20-22]. 本实验结果显示, IIR组血清SOD活性明显下降、MDA含量明显增多. BA+IIR组血清SOD活性升高, MDA含量减少. 表明黄芩苷具有抗氧化、清除自由基的作用, 能够减轻肠缺血再灌注过程中自由基造成肠道损伤.
Nrf2是一种重要的内源性抗氧化应激调控因子, 生理状态下位于胞浆内. 当受到活性氧刺激时, Nrf2进入细胞核内, 与ARE结合, 上调其下游的抗氧化因子基因如SOD、HO-1等表达[23-26]. 研究表明, Nrf2的激活对肝脏、肾脏、心脏的缺血再灌注损伤具有保护作用[27-29]. Nrf2还可以被一些中药单体激活, 人参皂苷Rb1可以激活Nrf2-ARE信号通路减轻小鼠肠缺血再灌注对肾脏的损伤[30]. Ungvari等[31]研究证实, 白藜芦醇可以激活Nrf2-ARE信号通路, 上调HO-1、苯醌还原酶的表达, 对细胞氧化应激具有显著的抑制作用. 本实验结果显示, IIR组小肠组织中Nrf2、HO-1蛋白表达均明显高于SO组, 说明肠缺血再灌注使活性氧增加, 激活Nrf2-ARE信号通路, 但不足以对抗损伤过程. BA组较SO组小肠组织Nrf2、HO-1蛋白表达升高, BA+IIR小肠组织Nrf2、HO-1表达明显高于IIR组, 表明黄芩苷可以激活Nrf2-ARE信号通路, 诱导HO-1表达增加, 增强组织抗氧化和清除自由基的能力, 减轻肠缺血再灌注损伤.
总之, 大鼠肠缺血再灌注过程中存在氧化应激损伤, 黄芩苷可以减轻大鼠肠缺血再灌注损伤, 抑制肠道通透性增加, 其机制可能是通过激活Nrf2-ARE信号通路, 诱导抗氧化酶SOD、HO-1表达, 提高机体清除氧自由基的能力, 从而对肠缺血再灌注损伤起到保护作用. 但黄芩苷激活Nrf2-ARE信号通路的机制还不明确, 临床效果和安全性还有待于进一步研究.
肠缺血再灌注损伤(intestinal ischemia reperfusion injury, IIRI)是临床上许多疾病共同的病理生理过程, 他不仅引起肠屏障功能障碍, 还可以导致远隔器官损伤、全身炎症反应综合征和多器官功能障碍综合征, 因此 IIRI防治成为研究热点, 本实验探讨黄芩苷对大IIRI的保护作用及其机制.
门秀丽, 教授, 河北联合大学(原华北煤炭医学院)病理生理学教研室
IRII是危急重症患者常见的病理生理过程之一, 在其发病机制中, 氧自由基起着关键作用, 黄芩苷具有抗氧化、清除氧自由基等药理活性, 可有效减轻脏器的缺血再灌注损伤, 核因子相关因子2(NF-E2-related factor 2, Nrf2)是一种重要的内源性抗氧化应激的调控因子, 当受到氧自由基和抗氧化剂等信号激活后可以诱导超氧化物歧化酶(superoxide dismutase, SOD)、血红素加氧酶1(heme oxygenase 1, HO-1)等抗氧化酶的表达.
Sun等研究表明, 人参皂苷Rb1可以激活Nrf2-ARE信号通路减轻小鼠IIR对肾脏的损伤.
本研究建立IIR模型, 观察黄芩苷对大鼠IIRI的作用及对Nrf2-ARE信号通路的影响, 旨在探讨黄芩苷对大鼠IIRI的保护作用及其机制.
本研究表明, 黄芩苷可以减轻大鼠IIRI, 抑制肠道通透性增加, 其机制可能是通过激活Nrf2-ARE信号通路, 诱导抗氧化酶SOD、HO-1表达实现的. 为黄芩苷的临床应用和IIRI的防治提供了理论指导.
IIRI是临床上常见的病理过程, 探讨IIRI的可能机制与保护措施有一定的临床指导价值.
编辑 郭鹏 电编 鲁亚静
| 1. | Mallick IH, Yang W, Winslet MC, Seifalian AM. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Dig Dis Sci. 2004;49:1359-1377. [PubMed] [DOI] |
| 2. | Sasaki M, Joh T. Oxidative stress and ischemia-reperfusion injury in gastrointestinal tract and antioxidant, protective agents. J Clin Biochem Nutr. 2007;40:1-12. [PubMed] [DOI] |
| 3. | Li W, Kong AN. Molecular mechanisms of Nrf2-mediated antioxidant response. Mol Carcinog. 2009;48:91-104. [PubMed] [DOI] |
| 4. | Kaspar JW, Niture SK, Jaiswal AK. Nrf2: INrf2 (Keap1) signaling in oxidative stress. Free Radic Biol Med. 2009;47:1304-1309. [PubMed] [DOI] |
| 5. | Srinivas NR. Baicalin, an emerging multi-therapeutic agent: pharmacodynamics, pharmacokinetics, and considerations from drug development perspectives. Xenobiotica. 2010;40:357-367. [PubMed] [DOI] |
| 6. | Megison SM, Horton JW, Chao H, Walker PB. A new model for intestinal ischemia in the rat. J Surg Res. 1990;49:168-173. [PubMed] [DOI] |
| 7. | Chiu CJ, McArdle AH, Brown R, Scott HJ, Gurd FN. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal. Arch Surg. 1970;101:478-483. [PubMed] [DOI] |
| 8. | Okudan N, Belviranlı M, Gökbel H, Oz M, Kumak A. Protective effects of curcumin supplementation on intestinal ischemia reperfusion injury. Phytomedicine. 2013;20:844-848. [PubMed] [DOI] |
| 9. | Yuan Y, Guo H, Zhang Y, Zhou D, Gan P, Liang DM, Chen JY. Protective effects of L-carnitine on intestinal ischemia/reperfusion injury in a rat model. J Clin Med Res. 2011;3:78-84. [PubMed] [DOI] |
| 10. | Vollmar B, Menger MD. Intestinal ischemia/reperfusion: microcirculatory pathology and functional consequences. Langenbecks Arch Surg. 2011;396:13-29. [PubMed] [DOI] |
| 11. | Kim SJ, Moon YJ, Lee SM. Protective effects of baicalin against ischemia/reperfusion injury in rat liver. J Nat Prod. 2010;73:2003-2008. [PubMed] [DOI] |
| 12. | Cao Y, Mao X, Sun C, Zheng P, Gao J, Wang X, Min D, Sun H, Xie N, Cai J. Baicalin attenuates global cerebral ischemia/reperfusion injury in gerbils via anti-oxidative and anti-apoptotic pathways. Brain Res Bull. 2011;85:396-402. [PubMed] [DOI] |
| 13. | Wang X, He F, Liao Y, Song X, Zhang M, Qu L, Luo T, Zhou S, Ling Y, Guo J. Baicalin pretreatment protects against myocardial ischemia/reperfusion injury by inhibiting mitochondrial damage-mediated apoptosis. Int J Cardiol. 2013;168:4343-4345. [PubMed] [DOI] |
| 14. | Lin M, Li L, Li L, Pokhrel G, Qi G, Rong R, Zhu T. The protective effect of baicalin against renal ischemia-reperfusion injury through inhibition of inflammation and apoptosis. BMC Complement Altern Med. 2014;14:19. [PubMed] [DOI] |
| 15. | Murray MJ, Barbose JJ, Cobb CF. Serum D(-)-lactate levels as a predictor of acute intestinal ischemia in a rat model. J Surg Res. 1993;54:507-509. [PubMed] [DOI] |
| 16. | Yao JH, Zhang XS, Zheng SS, Li YH, Wang LM, Wang ZZ, Chu L, Hu XW, Liu KX, Tian XF. Prophylaxis with carnosol attenuates liver injury induced by intestinal ischemia/reperfusion. World J Gastroenterol. 2009;15:3240-3245. [PubMed] [DOI] |
| 17. | Hou CW, Lee YC, Hung HF, Fu HW, Jeng KC. Longan seed extract reduces hyperuricemia via modulating urate transporters and suppressing xanthine oxidase activity. Am J Chin Med. 2012;40:979-991. [PubMed] [DOI] |
| 18. | Abramov AY, Scorziello A, Duchen MR. Three distinct mechanisms generate oxygen free radicals in neurons and contribute to cell death during anoxia and reoxygenation. J Neurosci. 2007;27:1129-1138. [PubMed] [DOI] |
| 19. | Li C, Jackson RM. Reactive species mechanisms of cellular hypoxia-reoxygenation injury. Am J Physiol Cell Physiol. 2002;282:C227-C241. [PubMed] [DOI] |
| 20. | Röth E, Hejjel L, Jaberansari M, Jancso G. The role of free radicals in endogenous adaptation and intracellular signals. Exp Clin Cardiol. 2004;9:13-16. [PubMed] |
| 21. | Gutteridge JM, Halliwell B. The measurement and mechanism of lipid peroxidation in biological systems. Trends Biochem Sci. 1990;15:129-135. [PubMed] [DOI] |
| 22. | Yang X, Bai H, Cai W, Li J, Zhou Q, Wang Y, Han J, Zhu X, Dong M, Hu D. Lycium barbarum polysaccharides reduce intestinal ischemia/reperfusion injuries in rats. Chem Biol Interact. 2013;204:166-172. [PubMed] [DOI] |
| 23. | Kobayashi M, Yamamoto M. Molecular mechanisms activating the Nrf2-Keap1 pathway of antioxidant gene regulation. Antioxid Redox Signal. 2005;7:385-394. [PubMed] [DOI] |
| 24. | Jeong WS, Jun M, Kong AN. Nrf2: a potential molecular target for cancer chemoprevention by natural compounds. Antioxid Redox Signal. 2006;8:99-106. [PubMed] [DOI] |
| 25. | Thimmulappa RK, Mai KH, Srisuma S, Kensler TW, Yamamoto M, Biswal S. Identification of Nrf2-regulated genes induced by the chemopreventive agent sulforaphane by oligonucleotide microarray. Cancer Res. 2002;62:5196-5203. [PubMed] |
| 27. | Kudoh K, Uchinami H, Yoshioka M, Seki E, Yamamoto Y. Nrf2 Activation Protects the Liver From Ischemia/Reperfusion Injury in Mice. Ann Surg. 2013; Dec 23. [Epub ahead of print]. [PubMed] |
| 28. | Liu M, Reddy NM, Higbee EM, Potteti HR, Noel S, Racusen L, Kensler TW, Sporn MB, Reddy SP, Rabb H. The Nrf2 triterpenoid activator, CDDO-imidazolide, protects kidneys from ischemia-reperfusion injury in mice. Kidney Int. 2014;85:134-141. [PubMed] [DOI] |
| 29. | Katsumata Y, Shinmura K, Sugiura Y, Tohyama S, Matsuhashi T, Ito H, Yan X, Ito K, Yuasa S, Ieda M. Endogenous prostaglandin D2 and its metabolites protect the heart against ischemia-reperfusion injury by activating Nrf2. Hypertension. 2014;63:80-87. [PubMed] [DOI] |
| 30. | Sun Q, Meng QT, Jiang Y, Xia ZY. Ginsenoside Rb1 attenuates intestinal ischemia reperfusion induced renal injury by activating Nrf2/ARE pathway. Molecules. 2012;17:7195-7205. [PubMed] [DOI] |
| 31. | Ungvari Z, Bagi Z, Feher A, Recchia FA, Sonntag WE, Pearson K, de Cabo R, Csiszar A. Resveratrol confers endothelial protection via activation of the antioxidant transcription factor Nrf2. Am J Physiol Heart Circ Physiol. 2010;299:H18-H24. [PubMed] [DOI] |