修回日期: 2014-01-21
接受日期: 2014-03-19
在线出版日期: 2014-04-18
甲胎蛋白(alpha-fetoprotein, AFP)是一种胎儿特异性α-球蛋白, 一直以来都被认为是临床诊断胎儿出生缺陷和肝细胞癌的经典肿瘤标志物. 近年来大量的临床统计结果及基础研究证实, AFP不仅仅作为临床的诊断指标, 而在肝细胞癌的发生发展过程中发挥了重要的作用. 近年来研究证实AFP在肝细胞癌中发挥信号分子样作用, 参与调控肝癌细胞的多种生物学进程.
核心提示: 本文第一次汇总了甲胎蛋白(alpha-fetoprotein, AFP)基因的转录调控相关的研究结果, 并全面接受了AFP的各项生物学功能, 尤其是提出了AFP作为信号分子调控肝癌细胞的增殖, 参与肝癌的发生发展过程.
引文著录: 王珊珊, 李慧, 李刚. 甲胎蛋白的分子结构及生物学功能. 世界华人消化杂志 2014; 22(11): 1487-1494
Revised: January 21, 2014
Accepted: March 19, 2014
Published online: April 18, 2014
Mammalian alpha-fetoprotein (AFP) as a fetal specific alpha-globulin has long been used as a serum fetal defect/tumor marker for diagnosis and prediction of liver diseases. In the last decade, clinical and basic research data indicated that AFP acts not only as a biomarker but also as an intracellular signal molecule to play multifarious role in the development of hepatocellular carcinoma.
- Citation: Wang SS, Li H, Li G. Molecular structure and biological function of alpha-fetoprotein. Shijie Huaren Xiaohua Zazhi 2014; 22(11): 1487-1494
- URL: https://www.wjgnet.com/1009-3079/full/v22/i11/1487.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i11.1487
甲胎蛋白(alpha-fetoprotein, AFP)是肿瘤相关的胚胎特异α-球蛋白, 分子量约为70 kDa. 一直以来, AFP在临床上作为检测胎儿缺陷和肿瘤发生的标志物[1]. 据最新统计, 全世界每年新发肝癌患者约60万例, 而我国的肝癌新发患者数占全球的一半以上, 肝癌已然成为威胁我国人民健康和生命的第一大杀手. 在成人的肝细胞癌中, 约有70%-80%的患者在血清中可以检测到AFP的非正常表达. 据临床统计结果显示, AFP水平的升高与肝癌的恶性程度、药物耐受、患者预后及患者生存率等密切相关[2].
人类对甲胎蛋白的研究最早可以追溯到20世纪40年代, 人们发现原发性肝癌患者血清中与人类胎儿血清中有一共同的特殊成分, 并将这种特殊的蛋白成分称为甲种胎儿球蛋白即甲胎蛋白.
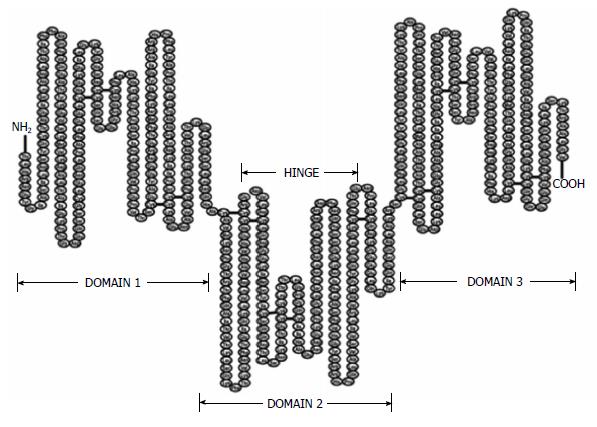
截至今日, AFP基因的DNA结构已经被全部克隆. AFP基因约为20 kbp大小, 由15个内含子和14个外显子组成, 包含590个氨基酸, 其中在N末端有19个氨基酸是信号肽序列[3], AFP蛋白质的分子量约为70 kDa[4]. AFP被归类于白蛋白基因超家族, 这个家族的结构特点为: 由半胱氨基酸残基, 通过二硫键结合, 内折成一个环, 形成一个U形的3级结构域. 这些分子, 通过晶体X-射线结果确定都含有3个结构域(图1)[5].
用GCG(Wisconsin Program)软件对其全序列进行了分析, 结果显示在第3个结构域中, 含有1个异二聚体化的基序, 这个序列中, 连续几个疏水性氨基酸组成的1个亮氨酸拉链样的结构. 分析结果还显示AFP与一些生长因子及核转录因子在序列上也存在一定的匹配性[6]. 这为后续人们研究AFP蛋白质的生物学作用提供了新的思路和方向. 根据文献, 我们总结了并展示了部分AFP的结构分析结果(表1).
| 蛋白质 | 氨基酸序列号 | 氨基酸序列 | 同源性/相似性(%) |
| 生长因子 | |||
| Human AFP | 447-480 | LSEDKLLACGEGAADIIIGHLCIRHEMTPCNPGVG | 100/100 |
| Human TGF-β | 106-117 | LSEDQLLLIQIP | 50/8 |
| Human ATV | 955-968 | LSEQRLLPRGEG | 58/17 |
| Human IL-2 | 1245-1256 | IXSIIVGHLGXF | 42/8 |
| 转录相关因子 | |||
| Human AFP | 339-362 | YSRRHPQLAVSVILRVAKGYQELL | 100/100 |
| Human RAR | 235-254 | FAKRLPGFTXGXXLTIADQXITLL | 35/40 |
| Human RXR | 346-365 | WAKRIPHFSXSXXLPLDDQXVILL | 35/35 |
| Human T3R | 286-305 | FAKKLPMFCXEXXLPCEDQXIILL | 20/45 |
| Human ER | 360-379 | FAKRVPGFVXDXXLTLHDQXVHLL | 25/35 |
| 转录相关因子 | |||
| Human AFP | 445-457 | LSEDKLLACGEG | 100/100 |
| Human Zn-Fg | 725-736 | LSDHKLLESTCK | 45/25 |
| Human Rev-erb | 523-535 | FSEXKLNALTEE | 50/30 |
| Human RAR | 307-319 | FANQXLLXPLEM | 30/40 |
| 转录相关因子 | |||
| Human AFP | 458-470 | AADIIIGHLCIR | 100/100 |
| Human HGMP | 12-21 | VAQIIIGHLCIR | 83/7 |
| Human Zn-Fg | 330-341 | AGGTLVGHLCVR | 50/25 |
| Human C-Myc | 217-226 | VOSIIVGHLCWF | 50/17 |
| 转录相关因子 | |||
| Human AFP | 471-480 | EMTPVNPGVG | 100/100 |
| Human TF11D | 163-174 | PMTPATPGSA | 50/20 |
| Human Kid-TS | 1145-1154 | KSTGANPGVP | 50/10 |
| Human Cad-TS | 3718-3727 | EMTPVLEAII | 50/0 |
| Human FTZ-F1 | 628-637 | KPTPISPGYQ | 50/30 |
| Human I-Rel TF | 528-537 | EASPSTPGRQ | 40/30 |
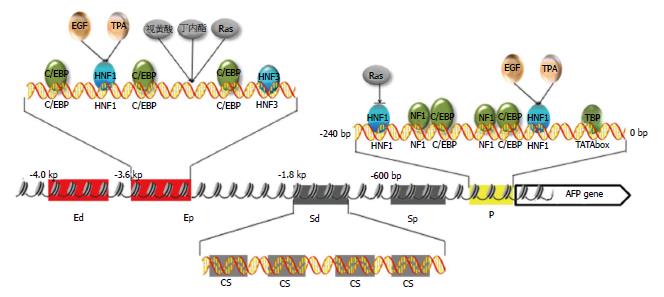
自从1983年AFP基因的DNA全序列被克隆开始, 人们对他的研究从未停止过. 婴儿时期, 基因处于开放状态, 到胎儿出生后, AFP很快处于关闭状态, 直至在肝细胞癌或肝脏良性再生时, AFP基因再度处于开放状态, 并在肝细胞癌中发挥了重要的作用, 到底AFP基因的转录开放与关闭是如何调控的?人AFP基因的5'-末端是高度保守的, 含有转录因子的特定结合序列[7]. AFP基因转录调控主要受控于5'-侧翼的3种调控区域, 即启动子、增强子和沉默子.
AFP基因在转录起始位点的上游44 bp处有一个帽子结构, 具有两个AFLU家族(灵长类特有的中度重复序列, 是基因组中最活跃的遗传区域之一). 在帽子序列上游的27 bp处, 还有一个经典的"TATA"盒子结构. AFP启动子位于基因上游200 bp的区域, 这个区域里有很多调节AFP基因的转录调控因子的结合位点[8]. 其中确定有两个肝细胞核因子1(hepatocyte nuclear factor-1, HNF1)的结合位点, 促进AFP基因的转录活性. 此外实验证实, 地塞米松等通过AFP基因上游的糖皮质激素反应区域(GRE), 也可以促进AFP启动子的活性[9].
有研究证实AFP基因的-109 bp发生了G-A点突变, 此位点位于启动子上HNF1、NF1和C/EBP的重叠结合位点内, 而G-A点突变, 使得此序列对HNF1的亲和力增强, 从而促进了AFP转录[10]. 12-O-十四烷酰佛波醋酸酯-13(12-Otetradecanoylphorbol-13-acetate, TPA)和表皮生长因子(epidermal growth factor, EGF)可以与HNF1结合位点相互作用, 从而协同促进AFP基因的转录活性; 而Ras通过HNF1抑制基因的转录, 视黄酸可以通过降低HNF1和HNF4的表达, 从而降低AFP的转录水平[11,12].
体外的双荧光素酶报告基因检测系统证明, 启动子的转录活性相对较低, 在的转录活性中, 增强子发挥了很大的作用, 因此增强子的研究在AFP的转录表达中占有了很重要的地位[13,14].
在AFP基因的转录调控区, 目前已经确定有两个增强子[15], 一个远端增强子位于转录起始位点上游的-4.0--3.7 kb处, 近端增强子位于-3.6--3.3 kb处. 已知, 在人AFP远端增强子上已经确定有两个C/EBP结合位点和HNF1、HNF4结合位点各一个. 在近端增强子上确定了3个C/EBP的结合位点和HNF1、HNF3结合位点各一个[5,15].
有报道证实, 这两个增强子具有组织特异性, 在非肝细胞中并不能发挥作用. 实验证明, AFP增强子的组织特异性主要是由HNF1的作用引起[16]. 有文献证实AFP基因具有高度的保守性, 但在大鼠和小鼠的AFP增强子中并未检测到有任何HNF1的结合位点, 因而推测得出, 具有HNF1的结合位点可能是人类AFP增强子的一个特征[17].
有报道证实, EGF和12-O-十四烷酰佛波醋酸酯-13(TPA)可以通过与增强子上的HNF1的结合位点相互协同促进AFP转录活性. 但Ras对增强子上的HNF1的活性抑制, 相较启动子也更为强烈. 肝素结合表皮生长因子样生长因子(heparin binding epidermal growth factor, HB-EGF)则可以选择性的抑制AFP增强子的活性[18]. 辛伐他丁可以激活AFP启动子和增强子的活性, 而视黄酸和丁内酯对增强子来说, 是负调控因素[18-20].
对增强子的研究很多, 但目前并不完全清楚增强子的作用机制, 对于AFP增强子的特殊性, 我们还需要进一步的实验证实.
在人AFP的转录调控区, 位于增强子和启动子之间, 存在两个沉默子. 远端沉默子位于转录起始位点的-1.8--1.3 kb处, 近端沉默子位于-400--200 bp处. 众所周知, AFP的启动子活性非常弱, 所以AFP的转录活性更多依赖增强子的活性[19]. 研究结果证实AFP的沉默子并不直接抑制启动子的功能, 只是阻止增强子对启动子的增强作用.
有报道称, 远端沉默子对AFP基因的调控能力远远大于近端沉默子. 在两个沉默子中, 都存在一个共有序列: 5'-CTTCATAACTAATACTT-3', 这个序列在远端沉默子中有4个拷贝, 在近端沉默子中只有1个拷贝[20]. 这个序列高度保守, 可以强烈的抑制AFP的转录活性, 但具体作用机制目前我们还不清楚.
在小鼠体内, 沉默子在胎儿肝脏的活性极其低, 但在成年肝脏中较高. 这提示我们沉默子在抑制AFP表达中发挥了很重要的作用, 沉默子的异常也可以作为重新开启AFP转录活性的关键. 因此对沉默子的研究有助于帮助我们找到AFP活化的关键. 下图展示了AFP基因的转录调控机制(图2).
近年来, 人们对于AFP基因的转录调控做了大量的研究, 也取得了一定的进展, 但是对于肝癌发生过程中, AFP基因的重新激活机制并不明朗, 还需要进一步的研究.
上述我们介绍了AFP的结构及其转录调控机制, 这些为AFP的生物学功能的研究提供了很好的基础, AFP在临床的应用越来越多地被人们所开发. 从开始的胎儿缺陷/肿瘤标志物, 到现在作为患者预后指标. 也可以用作临床治疗肝癌的一个靶分子等.
AFP是人类发现的第一个具有临床应用价值的肿瘤标志物, 一直以来被认为是诊断原发性肝细胞的重要标志物. 关于AFP的诊断标准, 国际学术界建议将参考值限定在20 ng/mL. 许多学者还将AFP值用来判断患者的预后及治疗效果, 一般认为AFP值高于500 ng/mL, 患者的存活期可能比较短[21]; 手术后AFP值依旧高于200 ng/mL, 表明肝癌组织并未完全切除或存在转移的情况. AFP mRNA水平目前在临床上研究也很多, 实验证实AFP mRNA水平与肝细胞癌的大小及转移情况存在显著的相关性[22-24].
对于AFP蛋白及mRNA在临床上的应用, 人们还在进一步的探索, 如何提高肝细胞癌的诊断以及准确判断患者预后等都还需要人们大量的临床统计工作.
AFP蛋白质归类于白蛋白家族, 所以其部分功能也具有白蛋白家族的共性. 大量的文献报道, AFP具有作为载体结合配体并运输的功能. AFP可以多种配体结合, 主要包括: 脂肪酸类、类固醇类、染料、重金属以及各种药物[25-27]. 最近有报道称, AFP可以和多种抗癌药物结合, 并通过受体介导的胞吞作用选择性的进入肿瘤细胞, 起到靶向高效杀死肿瘤细胞[28,29].
AFP是胎儿体内很重要的一个蛋白质分子, 具有免疫抑制功能, 能有效的抑制母体对胎儿的免疫排斥. 在胎儿发育过程中, AFP可以抑制T淋巴细胞介导的细胞毒性, 抑制T细胞的作用, 这可能是胎儿可以逃逸母体免疫排斥的主要原因[30], 但是AFP在肝细胞癌中所发挥的免疫逃逸功能并不是很清楚.
有研究证实AFP在人和小鼠原发性肝细胞癌中, 通过改变CD4+和CD8+等T淋巴细胞亚群的比例, 并导致淋巴细胞死亡, 从而抑制机体的免疫功能. 还有实验报道, AFP可能通过调节肿瘤坏死因子受体、c-Jun及Fas途径, 逃避机体的免疫监视[31]. 近期研究证实, 从人脐带血中分离的AFP作用于肝癌患者的单核细胞, 可以抑制单核细胞转变为成熟的树突细胞(dendritic cell, DC). 由于AFP可以抑制树突细胞的成熟, 因此可以使得肿瘤逃脱了机体的免疫监控.
尽管AFP抑制机体的免疫应答的机制我们并不十分清楚, 但可以肯定的是AFP是一种免疫抑制蛋白质.
正常情况下, AFP是作为一个胚胎时期的基因表达产物存在的, 伴随着胚胎的发育和细胞分裂旺盛的阶段. 而在原发性肝细胞癌中, 我们检测到AFP基因重新开始表达, 肝癌细胞比起正常肝脏细胞, 其增殖能力及抗凋亡能力都大大提高, 很有可能AFP是促进肿瘤细胞增殖的一个关键的内源性分子[32,33].
作为一种大分子的蛋白质, AFP通过膜受体介导的胞吞作用进入细胞内, 从而调节细胞的各种生物学进程. 体外实验发现, 在人肝癌细胞系HepG2和HLE细胞中, 加入适当剂量的AFP时可以直接促进肝癌细胞的增殖[21].
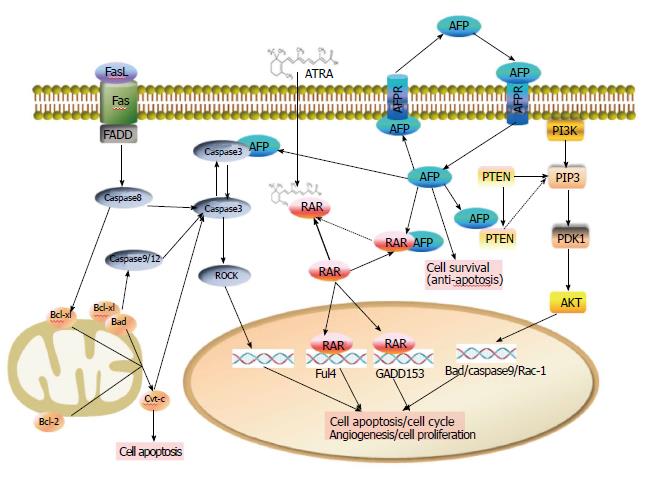
根据上述AFP结构分析得知, AFP在结构上存在与多种生长因子和核受体相互匹配的保守序列, 包括RAR、RXR、T3R和ER等多种核转录因子[34]. 我们推测, 胞浆当中的AFP可能是通过结合这些分子, 从而作为信号分子参与到多种信号通路, 调控细胞增殖等多种生物学进程.
我们实验室首次证实, 胞浆当中的AFP可以与核受体RAR相互作用, 阻止RA-RAR信号通路的传递, 导致RAR调控的下游基因fn14和gadd153等的表达发生改变, 从而影响整个细胞的生物学进程[35,36]. 揭示了AFP在肿瘤细胞增殖及耐药性方面的所发挥的作用. 部分解释了全反式维甲酸在治疗AFP阳性肝癌时所产生的耐药性, 也给我们在临床用药上提供了思路.
我们实验室还证实了, 胞浆当中的AFP可以与PTEN相互作用, 从而参与了PI3K/AKT信号通路, 参与调控细胞的增殖、迁移、侵袭和肿瘤的血管生成[37]. AFP还可以与Caspase3相互结合, 阻断了Caspase的信号传递, 抑制淋巴细胞分泌的肿瘤坏死因子、Fas和肿瘤坏死因子受体对肝癌细胞的攻击, 从而实现阻断细胞凋亡的信号传递, 促进细胞增殖[38].
总之, 我们可以肯定, AFP不仅可以直接促进细胞的增殖, 还可以作为胞浆内的信号分子, 参与多条信号通路, 从而调控细胞的多种生物学进程. 图3展示了我们实验室所做的工作, 总结了一下AFP在胞浆当中的生物学作用. 当然AFP分子更多的生物学活性还需要进一步的验证.
最近有报道称AFP分子促进肝癌细胞增殖, 但其中衍生的小片段却可以抑制细胞的增殖, 这种新的观点引起了人们的关注.
Mizejewski等[39]多次报道, AFP分子衍生四种生长抑制肽(growth inhibitory peptide, GIP), 分别为GIP-34、GIP-12、GIP-14和GIP-8. 但目前研究较多集中在GIP-34上, 结果证实GIP-34可以抑制多种肿瘤细胞的增殖, 在动物体内也得到了一定的证实[40-42]. 有报道称GIP-34通过P53和Bcl-2等参与细胞的调控, 但是对于其具体作用机制, 目前还不是十分清楚, 还需要进一步的实验证实.
如果我们在临床治疗上, 采用小肽段来代替全长的AFP基因, 其靶点更为专一, 不良反应较少, 可以为靶向治疗提供了更好的选择.
AFP并不是肝细胞癌所特有的, 在其他肿瘤中也多有报道. 其中以胃癌最常见, 胃癌中AFP的水平高低与患者的预后, 癌细胞的转移及生存率都有很大的关系[43,44]. 除了胃癌, 在其他消化系统癌症中, 例如: 直肠癌、胆囊癌等也检测到AFP的表达[45]. 此外, 在生殖系统癌症中, 也检测到AFP的表达[46,47], 在乳腺癌中, 也有多次报道AFP的存在, 可以与雌激素相互作用, 促进乳腺癌细胞的增殖[48-50].
近期还有报道称, AFP可以作为肿瘤标志物, 与IL-2共同转染树突细胞, 这些树突细胞, 将携带的AFP肿瘤抗原呈递给T淋巴细胞, 增强了T淋巴细胞的细胞毒性, 可以特异性地消灭肿瘤细胞[51], 目前在临床上已经有应用, 取得了很好的治疗效果.
人类从最初发现AFP蛋白到今日, 我们对AFP的认识也越来越多, 70年代作为胎儿缺陷/肿瘤的诊断标志物, 80年代认识AFP可以作为载体运输多种配体, 90年代发现AFP可以促进肝癌细胞的增殖, 到现在AFP可以作为胞内信号分子参与调控细胞的多种进程. 但是AFP是一种结构很复杂的蛋白质, 有3个不同的功能域, 每个功能域有不同的生物学活性, AFP还有多种异构体, 这对我们研究AFP的生物学活性, 都带来了极大的困难. 导致到目前为止, 我们对于AFP的生物学功能还不能完全阐述清楚. 目前AFP受体也没有得到完整的克隆, AFP受体在AFP发挥生物学作用中又起到了什么样的作用, 这些都还是未知数. 不过可以肯定的是, AFP蛋白可以通过多种途径, 促进肝细胞癌的发生发展, 我们需要更多的研究, 来阐述AFP的具体作用机制, 为临床上治疗肝细胞癌提供更多更好的办法.
甲胎蛋白(alpha-fetoprotein, AFP)是一直以来都被认为是临床诊断胎儿出生缺陷和肝细胞癌的经典肿瘤标志物. 近年来大量研究证实, AFP在肝细胞癌的发生发展过程中发挥了重要的作用, 尤其是促进肝癌细胞的增殖转移等过程, 同时研究证实AFP的水平于患者的预后有着密切的关系. 本文就AFP现有的研究报道, 进行了整体的梳理和汇总.
刘亮, 副主任医师, 复旦大学胰腺癌研究所, 复旦大学附属肿瘤医院胰腺肝胆外科
人们对于AFP的研究可以追溯到从20世纪70年代, 目前对于AFP的研究热点主要集中在: (1)AFP基因的转录调控; (2)AFP蛋白质发挥作用的分子机制; (3)AFP受体在AFP发挥生物学功能中发挥了什么样的生物学作用. 而研究的重点是: 如何提高AFP作为肝癌标志物的特异性和敏感性以及临床上AFP的应用价值.
本文主要是整理汇总了有关AFP的研究报道, 为人们深入全面认识AFP提供了一个平台. 在本文中主要的亮点就是集中描述了AFP在胞内的信号分子样作用, 这个概念的提出, 赋予了AFP新的生物学意义, 也为其他肿瘤标志物的研究提供了新的思路.
本文第一次深入全面的解析了AFP蛋白质, 从蛋白质的分子结构, 到AFP基因的转录调控机制, 最后到AFP的分子生物学功能及其机制, 都进行了综合的描述. 比其他综述类文章的描述更为全面和详细, 可以快速全面了解AFP.
通过本综述, 可以快速全面了解AFP这一分子. 在本文中我们提出了AFP的研究热点及难点, 亟待解决的问题, 为AFP研究者提供了研究方向, 指导人们对于AFP的难点研究, 引导人们更多研究AFP蛋白质的分子机制及其意义, 为临床上治疗肝细胞癌提供更多更好的办法.
本文综述整体框架清晰、内容详实, 是一篇质量较高的综述.
编辑 田滢 电编 鲁亚静
| 1. | Mizejewski GJ. Biological roles of alpha-fetoprotein during pregnancy and perinatal development. Exp Biol Med (Maywood). 2004;229:439-463. [PubMed] |
| 2. | Butterfield LH, Ribas A, Dissette VB, Lee Y, Yang JQ, De la Rocha P, Duran SD, Hernandez J, Seja E, Potter DM. A phase I/II trial testing immunization of hepatocellular carcinoma patients with dendritic cells pulsed with four alpha-fetoprotein peptides. Clin Cancer Res. 2006;12:2817-2825. [PubMed] [DOI] |
| 3. | Tamaoki T, Morinaga T, Sakai M, Protheroe G, Urano Y, Wegmann TG. Structural analysis of the human alpha-fetoprotein gene. Ann N Y Acad Sci. 1983;417:13-20. [PubMed] [DOI] |
| 4. | Tomasi TB. Structure and function of alpha-fetoprotein. Annu Rev Med. 1977;28:453-465. [PubMed] [DOI] |
| 5. | Mizejewski GJ. Alpha-fetoprotein structure and function: relevance to isoforms, epitopes, and conformational variants. Exp Biol Med (Maywood). 2001;226:377-408. [PubMed] |
| 6. | Dauphinée MJ, Mizejewski GJ. Human alpha-fetoprotein contains potential heterodimerization motifs capable of interaction with nuclear receptors and transcription/growth factors. Med Hypotheses. 2002;58:453-461. [PubMed] [DOI] |
| 7. | Sakai M, Morinaga T, Urano Y, Watanabe K, Wegmann TG, Tamaoki T. The human alpha-fetoprotein gene. Sequence organization and the 5' flanking region. J Biol Chem. 1985;260:5055-5060. [PubMed] |
| 8. | Bois-Joyeux B, Danan JL. Members of the CAAT/enhancer-binding protein, hepatocyte nuclear factor-1 and nuclear factor-1 families can differentially modulate the activities of the rat alpha-fetoprotein promoter and enhancer. Biochem J. 1994;301:49-55. [PubMed] |
| 9. | Mazume H, Nakata K, Hida D, Hamasaki K, Tsuruta S, Nakao K, Kato Y, Eguchi K. Effect of simvastatin, a 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitor, on alpha-fetoprotein gene expression through interaction with the ras-mediated pathway. J Hepatol. 1999;30:904-910. [PubMed] [DOI] |
| 10. | Locker J, Ghosh D, Luc PV, Zheng J. Definition and prediction of the full range of transcription factor binding sites--the hepatocyte nuclear factor 1 dimeric site. Nucleic Acids Res. 2002;30:3809-3817. [PubMed] [DOI] |
| 11. | Ishikawa H, Nakata K, Tsuruta S, Nakao K, Kato Y, Tamaoki T, Eguchi K. Differential regulation of albumin gene expression by heparin-binding epidermal growth factor-like growth factor in alpha-fetoprotein-producing and -nonproducing human hepatoma cells. Tumour Biol. 1999;20:130-138. [PubMed] [DOI] |
| 12. | Nakao K, Lawless D, Ohe Y, Miyao Y, Nakabayashi H, Kamiya H, Miura K, Ohtsuka E, Tamaoki T. c-Ha-ras down regulates the alpha-fetoprotein gene but not the albumin gene in human hepatoma cells. Mol Cell Biol. 1990;10:1461-1469. [PubMed] |
| 13. | Ishikawa H, Nakata K, Mawatari F, Ueki T, Tsuruta S, Ido A, Nakao K, Kato Y, Ishii N, Eguchi K. Utilization of variant-type of human alpha-fetoprotein promoter in gene therapy targeting for hepatocellular carcinoma. Gene Ther. 1999;6:465-470. [PubMed] [DOI] |
| 14. | Lee K. [Regulation of human alpha-fetoprotein gene by C/EBPalpha]. Hokkaido Igaku Zasshi. 2004;79:377-387. [PubMed] |
| 15. | Watanabe K, Saito A, Tamaoki T. Cell-specific enhancer activity in a far upstream region of the human alpha-fetoprotein gene. J Biol Chem. 1987;262:4812-4818. [PubMed] |
| 16. | Jose-Estanyol M, Danan JL. A liver-specific factor and nuclear factor I bind to the rat alpha-fetoprotein promoter. J Biol Chem. 1988;263:10865-10871. [PubMed] |
| 17. | Morinaga T, Yasuda H, Hashimoto T, Higashio K, Tamaoki T. A human alpha-fetoprotein enhancer-binding protein, ATBF1, contains four homeodomains and seventeen zinc fingers. Mol Cell Biol. 1991;11:6041-6049. [PubMed] |
| 18. | Keel BA, Eddy KB, Cho S, May JV. Human alpha-fetoprotein purified from amniotic fluid enhances growth factor-mediated cell proliferation in vitro. Mol Reprod Dev. 1991;30:112-118. [PubMed] [DOI] |
| 19. | Magee TR, Cai Y, El-Houseini ME, Locker J, Wan YJ. Retinoic acid mediates down-regulation of the alpha-fetoprotein gene through decreased expression of hepatocyte nuclear factors. J Biol Chem. 1998;273:30024-30032. [PubMed] [DOI] |
| 20. | Dohda T, Kaneoka H, Inayoshi Y, Kamihira M, Miyake K, Iijima S. Transcriptional coactivators CBP and p300 cooperatively enhance HNF-1alpha-mediated expression of the albumin gene in hepatocytes. J Biochem. 2004;136:313-319. [PubMed] [DOI] |
| 21. | Li P, Wang SS, Liu H, Li N, McNutt MA, Li G, Ding HG. Elevated serum alpha fetoprotein levels promote pathological progression of hepatocellular carcinoma. World J Gastroenterol. 2011;17:4563-4571. [PubMed] [DOI] |
| 22. | Marubashi S, Dono K, Nagano H, Sugita Y, Asaoka T, Hama N, Miyamoto A, Takeda Y, Umeshita K, Monden M. Detection of AFP mRNA-expressing cells in the peripheral blood for prediction of HCC recurrence after living donor liver transplantation. Transpl Int. 2007;20:576-582. [PubMed] [DOI] |
| 23. | Gross-Goupil M, Saffroy R, Azoulay D, Precetti S, Emile JF, Delvart V, Tindilière F, Laurent A, Bellin MF, Bismuth H. Real-time quantification of AFP mRNA to assess hematogenous dissemination after transarterial chemoembolization of hepatocellular carcinoma. Ann Surg. 2003;238:241-248. [PubMed] [DOI] |
| 24. | Zhi H, Zhan J, Deng QL, Huang ZM. [Postoperative detection of AFP mRNA in the peripheral blood of hepatic cellular carcinoma patients and its correlation with recurrence]. Zhonghua Zhongliu Zazhi. 2007;29:112-115. [PubMed] |
| 25. | Terentiev AA, Moldogazieva NT. Structural and functional mapping of alpha-fetoprotein. Biochemistry (Mosc). 2006;71:120-132. [PubMed] [DOI] |
| 26. | Deutsch HF. Chemistry and biology of alpha-fetoprotein. Adv Cancer Res. 1991;56:253-312. [PubMed] [DOI] |
| 27. | Torres JM, Anel A, Uriel J. Alpha-fetoprotein-mediated uptake of fatty acids by human T lymphocytes. J Cell Physiol. 1992;150:456-462. [PubMed] [DOI] |
| 28. | Moskaleva EYu GA, Shmyrev II, Rodina AV, Muizhnek EL, Severin ES, Katukov VYu YM, Severin SE. Alpha-fetoprotein-mediated targeting--a new strategy to overcome multidrug resistance of tumour cells in vitro. Cell Biol Int. 1997;21:793-799. [PubMed] [DOI] |
| 29. | Severin SE, Posypanova GA, Katukov VYu II, Luzhkov YuM GK, Zhukova OS, Vorozhtsov GN, Kaliya OL, Lukyanets EA, Severin ES. Antitumor activity of conjugates of the oncofetal protein alpha-fetoprotein and phthalocyanines in vitro. Biochem Mol Biol Int. 1997;43:1081-1089. [PubMed] |
| 30. | Peck AB, Murgita RA, Wigzell H. Cellular and genetic restrictions in the immunoregulatory activity of alpha-fetoprotein. III. Role of the MLC-stimulating cell population in alpha-fetoprotein-induced suppression of T cell-mediated cytotoxicity. J Immunol. 1982;128:1134-1140. [PubMed] |
| 31. | Xu GW, Sun ZT, Forrester K, Wang XW, Coursen J, Harris CC. Tissue-specific growth suppression and chemosensitivity promotion in human hepatocellular carcinoma cells by retroviral-mediated transfer of the wild-type p53 gene. Hepatology. 1996;24:1264-1268. [PubMed] [DOI] |
| 32. | Ohguchi S, Nakatsukasa H, Higashi T, Ashida K, Nouso K, Ishizaki M, Hino N, Kobayashi Y, Uematsu S, Tsuji T. Expression of alpha-fetoprotein and albumin genes in human hepatocellular carcinomas: limitations in the application of the genes for targeting human hepatocellular carcinoma in gene therapy. Hepatology. 1998;27:599-607. [PubMed] [DOI] |
| 33. | Cillo U, Vitale A, Navaglia F, Basso D, Montin U, Bassanello M, D'Amico F, Ciarleglio FA, Brolese A, Zanus G. Role of blood AFP mRNA and tumor grade in the preoperative prognostic evaluation of patients with hepatocellular carcinoma. World J Gastroenterol. 2005;11:6920-6925. [PubMed] |
| 34. | Moldogazieva NT, Terent'ev AA, Shaĭtan KV. [Relationship between structure and function of alpha-fetoprotein: conformational status and biological activity]. Biomed Khim. 2005;51:127-151. [PubMed] |
| 35. | Li C, Wang S, Jiang W, Li H, Liu Z, Zhang C, McNutt MA, Li G. Impact of intracellular alpha fetoprotein on retinoic acid receptors-mediated expression of GADD153 in human hepatoma cell lines. Int J Cancer. 2012;130:754-764. [PubMed] [DOI] |
| 36. | Wang S, Jiang W, Chen X, Zhang C, Li H, Hou W, Liu Z, McNutt MA, Lu F, Li G. Alpha-fetoprotein acts as a novel signal molecule and mediates transcription of Fn14 in human hepatocellular carcinoma. J Hepatol. 2012;57:322-329. [PubMed] [DOI] |
| 37. | Li M, Li H, Li C, Wang S, Jiang W, Liu Z, Zhou S, Liu X, McNutt MA, Li G. Alpha-fetoprotein: a new member of intracellular signal molecules in regulation of the PI3K/AKT signaling in human hepatoma cell lines. Int J Cancer. 2011;128:524-532. [PubMed] [DOI] |
| 38. | Li M, Li H, Li C, Zhou S, Guo L, Liu H, Jiang W, Liu X, Li P, McNutt MA. Alpha fetoprotein is a novel protein-binding partner for caspase-3 and blocks the apoptotic signaling pathway in human hepatoma cells. Int J Cancer. 2009;124:2845-2854. [PubMed] [DOI] |
| 39. | Mizejewski GJ, MacColl R. Alpha-fetoprotein growth inhibitory peptides: potential leads for cancer therapeutics. Mol Cancer Ther. 2003;2:1243-1255. [PubMed] |
| 40. | Mizejewski GJ, Mirowski M, Garnuszek P, Maurin M, Cohen BD, Poiesz BJ, Posypanova GA, Makarov VA, Severin ES, Severin SE. Targeted delivery of anti-cancer growth inhibitory peptides derived from human alpha-fetoprotein: review of an International Multi-Center Collaborative Study. J Drug Target. 2010;18:575-588. [PubMed] [DOI] |
| 41. | Mizejewski G, Smith G, Butterstein G. Review and proposed action of alpha-fetoprotein growth inhibitory peptides as estrogen and cytoskeleton-associated factors. Cell Biol Int. 2004;28:913-933. [PubMed] [DOI] |
| 42. | Mizejewski GJ, Muehlemann M, Dauphinee M. Update of alpha fetoprotein growth-inhibitory peptides as biotherapeutic agents for tumor growth and metastasis. Chemotherapy. 2006;52:83-90. [PubMed] [DOI] |
| 43. | Amano I, Sawai N, Mizuno C, Shaura Y, Nishiwaki M, Horimoto R, Oya H, Kato R, Seki K, Hashimoto H. [A case of HER2-positive and AFP-producing gastric cancer successfully treated by trastuzumab/docetaxel/S-1 combination therapy]. Gan To Kagaku Ryoho. 2012;39:2541-2544. [PubMed] |
| 44. | Mosimann F. Laparoscopic cholecystectomy has become the new gold standard for the management of symptomatic gallbladder stones. Hepatogastroenterology. 2006;53:1 p preceding I; author reply 1 p preceding I. [PubMed] |
| 45. | Yamanaka H, Nakane Y, Tanaka K, Imabayashi N, Nishi M, Hioki K, Takayama B, Yamamoto M. [AFP-producing gastric cancer--analyses of 17 cases]. Gan No Rinsho. 1986;32:1934-1940. [PubMed] |
| 46. | Calaminus G, Bamberg M, Harms D, Jürgens H, Kortmann RD, Sörensen N, Wiestler OD, Göbel U. AFP/beta-HCG secreting CNS germ cell tumors: long-term outcome with respect to initial symptoms and primary tumor resection. Results of the cooperative trial MAKEI 89. Neuropediatrics. 2005;36:71-77. [PubMed] [DOI] |
| 47. | Sekiya S, Inaba N, Iwasawa H, Kobayashi O, Takamizawa H, Matsuzaki O, Nagao K. AFP-producing Sertoli-Leydig cell tumor of the ovary. Arch Gynecol. 1985;236:187-196. [PubMed] [DOI] |
| 48. | Vakharia D, Mizejewski GJ. Human alpha-fetoprotein peptides bind estrogen receptor and estradiol, and suppress breast cancer. Breast Cancer Res Treat. 2000;63:41-52. [PubMed] [DOI] |
| 49. | Richardson BE, Hulka BS, Peck JL, Hughes CL, van den Berg BJ, Christianson RE, Calvin JA. Levels of maternal serum alpha-fetoprotein (AFP) in pregnant women and subsequent breast cancer risk. Am J Epidemiol. 1998;148:719-727. [PubMed] [DOI] |
| 50. | Latteri M, Spinnato G, Pantuso G, Di Lisi G, Latteri S, Bellanca L, Latteri MT, Cirello B, Ciaccio M. [Evaluation of ferritin, CEA and AFP in patients operated on for carcinoma of the breast. Preliminary results]. Minerva Chir. 1987;42:911-916. [PubMed] |
| 51. | Yang JY, Li X, Gao L, Teng ZH, Liu WC. Co-transfection of dendritic cells with AFP and IL-2 genes enhances the induction of tumor antigen-specific antitumor immunity. Exp Ther Med. 2012;4:655-660. [PubMed] |