修回日期: 2014-02-21
接受日期: 2014-02-28
在线出版日期: 2014-04-08
目的: 探讨甲基化酶抑制剂5'-氮杂-2'-脱氧胞苷(5'-Aza-2'-deoxycytidine, 5'-Aza-CdR)对结直肠癌细胞株HT-29和LoVo中CDX2基因甲基化水平、mRNA及蛋白表达的影响.
方法: 用不同浓度5'-Aza-CdR处理结直肠癌细胞株HT-29和LoVo. 应用TaqMan探针为基础的实时定量PCR(Methylight)方法、SYBR Green PCR方法及蛋白印迹实验(Western blot)检测药物处理前后HT-29和LoVo细胞中CDX2基因的甲基化状态、mRNA和蛋白表达.
结果: Methylight检测HT-29和LoVo细胞中CDX2蛋白在药物作用异常甲基化未得到逆转; 实时荧光定量PCR和Western blot检测到0.5、1.0、1.5 μmol/L 5'-Aza-CdR处理后CDX2基因mRNA和蛋白重新表达, 实时荧光定量PCR检测对照组和不同浓度实验组在HT-29细胞株mRNA相对表达量分别为1.000±0.000、0.973±0.024、1.014±0.019和1.094±0.020; 在LoVo细胞株相对表达量分别为1.000±0.000、0.966±0.038、1.050±0.029和1.007±0.019. Western blot检测CDX2蛋白在对照组和不同浓度实验组中HT-29细胞株相对表达量分别为0.454±0.049、0.501±0.041、0.340±0.050和0.531±0.046; LoVo细胞株相对表达量分别为0.527±0.037、0.415±0.037、0.432±0.040和0.626±0.046. 以上作用无时间、剂量依赖性, 但CDX2基因mRNA在HT-29细胞株表达(F = 25.146, P = 0.000)和LoVo细胞株表达(F = 5.470, P = 0.024)具有统计学差异, CDX2蛋白表达在HT-29细胞株表达(F = 9.700, P = 0.005)和LoVo细胞株表达(F = 17.701, P = 0.001)亦具有统计学差异.
结论: 结直肠癌细胞株HT-29和LoVo中CDX2基因mRNA和蛋白表达不受中DNA甲基化的表观遗传修饰的调控.
核心提示: 提示不同组织肿瘤中CDX2(caudal type homeobox transcription factor 2)表达有异质性, CDX2在CRC中与食管癌和胃癌中的沉默机制不同, 结直肠癌细胞株HT-29和LoVo中CDX2基因mRNA和蛋白表达不受中DNA甲基化的表观遗传修饰的调控.
引文著录: 许春伟, 葛畅, 王鲁平, 方园, 张玉萍. 5'-Aza-CdR对HT-29和LoVo结直肠癌细胞株中CDX2基因甲基化状态、mRNA表达及蛋白表达的影响. 世界华人消化杂志 2014; 22(10): 1423-1430
Revised: February 21, 2014
Accepted: February 28, 2014
Published online: April 8, 2014
AIM: To investigate the effect of 5'-Aza-2'-deoxycytidine (5'-Aza-CdR), a methylation inhibitor, on the methylation, mRNA and protein expression of the CDX2 gene in colorectal ancer cell lines HT-29 and LoVo.
METHODS: HT-29 and LoVo cells were treated with different dosages of 5'-Aza-CdR. After treatment, CDX2 gene methylation was determined by Methylight assay, and CDX2 mRNA and protein expression was detected by real-time PCR and Western blot, respectively.
RESULTS: Methylight assay showed that CDX2 gene methylation was not reversed by 5'-Aza-CdR. The expression levels of CDX2 mRNA were increased in both HT-29 (1.000 ± 0.000, 0.973 ± 0.024, 1.014 ± 0.019 and 1.094 ± 0.020, respectively) and LoVo cells (1.000 ± 0.000, 0.966 ± 0.038, 1.050 ± 0.029 and 1.007 ± 0.019, respectively) cells treated with 5'-Aza-CdR for different durations. Western blot analysis indicated that 5'-Aza-CdR treatment could recover the CDX2 protein expression in both HT-29 (0.454 ± 0.049, 0.501 ± 0.041, 0.340 ± 0.050 and 0.531 ± 0.046, respectively) and LoVo (0.527 ± 0.037, 0.415 ± 0.037, 0.432 ± 0.040 and 0.626 ± 0.046, respectively) cells. The effect of 5'-Aza-CdR on CDX2 mRNA and protein expression was not dose- or time-dependent, but the expression levels of CDX2 mRNA and protein differed significantly in HT-29 (mRNA: F = 25.146, P = 0.000; protein: F = 9.700, P = 0.005) and LoVo cells (mRNA: F = 5.470, P = 0.024; protein: F = 17.701, P = 0.001).
CONCLUSION: CDX2 mRNA and protein expression is not affected by DNA methylation in HT-29 and LoVo cells.
- Citation: Xu CW, Ge C, Wang LP, Fang Y, Zhang YP. Effect of 5'-Aza-2'-deoxycytidine on methylation, mRNA and protein expression of CDX2 gene in colorectal cancer HT-29 and LoVo cells. Shijie Huaren Xiaohua Zazhi 2014; 22(10): 1423-1430
- URL: https://www.wjgnet.com/1009-3079/full/v22/i10/1423.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i10.1423
结直肠癌(colorectal cancer, CRC)作为最常见恶性肿瘤之一, 其发病率仅位于肺癌和前列腺癌(女性为乳腺癌)之后, 居第3位, 而每年CRC病死率约占全部恶性肿瘤死亡总人数的8%, 在恶性肿瘤死因中居第4位[1]. CRC的发生与发展与癌基因和抑癌基因的缺失、扩增或突变有关. 有些基因在染色质水平上发生表型遗传修饰改变也会导致表达下调. 表型遗传修饰最多见的是CpG岛(CpG island)的甲基化改变. CDX2(caudal type homeobox transcription factor 2)是胃肠胚胎遗传通路中的一种特异性的核转录因子, 基因定位于人类染色体13q12-13, 全长22-23 kb, 由3个外显子和2个内含子构成, 与之对应的CDX2蛋白包含311个单氨基酸, 通过螺旋环-螺旋的方式结合于DNA的相应区域, 以转录因子的形式调节DNA的表达. CDX2基因对维持肠道细胞的正常发育、调节肠道细胞增殖、分化和凋亡起重要作用[2]. CDX2基因的表达随CRC的进展而下降, 尤其是在肿瘤广泛浸润至转移的过程中[3]. 研究表明CDX2表达下调并不是由于染色体的缺失或基因突变引起[4,5], CDX2表达可抑制CRC细胞的浸润和播散, 近年来被认为是肿瘤抑制基因[6,7]. 本实验通过研究5'-氮杂-2'-脱氧胞苷(5'-Aza-2'-deoxycytidine, 5'-Aza-CdR)对HT-29和LoVo细胞株作用后CDX2基因的DNA层面、mRNA层面和蛋白层面的改变进行初步探究, 探讨肿瘤发生发展过程中CDX2基因失活的甲基化机制及药物恢复CDX2基因表达的可能性, 以期寻找CRC的肿瘤标志物及新的治疗靶点.
结直肠癌细胞株HT-29和LoVo(北大医学部107实验室); DNA提取试剂盒(德国QIAGEN公司); 核酸蛋白质浓度测量仪B-500(上海创萌生物科技有限公司), DNA甲基化修饰试剂盒及甲基化阳性/阴性对照(美国ZYMO公司); qPCR反应试剂ROX(TaKaRa公司); Mix(上海辉睿生物科技有限公司); Mx3000P定量PCR扩增仪(美国Stratagene公司); 引物由生工生物工程(上海)有限公司合成; 5'-Aza-CdR(美国Sigma公司), 以DMSO溶剂充分溶解后配制成0.1 μmol/L的母液, 分装后-80 ℃保存; CDX2和内参β-actin(英国Abcam公司), Western blot相关试剂(北京索莱宝科技有限公司).
1.2.1 细胞培养和干预: 结直肠癌细胞株HT-29和LoVo置于10%胎牛血清和100 μmol/mL青霉素、链霉素的RPMI 1640的培养基中常规培养, 胰酶消化传代. 取贴壁生长良好的细胞以RPMI 1640调整细胞密度至2×106/mL, 接种于六孔培养板. 干预的LoVo和HT-29细胞分别加入0.5、1.0、1.5 μmol/L 5'-Aza-CdR混合培养液, 每24 h更换新鲜培养基, 连续作用72 h; 以HT-29和LoVo分别加入等量DMSO溶剂培养作为对照.
1.2.2 Methylight: 取对数生长期的HT-29和LoVo细胞株, 胰酶消化后抽提DNA. 抽提DNA按DNA提取试剂盒(德国QIAGEN公司)说明提取上述两种细胞不同浓度梯度的细胞DNA, 用紫外分光光度仪(上海创萌生物科技有限公司)测DNA浓度, 以DNA浓度在25 ng/μL为最低浓度, 使用DNA修饰试剂盒进行亚硫酸氢盐修饰, 按照试剂盒说明书操作, CDX2基因甲基化引物按文献设计[8], 上游引物: 5'-AAACTACGCACTACTCTAAACGAAA-3'; 下游引物: 5'-GTAGTTATAGTTTGGCGGGGTTTG-3'; 探针: FAM 5'-CGACAACCTACGCCTAACCGACCTC-3' BHQ1, 内参β-actin基因甲基化引物按文献设计[9], 上游引物: 5'-TGGTCATCCAGGTTTAGTAACT-3', 下游引物: 5'-AACCAATAAACCTACTCCTCCCTTAA-3', 探针: FAM 5'-ACCACCACCCAACACACAATAACAAACACA-3' BHQ1. PCR反应总体系为20 μL, 2×Taq PCR Master Mix 10 μL; 修饰后的DNA模板2 μL; 上、下游引物各1 μL(10 pmol); 探针FAM 0.4 μL(10 pmol); ROX 0.3 μL. 反应条件: 94 ℃预变性5 min; 94 ℃ 30 s, 56 ℃ 45 s, 72 ℃ 45 s, 共50个循环; 72 ℃延伸5 min, 4 ℃冷却5 min. 经亚硫酸氢盐修饰的Human Methylated & Non-methylated DNA Set作为阳性、阴性对照, 水为空白对照.
1.2.3 实时荧光定量PCR分析结直肠癌细胞株HT-29和LoVo中CDX2基因mRNA的表达情况: 取对数生长期的HT-29和LoVo细胞, 胰酶消化后抽提细胞总RNA, 逆转录合成cDNA, 行实时荧光定量PCR. CDX2基因引物按文献设计[10], 上游引物: 5'-GAACCTGTGCGAGTGGATG-3', 下游引物: 5'-CGGATGGTGATGTAGCGAC-3'; 内参基因GAPDH上游引物: 5'-GGCTGCTTTTAACTCTGG-3', 下游引物: 5'-GGAGGGATCTCGCTCC-3'. 20 μL PCR反应体系含10 μL SYBR Premix Ex Taq™(2×)、上、下游引物(10 μmol/L)各0.4 μL、0.4 ROX Reference Dye(50×)、2.0 μL DNA模板、6.8 μL dH2O. 反应条件为95 ℃预变性5 min; 95 ℃ 10 s, 55 ℃ 40 s, 72 ℃ 45 s, 共40个循环; 72 ℃延伸1 min, 70 ℃延伸30 s, 95 ℃延伸30 s. 实验重复3次, 取均值. 扩增完毕后分析熔解曲线, 采用2-∆∆Ct法分析CDX2 mRNA表达. ∆∆Ct = (Ct处理组目的基因-Ct处理组内参基因)-(Ct对照组目的基因-Ct对照组内参基因).
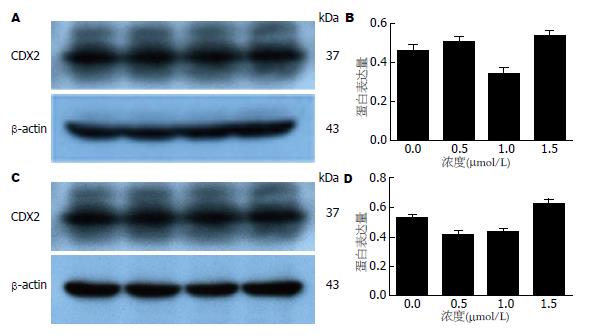
1.2.4 Western blot分析结直肠癌细胞株HT-29和LoVo中CDX2蛋白的表达情况: 取对数生长期的HT-29和LoVo细胞, 在上述两种细胞株各个浓度梯度的每管细胞中加入80 μL蛋白裂解和1 μL蛋白酶抑制剂PMSF液于冰上裂解30 min. 15000 r/min 37 ℃离心, 10 min后取上清液提取总蛋白, BCA法蛋白定量. 总蛋白100 ℃变性5 min后, 配置浓度为12%的SDS-PAGE凝胶, 进行蛋白质电泳, 蛋白电泳分离后经电转移槽转移至PVDF膜. BSA室温封闭2 h后, PVDF膜置于1:500稀释的CDX2单克隆抗体稀释液中4 ℃冰箱内培养过夜, TBST洗膜3次, 每次10 min, 再置于1:20000稀释的HRP标记的小鼠抗山羊IgG稀释液中37 ℃培养2 h, TBST洗膜4次, 每次10 min, 然后加入ECL发光液显影, 采集并分析处理图像. 凝胶成像系统摄像并分析各条带吸光度值, 以0.5 μmol/L 5'-Aza-CdR条带吸光度(A)值/β-actin条带A值为基准, 设置为1. 以目的基因条带A值/β-actin条带A值作为CDX2蛋白的相对表达强度. 实验重复3次, 取均值.
1.2.5 结果判断标准: Methylight结果判断标准[11]: 同时扩增目的基因(CDX2)和内参基因(β-actin), 根据标准曲线得到两者的原始拷贝数, 计算标准甲基化指数(normalized index of methylation, NIM)其定义为: NIM = [(CDX2 sample/CDX2 positive)/(β-actin sample/β-actin positive)]×100, 其中CDX2 sample指样本中甲基化CDX2基因的拷贝数, CDX2 positive指阳性对照中甲基化CDX2基因的拷贝数, β-actin sample和β-actin positive与上述相同. NIM≥4为甲基化, NIM<4为非甲基化.
统计学处理 所有数据采用SPSS19.0统计软件, 数据以mean±SD表示, 组间比较采用单因素方差分析(One-way ANOVA), 对照组与实验组比较采用配对t检验, 检验水准α = 0.05, 并设定P值为双侧分布, P<0.05为差异有统计学意义.
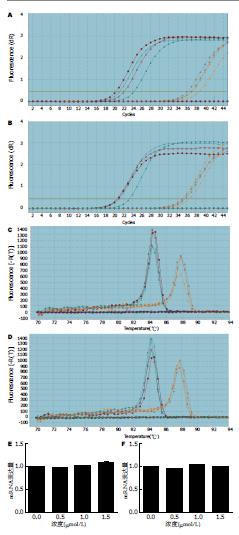
将阳性对照按10的倍数稀释成1-1×10-67个浓度梯度制作标准曲线(其拷贝数为103-109/mL). 各浓度梯度反应均做复孔. Methylight的线性范围为104-108拷贝/mL, R2为0.942. 实时荧光定量PCR得出数据按Methylight结果判断标准, 在DMSO对照组、0.5、1.0、1.5 μmol/L 5'-Aza-CdR实验组中HT-29和LoVo细胞株中CDX2基因甲基化状态分均为甲基化状态(表1, 图1).
| 5'-Aza-CdR浓度(µmol/L) | 细胞株 | |
| HT-29 | LoVo | |
| 0.0 | 甲基化 | 甲基化 |
| 0.5 | 甲基化 | 甲基化 |
| 1.0 | 甲基化 | 甲基化 |
| 1.5 | 甲基化 | 甲基化 |
实时荧光定量PCR得出的数据检验扩增效率(E)通过公式E = 2-1/斜率-1计算, CDX2基因mRNA为0.941, GAPDH基因mRNA为0.977, 两个基因的扩增效率相差<5%, 符合用2-∆∆Ct法相对定量分析条件. 经2-∆∆Ct法分析并以对照组、各不同浓度实验分组为横坐标, 将测出相应的平均相对定量比值为纵坐标绘出柱状图后发现0.5、1.0、1.5 μmol/L 5'-Aza-CdR作用后, HT-29细胞株中CDX2基因的mRNA表达水平较对照组有统计学差异, 但无时间、药物浓度依赖性(F = 25.146, P = 0.000), 与对照组DMSO组比较1.5 μmol/L 5'-Aza-CdR实验组(t = 8.156, P = 0.015); LoVo细胞株中CDX2基因的mRNA表达水平较对照组有统计学差异, 但无时间、药物浓度依赖性(F = 5.470, P = 0.024), 组间比较各实验组与对照组均无统计学差异(P>0.05)(表2, 图2).
| 5'-Aza-CdR浓度(µmol/L) | 细胞株 | |
| HT-29 | LoVo | |
| 0.0 | 1.000±0.000 | 1.000±0.000 |
| 0.5 | 0.973±0.024 | 0.966±0.038 |
| 1.0 | 1.014±0.019 | 1.050±0.029 |
| 1.5 | 1.094±0.020a | 1.007±0.019 |
| F值和P值 | F = 25.146, P = 0.000 | F = 5.470, P = 0.024 |
Western blot结果运用Image J软件进行条带图像分析, 获得HT-29和LoVo细胞株各条带光密度值, 并计算出两种细胞在各组中的平均光密度比值, 进行半定量分析及统计学分析, 并以各实验分组为横坐标, 将测出相应的平均光密度比值为纵坐标绘出柱状图后发现0.5、1.0、1.5 μmol/L 5'-Aza-CdR作用后, HT-29细胞株中CDX2蛋白表达水平较对照组有统计学差异, 但无时间、药物浓度依赖性(F = 0.438, P = 0.732), 与对照组DMSO组比较0.5 μmol/L 5'-Aza-CdR实验组(t = 5.150, P = 0.036)、1.5 μmol/L 5'-Aza-CdR实验组(t = 30.597, P = 0.001); LoVo细胞株中CDX2蛋白表达水平较对照组有统计学差异, 但无时间、药物浓度依赖性(F = 1.370, P = 0.320), 与对照组DMSO组比较0.5 μmol/L 5'-Aza-CdR实验组(t = -60.527, P = 0.000) (表3, 图3).
CRC是最常见的消化系恶性肿瘤之一, 每年全球新发病例达123万, 病死率约为发病率的1/2. 我国CRC发病率虽低于西方发达国家, 但近20年来CRC的发病率仍在逐渐上升, 同时, 其发病年龄有增高趋势. 近年研究表明CRC的发病是多因素、多阶段、多基因连续累积发生的过程, 除遗传学改变外, 表观遗传学改变亦参与CRC的发生、发展过程. 表观遗传学是指不涉及DNA序列改变, 但基因表达却发生可遗传的改变, DNA甲基化、组蛋白修饰、microRNA等是表观遗传学的主要形式. 与肿瘤发生关系最密切的是DNA甲基化修饰异常, 其中包括基因组去甲基化及部分区域高度甲基化两种形式. DNA甲基化可以导致癌相关基因沉默, 病变迅速进展为癌. CRC有若干高度甲基化基因, 若能认识CRC中基因异常DNA甲基化, 将可能获得CRC诊断的肿瘤标记物及新的治疗靶点[12-14].
本实验研究中我们采用去甲基化药物5'-Aza-CdR处理两个结直肠癌细胞株: MSS细胞株HT-29和MSI细胞株LoVo后通过实时荧光定量PCR检测, 我们发现DNA层面上DMSO溶剂对照组、0.5、1.0、1.5 μmol/L 5'-Aza-CdR实验组中HT-29和LoVo细胞株中CDX2基因甲基化状态分均为甲基化, 说明去甲基化药物5'-Aza-CdR不能逆转CDX2基因甲基化状态, 同时在mRNA层面上我们发现在0.5、1.0、1.5 μmol/L 5'-Aza-CdR作用后, 虽然HT-29细胞株中CDX2 mRNA表达水平较对照组有统计学差异, 但无时间、药物浓度依赖性(F = 25.146, P = 0.000), 与对照组DMSO组比较1.5 μmol/L 5'-Aza-CdR实验组(t = 8.156, P = 0.015); LoVo细胞株中CDX2基因的mRNA表达水平较对照组有统计学差异, 但无时间、药物浓度依赖性(F = 5.470, P = 0.024), 组间比较各实验组与对照组也均无统计学差异(P>0.05); 最后通过Western blot在蛋白层面上发现HT-29细胞株中CDX2蛋白表达水平较对照组有统计学差异, 但无时间、药物浓度依赖性(F = 9.700, P = 0.005), 与对照组DMSO组比较0.5 μmol/L 5'-Aza-CdR实验组(t = 5.150, P = 0.036)、1.5 μmol/L 5'-Aza-CdR实验组(t = 30.597, P = 0.001); LoVo细胞株中CDX2蛋白表达水平较对照组无统计学差异, 并且也无时间、药物浓度依赖性(F = 17.701, P = 0.001), 与对照组DMSO组比较0.5 μmol/L 5'-Aza-CdR实验组(t = -60.527, P = 0.000).
本实验研究显示去甲基化药物5'-Aza-CdR不能改变CDX2基因mRNA或CDX2蛋白表达, 即CDX2的表达不受DNA甲基化的调控. 这与之前的研究结果相符, 即CDX2在CRC表达沉默可能受转录后调控因子影响[15]. 近年来的研究显示CDX2在食管癌和胃癌中异位表达. 此时, CDX2基因启动子发生甲基化, 并与CDX2基因mRNA表达水平呈负相关[16-18]. 提示不同组织肿瘤中CDX2表达有异质性, CDX2在CRC中与食管癌和胃癌中的沉默机制不同.
CDX2基因的表达随结直肠癌的进展而下降, 尤其是在肿瘤广泛浸润至转移的过程中, 但CDX2基因在结直肠癌细胞株的甲基化情况目前尚缺乏系统研究. 本研究拟选用甲基化酶抑制剂5'-氮杂-2'-脱氧胞苷(5'-Aza-2'-deoxycytidine, 5'-Aza-CdR)检测其对结直肠癌细胞株HT-29和LoVo中CDX2基因甲基化水平及蛋白表达的影响并在DNA层面、mRNA层面和蛋白3个层面探讨了肿瘤发生发展过程中CDX2基因失活的甲基化机制及药物恢复CDX2基因表达的可能性, 结果表明结直肠癌细胞株HT-29和LoVo中CDX2基因mRNA和蛋白表达不受DNA甲基化的表观遗传修饰调控.
李正荣, 副教授, 副主任医师,南昌大学附属第一医院胃肠外科(普六病区); 卢宁, 副主任医师, 兰州军区乌鲁木齐总医院肿瘤科
国内王鲁平教授团队在结直肠锯齿状病变组织研究中发现组织中CDX2基因启动子中上游区域甲基化状态比较复杂, 极少部分甲基化状态可能有诱导CDX2蛋白表达下调, 在锯齿状通路的发生发展中影响作用也甚微; 大部分甲基化可能随着年龄增加而逐渐增加.
自本世纪初, 国内王鲁平教授团队在结直肠锯齿状病变研究方面一直处于领先水平. 其团队率先描述了锯齿状病变形态学特点、免疫组化特征以及分子生物学改变, 并在国内外: (1)首先报告了锯齿状病变中Runx3基因rs2236851位点基因型检测及蛋白表达; (2)首次提出CDX2基因甲基化主要与年龄因素有关, 年龄越大, 甲基化频率越高, 其可能是一个年龄相关性甲基化基因.目前王鲁平教授团队在锯齿状病变研究方面发表中英文论文80余篇.
首次选用一组与结直肠癌甲基化有关的基因, 用于检测结直肠癌细胞株甲基化状况, 从中筛选出结直肠癌细胞株相关甲基化基因, 为结直肠癌的诊断及分子分型提供有力的生物标记物, 为锯齿状甲基化癌变机制及靶向治疗提供理论依据. CDX2是胃肠胚胎遗传通路中一种新发现的特异性的核转录因子, 是尾型同源框基因家族中的一员. 本研究发现结直肠癌细胞株HT-29和LoVo中CDX2基因mRNA和蛋白表达不受DNA甲基化的表观遗传修饰调控.
本实验通过研究5'-Aza-CdR对HT-29和LoVo细胞株作用后CDX2基因的DNA层面、mRNA层面和蛋白层面的改变进行初步探究, 探讨肿瘤发生发展过程中CDX2基因失活的甲基化机制及药物恢复CDX2基因表达的可能性, 以期寻找结直肠癌(colorectal cancer)的肿瘤标志物及新的治疗靶点.
本文内容客观, 实验方法成熟, 观点新颖, 具有一定的科学意义.
编辑 田滢 电编 鲁亚静
| 1. | Siegel R, Ma J, Zou Z, Jemal A. Cancer statistics, 2014. CA Cancer J Clin. 2014;64:9-29. [PubMed] [DOI] |
| 2. | Beck F, Chawengsaksophak K, Waring P, Playford RJ, Furness JB. Reprogramming of intestinal differentiation and intercalary regeneration in Cdx2 mutant mice. Proc Natl Acad Sci U S A. 1999;96:7318-7323. [PubMed] |
| 3. | Brabletz T, Spaderna S, Kolb J, Hlubek F, Faller G, Bruns CJ, Jung A, Nentwich J, Duluc I, Domon-Dell C. Down-regulation of the homeodomain factor Cdx2 in colorectal cancer by collagen type I: an active role for the tumor environment in malignant tumor progression. Cancer Res. 2004;64:6973-6977. [PubMed] [DOI] |
| 4. | Subtil C, Guérin E, Schneider A, Chenard MP, Martin E, Domon-Dell C, Duluc I, Brabletz T, Kedinger M, Duclos B. Frequent rearrangements and amplification of the CDX2 homeobox gene in human sporadic colorectal cancers with chromosomal instability. Cancer Lett. 2007;247:197-203. [PubMed] [DOI] |
| 5. | Yagi OK, Akiyama Y, Yuasa Y. Genomic structure and alterations of homeobox gene CDX2 in colorectal carcinomas. Br J Cancer. 1999;79:440-444. [PubMed] [DOI] |
| 6. | Aoki K, Tamai Y, Horiike S, Oshima M, Taketo MM. Colonic polyposis caused by mTOR-mediated chromosomal instability in Apc+/Delta716 Cdx2+/- compound mutant mice. Nat Genet. 2003;35:323-330. [PubMed] [DOI] |
| 7. | Gross I, Duluc I, Benameur T, Calon A, Martin E, Brabletz T, Kedinger M, Domon-Dell C, Freund JN. The intestine-specific homeobox gene Cdx2 decreases mobility and antagonizes dissemination of colon cancer cells. Oncogene. 2008;27:107-115. [PubMed] [DOI] |
| 9. | Ogino S, Kawasaki T, Brahmandam M, Cantor M, Kirkner GJ, Spiegelman D, Makrigiorgos GM, Weisenberger DJ, Laird PW, Loda M. Precision and performance characteristics of bisulfite conversion and real-time PCR (MethyLight) for quantitative DNA methylation analysis. J Mol Diagn. 2006;8:209-217. [PubMed] [DOI] |
| 11. | Campbell DJ, Koch MA. Phenotypical and functional specialization of FOXP3+ regulatory T cells. Nat Rev Immunol. 2011;11:119-130. [PubMed] [DOI] |
| 12. | Snover DC. Update on the serrated pathway to colorectal carcinoma. Hum Pathol. 2011;42:1-10. [PubMed] [DOI] |
| 13. | Dhir M, Yachida S, Van Neste L, Glöckner SC, Jeschke J, Pappou EP, Montgomery EA, Herman JG, Baylin SB, Iacobuzio-Donahue C. Sessile serrated adenomas and classical adenomas: an epigenetic perspective on premalignant neoplastic lesions of the gastrointestinal tract. Int J Cancer. 2011;129:1889-1898. [PubMed] [DOI] |
| 14. | Arber N, Shapira I, Ratan J, Stern B, Hibshoosh H, Moshkowitz M, Gammon M, Fabian I, Halpern Z. Activation of c-K-ras mutations in human gastrointestinal tumors. Gastroenterology. 2000;118:1045-1050. [PubMed] |
| 15. | Hinoi T, Loda M, Fearon ER. Silencing of CDX2 expression in colon cancer via a dominant repression pathway. J Biol Chem. 2003;278:44608-44616. [PubMed] [DOI] |
| 16. | Liu T, Zhang X, So CK, Wang S, Wang P, Yan L, Myers R, Chen Z, Patterson AP, Yang CS. Regulation of Cdx2 expression by promoter methylation, and effects of Cdx2 transfection on morphology and gene expression of human esophageal epithelial cells. Carcinogenesis. 2007;28:488-496. [PubMed] [DOI] |
| 18. | 蒋 伟, 张 健锋, 董 丽娟, 戚 菁, 张 弘, 毛 振彪. 人胃癌细胞株CDX2基因表达与其启动子区甲基化的关系. 南通大学学报(医学版). 2012;32:21-24. |