修回日期: 2013-11-29
接受日期: 2014-01-15
在线出版日期: 2014-04-08
目的: 探通过结扎大鼠胆总管, 模拟胆管梗阻病理状态, 运用PCR技术, 探讨这一病理过程相关细胞因子在胆管梗阻肝脏纤维化过程中发挥的作用.
方法: 实验组实施近肝门端胆总管单线结扎; 对照组实施假手术, 开腹游离胆总管但不结扎. 术后不同时间处死大鼠, 取肝组织通过PCR检测各目的基因表达情况.
结果: 两组间转化生长因子-β(transforming growth factor-β, TGF-β1)、COL-Ⅰ的表达差异从第1天开始有统计学意义, BDL组与对照组中HGF的表达差异从第3天开始有统计学意义. 对BDL不同天数组间的表达研究发现COL-Ⅰ、TGF-β1在3-7 d无统计学意义, HGF在1-3、7-21 d无统计学意义, 而其他相邻各组间均有统计学意义, COL-Ⅰ、TGF-β1指标1-3 d增长趋势最明显, HGF指标3-7 d增长趋势最明显.
结论: 肝纤维化过程中的3-7 d是纤维化过程的特殊时期, 第3天之前以促纤维化过程为主要表现; 第3天开始出现抗纤维化表现, 促纤维化趋势减弱, 纤维化速度减慢; 第7天之后为持续的肝脏纤维化进程.
核心提示: HGF在3-7 d出现较明显的增长, 同时在这一时期, 转化生长因子β(transforming growth factor β)、COL-Ⅰ的表达的增长趋势也受到了抑制, 增长趋势降低, 肝纤维化过程中第3天之前以促纤维化过程为主要表现; 第3天开始出现抗纤维化表现, 促纤维化趋势减弱, 纤维化速度减慢; 第7天之后为持续的肝脏纤维化进程. 在3-7 d的时间段内, 机体的抗纤维化及肝再生等保护机制开始发挥作用, 代偿性的抑制肝损伤及纤维化.
引文著录: 孙珅, 张辰, 秦鸣放, 邹富胜, 刘大全, 李东华, 元海成. 大鼠胆管梗阻后肝脏纤维化相关细胞因子的变化. 世界华人消化杂志 2014; 22(10): 1402-1408
Revised: November 29, 2013
Accepted: January 15, 2014
Published online: April 8, 2014
AIM: To explore the roles of cytokines related to the pathological process of biliary obstruction and hepatic fibrosis.
METHODS: Rats were divided into two groups: an experimental group and a control group. The experimental group underwent ligation of the common bile duct to induce bile duct obstruction (BDO), and the control group received laparotomy only without ligation. Rats were sacrificed after the operation. Expression of genes of interest was detected by PCR.
RESULTS: Expression of COL-Ⅰand transforming growth factor-β (TGF-β1) changed significantly from day 1, and that of HGF showed a significant change from day 3. In the BDL group, expression of COL-Ⅰand TGF-β1 showed no significant differences during the period from day 3 to day 7, and that of HGF showed no significant differences during the periods from day 1 to day 3 and from day 7 to day 21, while statistically significant differences were observed in other periods. These findings suggest that expression of COL-Ⅰand TGF-β1 increased fastest from days 1 to 3, and that of HGF increased fastest from days 3 to 7.
CONCLUSION: The findings of the present study suggest that the period before day 3 is a stage of rapid fibrosis, the period between days 3 and 7 is a stage of slow fibrosis, and the period after day 7 is a stage of continuous progression of fibrosis.
- Citation: Sun S, Zhang C, Qin MF, Zou FS, Liu DQ, Li DH, Yuan HC. Changes in expression of hepatic fibrosis related cell factors in rats with bile duct obstruction. Shijie Huaren Xiaohua Zazhi 2014; 22(10): 1402-1408
- URL: https://www.wjgnet.com/1009-3079/full/v22/i10/1402.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i10.1402
在肝胆外科临床中, 胆管梗阻、胆汁淤积是常见的病理环境, 较长时间梗阻, 可诱发永久性肝损害, 甚至发展成肝纤维化及肝硬化, 是临床治疗的难题, 相关发病机制基础研究有现实意义. 有研究证明多种组织器官的纤维化进程中伴随着胚胎发育相关基因及多种细胞因子的重新激活. 其中COL-Ⅰ为胶原蛋白组成部分; 转化生长因子-β(transforming growth factor-β, TGF-β1)为炎症相关因子, 各种原因导致的炎症中TGF-β1都参与其中[1]; HGF对肝纤维化有保护作用, 静脉给予rhHGF对于因素所致的肝纤维化或肝硬化均有良好的治疗作用, 减少肝脏中胶原的沉积[2]. 这些为研究肝脏损伤的保护、治疗及肝纤维化的形成机制提供了最新途径. 所以我们将通过实验探讨几种细胞因子在肝脏纤维化中的变化和意义.
11-13周龄♂Wistar大鼠60只. 体质量250-300 g, 由中国医学科学院放射医学研究所实验动物中心(SCXK津2005-0001)提供. 标准条件下喂养, 并保持手术前至少7 d的12 h白-黑周期的环境条件. 经检疫合格, 无疾病者入选.
1.2.1 实验动物分组: ♂Wistar大鼠60只. 采用随机数字表方法分成实验组和对照组. 实验组和对照组每个时间点成功造模5只. 造模不成功的实验动物剔除补做. 术后第1、2、3、7、14、21天, 6个时间点实验组和对照组各处死5只动物.
1.2.2 动物模型建立: 术前禁食15 h, 不禁水, 称量大鼠质量, 以100 mL/L的水合氯醛30 mL/g ip麻醉大鼠, 麻醉完全后, 将大鼠固定于手术台上, 剑突下上腹部备皮, 碘伏消毒. 实验组动物脐上腹正中切口2.0-2.5 cm入腹, 拇食指轻牵拉十二指肠, 暴露胆总管, 在肝右叶下缘与胆总管交点处(肝右叶及乳头叶胆管汇入胆总管位置最低, 保证在所有肝叶胆管汇入点下方), 分离胆总管、以6-0丝线单线结扎胆总管. 实验对照组动物只剖腹, 游离胆总管不结扎. 所有动物腹腔滴入0.2 mL左氧氟沙星注射液, 关闭腹膜及皮肤层.
1.2.3 取材: 对大鼠肝脏左叶切取 1.0 cm×0.5 cm×0.5 cm大小肝组织, 于-80 ℃低温保存.
1.2.4 内参及目的基因引物设计: Pubmed网站的基因库中, 查询大鼠种属相关基因的完整序列, 利用Premier 5.0软件设计引物.
1.2.5 RT-PCR: (1)提取总RNA: 采用吸附柱法进行总RNA提取, 按照试剂盒说明书操作, RNA提取在超净台上进行, 以防外源性RNA酶污染. 所用器材经高压灭菌, 操作过程中经常更换手套, 使用无RNase的塑料制品和枪头避免交叉污染. 提取RNA在紫外分光光度计测定A260/280, 二者比值1.8-2.1证实RNA纯度良好, 低于1.8者重新提取RNA. 利用1%的普通琼脂糖凝胶电泳, 检测总RNA完整性; (2)逆转录反应: 在冰浴的无RNase的离心管中加入如下反应成分: 2 μL总RNA, 2 μL Oligo(dT)16, 9.5 μL RNase free ddH2O. 70 ℃保存5 min后迅速在冰上冷却2 min, 间断离心收集反应液后加入以下组分: 4 μL 5×M-MLV Buffer, 1 μL dNTPs, 0.5 μL RNasin, 1 μL M-MLV. 42 ℃温浴60 min. 95 ℃加热5 min终止反应, 置冰上进行后续实验或-20 ℃保存; (3)PCR反应: 按一下各组分配制25 μL PCR反应体系: 2.5 μL 10×PCR Bffuer, 2 μL MgCl2, 0.5 μL dNTPs, 1 μL上游引物, 1 μL下游引物, 1 mL RT反应产物, 0.3 μL Taq Polymerase, 16.7 μL ddH2O. 将反应体系放入PCR仪中进行扩增反应, 反应条件: 94 ℃ 4 min; 进入扩增循环: 94 ℃ 1 min, 退火(温度如表1)1 min, 73 ℃延伸1 min, 30个循环; 最后72 ℃延伸10 min; (4)RT-PCR扩增产物相对定量分析: 取10 μL PCR产物, 加入10 μL loading buffer, 进行2%琼脂糖凝胶电泳, 紫外灯下检测特异性条带; 用紫外扫描仪扫描, 通过计算条带面积获得积分光密度值(IA). 以目的条带IA值与内参照β-actin条带IA值的比值来表示mRNA的相对表达强度.
| 名称 | 引物序列 | 扩增产物(bp) | 退火温度(℃) |
| COL-I | F 5'-TACAGCACGCTTGTGGATG-3' | 190 | 57 |
| R 5'-TTGGGATGGAGGGAGTTTA-3' | |||
| TGF-β1 | F 5'-ATGGTGGACCGCAACAAC-3' | 329 | 55 |
| R 5'-TGAGCACTGAAGCGAAAGC-3' | |||
| HGF | F 5'-TCATTGGTAAAGGAGGCA-3' | 221 | 58 |
| R 5'-GTCACAGACTTCGTAGCG-3' | |||
| β-actin | F 5'-GTAAAGACCTCTATGCCAACA-3' | 227 | 57 |
| R 5'-GGACTCATCGTACTCCTGCT-3' |
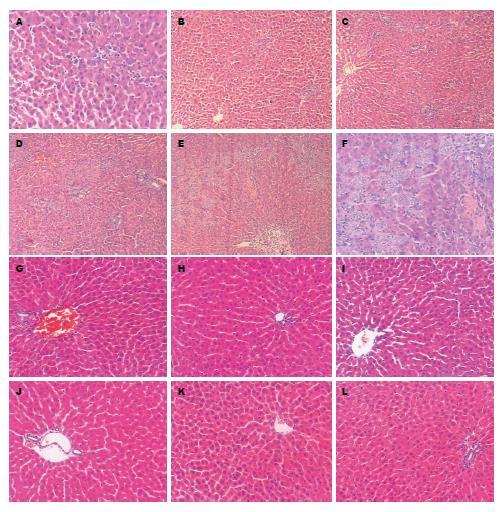
1.2.6 HE染色观察梗阻后肝组织变化: 常规石蜡切片, HE染色. IDA-2000高清晰度数码显微图象分析系统采集图像.
统计学处理 光密度比值为计量资料, 符合正态分布. 以mean±SD表示. 所有数据应用SPSS17.0 for Windows软件进行统计分析, P<0.05为差异有统计学意义.
经紫外分光光度计检测RNA A260/280为1.9-2.0, 则证明提取的总RNA纯度良好.
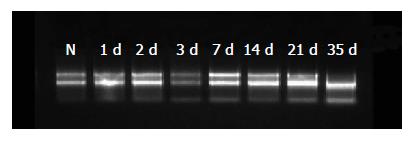
内参照β-actin在各体系中扩增结果基本一致, 证实PCR反应真实地反映了目的基因的表达.
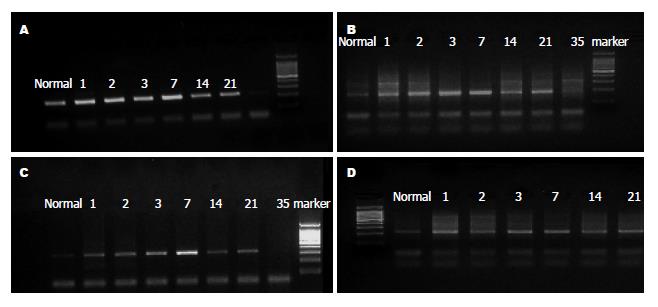
在对照组和BDL组大鼠肝脏中均能检测出目的基因的表达. 实验组TGF-β1及COL-Ⅰ目的条带增加趋势明显, 对照组则未见明显变化趋势. 统计分析显示两组TGF-β1、COL-Ⅰ的表达差异从第1天开始有统计学意义, BDL组与对照组中HGF的表达差异从第3天开始有统计学意义(表2, 表3和表4, 图2).
| 天数(d) | COL-Ⅰ | t值 | P值 | |
| BDL组 | 对照组 | |||
| 1 | 0.3816±0.0240 | 0.1305±0.0039 | 15.693 | <0.05 |
| 2 | 0.5030±0.0689 | 0.1662±0.0626 | 4.712 | <0.05 |
| 3 | 0.9335±0.1277 | 0.1628±0.0414 | 15.448 | <0.05 |
| 7 | 0.7592±0.0116 | 0.1907±0.0491 | 16.365 | <0.05 |
| 14 | 0.9476±0.0104 | 0.1272±0.0098 | 77.248 | <0.05 |
| 21 | 1.3700±0.0834 | 0.1798±0.0708 | 17.204 | <0.05 |
| 天数(d) | 转化生长因子-β1 | t值 | P值 | |
| BDL组 | 对照组 | |||
| 1 | 0.2477±0.0439 | 0.1441±0.0355 | 5.494 | <0.05 |
| 2 | 0.3645±0.0167 | 0.1468±0.0417 | 6.710 | <0.05 |
| 3 | 0.5722±0.0530 | 0.1203±0.0033 | 15.142 | <0.05 |
| 7 | 0.4825±0.0985 | 0.1287±0.0075 | 6.407 | <0.05 |
| 14 | 0.7805±0.0549 | 0.1231±0.0050 | 20.768 | <0.05 |
| 21 | 0.9848±0.0787 | 0.1212±0.0051 | 19.042 | <0.05 |
| 天数(d) | HGF | t值 | P值 | |
| BDL组 | 对照组 | |||
| 1 | 0.2518±0.0245 | 0.2019±0.0387 | 1.562 | >0.05 |
| 2 | 0.2741±0.0071 | 0.2602±0.0546 | 0.422 | >0.05 |
| 3 | 0.3233±0.0396 | 0.1739±0.0768 | 3.122 | <0.05 |
| 7 | 0.8454±0.0252 | 0.1329±0.0339 | 85.547 | <0.05 |
| 14 | 0.7475±0.2443 | 0.1146±0.0455 | 3.974 | <0.05 |
| 21 | 0.6568±0.0675 | 0.1246±0.1022 | 5.808 | <0.05 |
对BDL组的不同天数间的表达进行观察, COL-Ⅰ、TGF-β1指标1-3 d增长趋势明显, 在3-7 d出现下降趋势, HGF指标3-7 d增长趋势明显, 而在7 d后有下降趋势.
术后1 d见少量嗜中性粒细胞和淋巴细胞浸润; 术后第2天少许新增生胆管及无管腔的小胆管, 少量嗜中性粒细胞和淋巴细胞浸润, 个别动物偶见坏死; 术后第3天新增生的细小胆管和无管腔的小胆管, 嗜中性粒细胞和淋巴细胞浸润较术后第2天明显增加, 肝细胞轻度变性, 可见灶状和片状坏死, 肝组织汇管区可见胆管增生和纤维组织细胞增生, 偶见胆管扩张; 术后第7天肝细胞出现变性坏死发生率增加及程度加重, 重者见片状出血和坏死, 肝组织门区可见胆管增生和纤维细胞增生; 术后14 d小叶结构受到破坏, 可见肝细胞空泡变性及坏死; 术后21 d小叶结构破坏更加严重, 大量肝细胞坏死. 随时间进展肝脏损伤、纤维化程度逐渐加重. 对照组中未见大量炎性细胞浸润、肝细胞大量变性、坏死等(图3).
在阻塞性黄疸时, 大鼠肝脏中存在细胞凋亡、坏死情况, 与肝脏病理变化密切相关[3]. 引起肝细胞凋亡的因素很多, 包括胆红素可直接介导肝细胞凋亡的直接机制, 以及多种生物分子参与的间接机制, 其中体外培养的肝组织中加入TGF-β1可诱导肝细胞的大量凋亡, 充分证实了其诱导肝细胞凋亡作用[4]. 在肝脏受损后, 直接和间接的损伤机制开始发挥作用, 因此解除胆管梗阻是治疗胆管梗阻、胆汁淤积相关疾病的关键的第一步, 而对于间接的损伤因素, 正是我们要观察的TGF-β1指标. TGF-β是一类具有激素样活性的多肽分子, 可通过自分泌或旁分泌的方式产生, 广泛参与人体的各种病理生理过程. 研究发现, TGF-β能刺激巨噬细胞分泌细胞因子, 进而刺激成纤维细胞增生和诱导新生血管的形成: TGF-β还可直接刺激成纤维细胞合成大量的胶原(尤其是Ⅰ型胶原)、纤黏连蛋白和基质黏多糖蛋白, 并抑制细胞外基质的降解, 从而在创伤瘢痕愈合、细胞外基质形成、免疫调节等方面发挥着至关重要的作用[5]. TGF-β的这些活性作用在TGF-β1表现得最为明显[6]. 在实验中我们看到在模型建立的初期(1-3 d)该指标增长明显, 在胆管梗阻的早期就有该生物分子的参与, 而通过组织学的观察, 我们知道这一时期恰好是肝脏受损的较剧烈时期, 再次印证了TGF-β1参与了肝细胞的凋亡及坏死, 以及促进纤维化的发展.
胆管梗阻如不能得到缓解, 在一定时间后则会导致肝脏萎缩、肝细胞减少、纤维组织增生, 发生肝纤维化, 最终导致肝硬化. 纤维化的主要特征为细胞外基质成分的过度生成及沉积, 其中成肌纤维细胞(myofibroblast)的激活是纤维化过程中细胞外基质沉积的关键步骤, 体外实验[7]发现, TGF-β1处理肝细胞24 h后, Ⅰ型前胶原mRNA水平增加13倍. 这一过程中COL-Ⅰ代表了生成胶原纤维的多少, 并且研究表明TGF-β1与胶原蛋白具有相互促进调节作用. 通过我们的实验结果也证明了这一点. 另外有实验报道[8]α-SMA在相关动物模型中14-21 d时表达出现明显增速, 而我们的实验中COL-Ⅰ在1-3 d内出现显著增长, 因而COL-Ⅰ做为纤维化的早期指标可能较α-SMA更为敏感.
在肝脏纤维化的过程中, 存在对抗肝脏纤维化的趋势, 细胞因子HGF在对抗肝脏纤维化的过程中发挥作用[9]. HGF由肝Kuffer细胞、血窦内皮细胞、储脂细胞产生, 而肝实质细胞并不产生[10]. 几种因子可以调节HGF的产生. 白介素-1能增加HGF的基因表达[11]. 相反, TGF-β1和糖皮质激素均抑制HGF从成纤维细胞中释放[12]. Tsunashima等[13]的实验表明, HGF对肝纤维化有保护作用, 可改善肝功能, 降低血清胶原蛋白代谢产物含量, 减少肝脏中胶原的沉积, 抑制肝细胞凋亡, 发挥逆转肝纤维化的作用. HGF是目前已知的对成熟肝细胞最强烈的增殖刺激因子和促有丝分裂原[14]. 表皮生长因子、胰岛素以及TGF-α对HGF有协同刺激肝细胞增殖的作用[15].
在本实验中, HGF在3-7 d出现较明显的增长, 同时在这一时期, TGF-β1、COL-Ⅰ的表达的增长趋势也受到了抑制, 增长趋势降低, 我们可以由此推论肝纤维化过程中第3天之前以促纤维化过程为主要表现; 第3天开始出现抗纤维化表现, 促纤维化趋势减弱, 纤维化速度减慢; 第7天之后为持续的肝脏纤维化进程. 在3-7 d的时间段内, 机体的抗纤维化及肝再生等保护机制开始发挥作用, 代偿性的抑制肝损伤及纤维化, 此时如果解除胆管梗阻仍有可能使肝脏纤维化的病理过程得到逆转. 在肝脏损伤-纤维化-修复再生这一过程中, 存在类似于负反馈机制的过程, 若能及时解除胆管的梗阻, 肝细胞仍能得到修复、再生, 否则, 当"负反馈机制"失代偿后, 肝损伤、纤维化将无法逆转. 当然是否存在类似负反馈的机制, 我们如何利用抗纤维化的机制, 使得肝脏的不可逆性纤维化来的更迟些等问题仍有待进一步的研究.
细胞因子在梗阻性黄疸导致肝纤维化过程中的机制是肝脏疾病实验研究的重要内容, 尤其是急性肝脏损伤后的肝细胞及其内环境的变化以及促进过阻碍这些变化过程的细胞因子的变化.
姚鹏, 副教授, 北京军区总医院全军肝病中心
研究的热点在于梗阻后细胞因子的变化及其与纤维化过程的关系, 目前缺乏急性肝损伤后细胞因子随时间变化的规律的观察, 缺乏实验数据比较细胞因子变化规律与肝纤维化的关系.
本文描述了多种细胞因子随梗阻时间的变化规律, 主要阐述了急性肝损伤导致的肝脏纤维化的病理过程, 以往文章缺乏急性肝损伤观察的数据, 我们通过不同方式的对比找到细胞因子与时间的关系等.
文章通过结扎大鼠胆总管, 模拟胆管梗阻病理状态, 运用PCR技术, 探讨相关细胞因子在胆管梗阻肝脏纤维化过程中发挥的作用. 文章有一定的科学性及新颖性.
编辑 田滢 电编 鲁亚静
| 1. | Yang N, Mahato RI. GFAP promoter-driven RNA interference on TGF-β1 to treat liver fibrosis. Pharm Res. 2011;28:752-761. [PubMed] [DOI] |
| 2. | Ishikawa H, Jo JI, Tabata Y. Liver Anti-Fibrosis Therapy with Mesenchymal Stem Cells Secreting Hepatocyte Growth Factor. J Biomater Sci Polym Ed. 2011; Dec 14. [Epub ahead of print]. [PubMed] |
| 3. | Iwaisako K, Brenner DA, Kisseleva T. What's new in liver fibrosis? The origin of myofibroblasts in liver fibrosis. J Gastroenterol Hepatol. 2012;27 Suppl 2:65-68. [PubMed] [DOI] |
| 4. | Cong M, Iwaisako K, Jiang C, Kisseleva T. Cell signals influencing hepatic fibrosis. Int J Hepatol. 2012;2012:158547. [PubMed] [DOI] |
| 5. | Tang LX, He RH, Yang G, Tan JJ, Zhou L, Meng XM, Huang XR, Lan HY. Asiatic acid inhibits liver fibrosis by blocking TGF-beta/Smad signaling in vivo and in vitro. PLoS One. 2012;7:e31350. [PubMed] [DOI] |
| 6. | Chávez E, Segovia J, Shibayama M, Tsutsumi V, Vergara P, Castro-Sánchez L, Salazar EP, Moreno MG, Muriel P. Antifibrotic and fibrolytic properties of celecoxib in liver damage induced by carbon tetrachloride in the rat. Liver Int. 2010;30:969-978. [PubMed] [DOI] |
| 7. | 田 卫斌, 王 胜春, 李 晓伟, 胡 咏武, 赵 辉平. 大鼠肝纤维化形成过程中 TGFβ1/ERK信号通路与Ⅰ、Ⅲ、Ⅳ型胶原表达变化. 胃肠病学和肝病学杂志. 2010;19:414-419. |
| 8. | Rahimi RA, Leof EB. TGF-beta signaling: a tale of two responses. J Cell Biochem. 2007;102:593-608. [PubMed] |
| 9. | Xia JL, Dai C, Michalopoulos GK, Liu Y. Hepatocyte growth factor attenuates liver fibrosis induced by bile duct ligation. Am J Pathol. 2006;168:1500-1512. [PubMed] |
| 10. | Jia C. Advances in the regulation of liver regeneration. Expert Rev Gastroenterol Hepatol. 2011;5:105-121. [PubMed] [DOI] |
| 11. | Chau GY, Lui WY, Chi CW, Chau YP, Li AF, Kao HL, Wu CW. Significance of serum hepatocyte growth factor levels in patients with hepatocellular carcinoma undergoing hepatic resection. Eur J Surg Oncol. 2008;34:333-338. [PubMed] |
| 12. | Jozefczuk J, Drews K, Adjaye J. Preparation of mouse embryonic fibroblast cells suitable for culturing human embryonic and induced pluripotent stem cells. J Vis Exp. 2012;3854. [PubMed] [DOI] |
| 13. | Tsunashima Y, Kondo A, Matsuda T, Togari A. Hydrocortisone inhibits cellular proliferation by downregulating hepatocyte growth factor synthesis in human osteoblasts. Biol Pharm Bull. 2011;34:700-703. [PubMed] |
| 14. | Whittaker S, Marais R, Zhu AX. The role of signaling pathways in the development and treatment of hepatocellular carcinoma. Oncogene. 2010;29:4989-5005. [PubMed] [DOI] |
| 15. | de Andrade JA, Thannickal VJ. Innovative approaches to the therapy of fibrosis. Curr Opin Rheumatol. 2009;21:649-655. [PubMed] [DOI] |