修回日期: 2014-02-25
接受日期: 2014-03-12
在线出版日期: 2014-04-08
目的: 研究参杖颗粒对α-平滑肌肌动蛋白(alphasmoothmuscle actin, α-SMA)表达的影响, 探讨该方影响肝星状细胞(hepatic stellate cell, HSC)迁移和增殖的调节机制.
方法: 将HSC分别培养于不同浓度的参杖颗粒含药血清中, 采用Western blot测定α-SMA的表达量; RT-PCR检测α-SMA mRNA表达量; 流式细胞仪检测不同浓度的含药血清对HSC周期的影响; 细胞划痕实验检测不同浓度的含药血清对HSC迁移的影响.
结果: Western blot实验结果显示10倍浓度的参杖颗粒含药血清对HSC的α-SMA的表达有明显减少; 同时RT-PCR结果显示α-SMA的mRNA水平在10倍浓度血清处理的HSC中最低; 细胞周期检测结果显示细胞明显被阻滞于G2期, 以10倍浓度组抑制增殖效果最明显; 划痕实验显示10倍浓度血清处理的HSC迁移能力明显被抑制.
结论: 参杖颗粒对HSC的α-SMA的表达有明显抑制作用, 并明显阻止HSC的迁移和增殖.
核心提示: 参杖颗粒含药血清中剂量组对肝星状细胞(hepatic stellate cell, HSC)活化具有最好的抑制效应, 对HSC增殖、迁移及α-平滑肌肌动蛋白(alphasmoothmuscle actin)表达的抑制是其抗纤维化作用的作用机制之一.
引文著录: 段妍君, 殷妮娜, 高清华, 万莹, 马维平, 张昌文, 吕文亮. 参杖颗粒含药血清对HSC增殖及α-SMA表达的抑制效应. 世界华人消化杂志 2014; 22(10): 1396-1401
Revised: February 25, 2014
Accepted: March 12, 2014
Published online: April 8, 2014
AIM: To assess the effects of different concentrations of Shenzhang granules on cell proliferation and the expression of alpha smooth muscle actin (α-SMA) in hepatic stellate cells (HSCs).
METHODS: After HSCs were cultured with different concentrations of serum containing Shenzhang granules, α-SMA mRNA and protein expression was detected by RT-PCR and Western blot, respectively, cell cycle progression was assessed using flow cytometry, and cell migration was assessed using cell scratch assay.
RESULTS: After treatment with serum containing Shenzhang granules, the expression of α-SMA mRNA and protein was significantly reduced, cell cycle was arrested in G2 phase, and cell proliferation and migration were inhibited.
CONCLUSION: Treatment with Shenzhang granules can reduce α-SMA expression and inhibit cell proliferation in HSCs.
- Citation: Duan YJ, Yin NN, Gao QH, Wan Y, Ma WP, Zhang CW, Lv WL. Shenzhang granules inhibit cell proliferation and reduce α-SMA expression in hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2014; 22(10): 1396-1401
- URL: https://www.wjgnet.com/1009-3079/full/v22/i10/1396.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i10.1396
肝纤维化是肝脏细胞外基质(extracellular matrix, ECM)异常生成和积累的结果[1]. 当肝脏受到各种损伤时, 肝星状细胞(hepatic stellate cell, HSC)被活化并向肌纤维母细胞转化, 主要表现为细胞增殖、游动、收缩能力增强及细胞因子和ECM的大量合成, 并导致肝窦毛细血管化, HSC的活化增殖和收缩功能在此过程中起中心作用[2,3]. 当HSC转化为肌成纤维细胞时, 能特征性地表达α-平滑肌肌动蛋白(alphasmoothmuscle actin, α-SMA), 使得肝脏内α-SMA含量增加[4]. 中药复方抗肝纤维化实验研究表明: 中药复方能抑制和减少HSC中α-SMA的表达, 从而抑制HSC的激活和肝纤维化[5]. 因此α-SMA的变化被看成HSC活化与否的标志, 成为肝纤维化的一个重要的评价指标[6].
250-350 g ♂Wistar大鼠, 购自湖北中医药大学实验动物中心. 实验所用细胞及生物试剂均购自武汉科瑞生物技术有限公司, 包括: 大鼠HSC-T6, 编号: zxl006; α-SMA抗体(Santa Cruz, sc-324317); 高糖DMEM培养基(Hyclone); 胰蛋白酶(Sigma, 批号: HY27250); 胎牛血清(Gibco). 参杖颗粒由江阴天江药业有限公司生产, 处方: 丹参2 g(生产批号: 1207025)、虎杖1 g(生产批号: 1207073)、黄芪1.5 g(生产批号: 1209111)、鳖甲0.5 g(生产批号: 1206058)、苦参1 g(生产批号: 1207011).
1.2.1 制备含药血清: 取体质量250-350 g的♂Wistar大鼠40只(清洁级), 分为4组(正常对照组A组、5倍浓度组B组、10倍浓度组C组、20倍浓度组D组). 正常饲养, 给药组连续7 d, 每日7:00 am定时灌胃一次(颗粒药物浓度为5.25 g/mL, 依据: 根据公式换算给予大鼠与人的等效剂量为0.525 g/100 g, 10倍浓度为5.25 g/100 g, 而大鼠灌胃剂量通常在1-2 mL/100 g), 剂量分别相当于65 kg体质量的成人每日每公斤用药量的5倍、10倍及20倍, 对照组按1 mL/100 g灌以生理盐水. 末次给药后2 h, 每只大鼠断头取血5-10 mL于无菌试管(不加抗凝剂), 室温静置2 h后, 1500 r/min离心10 min, 取上清液即为各浓度含药血清和对照血清, 微孔滤膜除菌后分装于1 mL冻存管, 标记后置于-80 ℃冰箱备用.
1.2.2 细胞培养: 将HSC-T6置于10%胎牛血清的高糖DMEM培养基中, 37 ℃, 5%CO2条件下培养, 隔天换液, 当细胞融合度达80%时, 用0.25%胰蛋白酶消化, 以1:3比例传代, 24 h后换液, 72 h再次传代, 所有实验用细胞均处于对数增长期.
1.2.3 细胞分组及处理: 将处于生长对数期的HSC细胞以5×105/mL密度接种于6孔板中, 将细胞进行相应分组及处理, 正常对照组(control): 正常培养基培养; 5倍含药血清组(5×group): 用5%胎牛血清稀释含药血清处理HSC 24 h后进行相应实验; 10倍含药血清组(10×group): 处理步骤同5倍含药血清组; 20倍含药血清组(20×group): 处理步骤同5倍含药血清组.
1.2.4 免疫荧光检测各组细胞: 各组细胞用预热的4%的多聚甲醛固定细胞30 min; 固定后, 用预热D-PBS清洗; 用0.1%Triton破膜3 min; 用预热D-PBS清洗; 10%山羊血清封闭30 min; 用预热D-PBS清洗细胞; 孵育一抗(α-SMA 1:50), 室温2 h; 用预热D-PBS清洗细胞; 孵育二抗(anti-rabbit FITC, 1:50), 室温1 h; 用预热D-PBS清洗细胞, 90%甘油封片; 观察摄片.
1.2.5 Western blot检测α-SMA的表达: 收集各组细胞, 加适量预冷150 mmol/L Lysis buffer(Cocktail)裂解液, 提取总蛋白. 按照30 μL体系、2×leamnli buffer制样, 按实验设计顺序加样, 电泳(95 V), 95 V转膜75 min. 取出PVDF膜, 做标记后, 用5%脱脂牛奶封闭液封闭30 min. 倒掉封闭液后, 加入一抗兔抗小鼠多克隆抗体(α-SMA, 1:1000), 摇床上4 ℃过夜, 用1×TBST洗膜, 加入用1×TBST稀释的二抗室温孵育1 h, ECL显影并用蛋白灰度值用Image J软件进行分析.
1.2.6 RT-PCR检测α-SMA mRNA的表达: 细胞培养达到80%-90%融合后, 弃去陈旧培养液, 用适量灭菌的预热PBS洗两次去除残余培养液, 按TRIzol试剂盒步骤说明进行操作提取总RNA并用核酸测仪测定总RNA含量和纯度; 取cDNA 5 μg, 利用逆转录试剂盒合成cDNA. 根据Genbank查找基因序列并设计引物, 以GAPDH为内参, α-SMA引物序列: F: 5'-TGGTATTGTGCTGGACTCTG-3'; R: 5'-CCATCAGGCAGTTCGTAG-3', 产物长度288 bp; GAPDH: F: 5'-TATCGGACGCCTGGTTAC-3', R: 5'-CTCGCTCCTGGAAGATGG-3', 产物长度203 bp. 反应条件: 95 ℃预变性, 5 min; 95 ℃变性, 30 s; 58 ℃退火, 30 s; 68 ℃延伸, 10 min; 4 ℃, 终止. PCR产物经浓度为2%的琼脂糖凝胶电泳, 用凝胶成像分析系统进行扫描拍照, 灰度值用Image J软件进行分析.
1.2.7 流式细胞术检测细胞周期: 根据细胞周期检测试剂盒说明的步骤, 同时设立阴性对照组, 并收集细胞106个;用1 mLPBS重新悬浮细胞, 2000 r/min, 离心5 min, 小心移去上清液; 加入0.5 mLSolutionBuffer轻轻悬浮细胞(自此步骤起, 操作中均不能剧烈振荡), 2000 r/min, 离心5 min, 小心移去上清液; 再加入0.5 mLSolutionBuffer轻轻悬浮细胞, 2000 r/min, 离心5 min, 小心移去上清液; 加入250 μLSolutionA, 轻轻悬浮细胞, 25 ℃孵育10 min; 溶液中加入200 μLSolutionB, 轻轻悬浮细胞, 25 ℃孵育10 min; 最后加入200 μLSolutionC, 轻轻悬浮细胞, 4 ℃避光10 min; 应用莱卡流式细胞仪检测并分析.
1.2.8 细胞划痕实验: 先用marker笔在6孔板背后, 用直尺比着, 均匀得划横线, 大约每隔0.5 cm一道, 横穿过孔, 每孔至少穿过5条线. 在孔中加入约5×105个细胞. 第2天用10 μL枪头比着直尺, 尽量垂至于背后的横线划痕, 枪头要垂直, 不能倾斜. 用预热的PBS洗细胞3次, 去处划下的细胞, 加入无血清培养基, 放入培养箱培养, 24 h后取样, 拍照.
统计学处理 实验数据以mean±SD表示, 采用SPSS13.0统计分析软件, 对组间数据进行单因素方差分析, 并进行两两比较, 若组间方差不齐则用非参数秩和检验, P<0.05为差异有统计学意义.
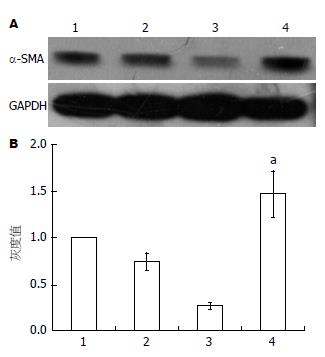
如图1A所示, Western blot在43 kDa的位置上出现的阳性杂交带为α-SMA蛋白表达, 与正常对照组相比, 参杖颗粒血清处理各组对α-SMA蛋白表达均具有抑制效应; 其中20倍组具有明显差异(P<0.05), 10倍组具有非常明显差异(P<0.01)(图1B).
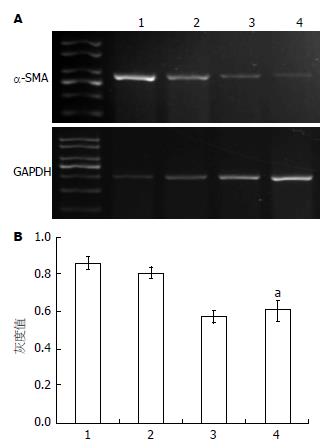
如图2A所示, 各组在288 bp处出现了α-SMA基因的特异性条带, 203 bp处出现了内参照GAPDH的条带. 如图2B所示, 通过对电泳条带光密度扫描分析, 正常对照组有较强的α-SMA基因表达(86.34%±3.31%); 与正常对照组比较, 不同浓度参杖颗粒血清处理的HSC细胞中, α-SMA基因表达均有下调; 5倍、10倍、20倍血清处理组α-SMA基因表达分别为80.74%±2.76%、57.26%±3.21%、70.36%±2.32%, 其中20倍组具有明显差异(P<0.05), 10倍组具有非常明显差异(P<0.01).
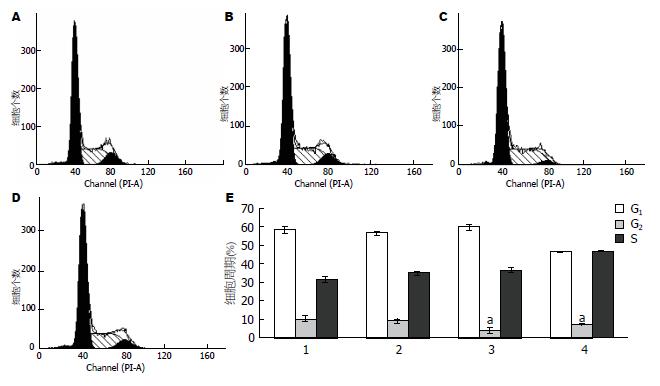
如图3所示, 流式细胞仪检测细胞周期结果显示, 正常对照组HSC G1期细胞比例为58.35%±1.28%, G2期为10.16%±1.11%, S期为31.49%±1.25%; 参杖颗粒血清处理组24 h后, G1期细胞数量增加, 而G2期细胞显著减少, 细胞明显被阻滞于G2期. 且以10倍组抑制效果最佳(P<0.01); 20倍组作用次之(P<0.05); 5倍组基本无抑制作用(图3E).
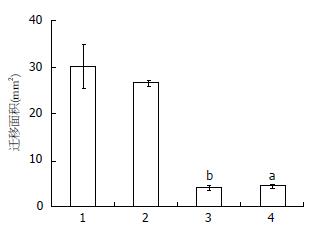
细胞划痕实验结果表明: 参杖颗粒血清处理的HSC细胞与正常对照细胞相比, 细胞的迁移面积均有减少, 其中10倍组迁移面积减少最显著(P<0.01), 提示参杖颗粒血清处理后HSC细胞的迁移能力明显下降(图4).
参杖颗粒是导师课题组治疗慢性肝病、肝纤维化的科研协定处方. 依据温病"伏气学说"之"毒伏肝络"理论, 肝纤维化是"毒邪内伏肝络日久"之结果[7]. 参杖颗粒即以此而立法组方, 包括丹参、虎杖、黄芪、鳖甲、苦参, 功效健脾补肾, 清热化湿解毒、活血通络[8,9]. 黄芪的主要有效成分为皂苷、多糖、黄酮等, 而黄芪皂苷是黄芪中具有代表性的活性成分, 在临床以及实验研究中都证实有较明确的抗纤维化作用[10,11]. 丹参辛、苦、温, 具活血化淤、清热宁神作用, 其有效成分包括丹参酮、丹参素等, 现代药理研究显示丹参具有调节机体免疫功能、抗肿瘤、诱导肿瘤细胞凋亡、促进微循环、抑制微动脉收缩等作用[12]. 虎杖苦寒, 清热化湿解毒, 其有效成分为白藜芦醇、大黄素, 广泛用于抗病毒, 抗肿瘤及慢性肝病的治疗中[13]. 鳖甲辛咸, 滋阴软坚散结, 多家报道其在抑制肝纤维增生, 改善肝功能方面有治疗作用[14]. 本课题组在前期研究中发现, 参杖颗粒不但能防治实验性大鼠肝纤维化, 还能改善肝脏微循环, 抑制HSC活化增殖, 促进HSC凋亡, 抑制HSC细胞内外的胶原生成率及TGF-β1 mRNA的表达[15].
HSC在肝纤维化过程中发挥了关键性作用, 在致病因子刺激下, HSC被激活, 转化为肌纤维样细胞, 并高表达α-SMA, 继而使肝脏ECM生成增加而降解减少, 最终导致肝脏胶原沉积与纤维化[16]. 随着肝纤维化细胞分子生物学机制的进一步明确, 以HSC为靶标的治疗措施逐渐成为抗肝纤维化的重要途径, 如抑制HSC活化和增殖, 调节基质合成和降解等[17]. 因此α-SMA的表达已被认为是HSC激活的显著特征之一, 成为肝纤维化的一个重要的评价指标.
本实验结果表明, 在参杖颗粒中剂量组作用24 h后, HSC细胞中α-SMA mRNA水平明显降低(P<0.01). 这说明该药可明显抑制HSC α-SMA基因和α-SMA蛋白的表达, 提示参杖颗粒抗肝纤维化的机制可能与其抑制HSC的活化有关: 一方面, 直接抑制HSC的增殖, 减少HSC细胞数量, 进而减少细胞外基质的形成; 另一方面, 通过抑制HSC的活化, 包括降低α-SMA的分泌量及表达水平、抑制活化HSC收缩迁移, 从而降低肝脏的纤维化程度. 因此, 根据以上结果, 说明α-SMA抗肝纤维化作用机制之一是从mRNA水平和蛋白水平抑制α-SMA表达, 抑制HSC增殖和迁移, 从而发挥抗肝纤维化作用.
肝星状细胞(hepatic stellate cell, HSC)是肝纤维化时细胞外基质合成的主要细胞, HSC持续激活是肝纤维化发生发展过程中的关键环节. 研究报道, 活血化瘀类中药复方具有较好的抗肝纤维化作用, 机制与抑制HSC的活化增殖有关.
赵铁建, 教授, 广西中医药大学基础医学院人体机能学系
参杖颗粒是导师课题组治疗慢性肝病、肝纤维化的科研协定处方, 在前期研究中发现, 参杖颗粒不但能防治实验性大鼠肝纤维化, 还能改善肝脏微循环, 抑制HSC活化增殖, 促进HSC凋亡, 其具体作用机制尚待深入研究.
Lin等的研究认为: 大黄提取物能抑制HSC的迁移, 同时抑制转化生长因子β1、α-平滑肌肌动蛋白(alpha smooth muscle-actin, α-SMA)以及胶原的表达, 抑制效应与提取物的浓度呈浓度依耐性.
参杖颗粒可以抑制HSC活化增殖的具体机制未见报道, 本实验运用参杖颗粒含药血清培养HSC, 观察HSC的增殖、迁移及α-SMA表达, 探索该方抗肝纤维化的机制.
探索参杖颗粒含药血清用于抑制HSC活化的适宜浓度, 探索参杖颗粒肝纤维化的机制, 为进一步研究打下基础.
本文创新性较好, 对于治疗肝纤维化具有一定的临床应用价值.
编辑 郭鹏 电编 鲁亚静
| 1. | Diao Y, Zhao XF, Lin JS, Wang QZ, Xu RA. Protection of the liver against CCl4-induced injury by intramuscular electrotransfer of a kallistatin-encoding plasmid. World J Gastroenterol. 2011;17:111-117. [PubMed] [DOI] |
| 2. | Sato M, Suzuki S, Senoo H. Hepatic stellate cells: unique characteristics in cell biology and phenotype. Cell Struct Funct. 2003;28:105-112. [PubMed] [DOI] |
| 3. | Friedman SL. Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the liver. Physiol Rev. 2008;88:125-172. [PubMed] [DOI] |
| 4. | De Minicis S, Seki E, Uchinami H, Kluwe J, Zhang Y, Brenner DA, Schwabe RF. Gene expression profiles during hepatic stellate cell activation in culture and in vivo. Gastroenterology. 2007;132:1937-1946. [PubMed] [DOI] |
| 5. | 杨 鹤梅, 李 素婷, 梅 立新, 马 春虎. 黄芩茎叶总黄酮对纤维化大鼠肝脏星形细胞活化的影响. 中国中医基础医学杂志. 2006;12:42-44. |
| 6. | Failli P, DeFRANCO RM, Caligiuri A, Gentilini A, Romanelli RG, Marra F, Batignani G, Guerra CT, Laffi G, Gentilini P. Nitrovasodilators inhibit platelet-derived growth factor-induced proliferation and migration of activated human hepatic stellate cells. Gastroenterology. 2000;119:479-492. [PubMed] [DOI] |
| 8. | Chor SY, Hui AY, To KF, Chan KK, Go YY, Chan HL, Leung WK, Sung JJ. Anti-proliferative and pro-apoptotic effects of herbal medicine on hepatic stellate cell. J Ethnopharmacol. 2005;100:180-186. [PubMed] [DOI] |
| 9. | Luk JM, Wang X, Liu P, Wong KF, Chan KL, Tong Y, Hui CK, Lau GK, Fan ST. Traditional Chinese herbal medicines for treatment of liver fibrosis and cancer: from laboratory discovery to clinical evaluation. Liver Int. 2007;27:879-890. [PubMed] [DOI] |
| 10. | Stickel F, Schuppan D. Herbal medicine in the treatment of liver diseases. Dig Liver Dis. 2007;39:293-304. [PubMed] [DOI] |
| 11. | Lin YL, Wu CF, Huang YT. Effects of rhubarb on migration of rat hepatic stellate cells. J Gastroenterol Hepatol. 2009;24:453-461. [PubMed] [DOI] |
| 14. | 高 建蓉, 陶 君, 张 赤志, 刘 焱文, 邵 志华, 蔡 卫民, 许 汉林, 吴 和珍, 陈 进文, 胡 祖良. 鳖甲防治肝纤维化实验研究. 中华中医药学刊. 2008;26:2462-2471. |
| 15. | 吕 文亮, 周 燕萍, 刘 林. 中药参杖颗粒抑制PDGF诱导的肝星状细胞MEK-1、c-fos表达. 中国中西医结合脾胃杂志. 2005;12:347-350. |
| 16. | Parekkadan B, van Poll D, Megeed Z, Kobayashi N, Tilles AW, Berthiaume F, Yarmush ML. Immunomodulation of activated hepatic stellate cells by mesenchymal stem cells. Biochem Biophys Res Commun. 2007;363:247-252. [PubMed] [DOI] |
| 17. | Yang C, Zeisberg M, Mosterman B, Sudhakar A, Yerramalla U, Holthaus K, Xu L, Eng F, Afdhal N, Kalluri R. Liver fibrosis: insights into migration of hepatic stellate cells in response to extracellular matrix and growth factors. Gastroenterology. 2003;124:147-159. [PubMed] [DOI] |