修回日期: 2014-02-24
接受日期: 2014-03-08
在线出版日期: 2014-04-08
目的: 研究生长分化因子-15(growth differentiation factor-15, GDF-15)基因在曲古菌素A(trichostatin A, TSA)作用胃癌细胞系SGC-7901后及胃腺癌组织中的表达.
方法: 采用Real-time PCR检测胃癌细胞系SGC-7901经过TSA干预后GDF-15基因表达的变化, 免疫组织化学检测GDF-15基因在胃癌及癌旁正常组织中的表达.
结果: GDF-15基因在胃癌细胞系SGC-7901经75 ng/mL TSA作用48 h后, 表达下调, 差异具有显著性(P<0.05), 免疫组织化学显示胃腺癌组织中GDF-15基因表达明显高于周围正常胃组织(P<0.05).
结论: GDF-15基因表达下降可能在TSA促胃癌细胞系SGC-7901凋亡中发挥作用. GDF-15基因在胃腺癌组织中表达增高.
核心提示: 生长分化因子-15(growth differentiation factor-15, GDF-15)在肿瘤进程中发挥双向作用. 早期GDF-15抑制肿瘤生长和诱导凋亡; 晚期促进细胞增殖、迁移、侵袭和转移. GDF-15在进展期胃癌中表达增高, 故GDF-15基因表达下降可能在曲古菌素A(trichostatin A)促胃癌细胞系SGC-7901凋亡中发挥作用.
引文著录: 李云龙, 崔武, 李晓林, 王浩, 田瑜, 曹志刚, 佟柏峰, 邹小明. 曲古菌素A作用胃癌细胞SGC-7901后GDF-15的表达及其在胃腺癌组织中的表达. 世界华人消化杂志 2014; 22(10): 1391-1395
Revised: February 24, 2014
Accepted: March 8, 2014
Published online: April 8, 2014
AIM: To examine the expression of growth differentiation factor-15 (GDF-15) in gastric cancer SGC-7901 cells treated with TSA and in gastric carcinoma tissues.
METHODS: GDF-15 gene expression in gastric cancer cell line SGC-7901 after TSA treatment was detected by real-time PCR, and GDF-15 protein expression in gastric cancer and tumor-adjacent normal tissues was detected by immunohistochemistry.
RESULTS: GDF-15 gene expression was significantly down-regulated in gastric cancer cell line SGC-7901 treated with 75 ng/mL TSA for 48 h (P < 0.05). Immunohistochemistry analysis demonstrated that GDF-15 protein expression in gastric adenocarcinoma was significantly higher than that in tumor-adjacent gastric tissue (P < 0.05).
CONCLUSION: Down-regulation of GDF-15 gene expression may play a role in TSA-induced apoptosis of SGC-7901 cells. GDF-15 protein expression is increased in gastric carcinoma.
- Citation: Li YL, Cui W, Li XL, Wang H, Tian Y, Cao ZG, Tong BF, Zou XM. Expression of GDF-15 in trichostatin A-treated gastric cancer SGC-7901 cells and in gastric adenocarcinoma tissues. Shijie Huaren Xiaohua Zazhi 2014; 22(10): 1391-1395
- URL: https://www.wjgnet.com/1009-3079/full/v22/i10/1391.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i10.1391
生长分化因子-15(growth differentiation factor-15, GDF-15)又称前列腺衍生因子(prostate-derived factor, PDF)、非甾体抗炎药激活基因-l(non-steroidal anti-inflammatory drug-activated gene 1, NAG-1)、巨噬细胞抑制因子-1(macrophageinhibitory cytokine-1, MIC-1), 在不同的细胞类型、疾病阶段和肿瘤微环境中发挥抑制和促进癌症进程的双重作用[1-7]. 癌症早期阶段, GDF-15发挥抑制作用, 抑制肿瘤生长和诱导凋亡; 但在晚期, GDF-15则促进细胞增殖、迁移、侵袭和远处转移. Lee等[8]的研究显示胃癌细胞系中GDF-15过表达可增加细胞的侵袭能力. 我们在研究中发现一定剂量曲古菌素A(trichostatin A, TSA)作用胃癌细胞系SGC-7901后可导致SGC-7901细胞凋亡[9], 进一步分析显示TSA作用胃癌细胞系SGC-7901后能诱导SGC-7901细胞部分基因表达的改变. 为此, 我们应用Real-time PCR检测TSA作用胃癌细胞系SGC-7901后GDF-15基因的表达, 并对进展期胃癌组织中GDF-15的表达进行检测, 以初步分析GDF-15基因在胃癌疾病进程中的作用.
胃癌细胞系SGC-7901由黑龙江省肿瘤防治研究所惠赠. TSA(分子式C17H22N2O3, 相对分子质量302.4, 纯度98%, Sigma公司), RPMI 1640培养基(Gibco公司), 胎牛血清(四季青公司), TRIzol(Invitrogen公司), ExScript™ RT-PCR试剂盒、Premix Ex Taq™试剂盒(TaKaRa公司), Mx4000荧光定量PCR仪(Stratagene公司), 兔抗人GDF-15多克隆抗体(Abcam公司), SP试剂盒及AEC显色剂(福州迈新生物技术有限公司)等.
1.2.1 细胞培养: SGC-7901细胞接种于含10%胎牛血清的RPMI 1640培养液中, 常规细胞培养, 取对数生长期细胞进行实验. 实验分2组: 对照组给予全RPMI 1640培养液, 实验组给予含TSA(终浓度75 ng/mL)[9]的RPMI 1640全培养液, 于37 ℃、5%CO2培养箱中继续培养48 h后实验.
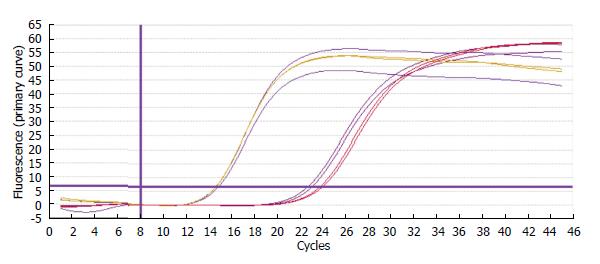
1.2.2 GDF-15基因Real-time PCR检测: (1)细胞总RNA的提取: 根据Invitrogen公司的TRIzol操作说明书进行. 紫外分析测定所抽提RNA的浓度; (2)逆转录获得cDNA: 根据TaKaRa公司的ExScript™ RT-PCR试剂盒操作说明书进行. 得到的产物置于-80 ℃保存备用; (3)Real-time PCR检测: 引物设计及Real-time PCR检测委托上海吉凯基因化学有限公司进行. 引物序列如下: GDF-15正向: 5'-GTTGCGGAAACGCTACGA-3'; GDF-15反向: 5'-AACAGAGCCCGGTGAAGG-3'. GAPDH正向: 5'-TGACTTCAACAGCGACACCCA-3'; GAPDH反向: 5'-CACCCTGTTGCTGTAGCCAAA-3'. 产物片段分别为210、121 bp. PCR反应条件: 设定程序为两步法Real-time. PCR预变性95 ℃ 15 s; 之后每一步变性95 ℃ 5 s; 退火延伸60 ℃ 30 s; 共进行45个循环. 每次在延伸阶段读取吸光值, 收集数据进行Real-time分析. 制作熔解曲线: PCR结束后, 95 ℃变性1 min, 然后冷却至55 ℃, 使DNA双链充分结合. 从55 ℃开始到95 ℃, 每一步增加0.5 ℃, 保持4 s, 同时读取吸光值.
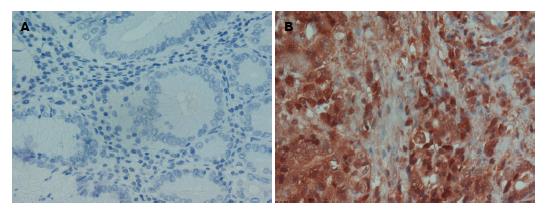
1.2.3 免疫组织化学: 40例进展期胃腺癌与40例其癌旁5 cm正常胃组织标本为2012-2013年我科手术切除标本, 按SP免疫组织化学染色步骤进行操作, 用已知表达抗体的组织作阳性对照, PBS缓冲液代替一抗作为阴性对照, 具体步骤按说明书进行. GDF-15阳性染色主要定位于细胞质中, 光镜下双盲法计数阳性细胞. 阳性细胞为胞浆出现棕黄色颗粒. 于上、下、左、右、中各随机选择至少5个高倍视野(×400), 计数不少于1000个细胞, 并统计阳性细胞数[10].
统计学处理 Real-time PCR数值分析采用2-∆∆Ct分析法, 仪器软件Stratagene公司自动分析给出表达比值(expression ratio = 2-∆∆Ct), 使用SPSS13.0统计分析软件进行ANVOVA方差分析, P<0.05为差异有统计学意义. 免疫组织化学数据处理采用SPSS13.0统计分析软件, 应用χ2检验对GDF-15在胃腺癌、正常胃组织中的表达结果进行分析, P<0.05为差异有统计学意义.
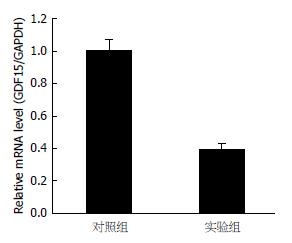
一定剂量TSA作用SGC-7901细胞48 h后GDF-15基因表达下降, 对照组2-∆∆Ct均值为1.001, 标准偏差为0.07355248, 实验组2-∆∆Ct均值为0.389, 标准偏差为0.04190327, P值
为0.01947725, P<0.05, 二者表达差异具有显著性(表1, 图1, 图2和图3).
| 样本 | GAPDH C t值 | GDF-15 C t值 | Ct | - ΔΔCt | 2- ΔΔCt |
| 对照组 | 14.68 | 22.78 | 8.10 | 0.075 | 1.053 |
| 对照组 | 14.69 | 22.94 | 8.25 | -0.075 | 0.949 |
| 实验组 | 14.50 | 23.93 | 9.43 | -1.255 | 0.419 |
| 实验组 | 14.56 | 24.21 | 9.65 | -1.475 | 0.360 |
GDF-15基因在胃腺癌组织中表达增强, 癌旁正常组织中表达较弱(图4), 40例胃腺癌标本, 阳性表达31例, 阳性表达率为77.5%, 40例癌旁正常组织阳性表达10例, 阳性表达率为25%, 二者表达差异具有显著性意义(P = 0.002, P<0.05).
GDF-15是Baek等[11]于1997发现的转化生长因子-β(transforming growth factor-β, TGF-β)超家族的成员, GDF-15在不同肿瘤中表达不一致. Liu等[12]的研究表明GDF-15能在体外减少肿瘤细胞间的黏附, 在细胞癌变的不同阶段上调, 这与贺飞
等[13]与曹征等[14]的研究相似, 提示GDF-15在细胞癌变过程中起到重要作用. 然而, 在化生的支气管鳞状上皮癌或者肺癌中GDF-15蛋白则不表达, 而在正常的气管支气管上皮中表达[15]; 也有研究表明在肿瘤中GDF-15可以促进细胞凋亡, 抑制细胞生长, 说明他在某些情况下具有抑制肿瘤的作用[16]. GDF-15在各种肿瘤中表达与相应正常组织相比, 是升高还是降低, 目前各家研究意见不一, 至今没有得到很好的解释.
已有研究表明, 一定浓度TSA作用SGC-7901细胞后, 可诱导SGC-7901细胞凋亡[9], 为了研究GDF-15基因是否在一定浓度TSA作用SGC-7901细胞后表达发生变化, 我们采用Real-time PCR方法检测了TSA作用SGC-7901细胞前后GDF-15因子表达, 实验发现, 胃腺癌细胞系SGC-7901经一定剂量TSA作用后, GDF-15因子表达明显下调, 这提示GDF-15基因的变化在SGC-7901细胞凋亡的过程中可能发挥一定作用. TSA作用SGC-7901后, 可能通过抑制GDF-15因子的表达, 在一定程度上抑制了GDF-15因子的促癌作用, 使SGC-7901细胞发生凋亡. 随后我们研究了GDF-15因子在临床病例中的表达, 选取我科手术治疗的40例进展期胃腺癌病例标本进行了GDF-15因子的免疫组织化学检测, 结果表明GDF-15基因在胃腺癌组织中的表达明显高于癌旁正常胃组织, 这进一步提示我们GDF-15基因在胃腺癌的发生发展中可能发挥作用. 一般认为GDF-15的促癌作用可能与以下3个机制相关: (1)抑制连环蛋白cateninδ1基因的表达[12]; (2)通过ERK1/2通路上调UPA系统增强癌细胞的侵袭性[8,17]; (3)诱导ErbB2受体酪氨酸激酶在人体癌细胞中过度表达[5]. GDF-15基因是否通过以上三个途径的功能受到抑制, 发挥诱导SGC-7901细胞凋亡还值得进一步研究.
实验表明, GDF-15基因在进展期胃癌组织中表达增强, 在胃癌细胞SGC-7901经一定浓度TSA作用后表达受到抑制, 可能促进了SGC-7901细胞凋亡, 但其具体机制还未明确, 仍待研究, 以进一步揭示胃癌的发生发展.
中国胃癌患者的病死率居于各种恶性肿瘤之首, 相关研究尤为重要. 生长分化因子-15(growth differentiation factor-15, GDF-l5)是转化生长因子-β(transforming growth factor-β, TGF-β)超家族成员之一, 可导致肿瘤的发生, 也可抑制肿瘤的发生. 研究胃癌与GDF-15的关系, 有利于提高对胃癌机制的认识.
高泽立, 副教授, 上海交大医学院九院周浦分院
曲古菌素A可促进胃癌细胞的凋亡, 也可导致胃癌细胞基因表达的变化, 关于曲古菌素A作用后胃癌细胞GDF-15基因表达的研究国内外未见报道, GDF-15与胃癌关系的研究也是热点之一.
GDF-15在多种肿瘤中发挥作用, 在黑素瘤, 结肠癌, 胰腺癌, 前列腺癌, 乳腺癌, 头颈鳞癌中均可见表达水平增高的报道. 但在胃癌研究中GDF-15研究较少, 目前将胃癌细胞系SGC-7901与临床胃癌病例结合研究GDF-15未见报道.
本文首次采用Real-time方法检测了曲古菌素A作用胃癌细胞系SGC-7901后GDF-15基因的表达情况, 并与临床进展期胃腺癌患者中GDF-15表达研究相结合, 创新意识强.
本文选题紧扣当前消化系肿瘤防治研究热点, 实验设计合理, 实验数据结果可靠, 统计方法得当. 参考文献较新, 值得广大临床及基础研究者阅读.
编辑 田滢 电编 鲁亚静
| 1. | Zhang L, Yang X, Pan HY, Zhou XJ, Li J, Chen WT, Zhong LP, Zhang ZY. Expression of growth differentiation factor 15 is positively correlated with histopathological malignant grade and in vitro cell proliferation in oral squamous cell carcinoma. Oral Oncol. 2009;45:627-632. [PubMed] [DOI] |
| 2. | Baek SJ, Kim KS, Nixon JB, Wilson LC, Eling TE. Cyclooxygenase inhibitors regulate the expression of a TGF-beta superfamily member that has proapoptotic and antitumorigenic activities. Mol Pharmacol. 2001;59:901-908. [PubMed] |
| 3. | Albertoni M, Shaw PH, Nozaki M, Godard S, Tenan M, Hamou MF, Fairlie DW, Breit SN, Paralkar VM, de Tribolet N. Anoxia induces macrophage inhibitory cytokine-1 (MIC-1) in glioblastoma cells independently of p53 and HIF-1. Oncogene. 2002;21:4212-4219. [PubMed] |
| 4. | Johnen H, Lin S, Kuffner T, Brown DA, Tsai VW, Bauskin AR, Wu L, Pankhurst G, Jiang L, Junankar S. Tumor-induced anorexia and weight loss are mediated by the TGF-beta superfamily cytokine MIC-1. Nat Med. 2007;13:1333-1340. [PubMed] |
| 5. | Kim KK, Lee JJ, Yang Y, You KH, Lee JH. Macrophage inhibitory cytokine-1 activates AKT and ERK-1/2 via the transactivation of ErbB2 in human breast and gastric cancer cells. Carcinogenesis. 2008;29:704-712. [PubMed] [DOI] |
| 6. | Boyle GM, Pedley J, Martyn AC, Banducci KJ, Strutton GM, Brown DA, Breit SN, Parsons PG. Macrophage inhibitory cytokine-1 is overexpressed in malignant melanoma and is associated with tumorigenicity. J Invest Dermatol. 2009;129:383-391. [PubMed] [DOI] |
| 7. | Senapati S, Rachagani S, Chaudhary K, Johansson SL, Singh RK, Batra SK. Overexpression of macrophage inhibitory cytokine-1 induces metastasis of human prostate cancer cells through the FAK-RhoA signaling pathway. Oncogene. 2010;29:1293-1302. [PubMed] [DOI] |
| 8. | Lee DH, Yang Y, Lee SJ, Kim KY, Koo TH, Shin SM, Song KS, Lee YH, Kim YJ, Lee JJ. Macrophage inhibitory cytokine-1 induces the invasiveness of gastric cancer cells by up-regulating the urokinase-type plasminogen activator system. Cancer Res. 2003;63:4648-4655. [PubMed] |
| 9. | Zou XM, Li YL, Wang H, Cui W, Li XL, Fu SB, Jiang HC. Gastric cancer cell lines induced by trichostatin A. World J Gastroenterol. 2008;14:4810-4815. [PubMed] |
| 11. | Baek SJ, Kim JS, Moore SM, Lee SH, Martinez J, Eling TE. Cyclooxygenase inhibitors induce the expression of the tumor suppressor gene EGR-1, which results in the up-regulation of NAG-1, an antitumorigenic protein. Mol Pharmacol. 2005;67:356-364. [PubMed] |
| 12. | Liu T, Bauskin AR, Zaunders J, Brown DA, Pankhurst S, Russell PJ, Breit SN. Macrophage inhibitory cytokine 1 reduces cell adhesion and induces apoptosis in prostate cancer cells. Cancer Res. 2003;63:5034-5040. [PubMed] |
| 15. | Newman D, Sakaue M, Koo JS, Kim KS, Baek SJ, Eling T, Jetten AM. Differential regulation of nonsteroidal anti-inflammatory drug-activated gene in normal human tracheobronchial epithelial and lung carcinoma cells by retinoids. Mol Pharmacol. 2003;63:557-564. [PubMed] |
| 16. | Koopmann J, Buckhaults P, Brown DA, Zahurak ML, Sato N, Fukushima N, Sokoll LJ, Chan DW, Yeo CJ, Hruban RH. Serum macrophage inhibitory cytokine 1 as a marker of pancreatic and other periampullary cancers. Clin Cancer Res. 2004;10:2386-2392. [PubMed] |
| 17. | Brown DA, Bauskin AR, Fairlie WD, Smith MD, Liu T, Xu N, Breit SN. Antibody-based approach to high-volume genotyping for MIC-1 polymorphism. Biotechniques. 2002;33:118-120, 122, 124 passim. [PubMed] |