修回日期: 2014-01-17
接受日期: 2014-02-18
在线出版日期: 2014-04-08
目的: 通过观察健脾活血方对胃癌前病变大鼠胃黏膜组织中CD44V6、 MLH1及MSH2表达的影响, 探讨健脾活血方对其干预的作用机制.
方法: 除正常组外, 其他大鼠采用以N-甲基-N-硝基-N-亚硝基胍(N-methyl-N-nitro N-nitrosoguanidine, MNNG)为主同时配合0.3 g/L雷尼替丁、400 mL/L乙醇及饥饱失常的多因素造模法建立胃癌前病变动物模型. 将造模成功的40只大鼠随机分为模型组(0.9%氯化钠溶液)、胃复春组(0.86 g/kg)、健脾活血方高、中、低剂量组(32、16、8 g/kg), 每组8只, 每组每天给予等量(10 mL/kg)的不同药物灌胃一次, 连续10 wk. 实验末处死大鼠, 给予相应处理后, 快速免疫组织化学检测CD44V6、MLH1及MSH2表达情况.
结果: 模型组CD44V6表达与正常组相比明显升高(5.12±1.96 vs 0.25±0.46, P<0.01); 健脾活血方高、中剂量组CD44V6表达与模型组相比均明显降低(2.25±0.71, 3.25±0.31 vs 5.12±1.96, P<0.01或P<0.05), 低剂量组CD44V6表达与模型组比较差异无统计学意义(P>0.05); 健脾活血方高剂量组CD44V6表达与胃复春组相比明显降低(2.25±0.71 vs 4.62±1.19, P<0.01), 中、低剂量组CD44V6表达与胃复春组比较差异无统计学意义(P>0.05). 模型组MLH1、MSH2表达与正常组相比均明显降低(3.75±1.04 vs 8.00±0.926; 3.62±1.69 vs 7.25±2.12, P<0.01); 健脾活血方高、中、低剂量组MLH1、MSH2表达与模型组相比均明显升高(6.50±0.93, 5.25±1.49, 5.12±1.25 vs 3.75±1.04; 6.62±2.13, 6.00±1.51, 5.50±1.41 vs 3.62±1.69, P<0.01或P<0.05); 健脾活血方高剂量组MLH1表达与胃复春组相比明显升高(6.50±0.93 vs 4.88±1.25, P<0.05), 中、低剂量组MLH1及高、中、低剂量组MSH2表达与胃复春组比较差异无统计学意义(P>0.05).
结论: 健脾活血方可通过降低CD44V6表达, 上调MLH1、MSH2表达, 减少细胞的非正常侵袭和转移, 增强基因的错配修复功能, 减少细胞的异常增殖和分化, 发挥对大鼠胃癌前病变的治疗作用.
核心提示: 本研究显示健脾活血方各组能不同程度地降低CD44V6的表达, 提高错配修复基因MLH1、MSH2的表达. 提示健脾活血方可能通过降低CD44V6的表达, 提高MLH1、MSH2的表达, 减少细胞的非正常侵袭和转移, 同时增强基因的错配修复功能, 减少基因的突变, 诱导病态细胞尽早凋亡, 达到治疗或逆转胃癌前病变的作用.
引文著录: 封慧, 叶柏, 朱萱萱, 严晶, 周杰. 健脾活血方对大鼠胃癌前病变模型CD44V6、MLH1、MSH2表达的影响. 世界华人消化杂志 2014; 22(10): 1384-1390
Revised: January 17, 2014
Accepted: February 18, 2014
Published online: April 8, 2014
AIM: To investigate the effects of Jianpi Huoxue decoction on CD44V6, mutL homolog 1 (MLH1) and mutS homologue 2 (MSH2) expression in precancerous lesions of gastric cancer (PLGC) in rats.
METHODS: PLGC was induced in rats with N-methyl-N-nitro N-nitrosoguanidine (MNNG) together with 0.3 g/L ranitidine, 400 mL/L alcohol and irregular diet. Forty model rats were randomly and equally divided into a model control group (0.9% normal saline, NS), a Weifuchun group (0.86 g/kg), and high-, medium- and low-dose Jianpi Huoxue decoction groups (32, 16, and 8 g/kg). Untreated normal rats comprised the normal control group. Each group was given corresponding medicine (10 mL/kg) once a day for 10 wk. All of the rats were sacrificed at the end of the experiment. The expression of CD44V6, MLH1 and MSH2 was detected by rapid immunohistochemistry.
RESULTS: In comparison with the normal control group, CD44V6 expression was significantly increased in the model control group (5.12 ± 1.96 vs 0.25 ± 0.46, P < 0.01). In comparison with the model group, CD44V6 expression was significantly decreased in the high- and medium-dose Jianpi Huoxue decoction groups (2.25 ± 0.71, 3.25 ± 0.31 vs 5.12 ± 1.96, P < 0.01 or < 0.05), although there was no significant difference between the low-dose Jianpi Huoxue decoction group and the model group (P > 0.05). In comparison with the Weifuchun group, CD44V6 expression was decreased in the high-dose Jianpi Huoxue decoction group (2.25 ± 0.71 vs 4.62 ± 1.19, P < 0.01), but there were no significant differences between the Weifuchun group, the medium- and low-dose Jianpi Huoxue decoction groups (P > 0.05 for both). In comparison with the normal group, MLH1 and MSH2 expression was significantly decreased in the model group (3.75 ± 1.04 vs 8.00 ± 0.926, 3.62 ± 1.69 vs 7.25 ± 2.12, P < 0.01 for both). In comparison with the model group, MLH1 and MSH2 expression was significantly increased in the high-, medium- and low-dose Jianpi Huoxue decoction groups (6.50 ± 0.93, 5.25 ± 1.49, 5.12 ± 1.25 vs 3.75 ± 1.04; 6.62 ± 2.13, 6.00 ± 1.51, 5.50 ± 1.41 vs 3.62 ± 1.69, P < 0.01 or < 0.05 for all). In comparison with the Weifuchun group, MLH1 expression was increased in the high-dose Jianpi Huoxue decoction group (6.50 ± 0.93 vs 4.88 ± 1.25, P < 0.05), but there were no significant differences between the Weifuchun group, the medium- and low-dose Jianpi Huoxue decoction groups (P > 0.05 for both). As for MSH2 expression, there were no significant differences between the Weifuchun group and all Jianpi Huoxue decoction groups (P > 0.05 for all).
CONCLUSION: The therapeutic effect of Jianpi Huoxue decoction for PLGC in rats is associated with decreasing CD44V6 expression and increasing MLH1 and MSH2 expression in gastric mucosa.
- Citation: Feng H, Ye B, Zhu XX, Yan J, Zhou J. Effect of Jianpi Huoxue decoction on CD44V6, MLH1 and MSH2 expression in precancerous lesions of gastric cancer in rats. Shijie Huaren Xiaohua Zazhi 2014; 22(10): 1384-1390
- URL: https://www.wjgnet.com/1009-3079/full/v22/i10/1384.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i10.1384
胃癌前病变(precancerous lesions of gastric cancer, PLGC)是指更容易发生癌变的组织病理变化[1], 包括肠上皮化生和异型增生, 常在慢性萎缩性胃炎基础上伴随发生. 正常胃黏膜上皮细胞向癌细胞转化是一个多基因、多因素、多阶段的过程, 受多种相关因子的调控, 其中细胞黏附分子CD44、错配修复基因MLH1及MSH2的异常表达在此过程中有着举足轻重的作用[2-7].
目前西医对PLGC的治疗较为棘手, 而传统中医从整体入手, 辨证施治, 在逆转胃黏膜萎缩以及肠上皮化生和异型增生方面有着独特的优越性. 健脾活血方是江苏省中医院脾胃病科叶柏教授根据多年临床实践总结的经验方, 在临床上治疗PLGC取得了较好的疗效, 作者通过动物实验, 观察该方对PLGC大鼠胃黏膜CD44V6、MLH1、MSH2基因表达的影响, 以进一步从分子生物学的角度探讨其可能作用机制.
清洁级SD大鼠60只, 雌雄各半, 体质量100-120 g, 由南通大学动物中心提供, 合格证号: SCXK(苏)2008-0010. 室温(22 ℃±2 ℃), 湿度55%-65%, 光照适度, 通风洁净良好. 全价营养颗粒饲料: 由江苏省协同医药生物技术有限公司提供, 批号: 110610. N-甲基-N-硝基-N-亚硝基胍(N-methyl-N-nitro N-nitrosoguanidine, MNNG)(东京仁成工业株式会社制造, 批号: GNGMH); 雷尼替丁(杭州赛诺菲圣德拉堡民生制药有限公司生产, 批号: 156701); 乙醇(用蒸馏水稀释成400 mL/L的浓度); 胃复春片(每片0.359 g, 杭州胡庆余堂药业有限公司, 批号: 110469), 健脾活血方(方药组成: 黄芪、炒白术、炒白芍、炒苡仁、广陈皮、法半夏、麦冬、莪术、仙鹤草、蛇舌草、炒谷芽、炒麦芽, 购自南京中医药大学第一附属医院中药房, 江阴天江药业有限公司生产), CD44V6抗体(美国NeoMarkers, 批号: MS-1092-so), MLH1抗体(福州迈新生物公司提供, 批号: MAB-0642), MSH2抗体(福州迈新生物公司提供, 批号: MAB-0291), 即用型快速免疫组织化学Max Vision™试剂盒(福州迈新生物公司提供, 批号: KIT-5030), 二氨乙基联苯胺(diaminobenzidine, DAB)显色试剂等(福州迈新生物公司提供). TP 1020自动脱水机(德国LEICA公司提供), RM2235型石蜡切片机(德国LEICA公司提供), CS-Ⅵ型摊片烤片机(湖北孝感宏业医用仪器有限公司提供), Tissue-Tek TEL组织包埋中心(日本SAKURA公司提供), LEICA DM 1000光学显微镜(德国Leica公司提供), 隔水式电热恒温培养箱(上海市跃进医疗器械一厂提供), 微波炉(TCL有限公司提供), MiniSee图像采集系统.
1.2.1造模: 60只大鼠适应性喂养1 wk后, 随机分为2组: 正常组和造模组. 正常组10只, 余下50只, 采用MNNG综合造模法[8,9]造模, 具体方法如下: 正常组: 仅以生理盐水同等条件下灌胃, 造模大鼠每天给予150 mg/L的MNNG溶液自由饮用, 含0.03%雷尼替丁的170 mg/L的MNNG溶液按10 mL/kg每天灌胃1次(即用即配), 400 mL/L的乙醇按10 mL/kg每周灌胃2次, 连续12 wk; 其中第5周开始结合饥饱失常(逢单禁食, 逢双饱食). 造模 12 wk后随机抽取正常组大鼠2只、造模组大鼠6只杀检, 观察组织病理学变化(以HE染色光学显微镜下观察的结果为主), 确认模型是否成功. 造模过程中共死亡4 只.
1.2.2 分组与给药: 造模成功后, 将造模组剩余40只大鼠随机分为5组, 分别为: 模型组8只、健脾活血方高、中、低剂量组(32、16、8 g/kg)各8只、胃复春对照组(0.86 g/kg)8只. 正常组和模型组: 等量的0.9%生理盐水. 每组每天给予相应的药物灌胃1次. 上述治疗10 wk. 实验第22周末处死大鼠, 剖腹取胃, 沿胃大弯剪开, 生理盐水冲洗, 肉眼观察, 平铺于硬纸板上, 于胃窦部剪取组织1块. 用40 g/L的中性甲醛固定胃组织, 石蜡包埋待检. 采用快速免疫组织化学方法检测CD44V6、MLH1、MSH2表达情况.
1.2.3 免疫组织化学检测CD44V6、MLH1、MSH2的表达: 采用快速免疫组织化学方法, 即用型快速免疫组织化学MaxVision™试剂盒是根据多聚合酶技术把多分子量过氧化物酶与抗鼠或/和抗兔IgG分子结合在聚合物上形成多聚物分子. 在实验过程中加空白对照(以PBS代替各种一抗)以监测抗体特性. 主要染色过程如下: (1)石蜡切片脱蜡水化, 微波中档抗原修复10 min. 自然冷却, 用PBS液(0.01 mol/L pH 7.4)冲洗3次×2 min; (2)正常山羊血清封闭, 室温孵育10 min. 倾去血清, 勿洗, 滴加抗体, 37 ℃孵育1 h; (3)PBS冲洗, 2 min×3次; (4)滴加即用型快速免疫组织化学MaxVision™二抗, 37 ℃或室温孵育10-15 min; (5)PBS冲洗, 2 min×3次; (6)滴加新鲜配制的DAB显色3-5 min, 显微镜下观察; (7)自来水充分冲洗, 苏木素复染, 自来水冲洗返蓝; (8)梯度酒精脱水、二甲苯透明, 中性树胶封片. 免疫组织化学标记结果: 各种蛋白阳性细胞以胞核或胞浆呈棕黄色为主. 阴性不着色.
大鼠的阳性细胞计数采用半定量法判断, 即根据每张切片的腺体和上皮阳性细胞面积及阳性细胞着色强度进行分级评分, 每个视野所见阳性细胞数的面积分0、1、2、3、4级. 0级为阴性, 计0分; 1级为阳性细胞占1%-25%, 计1分; 2级为阳性细胞占26%-50%, 计2分; 3级为阳性细胞占51%-75%计3分; 4级为阳性细胞占76%-100%, 计4分. 着色程度计分标准为: 无着色计0分; 浅黄色计1分; 棕黄色计2分; 棕褐色计3分. 根据两者乘积积分进行统计分析.
统计学处理 采用SPSS19.0软件进行统计学分析. 所有数据用mean±SD表示, 各组CD44V6、MLH1、MSH2表达情况的比较采用单因素方差分析及t检验. 以P<0.05为差异有统计学意义.
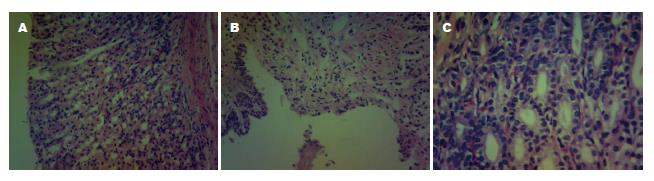
正常组胃黏膜结构层次完整, 胃黏膜上皮呈单层柱状上皮, 细胞排列紧密, 未见明显炎细胞浸润. 造模组大鼠胃黏膜组织固有层炎细胞浸润, 间质充血, 部分腺体萎缩, 胃窦部腺体紊乱, 伴有不同程度的异型增生, 偶可见杯状细胞, 核深染, 局部黏膜糜烂(图1).
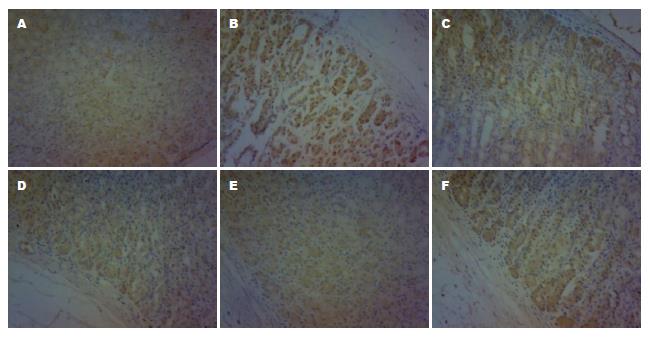
CD44V6蛋白在正常胃黏膜几乎不表达. 模型组CD44V6蛋白表达明显高于正常组, 主要定位于细胞胞浆, 两组比较差异有统计学意义(P<0.01); 健脾活血方高、中剂量组CD44V6蛋白表达与模型组相比明显降低, 差异有统计学意义(高剂量组P<0.01, 中剂量组P<0.05), 健脾活血方低剂量组、胃复春组CD44V6蛋白表达与模型组相比无明显差异(P>0.05); 健脾活血方高剂量组CD44V6蛋白表达与胃复春组相比明显降低, 差异有统计学意义(P<0.01), 中、低剂量组CD44V6蛋白表达与胃复春组相比无明显差异(P>0.05)(表1, 图2).
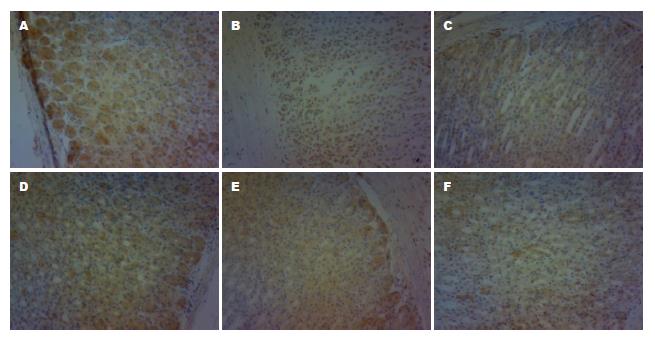
MLH1蛋白表达几乎出现于所有正常胃黏膜, 主要定位于细胞胞浆. 模型组MLH1蛋白表达与正常组相比明显降低, 差异有统计学意义(P<0.01); 健脾活血方高、中、低剂量组MLH1蛋白表达与模型组相比均明显升高, 差异有统计学意义(高剂量组P<0.01, 中、低剂量组P<0.05), 胃复春组MLH1蛋白表达与模型组相比无明显差异(P>0.05); 健脾活血方高剂量组MLH1蛋白表达与胃复春组相比明显升高, 差异有统计学意义(P<0.05), 中、低剂量组MLH1蛋白表达与胃复春组相比无明显差异(P>0.05)(表1, 图3).
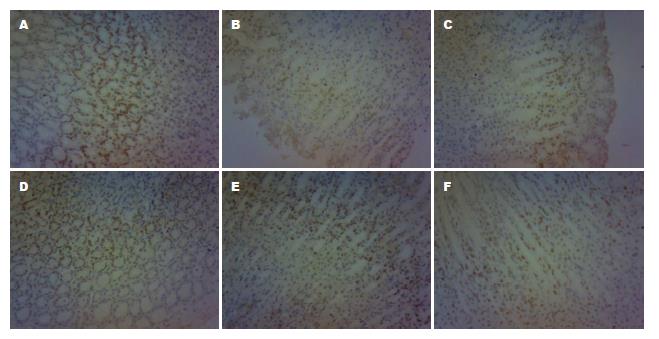
MSH2蛋白在大鼠正常胃黏膜中表达明显, 主要定位于细胞核, 部分细胞同时出现胞浆染色. 模型组MSH2表达与正常组相比明显降低, 差异有统计学意义(P<0.01); 健脾活血方高、中、低剂量组及胃复春组MSH2蛋白表达与模型组相比均明显升高, 差异有统计学意义(高剂量组P<0.01, 中、低剂量组、胃复春组P<0.05); 健脾活血方高、中、低剂量组MSH2蛋白表达与胃复春组相比无明显差异(P>0.05)(表1, 图4).
PLGC是胃黏膜从正常细胞向癌细胞转化过程中的一个重要阶段, 其意义在于有恶变及正常逆转的双向可能性. 目前, 由慢性胃炎→胃黏膜萎缩→肠上皮化生→异型增生→胃癌的发展模式已被业内广泛认同. 由于并非所有的PLGC都能发展成胃癌, 有的可能在其过程中停止, 甚至逆转或消失, 所以积极有效地治疗PLGC将成为胃癌治疗及预防的一个突破口, 这与中医未病先防、既病防变的"治未病"思想不谋而合.
越来越多的研究表明PLGC的发生发展与细胞黏附能力的丧失及错配修复基因的功能缺陷有着密切的关系. 正常细胞黏附力的丧失是人类癌症发展过程中的一个重要现象, 他可以让癌症细胞向周围浸润或者离开最初产生的地方, 到达其他部位, 如淋巴结、肝、肺等处. CD44[10]是一种与细胞附着力相关的细胞黏附分子, 由10个组成型外显子和10个变异型外显子组成. 含不同变异体外显子编码序列的CD44称为CD44拼接变异体, 即CD44V. 与正常上皮组织相比, 人类肿瘤组织普遍存在CD44V的表达紊乱, 尤其是CD44V6, 该基因的活化或过度表达可加速胃黏膜癌变并使癌细胞获得侵袭性的能力[11]. 人类的DNA错配修复系统(mismatch repair, MMR)是人体细胞中修复DNA碱基错配的安全保障体系, 他不仅能特异性识别和修复DNA复制过程中出现的碱基错配, 增强DNA复制忠实性、维持基因组稳定性和降低自发性突变, 还能通过诱导DNA损伤细胞的凋亡来预防癌变的发生. 当错配修复基因发生突变或缺失导致错配修复功能降低时, DNA复制时出现的错配得不到及时纠正, 使基因组中的突变增多[12], 细胞发生恶变的危险性随之升高[13,14]. 目前发现的人类MMR系统包含有9个错配修复基因, 其中具有hMLH1和/或hMSH2突变或缺失的人群更易患胃肠道恶性肿瘤[15,16]. hMLH1基因是1994年Bronner等[17]在研究遗传性非息肉性结直肠癌的过程中发现的, 位于人类染色体的3p21-23, 编码一种由756个氨基酸残基组成的蛋白质. hMSH2是第一个被分离的人类错配修复基因, 该基因位于人类第2号染色体2p21-22[18]. 其编码的909个氨基酸残基的蛋白质是正常基因编码损伤DNA修复必需的蛋白质. 从MMR基因与肿瘤发生的关系来看, 多数研究认为[19-21]在胃癌发生早期即存在hMLH1和hMSH2表达的下调或缺失, 是胃癌发生发展过程中的早期分子事件, 并且在胃癌发展过程中持续作用. 本研究显示, 模型组大鼠胃黏膜CD44V6蛋白表达较正常组相比有明显升高(P<0.01), MLH1、MSH2蛋白表达较正常组相比均有所下降(P<0.01). 说明大鼠在胃癌前病变阶段存在CD44V6的表达上调及MLH1、MSH2的表达下调, 这可能是MNNG等诱发大鼠胃癌前病变的重要原因之一.
中医无PLGC病名, 根据其临床表现, 可把本病列入"胃脘痛"、"痞满"、"嘈杂"等范畴. 禀赋不足, 后天失调, 或饥饱失常, 劳倦过度, 久病正虚等, 均能引起脾气虚弱, 运化失职, 失于和降, 中土不荣, 导致PLGC发生. 《脾胃论》谓: "脾胃不足, 皆为血病. 气虚不足以推血, 则血必有瘀. "江苏省中医院叶柏教授认为本病的病机主要是脾胃虚弱、气阴不足、胃络瘀阻, 治疗本病关键在于健运脾胃、益气养阴、疏肝理气、活血化瘀. 健脾活血方便由此法而立. 该方用药轻灵, 益气不伤阴, 化瘀不伤正, 行而不峻, 化而兼养. 本研究显示健脾活血方各组能不同程度地降低CD44V6的表达, 提高MLH1、MSH2的表达, 以高剂量为优. 提示健脾活血方可能通过降低CD44V6的表达, 提高MLH1、MSH2的表达, 增强细胞的黏附能力, 减少细胞的非正常侵袭和转移, 同时增强基因的错配修复功能, 减少基因的突变, 抑制细胞的异常增殖和分化, 诱导病态细胞尽早凋亡, 达到治疗或逆转PLGC的作用.
随着分子生物学技术的发展, 人们对癌细胞研究侧重点发生了改变, 由对癌细胞自身变化特性的研究, 转移到对癌细胞如何产生方面的研究, 即癌前病变的研究, 这是现代学者研究癌症的一大特色.
牛英才, 研究员, 齐齐哈尔医学院医药科学研究所
PLGC的一直是消化科和肿瘤科的研究热点. 临床研究表明, 中医药对PLGC有一定逆转作用, 但PLGC阶段存在哪些基因调控异常和中医药通过哪些途径来治疗PLGC尚有待进一步深入研究.
蒋时红等选取临床上治疗PLGC的3种常用的中医治法, 针对诱导细胞凋亡方面进行比较研究, 发现在临症运用益气健脾法、养阴荣络法治疗本病时, 可根据病情加用活血化瘀类中药, 在诱导细胞凋亡方面具有一定的优势, 有可能获得更好的疗效.
本次通过动物实验对健脾活血方进行分子机制的研究, 为健脾活血方治疗PLGC提供了有力的理论依据, 发展了中医药理论, 同时可以指导临床用药, 让中医药理论来源于临床, 回归于临床.
实验设计合理, 本文从细胞黏附分子和错配修复基因的角度探讨了健脾活血方对大鼠PLGC模型的作用机制, 对于进一步揭示中医药治疗PLGC的效果及分子机制做出了有益的探索, 具有一定的临床指导意义与科学探索价值.
编辑 郭鹏 电编 鲁亚静
| 1. | Gutierrez-Gonzalez L, Graham TA, Rodriguez-Justo M, Leedham SJ, Novelli MR, Gay LJ, Ventayol-Garcia T, Green A, Mitchell I, Stoker DL. The clonal origins of dysplasia from intestinal metaplasia in the human stomach. Gastroenterology. 2011;140:1251-1260. e1-e6. [PubMed] [DOI] |
| 6. | Zahary MN, Kaur G, Abu Hassan MR, Singh H, Naik VR, Ankathil R. Germline mutation analysis of MLH1 and MSH2 in Malaysian Lynch syndrome patients. World J Gastroenterol. 2012;18:814-820. [PubMed] [DOI] |
| 7. | Kaur G, Masoud A, Raihan N, Radzi M, Khamizar W, Kam LS. Mismatch repair genes expression defects & amp; association with clinicopathological characteristics in colorectal carcinoma. Indian J Med Res. 2011;134:186-192. [PubMed] |
| 12. | Ling XL, Fang DC, Wang RQ, Yang SM, Fang L. Mitochondrial microsatellite instability in gastric cancer and its precancerous lesions. World J Gastroenterol. 2004;10:800-803. [PubMed] |
| 13. | Stoffel E, Mukherjee B, Raymond VM, Tayob N, Kastrinos F, Sparr J, Wang F, Bandipalliam P, Syngal S, Gruber SB. Calculation of risk of colorectal and endometrial cancer among patients with Lynch syndrome. Gastroenterology. 2009;137:1621-1627. [PubMed] [DOI] |
| 14. | Corso G, Velho S, Paredes J, Pedrazzani C, Martins D, Milanezi F, Pascale V, Vindigni C, Pinheiro H, Leite M. Oncogenic mutations in gastric cancer with microsatellite instability. Eur J Cancer. 2011;47:443-451. [PubMed] [DOI] |
| 15. | Goecke T, Schulmann K, Engel C, Holinski-Feder E, Pagenstecher C, Schackert HK, Kloor M, Kunstmann E, Vogelsang H, Keller G. Genotype-phenotype comparison of German MLH1 and MSH2 mutation carriers clinically affected with Lynch syndrome: a report by the German HNPCC Consortium. J Clin Oncol. 2006;24:4285-4292. [PubMed] [DOI] |
| 17. | Bronner CE, Baker SM, Morrison PT, Warren G, Smith LG, Lescoe MK, Kane M, Earabino C, Lipford J, Lindblom A. Mutation in the DNA mismatch repair gene homologue hMLH1 is associated with hereditary non-polyposis colon cancer. Nature. 1994;368:258-261. [PubMed] [DOI] |
| 19. | Yao Y, Tao H, Kim JJ, Burkhead B, Carloni E, Gasbarrini A, Sepulveda AR. Alterations of DNA mismatch repair proteins and microsatellite instability levels in gastric cancer cell lines. Lab Invest. 2004;84:915-922. [PubMed] [DOI] |
| 21. | Takeda Y, Yashima K, Hayashi A, Sasaki S, Kawaguchi K, Harada K, Murawaki Y, Ito H. Expression of AID, P53, and Mlh1 proteins in endoscopically resected differentiated-type early gastric cancer. World J Gastrointest Oncol. 2012;4:131-137. [PubMed] [DOI] |