修回日期: 2013-11-05
接受日期: 2013-11-19
在线出版日期: 2014-01-08
目的: 检测过表达Fas相关蛋白1(Fas-associated factor 1, FAF1)对胃癌细胞HGC-27增殖及凋亡的影响, 探讨FAF1与胃癌发生发展的相关性.
方法: 实验分为阴性对照组(未转染组)、空载转染组(感染空载体慢病毒颗粒1.0×108 TU/mL)、过表达FAF1组(感染FAF1过表达慢病毒颗粒1.0×108 TU/mL). 激光共聚焦显微镜观察转染效率, Western blot检测FAF1蛋白的表达情况, 透射电镜观察细胞超微结构变化, 流式细胞仪检测细胞周期分布及凋亡情况, MTT检测细胞生长情况.
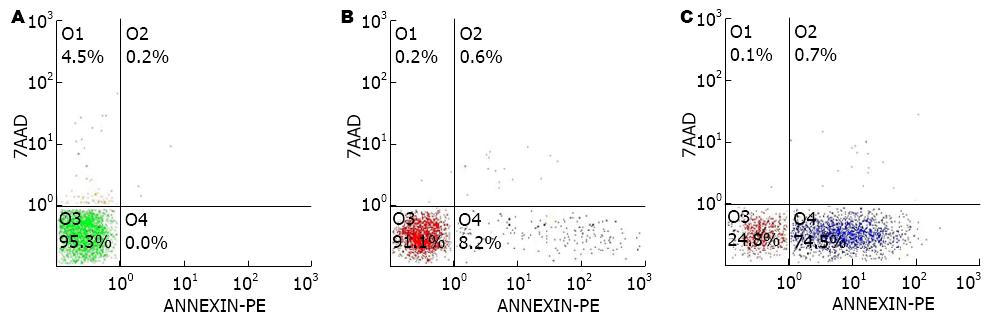
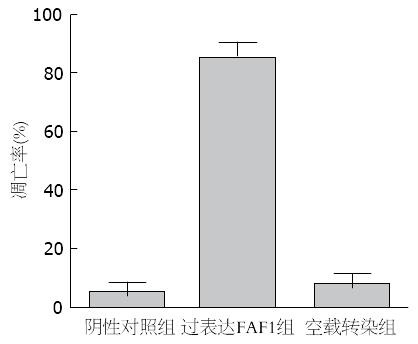
结果: 依据GFP绿色荧光可测定细胞转染效率达95%以上; 与阴性对照组和空载转染组相比, 过表达FAF1组FAF1蛋白明显高表达; 阴性对照组和空载转染组均细胞膜完整, 细胞核正常, 两者超微结构无明显差异, 而过表达FAF1组胞核裂解成碎片状, 可见凋亡小体形成; FAF1过表达能够抑制人胃癌细胞HGC-27的增殖, 诱导细胞凋亡, 改变细胞周期的分布, 与阴性对照组和空载转染组相比, 过表达FAF1组细胞的倍增时间显著延长, 细胞凋亡率显著提高(84.66%±5.92% vs 4.60%±3.80%和7.32%±3.82%, P<0.05), G0/G1期细胞显著降低(46.43%±2.43% vs 54.93%±3.5%和54%±0.3%, P<0.05), G2/M期细胞显著增多(29.78%±3.91% vs 19.33%±3.82%和20.93%±2.46%, P<0.05), 差异均有统计学意义.
结论: 构建的过表达FAF1慢病毒可以抑制胃癌细胞的生长, 改变细胞周期的分布, 促进胃癌细胞的凋亡.
核心提示: Fas相关蛋白1(Fas-associated factor 1, FAF1)是新近发现的凋亡相关蛋白, 在胃癌中特异性低表达. 本课题组前期从组织学研究表明FAF1与胃癌的分化及生存预后具有重要的关系, 但在细胞水平的作用尚不清楚, 我们用慢病毒介导FAF1基因过表达转染人胃癌细胞HGC-27后, 发现其能够改变胃癌细胞的周期分布, 明显的促进细胞的凋亡及抑制细胞的增殖.
引文著录: 袁燕玲, 刘爱群, 冯洁, 陈佳玮, 葛莲英. 过表达FAF1对胃癌细胞HGC-27增殖及凋亡的影响. 世界华人消化杂志 2014; 22(1): 17-23
Revised: November 5, 2013
Accepted: November 19, 2013
Published online: January 8, 2014
AIM: To investigate the influence of the overexpression of Fas-associated factor 1 (FAF1) on cell proliferation and apoptosis in human gastric cancer cell line HGC-27 to explore the relationship between FAF1 and gastric cancer.
METHODS: HGC-27 cells were divided into three groups: a negative control group, an empty vector transfection group (those transfected with empty vector particles 1.0 × 108 TU/mL), and a FAF1 overexpression group (those transfected with recombinant FAF1 lentiviral particles 1.0 × 108 TU/mL). Transfection efficiency was detected by laser scanning confocal microscopy. Protein expression level of FAF1 was detected by Western blot. Changes of cell ultrastructure were detected by transmission electron microscopy. Cell cycle distribution and apoptosis were observed by flow cytometry. Cell proliferation was detected by MTT assay.
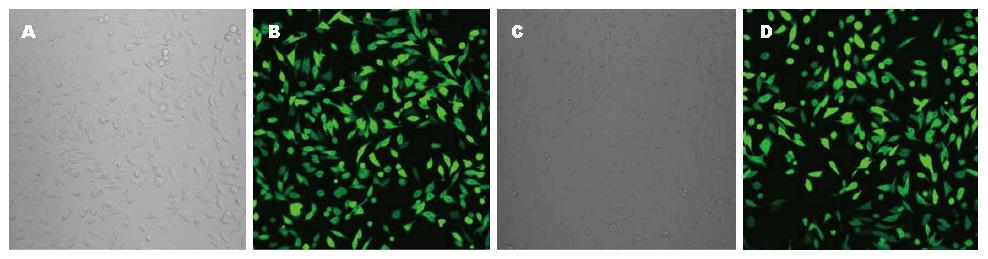
RESULTS: The transfection efficiency was greater than 95% according to the green fluorescence. The expression of FAF1 protein was significantly higher in the FAF1 overexpression group than in the two control groups. The cell ultrastructure was normal in the two control groups; however, in the FAF1 overexpression group, cell nuclei split into pieces and apoptotic bodies and vacuoles formed. Overexpression of FAF1 inhibited HGC-27 cell growth, induced cell apoptosis, and changed the cell cycle progression. Compared to the negative control group and empty vector transfection group, cell doubling time was significantly extended, cell apoptosis was significantly increased (84.66% ± 5.92% vs 4.60% ± 3.80%, 7.32% ± 3.82%, both P < 0.05), the percentage of cells in G0/G1 phase was significantly decreased (46.43% ± 2.43% vs 54.93% ± 3.5%, 54% ± 0.3%, both P < 0.05), and the percentage of cells in G2/M phase was significantly increased (29.78% ± 3.91% vs 19.33% ± 3.82%, 20.93% ± 2.46%, both P < 0.05) in the FAF1 overexpression group.
CONCLUSION: FAF1 overexpression could inhibit cell growth, induce cell apoptosis, and change cell cycle progression.
- Citation: Yuan YL, Liu AQ, Feng J, Chen JW, Ge LY. Effects of FAF1 overexpression on proliferation and apoptosis of gastric carcinoma HGC-27 cells. Shijie Huaren Xiaohua Zazhi 2014; 22(1): 17-23
- URL: https://www.wjgnet.com/1009-3079/full/v22/i1/17.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i1.17
胃癌是人类第4大恶性肿瘤, 其死亡率居世界第2位[1]. 其中50%的胃癌发生在东南亚国家尤其是中国、韩国、日本[2]. 2008年我国有35.2万例死于胃癌[3]. 研究胃癌发生发展的分子机制, 对指导其预防和治疗十分重要. Fas相关蛋白1(Fas-associated factor 1, FAF1)是Fas死亡信号结合体(Fas-associated death domain protein, FADD)的成员之一[4], 能够增强Fas介导的细胞凋亡[5], 并且在胃癌组织中特异性低表达[6], 有可能是胃癌发生发展中的一个抑癌基因[7]. 本课题组前期从组织学研究表明FAF1 mRNA在胃癌组织中的表达水平明显低于正常组织, FAF1蛋白的阳性表达率随着肿瘤分化程度的降低, 浸润深度的增加, 伴有淋巴结转移和远处转移及TNM分期晚者明显减少, 说明FAF1与胃癌细胞的分化及生存预后具有重要的关系, 他可能作为一个抑癌基因参与胃癌的发生发展过程[8,9]. 目前的研究尚未见FAF1在胃癌细胞水平调控的报告, 本研究通过观察过表达FAF1后胃癌细胞增殖、凋亡的变化, 进一步在细胞水平上探讨FAF1与胃癌发生发展的关系.
HGC-27购自中南大学湘雅中心实验室, 胎牛血清、RPMI 1640完全培养基为Hyclone公司产品, BCA蛋白检测试剂盒购自碧云天公司, FAF1抗体购自Abnova公司, 小鼠抗人β-actin抗体购自CST公司, 细胞周期检测试剂盒购自南京凯基生物科技发展有限公司, 凋亡试剂盒购自eBioscienc公司, 四甲基偶氮唑蓝(MTT)购自Amresco公司, FAF1过表达慢病毒颗粒和空载体慢病毒颗粒由上海吉凯基因化学技术有限公司负责设计、合成.
1.2.1 细胞培养及慢病毒颗粒转染: HGC-27细胞常规培养于含10%胎牛血清的RPMI 1640完全培养基中, 在37 ℃、5%CO2培养箱中常规培养.取对数生长期HGC-27细胞按2000/孔接种于96孔板中, 用无抗生素的含10%胎牛血清的RPMI 1640完全培养基培养24 h后细胞融合度约30%, 然后按照慢病毒使用说明书进行转染, 慢病毒颗粒用量为10 μL/孔, 转染后12 h将培养液更换为含2.5 μg/mL Polybrene的10%胎牛血清的RPMI 1640完全培养基继续培养, 96 h后倒置显微镜下可见细胞出现绿色荧光, 扩大培养进行后续试验.
1.2.2 激光共聚焦检测细胞转染效率: 取对数生长期细胞, 制成单细胞悬液, 铺于35 mm2培养皿, 培养24 h后激光共聚焦显微镜观察细胞绿色荧光蛋白表达情况, 计算转染效率.
1.2.3 Western blot检测FAF1蛋白的表达: RIPA细胞裂解液抽提各组细胞总蛋白, BCA法定量. 作SDS-PAGE电泳, 分离胶浓度为10%, 电压100 V, 电泳90 min. 用电转仪将产物转移到PVDF膜上, 分别加入FAF1抗体(1:1000)及单克隆抗体β-actin(1:1000), 4 ℃孵育过夜, TBST充分洗膜后相应二抗(1:2000)室温孵育1 h, TBST洗膜后ECL化学发光检测蛋白质印迹, 将暗夹夹紧压片, 显影、定影、水冲洗胶片晾干后保存.
1.2.4 透射电镜观察细胞超微结构改变: 取对数生长期细胞, 用4 ℃预冷的PBS洗涤细胞2次后用2.5%戊二醛4 ℃固定过夜, 次日将固定的细胞团块送入电镜室制作成细胞切片, 在透射电镜下观察细胞超微结构.
1.2.5 流式细胞术测细胞周期: 收集对数生长期细胞, 用磷酸盐缓冲液洗涤细胞2次, 70%冰乙醇固定, 4 ℃过夜. 离心洗涤后, 加入100 μL RNase A 37 ℃水浴30 min, 再加入400 μL PI染色混匀, 4 ℃避光30 min. 流式细胞仪检测细胞周期分布, 记录激发波长488处红色荧光.
1.2.6 流式细胞仪检测细胞的凋亡: 取对数生长期细胞, 用不含EDTA的胰酶消化, 离心清洗3次后制成单细胞悬液, 取1×106个细胞, 采用Annexin V/7-ADD法检测细胞凋亡.
1.2.7 MTT法检测细胞增殖活性: 将细胞以2×103/孔密度接种于96孔培养板, 每组8孔, 于37 ℃、5%CO2培养箱培养箱培养. 到达观测时段时, 每孔加入5 mg/mL MTT 20 μL, 继续孵育4 h后, 弃上清液, 加DMSO 150 μL, 振荡10 min, 用酶标仪在492 nm波长下检测每孔的吸光度(A)值, 记录结果, 绘制生长曲线, 并且依据公式TD = t×lg2/lg(Nt/N0)(Nt为t时间的细胞数, N0为初种细胞数)[10]计算细胞倍增时间.
统计学处理 采用SPSS16.0软件进行统计分析. 计量资料用mean±SD表示, 各组均数与标准差比较用独立样本t检验, P<0.05为差异有统计学意义.
根据镜下带绿色荧光的细胞数占细胞总数百分比, 计算转染效率均达到95%以上, 说明转染成功, 可进行后续试验(图1).
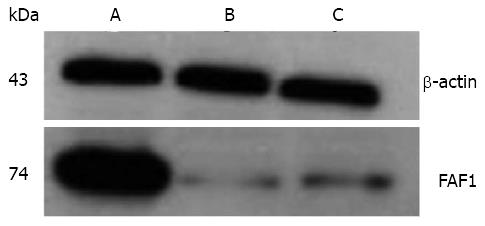
在各组内参β-actin蛋白表达水平一致的同时, 过表达FAF1组FAF1蛋白表达量明显高于阴性对照组与空载体组, 而阴性对照组与空载体组之间FAF1蛋白表达无明显差异. 由此说明, 经慢病毒颗粒感染后, 细胞FAF1蛋白明显的过表达, 并且空载慢病毒对蛋白表达基本不影响(图2).
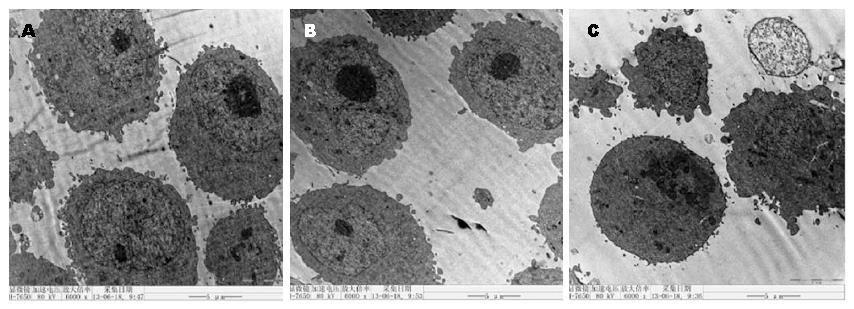
与两对照组相比, 实验组细胞体积变小, 细胞质固缩, 胞质电子致密度增高, 胞核裂解成碎片状, 沿核膜排列, 并且产生了数量不等, 体积不同的凋亡小体, 两对照组超微结构无明显差异, 细胞膜完整, 细胞核正常(图3).
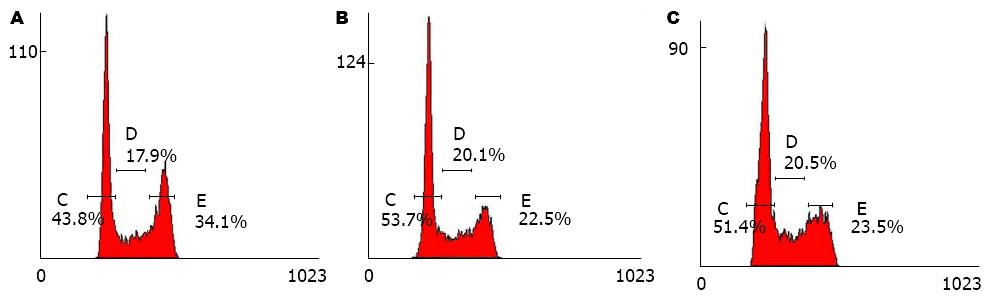
流式细胞仪检测阴性对照组、空载转染组及过表达FAF1组细胞周期发现(图4), 各组G0/G1期比例分别为54.93%±3.5%、54%±0.3%、46.43%±2.43%, G2/M期比例分别为19.33%±3.82%、20.93%±2.46%、29.78%±3.91%. 经统计学分析, 过表达FAF1组G0/G1期比例较其余两组下降(P<0.05), G2/M期比例较其余两组升高(P<0.05), 而阴性对照组与空载转染组相比差异无显著性, 说明FAF1过表达后可阻滞胃癌细胞于G2/M期.
过表达FAF1组细胞凋亡率明显高于阴性对照组与空载转染组(P<0.05), 空载体转染与阴性对照组无明显差异(图5, 图6), 提示过表达FAF1能够促进细胞的凋亡.
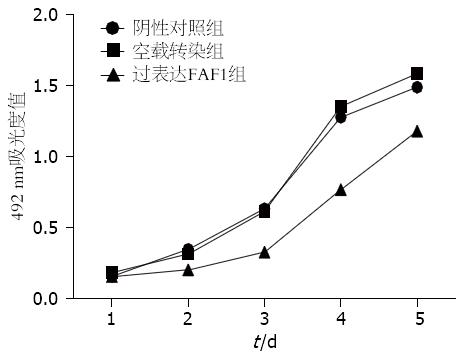
根据细胞培养5 d测得的吸光度值绘制生长曲线如图7所示, 与阴性对照组和空载转染组相比; 过表达FAF1组生长速度较慢, 从第2天开始, 每天的活细胞数目均少于另外两组(P<0.05), 阴性对照组、空载转染组, 过表达FAF1组细胞倍增时间分别为26.64、23.52、45.12 h, 表明FAF1表达升高后, 细胞倍增时间明显延长, 从而细胞生长速度减慢.
慢病毒载体是一种复制缺陷型逆转录病毒载体, 对分裂细胞和非分裂细胞均具有感染能力, 能够将肿瘤治疗基因安全高效地整合到人体内, 使治疗基因长期、稳定、高效地表达, 而不易诱发宿主免疫反应, 是目前进行转基因和RNAi研究最好的工具之一[11].
细胞增殖和凋亡的异常在胃癌的发病中起重要作用, 已有大量相关研究的报道[12,13]. 并且有研究表明, 细胞的增殖, 分化、衰老和凋亡均是细胞周期依赖性的, 抑制肿瘤细胞周期蛋白的表达[14]. 可以说细胞周期调节紊乱是恶性肿瘤细胞凋亡和增殖异常的重要原因, 细胞周期的调控实际上就是对细胞周期调控点G0/G1期、S期和G2/M期的调控, 是以细胞周期蛋白的合成和降解为主的多因素参与过程[15]. FAF1已经被证实在几种癌症中表达缺失或下调, 在胃癌组织中的低表达尤为明显, 其功能的缺失可以为某些肿瘤提供生存信号[6,16]. 目前研究表明, FAF1可以促进细胞的凋亡, 其机制可能为: (1)作为Fas死亡信号结合体的成员之一, 增强Fas介导的细胞凋亡[5,17]; (2)FAF1氨基酸序列1到201为FAS死亡结构域绑定区域, 181到381为类DED(death effect domains)区域, 其作为Fas死亡诱导信号复合物的组成部分与FADD和Caspase8的DED相互作用,通过活化Caspase8后, 随后出现Caspase家族的连锁反应(如Caspase3的活化), 从而分解DNA促进细胞凋亡[4]; (3)FAF是细胞凋亡抑制剂CK2的调节亚单位之一, 当受到DNA损伤时, FAF1与CK2全酶在细胞内形成复合物, 抑制CK2从而诱导细胞的凋亡[18]; (4)FAF1的过表达会促进核浓缩, 在缺乏外源信号的情况下, 可以直接启动细胞凋亡[19].
本研究中, 我们成功用慢病毒颗粒感染HGC-27细胞, 空载体组FAF1蛋白表达无明显改变, FAF1过表达组FAF1蛋白明显高表达, 说明HGC-27过表达FAF1成功. 结果表明, 过表达FAF1后, 胃癌细胞在形态学上呈现凋亡改变, 凋亡率也明显的增加, 进一步证实了FAF1促凋亡的作用, 并且发现在没有FasL结合的情况下, FAF1过表达也能引起较为强烈的细胞凋亡, 这可能与其过表达后活化Caspase8从而引起Caspase家族的级联反应有关[20]. MTT结果显示过表达FAF1后, 细胞倍增时间延长, 细胞增殖周期延长, 生长速度减慢, 说明FAF1能够抑制细胞的生长; FAF1过表达后, 细胞周期的分布也发生改变, G0/G1期细胞比例明显下降, G2/M期细胞比例明显增加, 提示FAF1基因可使细胞周期重新分布, 产生G2/M期阻滞. NF-κB是C-myc启动子的重要调节因子, 他的激活有刺激细胞增殖的作用[21], 并且在多种肿瘤中活性是增强的[22,23]. 有研究表明NF-κB活化后可以调节胃癌细胞产生一些促进细胞增殖的因子如粒细胞集落刺激因子等[24], 而FAF1能够抑制Iκκ复合物的激活和NF-κB P65亚基异位入核, 从而抑制NF-κB活性[25], 我们猜想其能够抑制肿瘤细胞的增殖可能与此作用有关. G2/M期是细胞周期的两个检查点之一, 是细胞增殖的重要阶段, G2/M期阻滞也是损伤DNA的修复期, DNA损伤在染色体分离前得不到修复, 则退出增殖周期进入凋亡途径. 因此, 我们猜测FAF1产生G2/M期阻滞, 抑制细胞增殖, 可能与其促凋亡作用有关[26]. 当然, FAF1参与G2/M期阻滞并与凋亡是否产生耦联及其机制, 还需要进一步的研究.
Fas/FasL信号途径是细胞凋亡的核心途径之一[27]. 而胃癌中FasL的表达是上调的, 并且通过杀死Fas敏感的抗肿瘤免疫效应细胞来实现免疫逃逸, 同时抑制Fas介导的细胞凋亡[28,29]. Ohno等[30]的研究表明胃癌中自发性凋亡可作为独立的预后因素, 而Fas表达阳性者较表达阴性者预后佳. FAF1作为Fas死亡信号结合体成员之一, 能够通过多种途径促进细胞的凋亡, 并且能够抑制细胞的增殖, 深入研究其机制极有为胃癌的药物靶向治疗提供新的方向.
总之, 本研究通过慢病毒载体感染胃癌细胞成功过表达FAF1后, 验证了FAF1对胃癌细胞具有促凋亡作用, 并且创新性的发现FAF1能够抑制细胞的生长, 改变细胞周期的分布, 但其具体机制尚不明确. 我们将会在未来的研究中进一步探讨其可能的作用机制.
感谢冯艳、沈筱芸等在实验过程中给予的帮助, 谢谢!
胃癌是人类第4大恶性肿瘤, 其死亡率居世界第2位, Fas相关蛋白1(Fas-associated factor 1, FAF1)能够增强Fas介导的细胞凋亡, 并且在胃癌组织中特异性低表达. FAF1 mRNA在癌组织中的表达水平明显低于正常组织, 并与肿瘤的分化程度、有无远处转移等临床病程特征有着明显的关联,说明FAF1与胃癌细胞的分化及生存预后具有重要的关系, 他可能作为一个抑癌基因参与胃癌的发生发展过程.
潘阳林, 副教授, 副主任医师, 中国人民解放军第四军医大学西京医院消化病医院消化六科
目前的研究尚未见Fas相关蛋白1(Fas-associated factor 1, FAF1)在细胞水平调控的报告,本研究通过观察过表达FAF1后胃癌细胞增殖,凋亡的变化,进一步在细胞水平上探讨FAF1与胃癌发生发展的关系.
FAF1已经被证实在几种癌症中表达缺失或下调, 在胃癌组织中的低表达尤为明显, 其功能的缺失可以为某些肿瘤提供生存信号.
通过慢病毒载体感染胃癌细胞成功过表达Fas相关蛋白1(Fas-associated factor 1, FAF1)后, 验证了FAF1对胃癌细胞具有促凋亡作用, 并且创新性的发现FAF1能够抑制细胞的生长, 改变细胞周期的分布, 但其具体机制尚不明确. 我们将会在未来的研究中进一步探讨其可能的作用机制.
用慢病毒颗粒感染HGC-27细胞, 空载体组Fas相关蛋白1(Fas-associated factor 1, FAF1)表达无明显改变, FAF1过表达组FAF1蛋白明显高表达, 说明HGC-27过表达FAF1成功, 同时也证明慢病毒作为基因研究的载体具有低毒、高效的优势.
本文探讨了FAF1转染胃癌细胞系后发生的表型变化, 发现FAF1可显著抑制细胞增殖、促进凋亡, 对胃癌的恶性生物表型的机制研究有一定借鉴意义.
编辑: 田滢 电编:鲁亚静
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] |
| 2. | Ferlay J, Shin HR, Bray F, Forman D, Mathers C, Parkin DM. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer. 2010;127:2893-2917. [PubMed] [DOI] |
| 4. | Ryu SW, Lee SJ, Park MY, Jun JI, Jung YK, Kim E. Fas-associated factor 1, FAF1, is a member of Fas death-inducing signaling complex. J Biol Chem. 2003;278:24003-24010. [PubMed] [DOI] |
| 5. | Chu K, Niu X, Williams LT. A Fas-associated protein factor, FAF1, potentiates Fas-mediated apoptosis. Proc Natl Acad Sci U S A. 1995;92:11894-11898. [PubMed] |
| 6. | Bjørling-Poulsen M, Seitz G, Guerra B, Issinger OG. The pro-apoptotic FAS-associated factor 1 is specifically reduced in human gastric carcinomas. Int J Oncol. 2003;23:1015-1023. [PubMed] |
| 7. | Menges CW, Altomare DA, Testa JR. FAS-associated factor 1 (FAF1): diverse functions and implications for oncogenesis. Cell Cycle. 2009;8:2528-2534. [PubMed] [DOI] |
| 8. | 刘 爱群, 葛 莲英, 罗 小玲, 罗 元, 林 思彤. FAF1 mRNA在胃癌组织中的表达及其与幽门螺杆菌感染的相关性. 世界华人消化杂志. 2010;18:2422-2426. [DOI] |
| 9. | 刘 爱群, 葛 莲英, 邵 红, 罗 元, 林 思彤. Fas相关因子1和Survivin在胃癌中的表达及其与患者预后的关系. 中华临床医师杂志(电子版). 2011;21:18. |
| 11. | Cockrell AS, Kafri T. Gene delivery by lentivirus vectors. Mol Biotechnol. 2007;36:184-204. [PubMed] |
| 12. | Konturek PC, Kania J, Konturek JW, Nikiforuk A, Konturek SJ, Hahn EG. H. pylori infection, atrophic gastritis, cytokines, gastrin, COX-2, PPAR gamma and impaired apoptosis in gastric carcinogenesis. Med Sci Monit. 2003;9:SR53-SR66. [PubMed] |
| 13. | Shiotani A, Iishi H, Ishiguro S, Tatsuta M, Nakae Y, Merchant JL. Epithelial cell turnover in relation to ongoing damage of the gastric mucosa in patients with early gastric cancer: increase of cell proliferation in paramalignant lesions. J Gastroenterol. 2005;40:337-344. [PubMed] [DOI] |
| 14. | Yu Q, Geng Y, Sicinski P. Specific protection against breast cancers by cyclin D1 ablation. Nature. 2001;411:1017-1021. [PubMed] [DOI] |
| 15. | Obaya AJ, Sedivy JM. Regulation of cyclin-Cdk activity in mammalian cells. Cell Mol Life Sci. 2002;59:126-142. [PubMed] |
| 16. | MacDonald BT, Tamai K, He X. Wnt/beta-catenin signaling: components, mechanisms, and diseases. Dev Cell. 2009;17:9-26. [PubMed] [DOI] |
| 17. | Kim HJ, Song EJ, Lee YS, Kim E, Lee KJ. Human Fas-associated factor 1 interacts with heat shock protein 70 and negatively regulates chaperone activity. J Biol Chem. 2005;280:8125-8133. [PubMed] [DOI] |
| 18. | Park MY, Ryu SW, Kim KD, Lim JS, Lee ZW, Kim E. Fas-associated factor-1 mediates chemotherapeutic-induced apoptosis via death effector filament formation. Int J Cancer. 2005;115:412-418. [PubMed] [DOI] |
| 19. | Fraser AG, Kamath RS, Zipperlen P, Martinez-Campos M, Sohrmann M, Ahringer J. Functional genomic analysis of C. elegans chromosome I by systematic RNA interference. Nature. 2000;408:325-330. [PubMed] [DOI] |
| 22. | Dolcet X, Llobet D, Pallares J, Matias-Guiu X. NF-kB in development and progression of human cancer. Virchows Arch. 2005;446:475-482. [PubMed] [DOI] |
| 23. | Shin SR, Sánchez-Velar N, Sherr DH, Sonenshein GE. 7,12-dimethylbenz(a)anthracene treatment of a c-rel mouse mammary tumor cell line induces epithelial to mesenchymal transition via activation of nuclear factor-kappaB. Cancer Res. 2006;66:2570-2575. [PubMed] [DOI] |
| 25. | Park MY, Jang HD, Lee SY, Lee KJ, Kim E. Fas-associated factor-1 inhibits nuclear factor-kappaB (NF-kappaB) activity by interfering with nuclear translocation of the RelA (p65) subunit of NF-kappaB. J Biol Chem. 2004;279:2544-2549. [PubMed] [DOI] |
| 26. | 赵 卫红, 寿 好长. G2-M期阻滞与肿瘤. 国外医学: 肿瘤学分册. 1999;26:76-78. |
| 28. | Bennett MW, O'connell J, O'sullivan GC, Roche D, Brady C, Kelly J, Collins JK, Shanahan F. Expression of Fas ligand by human gastric adenocarcinomas: a potential mechanism of immune escape in stomach cancer. Gut. 1999;44:156-162. [PubMed] [DOI] |
| 29. | Osaki M, Kase S, Kodani I, Watanabe M, Adachi H, Ito H. Expression of Fas and Fas ligand in human gastric adenomas and intestinal-type carcinomas: correlation with proliferation and apoptosis. Gastric Cancer. 2001;4:198-205. [PubMed] |
| 30. | Ohno S, Tachibana M, Shibakita M, Dhar DK, Yoshimura H, Kinugasa S, Kubota H, Masunaga R, Nagasue N. Prognostic significance of Fas and Fas ligand system-associated apoptosis in gastric cancer. Ann Surg Oncol. 2000;7:750-757. [PubMed] |