修回日期: 2013-11-04
接受日期: 2013-11-11
在线出版日期: 2014-01-08
目的: 探讨干细胞相关蛋白PIWI样蛋白1(PIWI-like protein-1, PIWIL1)在肝细胞癌组织中的表达及临床意义, 并探索其表达与患者预后的关系.
方法: 应用免疫组织化学检测47例肝细胞癌标本中PIWIL1的表达, 免疫印迹(Western blot)法检测31例肝细胞癌组织中PIWIL1的表达, 分析PIWIL1表达与临床特征及预后的关系.
结果: PIWIL1在肝癌组织中高表达, 在正常肝组织中低表达, PIWIL1同肿瘤分化程度、有无临近组织侵犯有关, 与肿瘤大小及甲胎蛋白(α-fetoprotein, AFP)水平无关; 其阳性表达预示患者预后较差.
结论: PIWIL1的高表达同病理分化程度、临近组织侵犯相关及患者预后相关.
核心提示: PIWI样蛋白1(PIWI-like protein-1, PIWIL1)在肝癌组织中高表达, 在正常肝组织中低表达, PIWIL1同肿瘤分化程度、有无临近组织侵犯有关, 与肿瘤大小及甲胎蛋白(α-fetoprotein)水平无关; 其阳性表达预示患者预后较差.
引文著录: 范正军, 杨飞龙, 孙涛, 程波. PIWIL1在肝细胞癌中的表达及临床意义. 世界华人消化杂志 2014; 22(1): 119-124
Revised: November 4, 2013
Accepted: November 11, 2013
Published online: January 8, 2014
AIM: To discuss the clinical significance of positive expression of PIWI-like protein-1 (PIWIL1) in hepatocellular carcinoma (HCC).
METHODS: Immunohistochemistry was used to detect the expression of PIWIL1 in 47 cases of HCC and matched tumor-adjacent hepatic tissues. Western blot was used to detect the expression of PIWIL1 in 31 fresh HCC tissues and matched tumor-adjacent hepatic tissues. The relationship between PIWIL1 positive expression and clinical features or prognosis of HCC patients was analyzed.
RESULTS: The positive rate of PIWIL1 expression was significantly higher in HCC than in normal liver tissue (P < 0.05). PIWIL1 expression was positively correlated with the invasion to the adjacent tissue and the histological differentiation (both P < 0.05). PIWIL1 positive cases had a poor prognosis.
CONCLUSION: The high expression of PIWIL1 is related to pathological differentiation and the invasion to the adjacent tissue, as well as to the prognosis of HCC patients.
- Citation: Fan ZJ, Yang FL, Sun T, Cheng B. Clinical significance of expression of PIWIL1 protein in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2014; 22(1): 119-124
- URL: https://www.wjgnet.com/1009-3079/full/v22/i1/119.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i1.119
肝细胞癌(hepatocellular carcinoma, HCC)是人类消化系中最常见的恶性肿瘤之一, 具有发病率高、治疗效果欠佳、病死率高等特点, 多数患者发现时已处于中晚期, 丧失了最佳的治疗时机. 目前, 我国每年因肝细胞癌死亡的人数在恶性肿瘤所致死亡中仅次于肺癌居第2位[1]. 肝细胞癌恶性程度高、病情进展迅速、容易早期转移等是造成预后差的主要原因, 目前对肝癌的治疗主要是以手术治疗为主, 辅以介入化疗栓塞、消融治疗、免疫治疗等的综合治疗, 但效果仍不理想.
PIWI样蛋白1(PIWI-like protein-1, PIWIL1), 又称人肿瘤睾丸抗原(HIWI), 是人体中PIWI的同源物[2], 为Argonaute蛋白家族成员, 在人体组织中广泛表达, 包括前列腺、卵巢、脑、肝脏、心脏、肾脏和骨骼肌等[3]. 在人的干细胞自我更新、RNA干扰中发挥至关重要的作用, 并影响癌细胞增殖[4]. 已有证据表明PIWIL1的表达水平与肿瘤的分期密切相关, 并对患者的预后具有提示意义[5]. PIWIL1基因可以作为肝脏肿瘤治疗的潜在靶点. 本课题主要是检测PIWIL1在肝细胞癌中的表达情况, 并初步探讨其表达同临床特征及预后的关系.
47例石蜡包埋肝细胞癌及癌旁组织标本取自郑州大学第一附属医院病理科2011-12/2013-01肝细胞癌患者行术后病理检查标本, 12例石蜡包埋正常肝组织标本取自郑州大学第一附属医院病理科2012-11/2013-04肝血管瘤患者行术后病理检查标本, 31例肝癌新鲜标本取自郑州大学第一附属医院肝胆外科2012-11/2013-04手术切除的肝癌患者, 12例正常肝组织新鲜标本取自郑州大学第一附属医院肝胆外科2012-11/2013-04手术切除的肝血管瘤患者; 全部患者术前均未接受其他治疗方法并有完整随访资料; 其中石蜡标本男性患者37例, 女性患者10例, 平均年龄52.32岁±8.57岁, 新鲜组织标本男性24例, 女性7例, 平均年龄51.64岁±10.66岁, 所有标本术后病理诊断均为肝细胞肝癌, 正常肝组织12例(取自肝血管瘤患者), 其中男性9例, 女性3例, 平均年龄46.87岁±11.76岁. 兔抗人PIWIL1抗体购自Abcam公司, 二抗试剂盒、DAB显色试剂盒、蛋白提取试剂盒、蛋白提取缓冲液、Western blot检测试剂盒均购自武汉博士德生物工程有限公司, 蛋白Marker、兔抗人多抗β-actin、PVDF膜、ECL化学发光试剂、考马斯亮蓝染液购自美国Sigma公司.
1.2.1 免疫组织化学染色法(SABC法): 标本固定、包埋、切片后65 ℃烤30 min, 依次脱蜡水化, 加3%的双氧水10 min后蒸馏水洗片3次, 枸橼酸盐缓冲液中水浴修复抗原后PBS洗2次, 5%BSA室温下孵育20 min, 加一抗后4 ℃冰箱中过夜; PBS洗3次后加二抗37 ℃孵育25 min, PBS洗3次后加SABC 37 ℃孵育25 min, PBS洗4次, DAB染色、苏木素液复染、脱水、封片、光镜观察.
1.2.2 Western blot检测法: 取冻存组织标100 mg于2 mL EP管中, 剪碎组织块后加400 μL裂解液(含PMSF)匀浆, 裂解充分后将裂解液移至1.5 mL EP管内, 4 ℃下12000 r/min离心5 min, 提取上清分装于0.5 mL EP管内, -20 ℃保存; Bradtbrd法蛋白定量; 配置5%浓缩胶和10%分离胶, 沸水中蛋白变性10 min, 加样、恒压120 V电泳后80 V恒压转膜; 转膜后用5%的脱脂奶粉室温封闭; 加入一抗后4 ℃过夜; TBST液清洗3次后加1:2000稀释的二抗, 室温孵育2 h后TBST清洗3次; ECL后移至暗室曝光、显影清洗、定影.
1.2.3 结果判定: 免疫组织化学采用Greenspan半定量法对细胞染色强度及阳性细胞百分率进行评分, 细胞基本不着色(淡黄色)为1分, 中等着色(棕黄色)为2分, 强着色(棕褐色)为3分, 着色细胞占计数细胞百分比率为0者, 记0分, <10%为1分, 10%-50%为2分, >50%为3分, 将每张切片着色程度得分与着色细胞百分率得分相乘, 既得阳性系数. 阳性系数为0分者为阴性(-), 1-3分为弱阳性(+), 大于等于4分者为阳性(++); Western blot检测以内参及检测指标得出相对集中的条带为阳性.
1.2.4 生存分析: 根据对所有患者2011-12/2013-06随访结果进行生存时间或无瘤时间的分析, 得出不同PIWIL1表达患者的生存时间或者无瘤时间的差异和生存曲线. 随访采用电话随访或者复查方式进行.
统计学处理 SPSS17.0进行统计学分析, 有序分类计数资料之间的比较以秩和检验, 无序多分类计数资料之间的比较以χ2检验或Fisher确切概率法, 相关性分析采用Spearman相关分析, 生存分析采用Kaplan-Meier(K-M)法Log-rank检验, P<0.05为差异有统计学意义.
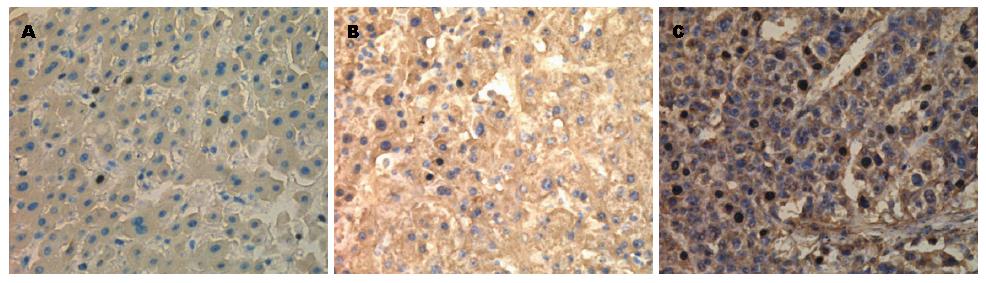
免疫组织化学染色显示, 在47例HCC组织及癌旁组织、12例正常肝组织中, 均检测到有PIWIL1表达, PIWIL1在胞核胞质均有表达(图1), 其中PIWIL1在3种组织中阳性率分别为93.6%、80.9%、41.7%(表1).
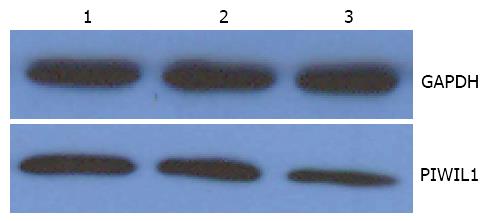
Western blot检测31例癌及癌旁组织和12例正常肝组织示显示PIWIL1在HCC组织同癌旁组织差别具有统计学意义(P<0.05, 表2); 在癌旁组织同正常肝组织差别无统计学意义(P>0.05, 表2); PIWIL1在正常肝组织、癌旁组织、HCC组织中的表达水平呈逐渐增高趋势(图2).
从PIWIL1的表达与临床特征关系的研究中可以看出: PIWIL1在HCC、癌旁组织及正常肝组织中的阳性表达与患者的年龄、性别、甲胎蛋白(α-fetoprotein, AFP)水平、肝炎的有无、肿瘤的大小均无相关性(P>0.05), 而与周围组织侵犯、肿瘤分化程有关(P<0.05)(表3).
| 类别 | n | PIWIL1 | P值 | ||
| ++ | + | - | |||
| 年龄(岁) | >0.05 | ||||
| 21-40 | 3 | 1 | 1 | 1 | |
| 41-80 | 44 | 25 | 14 | 5 | |
| 性别 | >0.05 | ||||
| 男 | 37 | 21 | 12 | 4 | |
| 女 | 10 | 5 | 3 | 2 | |
| 分化程度 | <0.05 | ||||
| 高分化 | 15 | 3 | 6 | 6 | |
| 中低分化 | 32 | 23 | 9 | 0 | |
| AFP(ng/mL) | >0.05 | ||||
| <400 | 25 | 13 | 9 | 3 | |
| ≥400 | 22 | 13 | 6 | 3 | |
| 肝炎 | >0.05 | ||||
| 有 | 41 | 23 | 12 | 6 | |
| 无 | 6 | 3 | 3 | 0 | |
| 组织侵犯 | <0.05 | ||||
| 有 | 9 | 8 | 1 | 0 | |
| 无 | 38 | 18 | 14 | 6 | |
| 肿块大小D(cm) | >0.05 | ||||
| D≤2 | 9 | 6 | 2 | 1 | |
| 2<D≤5 | 28 | 14 | 10 | 4 | |
| 5<D≤10 | 8 | 5 | 3 | 0 | |
| D>10 | 2 | 1 | 0 | 1 | |
应用统计软件SPSS17.0做统计分析可以看出, 免疫组织化学及Western blot两种方式检测PIWIL1在三种组织中表达的阳性率差异无统计学意义(P>0.05)(表4), 两种检测方法的结果一致.
| 组织类别 | PIWIL1 | P值 | |
| Westernblot(+) | 免疫组织化学(+) | ||
| 肝细胞癌 | 22(71.0) | 44(93.6) | >0.05 |
| 癌旁组织 | 17(54.8) | 38(80.9) | |
| 正常肝组织 | 3(25.0) | 5(41.7) | |
肝细胞癌具有恶性程度高、病情进展迅速、容易早期转移等特点, 尽管临床上采取多种治疗方式对其加以控制, 但疗效欠佳. 越来越多的证据表明: 肿瘤的发生同体细胞基因组在致癌因素刺激下引起癌基因的激活和抑癌基因的失活继而引起细胞增殖失控、凋亡受阻, 分化异常密切相关[6]. 其中对癌基因的表达调控机制及基因干扰研究目前已成为恶性肿瘤研究中的热点[7], 对于肝癌的研究而言, 今后也有望在此领域取得突破. PIWIL1为新发现的恶性肿瘤相关蛋白, 从属于Argonaute蛋白家族PIWI亚家族, 是小RNA复合体基本成员之一, 生物序列高度保守, 基因定位为12q24.33, 此区域也是TGCT(青年和成年人睾丸生殖细胞癌)发生相关的基因区, PIWIL1基因编码一个3.6 kb的mRNA, 并表达为一个全长含有861个氨基酸残基的蛋白PIWIL1[8].
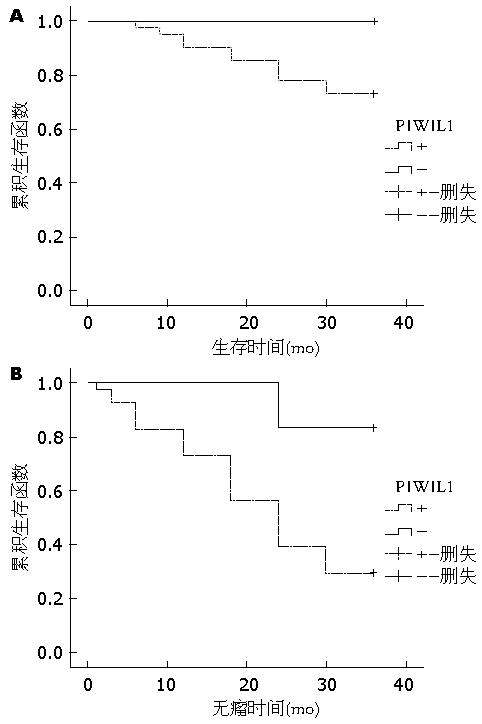
PIWIL1在人体组织中广泛表达, 包括前列腺、卵巢、脑、肝脏、心脏、肾脏和骨骼肌等[9], 在人的干细胞自我更新、RNA 干扰中发挥至关重要的作用, 并影响癌细胞增殖[10], 本实验亦证实PIWIL1在HCC组织、癌旁肝组织、正常肝组织均有表达, 并且在不同组织中表达存在差异性, 免疫组织化学及Western blot均证实PIWIL1在HCC组织中表达程度高于癌旁肝组织, 而免疫组织化学证实PIWIL1在癌旁组织表达高于正常肝组织, Western blot检测未见二者存在明显差别, 可能与Western blot的检测敏感性及样本量有关, 因此可以认为PIWIL1同肝细胞癌的发生发展存在明显的相关性, 对PIWIL1的深入研究可能揭示肝细胞癌的发生及进展过程. 目前已有证据表明PIWIL1 mRNA的表达水平与肿瘤细胞的侵袭能力相关, 从而影响患者的预后[11]. Taubert等[12]发现PIWIL1在软组织肉瘤中高表达提示患者的预后不良, 并认为此种关系可能也会出现于其他恶性肿瘤中; Grochola等[13]发现PIWIL1在胰腺导管腺癌(pancreas ductal adenocarcinoma, PDAC)中表达水平与男性患者的生存期成负相关, PIWIL1在PDAC的发生机制及治疗的研究中可以作为一个潜在的靶点, 本实验通过一定数量的随访研究证实PIWIL1阳性及阴性患者的生存时间不存在明显的差异性, 而二者的无瘤生存时间存在明显的差异, 可见PIWIL1的阳性表达对患者术后的复发转移倾向具有提示意义, 本实验得出不同表达患者生存时间无明显差异可能由于患者术后随访时间较短, 因此可以将PIWIL1在肝细胞癌组织中的表达与否作为提示患者预后的一个参考因素; 何炜等认为PIWIL1在食管癌组织中的高表达同组织分型、临床分期及预后密切相关[14], 本实验也表明PIWIL1的阳性表达同组织的分化程度及周围组织侵犯的有无存在明显的相关性, PIWIL1阳性表达者分化程度较低且具有周围组织侵犯的倾向; Liu等[15]发现在胃癌细胞中PIWIL1与细胞增殖标志物Ki67具有相似的表达形式, 并且通过对PIWIL1的RNA干扰发现AGS胃癌细胞停滞于G2/M期, 表明PIWIL1在胃癌的发展中起重要的作用, PIWIL1可能作为癌症生物治疗的新靶点; 因此也可能通过对肝细胞癌中PIWIL1表达的控制进而控制肝细胞癌的发生和发展, 但本研究暂未对PIWIL1在肝细胞癌中的作用机制深入研究, 若要证实PIWIL1在肝细胞癌治疗中的作用尚需进一步研究; 本实验通过免疫组织化学和Western blot及临床数据表明PIWIL1同肝细胞癌的发生发展有关, 其表达情况同肝癌患者的预后相关, 因此, 也可以将PIWIL1检测作为肝细胞癌诊断的新靶点, 并通过其表达情况预测患者生存时间. 本课题初步探索PIWIL1在肝细胞癌中的表达情况及同预后的关系, 由于样本量较小, 随访时间较短, 若要明确在肝癌发生中的确切机制及对预后的预测, 仍需进一步大样本深入研究.
我国每年因肝细胞癌死亡的人数在恶性肿瘤所致死亡中居第2位. 目前对肝细胞癌(hepatocellular carcinoma, HCC)癌基因的表达调控机制及基因干扰研究目前已成为热点. PIWI样蛋白1(PIWI-like protein-1, PIWIL1)为一候选癌基因, 在人类的许多肿瘤中表达, 而在HCC中的研究, 国内外文献报道尚少.
李孟森, 教授, 海南医学院/海南省肿瘤发生和干预重点实验室
人肿瘤睾丸抗原(HIWI)是人体中PIWI的同源物, 为Argonaute蛋白家族成员, 在人体组织中广泛表达已有证据表明PIWIL1 mRNA 的表达水平与肿瘤细胞的侵袭能力相关, PIWIL1基因可以作为肝脏肿瘤治疗的潜在靶点. 本课题主要是检测PIWIL1在肝细胞癌中的表达情况, 并初步探讨其表达同临床特征及预后的关系.
目前已经有研究证实PIWIL1同胰腺癌、胃癌、食管癌等密切相关, 而对于其在肝癌中的研究尚少.
把PIWIL1和肝癌患者的预后结合起来, 对临床肝癌患者的治疗有一定的参考价值.
通过多种方法检测PIWIL1在肝细胞癌中的表达, 可能提高肿瘤的检出率, 对临床肝癌患者的预后推断也有一定的参考价值.
本文研究设计合理, 分析具体, 内容有较好的创新性, 能把PIWIL1和肝癌患者的预后结合起来, 对临床肝癌患者的治疗有一定的参考价值.
编辑: 田滢 电编:鲁亚静
| 3. | 田 瑞卿, 刘 民, 李 欣, 汤 华. PIWIL1在不同肿瘤细胞中的差异性表达. 中国生物化学与分子生物学报. 2008;11:1072-1075. |
| 4. | 姜 琳, 潘 淑娟, 葛 郁芝, 殷 勤伟. Argonaute亚族蛋白对人类肿瘤细胞周期的影响. 生物化学与生物物理进展. 2008;12:1394-1402. |
| 5. | Zeng Y, Qu LK, Meng L, Liu CY, Dong B, Xing XF, Wu J, Shou CC. HIWI expression profile in cancer cells and its prognostic value for patients with colorectal cancer. Chin Med J (Engl). 2011;124:2144-2149. [PubMed] |
| 7. | 郑 素平. RNA干扰在肿瘤治疗方面的研究进展. 中山大学研究生学刊(自然科学·医学版). 2011;2:1-8. |
| 8. | Qiao D, Zeeman AM, Deng W, Looijenga LH, Lin H. Molecular characterization of hiwi, a human member of the piwi gene family whose overexpression is correlated to seminomas. Oncogene. 2002;21:3988-3999. [PubMed] [DOI] |
| 9. | 田 瑞卿, 刘 民, 李 欣, 汤 华. PIWIL1在不同肿瘤细胞中的差异性表达. 中国生物化学与分子生物学报. 2008;11:1072-1075. |
| 10. | Lee JH, Schütte D, Wulf G, Füzesi L, Radzun HJ, Schweyer S, Engel W, Nayernia K. Stem-cell protein Piwil2 is widely expressed in tumors and inhibits apoptosis through activation of Stat3/Bcl-XL pathway. Hum Mol Genet. 2006;15:201-211. [PubMed] [DOI] |
| 11. | Cox DN, Chao A, Baker J, Chang L, Qiao D, Lin H. A novel class of evolutionarily conserved genes defined by piwi are essential for stem cell self-renewal. Genes Dev. 1998;12:3715-3727. [PubMed] |
| 12. | Taubert H, Würl P, Greither T, Kappler M, Bache M, Bartel F, Kehlen A, Lautenschläger C, Harris LC, Kaushal D. Stem cell-associated genes are extremely poor prognostic factors for soft-tissue sarcoma patients. Oncogene. 2007;26:7170-7174. [PubMed] [DOI] |
| 13. | Grochola LF, Greither T, Taubert H, Möller P, Knippschild U, Udelnow A, Henne-Bruns D, Würl P. The stem cell-associated Hiwi gene in human adenocarcinoma of the pancreas: expression and risk of tumour-related death. Br J Cancer. 2008;99:1083-1088. [PubMed] [DOI] |
| 15. | Liu X, Sun Y, Guo J, Ma H, Li J, Dong B, Jin G, Zhang J, Wu J, Meng L. Expression of hiwi gene in human gastric cancer was associated with proliferation of cancer cells. Int J Cancer. 2006;118:1922-1929. [PubMed] [DOI] |