修回日期: 2013-10-29
接受日期: 2013-11-19
在线出版日期: 2014-01-08
目的: 从代谢组学的角度探讨慢性乙型肝炎湿热中阻证的分子机制.
方法: 采用超高性能液相色谱与质谱(UPLC-Q-TOP/MS)联用技术并结合正交偏最小二乘方-判别分析(OPLS-DA)进行对比分析慢性乙型肝炎湿热中阻证与正常对照组血浆代谢物水平.
结果: 慢性乙型肝炎湿热中阻证组与正常对照组有明显的代谢图谱分离; 慢性乙型肝炎湿热中阻证组比较正常对照组有14种代谢产物主成分差异, 其中牛磺鹅脱氧胆酸、胆烷酸、甘氨鹅脱氧胆酸-3-葡萄糖醛酸、胆酸葡萄糖醛酸、甘氨鹅脱氧胆酸-3-葡萄糖醛酸等主要与胆汁酸代谢密切相关; 溶血磷脂酰胆碱(C18:3)、溶血磷脂酰胆碱(C18:2)、溶血磷脂酰乙醇胺(C22:1)、二羟基雄甾烯酮硫酸、磷脂酰胆碱、磷脂酰乙醇胺(C24:1)、13'-羟基-α-生育酚等主要与脂类代谢密切相关.
结论: 慢性乙型肝炎湿热中阻证患者与健康者存在代谢产物主成分差异, 这些代谢产物主成分差异可能是慢性乙型肝炎湿热中阻证的潜在分子标志物.
核心提示: 本研究发现慢性乙型肝炎(chronic hepatitis B)湿热中阻证患者升高的溶血磷脂成分如溶血磷脂酰胆碱(C18:3; C18:2)、溶血磷脂酰乙醇胺(C22:1)等以及升高的疏水性胆汁酸成分如牛磺鹅脱氧胆酸、胆烷酸、甘氨鹅脱氧胆酸-3-葡萄糖醛酸等均对肝脏有明显的损伤作用.
引文著录: 刘友平, 李波, 张光海, 米绍平, 李洪, 魏嵋. 慢性乙型肝炎湿热中阻证的血浆代谢组学. 世界华人消化杂志 2014; 22(1): 107-113
Revised: October 29, 2013
Accepted: November 19, 2013
Published online: January 8, 2014
AIM: To investigate the molecular mechanisms of damp-heat stasis in the middle-jiao syndrome in patients with chronic hepatitis B.
METHODS: Plasma samples were collected prospectively from normal controls (n = 20) and patients with chronic hepatitis B and damp-heat stasis in the middle-jiao syndrome (DHSS) (TM1 group: n = 20) and analyzed using ultraperformance liquid chromatography (LC)/time-of-flight mass spectrometry (MS) coupled with orthogonal partial least squares-discriminant analysis (OPLS-DA).
RESULTS: Significant metabonomic differences were observed between the two groups. Plasma levels of 14 metabolites in the TM1 group were obviously altered compared with those in the control group (P < 0.05), among which taurochenodesoxycholic acid, 7b-hydroxy-3-oxo-5b-cholanoic acid, glycochenodeoxycholic acid 3-glucuronide, glycochenodeoxycholate-3-sulfate and cholic acid glucuronide are related to the metabolism of bile acids, lysophosphatidylcholine (lysoPC), lysophosphatidylethanolamine (LysoPE) (C22:1), 3b,16a-dihydroxyandrostenone sulfate, phosphatidylcholine (PC) (C22:6), phosphatidylethanolamine (PE) (C24:1), lysophosphatidylcholine (lysoPC) (C18:2) and 13'-hydroxy-alpha-tocopherol are related to the metabolism of lipids.
CONCLUSION: There are significant metabonomic differences between normal controls and patients with chronic hepatitis B and DHSS, and these metabolites may be used as potential biological markers for DHSS in patients with chronic hepatitis B.
- Citation: Liu YP, Li B, Zhang GH, Mi SP, Li H, Wei M. Metabonomic analysis of plasma samples from chronic hepatitis B patients with damp-heat stasis in the middle-jiao syndrome. Shijie Huaren Xiaohua Zazhi 2014; 22(1): 107-113
- URL: https://www.wjgnet.com/1009-3079/full/v22/i1/107.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i1.107
目前世界上有超过4亿例乙型肝炎病毒(hepatitis B virus, HBV)感染者(大约占世界人口的5%)[1], 并且, HBV感染容易发展成为慢性乙型肝炎(chronic hepatitis B, CHB)、肝硬化和肝细胞癌[2], 因此慢性乙型肝炎的防治是一个全球性公共卫生问题, 已引起世界各国的关注. 近年来, 祖国传统医学在治疗CHB上显示出独特的优势. 中医的核心思想是"辨证论治", 其中, 辨证是论治的前提, 但长期以来中医对"证"的判断主观性较强, 缺乏规范化的客观性标准. 近年来国内外不少学者采用多种方法对中医"证"的内涵进行了研究, 但单层次、单系统的研究所发现的证侯的微观指标, 很难全面揭示"证"的科学内涵[3]. 近年来, 随着系统生物学的逐步深入, 组学已成为目前中医药研究中最活跃的领域之一. 组学所具备的整体性、复杂性、时空性和动态性等特点与中医理论中注重整体研究, 强调功能联系的观点是相通的[4]. 如代谢组学, 是对机体代谢终端产物进行综合性多元化分析, 他抛开了体内纷繁复杂的网络式代谢过程和生物分子相互作用过程, 从整体上展示生物体复杂的内在变化状态[5]. 因此, 代谢组学是最接近生物表型和最能有效反映细胞个体或群体功能的表征技术[6]. 本研究选取慢性乙型肝炎湿热中阻证患者为研究对象, 引入代谢组学方法, 以超高效液相色谱仪与四极杆飞行时间串联质谱仪联用技术(UHPLC-Q-TOF/MS)为平台, 研究慢性乙型肝炎湿热中阻证患者与正常对照组血浆代谢表型的变化, 从分子水平上进一步探讨慢性乙型肝炎湿热中阻证的分子机制. 为慢性乙型肝炎湿热中阻证型的物质基础研究提供现代科学依据.
研究对象均来自2011-02/2012-01泸州医学院附属中医医院门诊及体检中心, 年龄18-68岁, 男女不限. 研究对象的选取由医院道德委员会批准, 且所有研究对象均填写了知情同意书. 实验分两组: 正常对照组(Ctrl)(体检为无乙型肝炎感染史健康人)、慢性乙型肝炎湿热中阻证组(TM1), 每组20例, 组间在性别、年龄、并发症及临床阶段均无显著性差异(P>0.05). CHB湿热中阻证患者的收集由两名接受过严格培训的副高以上中医师辨证收集. 慢性乙型肝炎诊断标准: 参照2000年中华医学会肝病分会、传染病与寄生虫病学分会修订的《病毒性肝炎防治方案》. 临床符合慢CHB, 并有一种以上HBV-感染标志阳性. CHB中医辨证分型标准按照国家中医药管理局《中医病证诊断疗效标准》制定1991-12中华医学会内科肝病专业委员会天津会议讨论制定的《病毒性肝炎中医辨证标准(试行)》进行病例纳入标准: (1)符合慢性乙型肝炎诊断标准; (2)符合慢性乙型肝炎湿热中阻证: 主证-身目发黄, 色泽鲜明, 苔黄腻; 次证-恶心、厌油, 纳呆; 肋胀脘闷. 病例排除标准: (1)合并其他病毒感染者; (2)年龄<18岁或>68岁者; (3)孕妇及其他药瘾者; (4)急性肝炎、肝硬化、肝癌及其并发症患者; (5)不符合中医辨证分型标准者; (6)合并其他严重心脑血管、肺、肾和造血系统疾病者. 美国Waters Acquity UPLC超高效液相色谱仪, 美国Waters Q-TOF Premier质谱仪购自美国Waters公司. LC/MS级乙腈购自J. T. Baker公司(USA); HPLC级甲醇购自Merck公司(Darmstadt, Germany); 甲酸购自Fluka公司(Buchs, Switzerland), 亮氨酸-脑啡肽(leucine-enkephalin, LE)标准品购自Sigma公司(USA). 谷丙转氨酶(alanine transaminase, ALT)、天冬氨酸转氨酶(aspartate transaminase, AST)、球蛋白(globulin , GLO)、总胆红素(total bilirubin, TBIL), 直接胆红素(direct bilirubin, DBIL)检测试剂盒购自上海荣盛生物制剂厂. 其他试剂均为市售分析纯.
1.2.1 样品收集及处理: 实验对象不做任何治疗, 记录体检肝功、B超、HBV DNA等检查结果, 并抽取所有实验对象空腹外周血EDTA抗凝, 3000 r/min离心10 min后收集血浆100 μL置于200 μL Eppendorf管中, 置-80 ℃冰箱保存. 所有血浆进行代谢组学分析前, 先在室温下解冻, 震荡1 min. 向100 μL样本中加入400 μL色谱级甲醇:乙腈 = 1:1, 漩涡震荡2 min后于4 ℃放置10 min, 4 ℃离心(15000 g)15 min, 取上清液400 μL, 4 ℃离心(15000 g)10 min, 取200 μL上清液进行LC-MS全谱检测.
1.2.2 UHPLC-MS分析: (1)液相色谱条件: 色谱分离的仪器分析平台为Acquity Ultra Performance LC Q-TOF premie(Waters), 分离色谱柱为Waters ASQUITY UPLC C18色谱柱(100 mm × 2.1 mm, 1.7 μm)及UPLC C18保护柱(2.1 mm× 5 mm). 色谱分离条件为: 柱温为40℃; 流速0.4 mL/min; 流动相组成A: 水+0.1%甲酸, B: 乙腈+0.1%甲酸; 进样量为5 μL, 自动进样器温度4 ℃; (2)质谱条件: 质谱分析分别采用ESI正离子和负离子两种模式进行检测; 以氮气作为雾化、锥孔气; 飞行管检测模式V型. 电喷雾正电离(electrospray Ionization, 简记为ESI+)模式条件为: 毛细管电压(capillary voltage)3 kV、锥孔电压(sampling cone)35 kV、离子源温度(source temperature)100 ℃; 脱溶剂气温度(desolvation temperature)300 ℃、反向锥孔气流(cone gas flow)50 L/h、脱溶剂气流量(desolvation gas flow)600 L/h、萃取锥孔(extraction cone)4 V. 负离子模式(ESI-)条件为: 毛细管电压(capillary voltage)3 kV、锥孔电压50 kV、离子源温度100 ℃; 脱溶剂气温度350 ℃、反向锥孔气流50 L/h、脱溶剂气流量700 L/h、萃取锥孔4 V. 为确保质量的准确性和重复性, 应用亮氨酸-脑啡肽作为锁定质量, 正离子模式下产生[M+H]+离子556.2771 Da, 负离子模式下产生[M-H]-离子554.2615 Da; (3)实验数据分析: 将UPLCQ-TOF-MS获得的原始质谱数据导入MarkerLynx软件包(waters, USA), 进行峰识别、峰对齐和基线矫正等预处理, 最后输出三维矩阵, 即由精确质核比与保留时间组成的变量、样品名称和峰强度/面积. 将处理后的数据矩阵导入Simca-P软件(版本11.5)分别进行主成分分析(PCA)及正交偏最小二乘方判别分析(OPLS-DA). 对正常对照组和慢性乙型肝炎湿热中阻证组进行模式识别, 并寻找组间较大差异性代谢物, 并对这些物质进行初步鉴定.
统计学处理 所有数据的统计分析在Excel及SPSS11.0软件上进行, 组间比较采用t检验. P<0.05为差异有统计学意义.
与正常组比较, 慢性乙型肝炎湿热中阻证组血浆中ALT、AST、GLO、TBIL、DBIL、HBV DNA水平均升高(P<0.05), 总蛋白(total protein, TP)轻度降低(P<0.05)(表1).
| 正常组 | 慢性乙型肝炎湿热中阻证组 | |
| 总蛋白(g/L) | 65.12±3.95 | 54.14±2.74 |
| 球蛋白(g/L) | 23.58±2.21 | 31.82±2.55 |
| 谷丙转氨酶(U/L) | 29.52±7.02 | 282.62±112.89 |
| 天冬氨酸转氨酶(U/L) | 32.38±4.87 | 850.25±140.01 |
| 总胆红素(μmol/L) | 14.13±2.33 | 67.14±2.735 |
| 直接胆红素(μmol/L) | 8.93±1.36 | 43.92±3.86 |
| HBVDNA(cps/mL) | <1000 | 3.6×106±6520.24 |
对所有质控样本(quality control, QC)的总离子流色谱图(TIC)进行检查, 重现性良好, 未发现含有异常总离子流色谱图(TIC)的样本(图1). 由于QC样本均匀分散在整个实验过程中, 说明系统稳定性良好, 数据可靠性良好, 可以满足代谢组学研究的要求.
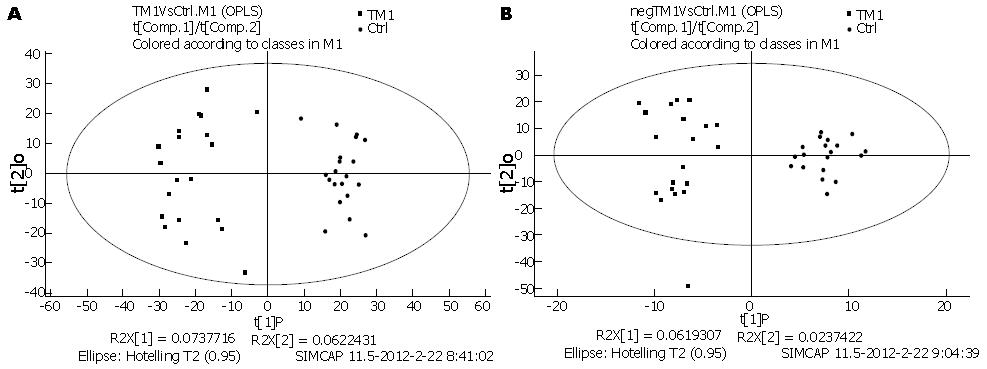
2.3.1 正交偏最小二乘方-判别分析(OPLS-DA): 采用有监督的多维统计分析方法-正交偏最小二乘方-判别分析(orthogonal partial least squares-discriminant analysis, OPLS-DA)对两组样本之间的差异进行模型分析. 采用(pareto scaling)标度化, 首先对全部数据进行OPLS-DA建模, 然后采用正交信号校正技术(orthogonal signal correction, OSC)滤掉与类别判断正交不相关的变量信息, 保留与类别判断有关的变量, 再进行偏最小二乘方-判别分析(partial least squares discrimination analysis, PLS-DA)分析, 发现各组之间在OPLS-DA得分图上具有很好的代谢谱分离, 表明两组样本之间具有显著的代谢差异(图2).
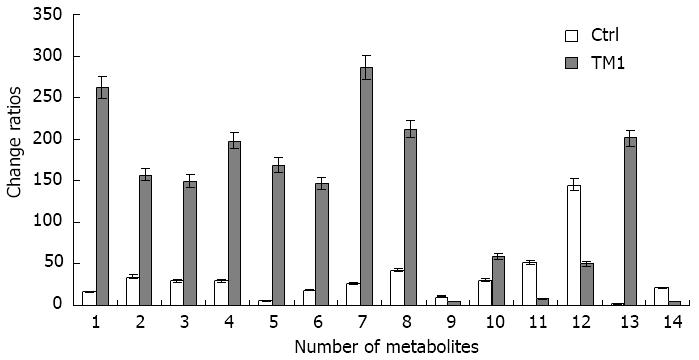
2.3.2 差异性代谢物的鉴定: 采用OPLS-DA模型第一主成分的VIP(variable importance in the projection)值[阈值>2(负离子)或阈值>3(正离子)], 并结合学生氏t检验的P值(阈值<0.05)来寻找差异性表达代谢物, 并将P<0.05的化合物进行二级质谱定性. 差异性代谢物的定性方法为: 根据精确分子量搜索Met lin和HMDB数据库, 搜索质量阈值设定为25 ppm. 最终分析发现: CHB湿热中阻证观察组与正常对照组比较共14种代谢物发生显著性量的改变(P<0.05)(表2, 图3); 其中有4种代谢物相对对照组是降低的(图3), 其余均升高.
| 编号 | 代谢物 | 离子模式 | 分子量 | P值(TM1VsCtrl) | 变化比率(Ctrl/TM1) | 相关代谢途径/功能 |
| 1 | 牛磺鹅脱氧胆酸 | ESI- | 498.285 | 0.0015 | 17/262 | 胆汁酸代谢 |
| 2 | 溶血磷脂酰胆碱 | ESI- | 516.294 | 0.0001 | 35/157 | 脂类代谢 |
| 3 | 胆烷酸 | ESI- | 401.305 | 0.0001 | 30/150 | 胆汁酸代谢 |
| 4 | 甘氨鹅脱氧胆酸-3-葡萄糖醛酸 | ESI- | 624.338 | 0.0013 | 30/198 | 胆汁酸代谢 |
| 5 | 甘氨鹅脱氧胆盐-3-硫酸盐 | ESI- | 564.227 | 0.0015 | 6/169 | 胆汁酸代谢 |
| 6 | 2,6-二氨基-4-羟基-5-N-甲基甲酰嘧啶 | ESI- | 548.228 | 0.0001 | 19/147 | 核苷酸代谢 |
| 7 | 溶血磷脂酰乙醇胺 | ESI- | 556.331 | 0.0005 | 27/286 | 脂类代谢 |
| 8 | 二羟基雄甾烯酮硫酸 | ESI- | 383.152 | 0.0012 | 43/212 | 脂类代谢 |
| 9 | α-蒎烯氧化物 | ESI- | 151.112 | 0.0009 | 11/5 | 细胞信号转导/膜的稳定性 |
| 10 | 13'-羟基-α-生育酚 | ESI- | 445.331 | 0.0014 | 31/59 | 脂类代谢 |
| 11 | 胆酸葡萄糖醛酸 | ESI- | 583.312 | 0.0004 | 52/9 | 胆汁酸代谢 |
| 12 | 磷脂酰胆碱 | ESI+ | 852.563 | 0.0001 | 145/50 | 脂类代谢 |
| 13 | 磷脂酰乙醇胺 | ESI+ | 822.569 | 0.0021 | 2/201 | 脂类代谢 |
| 14 | 溶血磷脂酰胆碱 | ESI+ | 520.339 | 0.0026 | 22/5 | 脂类代谢 |
本研究以UHPLC-Q-TOF/MS为平台, 对CHB湿热中阻证患者及正常对照组进行血浆代谢谱对比分析发现: 两组间具有很好的代谢谱分离, 表明两组样本之间具有显著的代谢差异, 所以采用此方法进行慢性乙型肝炎湿热中阻证机制的研究是可行的. 进一步对两组数据进行分析发现, 慢性乙型肝炎湿热中阻证组较正常对照组共有14个代谢物发生显著性量的变化(P<0.05), 其中仅α-蒎烯氧化物、溶血磷脂酰胆碱(C18:2)、胆酸葡萄糖醛酸、磷脂酰胆碱(C22:6)4种代谢物与对照组比较为显著性下降外, 其余都为显著性上升. 其中牛磺鹅脱氧胆酸、胆烷酸、甘氨鹅脱氧胆酸-3-葡萄糖醛酸、胆酸葡萄糖醛酸、甘氨鹅脱氧胆酸-3-葡萄糖醛酸等主要与胆汁酸代谢密切相关; 溶血磷脂酰胆碱(C18:3)、溶血磷脂酰胆碱(C18:2)、溶血磷脂酰乙醇胺(C22:1)、二羟基雄甾烯酮硫酸、磷脂酰胆碱、磷脂酰乙醇胺(C24:1) 、13'-羟基-α-生育酚等主要与脂类代谢密切相关. 相关研究表明: CHB患者普遍都存在脂类代谢紊乱及胆汁酸代谢紊乱[7]. 可见, 慢性乙型肝炎湿热中阻证患者也不例外.
有研究报道, 表达乙型肝炎病毒的肝细胞可产生与内质网相关的、包括溶血磷脂在内的内源性抗原脂质, 这些内源性抗原脂质是由乙型肝炎病毒诱导分泌的磷脂酶产生的, 可诱导自然杀伤T细胞(natural killer T cell, NKT)的激活[8], 从而导致内质网内脂质环境的失衡ER[9]. 本研究发现, CHB湿热中阻证患者中溶血磷脂酰胆碱(C18:3; C18:2)、 溶血磷脂酰乙醇胺(C22:1)、磷脂酰胆碱(C22:6)、磷脂酰乙醇胺(C24:1)、13'-羟基-α-生育酚等与脂质代谢相关的代谢成分发生了明显的代谢紊乱,其中溶血磷脂酰胆碱(C18:2)和磷脂酰胆碱(C22:6)为明显降低成分外, 其余为升高成分, 而溶血磷脂是各种甘油磷脂经水解脱去一个脂酰基后的产物, 是一类具有较强表面活性的物质, 对血管内皮细胞有直接毒害作用作用, 能使红细胞及其他细胞膜破裂, 引起溶血或细胞坏死[10-12]. 可见, 以上升高的溶血磷脂成分可能是慢性乙型肝炎湿热中阻证肝损伤机制之一.
此外在对肝脏损伤机制的研究过程中, 胆盐毒性作用学说一直是大家认可和关注的焦点, 特别是疏水性胆汁酸, 如胆酸、牛磺鹅脱氧胆酸、鹅脱氧胆酸、甘氨鹅脱氧胆酸、和石胆酸. 大量研究表明疏水性胆汁酸具有很强的细胞毒性损伤作用, 在体内外均可诱导肝细胞明显凋亡[13-15]. 本研究发现: CHB湿热中阻证患者中牛磺鹅脱氧胆酸、胆烷酸、甘氨鹅脱氧胆酸-3-葡萄糖醛酸、甘氨鹅脱氧胆盐-3-硫酸盐等胆汁酸成分相对健康正常组均显著升高(P<0.05), 且其中大部分都是疏水性胆汁酸. 可见, 这些升高的疏水性胆汁酸成分可能是慢性乙型肝炎湿热中阻证患者肝损伤机制的另一主要原因之一.
总之, 以上这些差异表观的代谢物成分主要与脂类及胆汁酸代谢相关, 而肝脏在脂类和胆汁酸的代谢中均起着重要作用. 可见, 以上这些差异代谢物可能是导致慢性乙型肝炎湿热中阻证严重肝损伤的罪魁祸首, 也是CHB湿热中阻证发生发展机制的标志性代谢产物.
肝脏是人体消化系统中最大的消化腺, 是人体内以代谢功能为主参与新陈代谢的重要器官. 代谢组学就是对机体代谢终端产物进行综合性多元化分析, 从整体上展示生物体复杂的内在变化状态. 组学所具备的整体性、复杂性、时空性和动态性等特点与中医理论中注重整体研究, 强调功能联系的观点是相通的. 因此采用代谢组学研究慢性乙型肝炎湿热中阻证血浆代谢谱改变可为该病证侯及辨证的规范化提供一定的科学依据.
姚登福, 教授, 南通大学附属医院
中医的核心思想是"辨证论治", 其中, 辨证是论治的前提, 但长期以来中医对"证"的判断主观性较强, 缺乏规范化的客观性标准. 因此, 对慢性乙型肝炎中医证候客观化研究已成为当务之急.
Debois等认为, 代谢组学是最接近生物表型和最能有效反映细胞个体或群体功能的表征技术.
本研究通过超高性能液相色谱与质谱(UPLC-Q-TOP/MS)联用技术对比分析慢性乙肝湿热中阻证与正常对照组血浆代谢物水平发现: 两组间有明显的代谢图谱分离; 慢性乙肝湿热中阻证组比较正常对照组有14种代谢产物主成分差异, 如溶血磷脂酰胆碱(C18:3; C18:2)、溶血磷脂酰乙醇胺(C22:1)、磷脂酰胆碱(C22:6)、磷脂酰乙醇胺(C24:1)、牛磺鹅脱氧胆酸、胆烷酸、甘氨鹅脱氧胆酸-3-葡萄糖醛酸、甘氨鹅脱氧胆盐-3-硫酸盐等, 以上这些差异表观的代谢物成分主要与脂类及胆汁酸代谢相关.
慢性乙型肝炎湿热中阻证组比较正常对照组有14种代谢产物主成分差异, 这些差异代谢物大多数对肝脏有明显的损伤作用. 因此, 这些差异代谢物可能是导致慢性乙型肝炎湿热中阻证严重肝损伤的罪魁祸首, 也是慢性乙型肝炎湿热中阻证发生发展机制的标志性代谢产物.
本文从分子水平上探讨慢性乙肝湿热中阻证的分子机制, 可为慢性乙肝湿热中阻证型的物质基础研究提供现代科学依据.
编辑: 田滢 电编:鲁亚静
| 1. | Wu B, Shen J, Cheng H. Cost-effectiveness analysis of different rescue therapies in patients with lamivudine-resistant chronic hepatitis B in China. BMC Health Serv Res. 2012;12:385. [PubMed] [DOI] |
| 3. | 杜 武勋, 朱 明丹, 袁 宏伟, 冯 利民, 朱 林平, 刘 岩, 周 营, 魏 聪聪, 张 少强. 病证结合, 方证相应的系统-系统的方证相应动态研究. 中国中西医结合杂志. 2012;32:839-842. |
| 5. | Nicholson JK, Holmes E, Lindon JC, Wilson ID. The challenges of modeling mammalian biocomplexity. Nat Biotechnol. 2004;22:1268-1274. [PubMed] [DOI] |
| 6. | Debois D, Bralet MP, Le Naour F, Brunelle A, Laprévote O. In situ lipidomic analysis of nonalcoholic fatty liver by cluster TOF-SIMS imaging. Anal Chem. 2009;81:2823-2831. [PubMed] [DOI] |
| 7. | Du Z, Zhang L, Liu S. [Application of liquid chromatography-mass spectrometry in the study of metabolic profiling of cirrhosis in different grades]. Se Pu. 2011;29:314-319. [PubMed] [DOI] |
| 8. | Zeissig S, Murata K, Sweet L, Publicover J, Hu Z, Kaser A, Bosse E, Iqbal J, Hussain MM, Balschun K. Hepatitis B virus-induced lipid alterations contribute to natural killer T cell-dependent protective immunity. Nat Med. 2012;18:1060-1068. [PubMed] [DOI] |
| 9. | Satoh O, Umeda M, Imai H, Tunoo H, Inoue K. Lipid composition of hepatitis B virus surface antigen particles and the particle-producing human hepatoma cell lines. J Lipid Res. 1990;31:1293-1300. [PubMed] |
| 10. | Chang MK, Hartvigsen K, Ryu J, Kim Y, Han KH. The pro-atherogenic effects of macrophages are reduced upon formation of a complex between C-reactive protein and lysophosphatidylcholine. J Inflamm (Lond). 2012;9:42. [PubMed] [DOI] |
| 11. | Esterbauer H, Ramos P. Chemistry and pathophysiology of oxidation of LDL. Rev Physiol Biochem Pharmacol. 1996;127:31-64. [PubMed] [DOI] |
| 14. | Rust C, Bauchmuller K, Bernt C, Vennegeerts T, Fickert P, Fuchsbichler A, Beuers U. Sulfasalazine reduces bile acid induced apoptosis in human hepatoma cells and perfused rat livers. Gut. 2006;55:719-727. [PubMed] [DOI] |
| 15. | Jürgens S, Meyer F, Spechler SJ, Souza R. The role of bile acids in the neoplastic progression of Barrett's esophagus - a short representative overview. Z Gastroenterol. 2012;50:1028-1034. [PubMed] |