修回日期: 2012-01-25
接受日期: 2013-03-06
在线出版日期: 2013-03-28
目的: 探讨α-亚麻酸(α-linolenic acid, ALA)对转化生长因子β1(transforming growth factor-β, TGF-β1)诱导的肝星状细胞(hepatic satellite cell, HSC)增殖及分泌功能的影响.
方法: 采用活化的HSC作为研究模型, 将传代的细胞分为5组, 以MTT比色法观察ALA对HSC的增殖效应, 以ELASA检测细胞培养上清液中Ⅰ型及Ⅲ型胶原的含量, 以Western blot法检测α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)的表达.
结果: TGF-β1能诱导HSC增殖并促进胶原的分泌, ALA可不同程度抑制TGF-β1所诱导的HSC增殖及Ⅰ、Ⅲ型胶原和α-SMA的表达(P<0.01), 且呈剂量依赖性(P<0.05).
结论: ALA在高浓度时对TGF-β1能诱导的HSC起抑制作用, 可能对脂肪性肝纤维化及其引起的肝硬化有治疗作用.
引文著录: 王莉娟, 吴金明, 方红龙, 刘扬, 黄智铭. α-亚麻酸对转化生长因子β1诱导的肝星状细胞的影响. 世界华人消化杂志 2013; 21(9): 804-808
Revised: January 25, 2012
Accepted: March 6, 2013
Published online: March 28, 2013
AIM: To investigate the effect of treatment with α-linolenic acid (ALA) on cell proliferation, secretion of types Ⅰ and Ⅲ collagen, and α-smooth muscle actin (α-SMA) expression in transforming growth factor beta 1 (TGF-β1)-treated rat hepatic satellite cells (HSCs).
METHODS: Cultured HSCs were divided into five groups: control group, TGF-β1 group (5 ng/mL) and three TGF-β1 plus LNA groups (treated with TGF-β1 plus 50, 150 or 250 ng/mL of ALA). Cell proliferation was assessed by MTT assay. The levels of types Ⅰ and Ⅲ collagen were measured by ELISA. Western blot was used to detect the expression of α-smooth muscle actin.
RESULTS: TGF-β1 induced cell proliferation and increased the secretion of collagen in HSCs. Compared to the TGF-β1 group, treatment with different doses of ALA inhibited cell proliferation and decreased the secretion of types Ⅰ and Ⅲ collagen and expression of α-SMA (all P < 0.05).
CONCLUSION: Treatment with ALA inhibits TGF-β1-induced cell proliferation, secretion of types Ⅰ and Ⅲ collagen, and α-SMA expression in rat HSCs.
- Citation: Wang LJ, Wu JM, Fang HL, Liu Y, Huang ZM. Effect of ALA treatment on cell proliferation, secretion of types Ⅰ and Ⅲ collagen, and α-SMA expression in rat hepatic satellite cells treated with transforming growth factor β1. Shijie Huaren Xiaohua Zazhi 2013; 21(9): 804-808
- URL: https://www.wjgnet.com/1009-3079/full/v21/i9/804.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i9.804
目前非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)越来越引起人们的重视, 研究发现约1%-5%的NAFLD患者最终可发展为肝纤维化及肝硬化[1]. 其中肝星状细胞(hepatic satellite cell, HSC)的活化及增殖发挥了重要作用[1]. n-3多不饱和脂肪酸有降低血脂、减少炎性细胞因子、减少肝脏丙二酰CoA的量、增强机体免疫功能、对肿瘤的抑制的分泌等生理作用[2-4], 其中以α-亚麻酸(α-linolenic acid, ALA)为代表, 但其对肝纤维化的影响研究较少. n-3多不饱和脂肪酸也为游离脂肪酸的组成部分, 可能对脂肪性肝纤维化产生一定影响. 另外转化生长因子β1(transforming growth factor-β1, TGF-β1)可通过HSC内的TGF-β/Smads信号通路促进纤维化的发生发展, 被认为是调控肝纤维化的核心物质, 用TGF-β1促进增殖可使n-3多不饱和脂肪酸对HSC的作用结果更容易显现. 探讨ALA对TGF-β1所诱导的HSC增殖和活化的影响不仅有助于了解n-3多不饱和脂肪酸在脂肪性肝纤维化及肝硬化中所起的作用, 还对已进展为肝硬化患者的营养能量的补充具有指导意义.
DMEM培养基及胎牛血清(美国GIBCO公司), α-亚麻酸(美国Sigma产品), MTT(北京索来宝生物公司), 重组人TGF-β1(美国Pedro Tech公司), 肝星状细胞系HSC2-T6细胞(温州医学院附属第一医院感染内科陈永平教授惠赠), 大鼠Ⅰ型及Ⅲ型胶原ELISA试剂盒(美国ADL公司), 大鼠α-肌动蛋白抗体及内参β-tubulin(美国Santa Cruz公司).
1.2.1 HSC培养: 肝星状细胞系HSC2-T6细胞用含10%胎牛血清的DMEM培养瓶, 在37 ℃、5%CO2条件下培养, 计数及观察细胞活性, 以1×105/mL的浓度接种于培养瓶中, 以后每2-3 d换液1次.
1.2.2 自身配对设计: 实验分组: A组: 对照组、B组: TGF-β1 5 ng/mL组、C组: TGF-β1 5 ng/mL+ALA 50 mmol/L组、D组: TGF-β1 5 ng/mL+ALA 150 mmol/L组: E组: TGF-β1 5 ng/mL+ALA 250 mmol/L组.
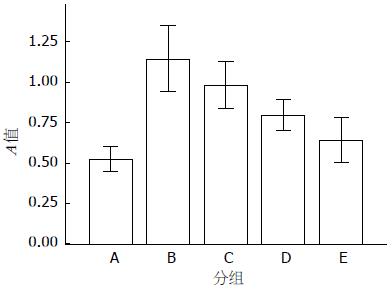
1.2.3 MTT法检测细胞增殖: HSC-T6细胞融合成单层后, 取对数生长期细胞, 分别以0.25%胰蛋白酶消化, 并接种至无菌96孔板内, 每次每组4个复孔, 调整细胞接种密度为1×106/mL, 每孔均加入细胞悬液200 μL, 置37 ℃, 5%CO2培养箱中, 24 h 96孔板内细胞贴壁后, 吸去原培养液, 按分组加入试剂, 每孔再加入无菌MTT溶液(5 mg/mL), 继续在原条件下孵育4 h, 然后终止培养, 吸去孔内培养液, 每孔加入150 μL的DMSA, 微型振荡器振荡10 min, 选择490 nm波长, 在酶标仪上检测各孔的吸光(A)值, 实验重复4次.
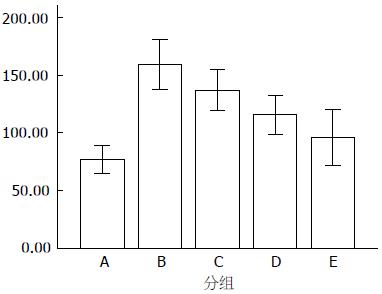
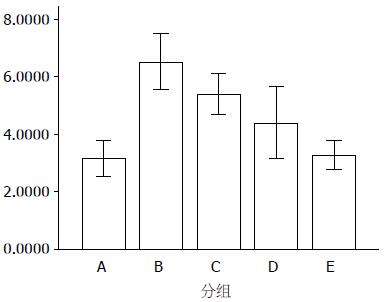
1.2.4 ELISA法检测型Ⅰ及Ⅲ型胶原的表达: 收集做MTT时药物处理后的上清液. 按Ⅰ型及Ⅲ型胶原ELISA试剂盒操作说明书操作.
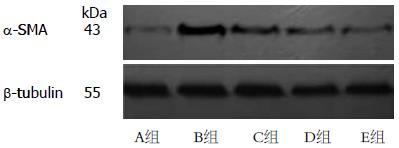
1.2.5 Western blot法检测α-SMA的表达: 各组蛋白标本经聚丙烯酰胺凝胶电泳分离后转移至PVDF膜, 封闭1 h后, 加入α-肌动蛋白抗体(1:400)和内参β-tubulin抗体(1:500), 一抗过夜后加入辣根过氧化物酶标记的二抗(1:2 500)作用1 h, 电化学发光法检测, 在暗室中X光胶片曝光并冲洗显影, 测定各条带的灰度值, 经内参照β-tubulin校正后得到蛋白的相对表达量.
统计学处理 数据用mean±SD表示, 采用SPSS17.0作One-way ANOVA分析, 两两比较用LSD检验, P<0.05为差异有统计学意义.
组间比较F = 25.07, P<0.01, 差异有统计学意义. LSD法多重比较可以发现ALA对HSC的增殖有抑制作用(B、C、D、E 4组各组间差异有统计学意义, P<0.05, A组与E组间差异无统计学意义, P>0.05), 并呈剂量依赖性, A组与E组间无统计学差异可能为ALA对HSC的抑制作用与TGF-β1对HSC的增殖作用相互抵消所致. TGF-β1对HSC的增殖有促进作用(A组与B、C、D组比较, P<0.05, 表1, 图1).
Ⅰ型胶原纤维蛋白组间比较, F = 19.41, P<0.01, 差异有统计学意义; Ⅲ型胶原纤维蛋白组间比较, F = 16.66, P<0.01, 差异有统计学意义. 抑制作用呈剂量依赖性(P<0.05). LSD法多重比较可以发现TGF-β1可促进HSC分泌Ⅰ型及Ⅲ型(P<0.01), 而ALA对Ⅰ型及Ⅲ型胶原蛋白的分泌均有一定的抑制作用(B、C、D、E 4组各组间差异有统计学意义, P<0.05, A组与E组间差异无统计学意义, P>0.05, A组与E组间无统计学差异可能为ALA对HSC的抑制作用与TGF-β1对HSC的增殖作用相互抵消所致), 并呈剂量依赖性(P<0.05, 表2, 图2, 3).
α-SMA组间比较F = 226.31, P<0.01, 差异有统计学意义. LSD法检验可以看出TGF-β1能明显促进HSC表达α-SMA(P<0.01), 经ALA作用后,TGF-β1诱导的α-SMA表达受到抑制并呈剂量依赖性(P<0.05, 表3, 图4).
| 分组 | α-SMA灰度值 | F 值 | P值 |
| A组 | 34.33±13.65 | 226.31 | <0.01 |
| B组 | 450.00±18.08 | ||
| C组 | 226.33±23.01 | ||
| D组 | 136.05±15.02 | ||
| E组 | 84.67±15.50 |
我们的研究结果可证实ALA对在高浓度时对TGF-β1所诱导的HSC可能起抑制作用, 对脂肪性肝纤维化及脂肪性肝硬化可能具有一定治疗作用. TGF-β1所介导的信号通道被认为在HSC的活化及ECM的产生起重要作用[5], 本实验也证实TGF-β1可促进HSC的增殖, HSC2-T6肝星状细胞系本身是活化的肝星状细胞系, 为使效果更明显, 予TGF-β1再激活.
有研究表明多不饱和脂肪酸(n-3及n-3+n-6)可能不能纠正肝纤维化及脂质沉积[6]. 还有研究发现: n-3族多不饱和脂肪酸对脂肪肝及其产生的病理危害可能有一定的治疗的作用[7,8], 可能与其在肝病早期即对脂质沉积有一定的抑制作用有关[8], 究其机制, 推测可能与n-3类脂肪酸能抑制核转录κB(nuclear transcription factor, NF-κB)及使花生四烯类产物减少有关[2,3]. 这提示n-3族多不饱和脂肪酸对脂肪性肝纤维化可能有治疗作用, 但对体外HSC的增殖及分泌功能等尚无其他研究成果. 因此本实验用MTT法、WB及ELISA法检测ALA对HSC的增值、活化、分泌功能的影响, 讨论n-3族多不饱和脂肪酸对脂肪性肝纤维化的作用.
细胞增殖是HSC活化的重要特征之一. MTT法检测结果显示ALA能一定程度的抑制由TGF-β1诱导的HSC的增殖, 并呈浓度依赖性: ALA低浓度时无明显作用; 当ALA浓度逐渐升高时可部分抑制HSC的活化, 并随着浓度的增高抑制作用增强.
各种原因导致的肝纤维化最后均表现为ECM的增加, 星状细胞分泌胶原纤维增加. 实验结果提示ALA对HSC分泌胶原纤维有抑制作用, 作用随ALA浓度的增加而加强. α-SMA是HSC活化的标志, 活化的HSC表达α-SMA, 表达α-SMA的多少可一定程度反映HSC的活化程度. 高浓度的ALA可使HSC的α-SMA表达减少, 低浓度时作用不明显, 说明高浓度时可抑制HSC的活化.
HSC的活化和增殖在脂肪性肝纤维化和肝硬化的发生发展起重要作用. 近年来非酒精性脂肪性肝病发病机制逐渐明确, 其中二次打击学说已被普遍认可, 以胰岛素抵抗为主的代谢综合征起重要作用[9]. 肿瘤坏死因子-a(tumor necrosis factor-α, TNF-α)、TGF-β、IGF-1等细胞因子刺激并激活HSC, 表达α-SMA活化后以分泌以Ⅰ型及Ⅲ型胶原为主的细胞外基质[10]. 已有研究表明: n-3多不饱和脂肪酸的可改善肝脂代谢, 能提高肝脏代谢关键酶脂蛋白酶的LDL受体的活性, 减少肝内甘油三酯的合成, 有直接降脂作用.
NF-κB是由作为转录因子的Rel家族组成的同二聚体或异二聚体. NF-κB可阻止TNF-α所诱导的HSC的凋亡[11]. NF-κB的缺失可对活化的HSC凋亡起一定的作用[12], 而n-3族多不饱和脂肪酸可明显降低细胞中NF-κB的含量[3], 可能与其抑制已活化的HSC的增殖有关.
n-3族多不饱和脂肪酸还能降低细胞膜n-6族不饱和脂肪酸的含量, 从而降低n-6族不饱和脂肪酸代谢产物花生四烯类产物等炎性物质的产生[2], 减少对HSC的刺激也可能是n-3族多不饱和脂肪酸对HSC起作用的途径之一. 综上所述, n-3族多不饱和脂肪酸可能通过多种途径对HSC的增殖起抑制作用, 可能对脂肪性肝纤维化及其引起的肝硬化有治疗作用.
研究表明约1%-5%的非酒精性脂肪肝病(NAFLD)患者最终可发展为肝纤维化及肝硬化, 其中肝星状细胞(HSC)的活化及增殖发挥了重要作用, 若能干扰HSC的活化及增殖, 可能是阻止肝硬化的途径之一. n-3族多不饱和脂肪酸可明显降低细胞中和转录因子(NF-κB)的含量, 可能对已活化的HSC的增殖有一定抑制作用.
高泽立, 副教授, 周浦医院消化科,上海交大医学院九院周浦分院
据研究n-3族多不饱和脂肪酸有降低血脂、减少炎性细胞因子、减少肝脏丙二酰CoA含量、增强机体免疫功能等生理作用, 但其是否对脂肪性肝纤维化及其引起的肝硬化有治疗作用尚不能明确.
n-3族多不饱和脂肪酸对脂肪肝及其产生的病理危害可能有一定的治疗的作用, 可能与其在肝病早期即对脂质沉积有一定的抑制作用有关, 推测可能与n-3类脂肪酸能抑制NF-κB及使花生四烯类产物减少有关.
本文利用体外刺激活化的肝星状细胞, 结果表明其可抑制活化细胞的增殖及减少胶原分泌等作用, 多方面说明其可能用于肝纤维化的治疗.
ALA可抑制HSC的增殖及分泌, 为治疗脂肪性肝纤维化及其所引起的肝硬化提供新的途径.
本文设计合理, 实验方法可信, 统计方法运用合理, 参考文献较新, 值得基础研究者和广大临床医生阅读.
编辑: 田滢 电编: 鲁亚静
| 1. | Ji G, Zhao X, Leng L, Liu P, Jiang Z. Comparison of dietary control and atorvastatin on high fat diet induced hepatic steatosis and hyperlipidemia in rats. Lipids Health Dis. 2011;10:23. [PubMed] [DOI] |
| 2. | Norris JM, Yin X, Lamb MM, Barriga K, Seifert J, Hoffman M, Orton HD, Barón AE, Clare-Salzler M, Chase HP. Omega-3 polyunsaturated fatty acid intake and islet autoimmunity in children at increased risk for type 1 diabetes. JAMA. 2007;298:1420-1428. [PubMed] [DOI] |
| 3. | Hardman WE. Omega-3 fatty acids to augment cancer therapy. J Nutr. 2002;132:3508S-3512S. [PubMed] |
| 4. | Simopoulos AP. The importance of the omega-6/omega-3 fatty acid ratio in cardiovascular disease and other chronic diseases. Exp Biol Med (Maywood). 2008;233:674-688. [PubMed] [DOI] |
| 5. | Zhao L, Gandhi CR, Gao ZH. Involvement of cytosolic phospholipase A2 alpha signalling pathway in spontaneous and transforming growth factor-beta-induced activation of rat hepatic stellate cells. Liver Int. 2011;31:1565-1573. [PubMed] [DOI] |
| 6. | Fernández I, Fontana L, Gil A, Ríosc A, Torres MI. Dietary supplementation with monounsaturated and long-chain polyunsaturated fatty acids influences the liver structural recovery and hepatocyte binuclearity in female Wistar rats in experimental cirrhosis induced by thioacetamide. Exp Toxicol Pathol. 2005;57:65-75. [PubMed] |
| 7. | Spadaro L, Magliocco O, Spampinato D, Piro S, Oliveri C, Alagona C, Papa G, Rabuazzo AM, Purrello F. Effects of n-3 polyunsaturated fatty acids in subjects with nonalcoholic fatty liver disease. Dig Liver Dis. 2008;40:194-199. [PubMed] |
| 8. | González-Périz A, Horrillo R, Ferré N, Gronert K, Dong B, Morán-Salvador E, Titos E, Martínez-Clemente M, López-Parra M, Arroyo V. Obesity-induced insulin resistance and hepatic steatosis are alleviated by omega-3 fatty acids: a role for resolvins and protectins. FASEB J. 2009;23:1946-1957. [PubMed] [DOI] |
| 9. | Cani PD, Amar J, Iglesias MA, Poggi M, Knauf C, Bastelica D, Neyrinck AM, Fava F, Tuohy KM, Chabo C. Metabolic endotoxemia initiates obesity and insulin resistance. Diabetes. 2007;56:1761-1772. [PubMed] [DOI] |
| 10. | Yamamoto M, Sumiyoshi H, Nakagami K, Tahara E. Distribution of collagen types I, III, and V in fibrotic and neoplastic human liver. Acta Pathol Jpn. 1984;34:77-86. [PubMed] |
| 11. | Lang A, Schoonhoven R, Tuvia S, Brenner DA, Rippe RA. Nuclear factor kappaB in proliferation, activation, and apoptosis in rat hepatic stellate cells. J Hepatol. 2000;33:49-58. [PubMed] |
| 12. | Son G, Iimuro Y, Seki E, Hirano T, Kaneda Y, Fujimoto J. Selective inactivation of NF-kappaB in the liver using NF-kappaB decoy suppresses CCl4-induced liver injury and fibrosis. Am J Physiol Gastrointest Liver Physiol. 2007;293:G631-G639. [PubMed] |