修回日期: 2013-01-30
接受日期: 2013-02-01
在线出版日期: 2013-03-28
目的: 研究厄贝沙坦对糖尿病胃轻瘫(diabetic gastroparesis, DG)的治疗作用及其可能的作用机制.
方法: 30只健康♂SD大鼠予链脲佐菌素(streptozotocin, STZ)腹腔注射, 制备糖尿病大鼠模型. 随机分为正常对照组(NC组)、糖尿病模型对照组(DC组)、厄贝沙坦治疗组(DI组), DI组予以厄贝沙坦按0.012 g/(kg•d)灌胃, 其余两组给予等体积生理盐水灌胃. 6 wk后, 行酚红灌胃法测胃排空率; 放射免疫分析法测定大鼠胃组织内皮素(ET-1)含量、化学比色法检测胃组织一氧化氮合酶(NOS)活性、反转录聚合酶联反应(RT-PCR)测定胃组织血管紧张素受体(AT1R)mRNA表达.
结果: DC组及DI组的胃排空率较NC组明显下降(18.65%±4.30%, 22.64%±2.88% vs 62.64%±4.51%), 而与DC组相比, DI组的胃排空率明显升高(22.64%±2.88% vs 18.65%±4.30%; DI组胃组织ET-1含量较DC组明显下降(21.660 pg/mgpro±4.686 pg/mgpro vs 26.850 pg/mgpro±2.897 pg/mgpro), 但是仍高于NC组(21.660 pg/mgpro±4.686 pg/mgpro vs 18.520 pg/mgpro±2.795 pg/mgpro); NOS分为结构性NOS(cNOS)和诱导性(iNOS), 与NC组相比, DC组、DI组cNOS活性显著下降(0.521 pg/mgpro±0.057 pg/mgpro vs 0.323 pg/mgpro±0.079 pg/mgpro, 0.384 pg/mgpro±0.067 pg/mgpro), DI组cNOS活性较之DC组没有显著差异(0.323 pg/mgpro±0.079 pg/mgpro vs 0.384 pg/mgpro±0.067 pg/mgpro), 而DI组iNOS活性较DC组明显下降(0.246 pg/mgpro±0.033 pg/mgpro vs 0.276 pg/mgpro±0.021 pg/mgpro), 但仍高于NC组(0.246 pg/mgpro±0.033 pg/mgpro vs 0.209 pg/mgpro±0.015 pg/mgpro); 厄贝沙坦干预后, DI组胃组织(AT1R)mRNA表达低于DC组, 差异有统计学意义(0.546±0.005 vs 0.741±0.010), 而仍显著高于NC组(0.546±0.005 vs 0.207±0.004).
结论: 厄贝沙坦可能通过影响DG大鼠胃组织ET-1、NOS、AT1R mRNA水平来改善DG大鼠的胃排空障碍.
引文著录: 何莉莉, 朱雅娜, 任荣, 张玉, 王飞, 李媛, 张艺凡, 孙玉凤. 厄贝沙坦对糖尿病胃轻瘫大鼠ET-1和AT1R表达的影响. 世界华人消化杂志 2013; 21(9): 798-803
Revised: January 30, 2013
Accepted: February 1, 2013
Published online: March 28, 2013
AIM: To investigate the therapeutical effect of irbesartan on diabetic gastroparesis (DG) in rats and to explore potential mechanisms involved.
METHODS: Thirty male Sprague-Dawley rats were randomly divided into either a normal control group (NC group, n = 10) or a diabetes mellitus group (DM group, n = 20). Diabetes mellitus was induced with streptozotocin (50 mg/kg i.p.). The DM group was further divided into a diabetic control group (DC group, n = 10) and an irbesartan group (DI group, n = 10). The DI group was given irbesartan 0.012 g/(kg•d) through stomach feeding, while the NC and DC groups were given equal volume of saline by gavage. Six weeks later, all the rats were administered with phenol red solution to measure the rate of gastric emptying. Endothelin (ET-1) content in stomach tissue was measured by radioimmunoassay. Chemical colorimetry was used to measure the activity of nitric oxide synthase (NOS) in the stomach tissue. The expression level of angiotensin receptor (AT1R) mRNA was determined by RT-PCR.
RESULTS: Compared to the NC group, the rate of gastric emptying significantly decline in the other two groups (62.64% ± 4.51% vs 18.65% ± 4.30%, 22.64% ± 2.88%); however, the rate of gastric emptying was significantly higher in the DI group than in the DC group (22.64% ± 2.88% vs 18.65% ± 4.30%). There was a significant difference in ET-1 content among the three groups (NC 18.520 pg/mgpro ± 2.795 pg/mgpro vs DC 26.850 pg/mgpro ± 2.897 pg/mgpro vs DI 21.660 pg/mgpro ± 4.686 pg/mgpro). Compared to the NC group, cNOS activity significantly declined in the DC and DI groups (0.521 pg/mgpro ± 0.057 pg/mgpro vs 0.323 pg/mgpro ± 0.079 pg/mgpro, 0.384 pg/mgpro ± 0.067 pg/mgpro); however, there was no significant change in cNOS activity between the DC and DI groups (0.323 pg/mgpro ± 0.079 pg/mgpro vs 0.384 pg/mgpro ± 0.067 pg/mgpro). iNOS activity in the DI group was significantly lower than that in the DC group (0.246 pg/mgpro ± 0.033 pg/mgpro vs 0.276 pg/mgpro ± 0.021 pg/mgpro), but higher than that in the NC group (0.246 pg/mgpro ± 0.033 pg/mgpro vs 0.209 pg/mgpro ± 0.015 pg/mgpro). The expression of AT1R mRNA in DC group and DI group was up-regulated significantly (0.741 ± 0.010, 0.546 ± 0.005 vs 0.207 ± 0.004) compared with the NC group. After intervention with irbesartan, the level of AT1R mRNA in the DI group was lower than that in the DC group (0.546 ± 0.005 vs 0.741 ± 0.010).
CONCLUSION: Irbesartan can improve, to some extent, gastric emptying in rats with diabetic gastroparesis possibly by altering the levels of ET, NOS, and AT1R mRNAs in the stomach tissue.
- Citation: He LL, Zhu YN, Ren R, Zhang Y, Wang F, Li Y, Zhang YF, Sun YF. Effect of irbesartan on expression of ET-1 and AT1R in gastric tissues of diabetic rats with gastroparesis. Shijie Huaren Xiaohua Zazhi 2013; 21(9): 798-803
- URL: https://www.wjgnet.com/1009-3079/full/v21/i9/798.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i9.798
胃轻瘫(gastroparesis)是在排除胃机械性梗阻的情况下, 出现的以胃排空延迟主要特征的慢性疾病. 其中糖尿病是引起胃轻瘫的3大主要病因之一[1]. 已有报道显示: 胃轻瘫在糖尿病患者中发病率高达90%[2]. 糖尿病胃轻瘫(diabetic gastroparesis, DG)是由Kassmander在1958年首次提出的, 已被公认为糖尿病的并发症之一[3]. 目前医学界普遍认为DG的发病机制现主要认为与迷走副交感神经功能失调、高血糖、肠神经元的表达缺失、平滑肌异常、Caja肠间质细胞(interstitial cells of Caja, ICCs)病变、激素异常、微血管病变等因素有关[4], 其中有关胃微血管病变在DG发病机制研究的报道较少, 胃微循环是保证胃内平滑肌细胞、神经细胞及其他参与胃的舒缩活动的细胞正常功能的基础. 因此我们认为正常的胃微循环是保持胃动力的基础. 糖尿病微血管病变常见于眼、肾, 也可见于消化系, 主要的病理特征是内皮功能受损[5]. ET-1与NO是反映血管内皮功能的一对有价值的指标, 都由内皮细胞产生. NO的主要功能是使血管平滑肌舒张, 抑制血管平滑肌增殖, 能够使胃血流保持在一定水平; ET是血管内皮细胞损伤的标志物, 是迄今所知体内最强、持续时间最长的缩血管物质, 其大量的分泌能够造成血流淤滞, 使胃肠道缺血, 胃平滑肌细胞受损, 影响平滑肌舒缩功能, 可导致胃动力障碍. 血管紧张素-Ⅱ(angiotensin, Ang-Ⅱ), 在病理条件下可促进内皮细胞分泌ET, 激活ROS可以降低内皮细胞一氧化氮合酶(nitric oxide synthase, NOS)活性, 清除内皮细胞NO, 从而抑制内皮细胞活力. 而AngⅡ主要通过与血管紧张素受体(angiotensin receptor, ATR)主要是AT1R结合来发挥生物学效应的, 即AT1R的表达水平决定了AngⅡ的生物学效能. 厄贝沙坦是血管紧张素受体拮抗剂, 国内外已有研究表明血管紧张素受体拮抗剂能够改善血管内皮功能, 有助于减少微血管并发症[6,7], 而且厄贝沙坦是临床上治疗糖尿病并发心血管疾病及肾病的常用药, 但是作为糖尿病并发症之一的胃轻瘫, 厄贝沙坦对其是否也有一定的治疗作用, 国内外未见报道. 本实验采用厄贝沙坦对DG大鼠进行干预, 通过观察其对DG大鼠胃组织ET-1、AT1R mRNA水平变化及NOS活性的影响来探讨厄贝沙坦对DG可能的治疗作用.
健康♂SD大鼠(SPF级)30只, 体质量201-205 g, 由河北医科大学实验动物中心提供(动物合格证编号: 1112061), 安博维(杭州赛诺菲圣德拉堡民生制药公司), TURE script 1st Strand cDNA Synthesis Kit(Reagents公司), NOS测定试剂盒(南京建成生物工程研究所), TRIzol试剂(Invitrogen公司), 2×Tap PCR Master Mix(Reagents公司), 碘[125I]内皮素放射免疫分析法药盒(北京华埠力特生物技术研究所). 凝胶分析系统(UVP公司, 美国).
1.2.1 建模: 将大鼠随机分为正常对照组(n = 10)、糖尿病模型组(n = 10)和厄贝沙坦治疗组(n = 10), 均予以普通饲料(由河北医科大学实验动物中心提供)喂养, 适应性喂养2 wk后, 糖尿病模型组和厄贝沙坦组大鼠空腹一次性腹腔注射1%STZ(购自美国sigma公司, 以0.1 mmol/L pH为4.4的柠檬酸缓冲液配制而成)溶液50 mg/kg, 正常组大鼠仅注射相同体积的柠檬酸缓冲液(pH 4.4, 0.1 mmol/L). 72 h后, 采大鼠尾静脉血, 测定随机血糖, ≥16.19 mmol/L确立糖尿病模型建立.
1.2.2 给药方法: 造模成功后, 厄贝沙坦组予以0.012 g/(kg•d)灌胃, 正常对照组和糖尿病模型组给予等体积生理盐水灌胃. 每日10:00给药一次, 共6 wk. 实验结束时测胃排空率及取动物血清和胃组织.
1.2.3 观察指标和方法: (1)一般情况: 观察大鼠一般情况包括: 精神状态、活动情况、饮食、毛色、饮水量、尿量等; (2)体质量: 称量各组大鼠给药前后体质量, 计算体质量变化; (3)生化指标测定: 血糖(blood glucose, BG)、血清肌酐(serum creatinine, Scr)、胆固醇(total cholesterol, TC)、甘油三酯(total triglyceride, TG), 用Beckman cx7全自动生化分析仪测定; (4)酚红灌胃法检测胃排空率(gastric emptying rate, GER): 于第6周末, 禁食16-24 h、禁水2 h后, 予大鼠500 mg/L酚红溶液2 mL灌胃, 15 min后处死大鼠, 剖腹, 结扎贲门和幽门, 取出整个鼠胃, 沿胃大弯切开, 以蒸馏水冲洗胃内容物, 定容为20 mL. 加入20 mL 0.5 mol/L氢氧化钠搅拌均匀, 静置1 h. 取5 mL上清液, 加入0.5 mL 20%三氯乙酸去蛋白, 3 500 r/min离心10 min, 取上清液, 以分光光度计于560 nm波长处测定吸光度(A)值(实测值), 另取2 mL酚红溶液加入18 mL蒸馏水、20 mL 0.5 mol/L氢氧化钠、4 mL 20%三氯乙酸, 搅拌均匀, 测定A值(标准酚红A值). 大鼠GER = (1-实测酚红A值/标准酚红A值)×100%; (5)放射免疫法测胃组织ET含量: 胃组织总蛋白提取: 取-80 ℃冻存的胃组织标本100 mg, 置于1-2 mL匀浆器中, 用干净的剪刀将组织块尽量剪碎. 加1 mL RIPA和10 μL PMSF于匀浆器中, 在低温下进行匀浆. 将匀浆彻底后的液体移至1.5 mL EP管中, 然后在4 ℃下10 000 r/min离心10-20 min, 上清液即为所提取的蛋白溶液; 胃组织ET含量测定: 将冷冻于-80 ℃冰箱的组织提取液分别取出后置于冷水中复融, 混匀, 再次4 ℃ 3 000 r/min离心20 min, 取上清分装后用于测定. 放免测定采用非平衡法, 具体操作步骤按碘[125I]内皮素放射免疫分析法药盒说明操作, 最后结果算出每毫克蛋白中ET-1含量; (6)化学比色法用于胃组织NOS活力测定: NOS催化L-Arg和分子氧反应生成NO, NO与亲核性物质生成有色化合物, 在530 nm波长下测定A值, 然后除以每毫升胃组织蛋白含量, 算得胃组织NOS活力. 具体步骤按NOS测定试剂盒说明操作. 组织NOS酶活力计算定义为: 每毫克组织蛋白每分钟生成1 nmol NO为一个酶活力单位; (7)RT-PCR法检测胃组织AT1R mRNA表达: 以TRIzol试剂按说明提取总RNA, 按201 μL反应体系加RNA 2 μL, 参照TURE script 1st Strand cDNA Synthesis Kit说明操作, 反应条件: 42 ℃ 30 min(cDNA合成), 99 ℃ 5 min(逆转录酶失活), 5 ℃ 5 min. 然后对cDNA进行扩增; 取cDNA 2 μL, 2×Tap PCR Master Mix 10 μL, 目的基因和对应内参的上、下游引物(20 μmol/L)各1 μL, 用DEPC水补至20 μL. 反应条件: AT1R: 94 ℃预变性3 min; 94 ℃变性40 s, 56 ℃退火50 s, 72 ℃延伸90 s, 循环30次, 72 ℃延伸10 min. GAPDH: 94 ℃预变性3 min; 94 ℃变性40 s, 59 ℃退火50 s, 72 ℃延伸90 s, 循环30次, 72 ℃延伸10 min. PCR产物在含x-gal的1%琼脂糖凝胶中电泳后, 置于凝胶分析系统进行吸光度扫描, 用目的基因吸光度与内参(β-actin)A值的比值来表示目的基因相对表达含量. GADPH被用做对照. AT1R mRNA的引物序列为: sense 5'-CCAGCGTCAGTTTCAATC-3'; antisense 5'-TAGGGCTTTCCAAATAAGAGTA-3'(扩增片段为350 bp); 内参β-actin的引物序列: sense 5'- CCTTCATTGACCTCAACTAC-3'; antisense 5'- GGAAGGCCATGCCAGTGAGC-3'(扩增片段为594 bp).
统计学处理 应用SPSS13.0软件. 计量资料符合正态分布, 方差齐, 用mean±SD表示, 组间比较采用单因素方差分析, 差别有统计学意义的, 可进一步做两两比较, 应用SNK法, α = 0.05.
对照组大鼠饮食正常, 眼睛有神, 活动自如, 被毛紧披有光泽, 肌肉丰满, 粪便呈麦粒状, 尿量正常. 其他两组被注射STZ后, 均出现了明显的多饮、多食、多尿症状, 并逐渐出现精神萎靡, 反应迟钝. 实验结束前, 与对照组相比, 造模各组大鼠, 肌肉较少, 骨骼突出, 上述症状以模型组最为突出. 治疗期间, 由于高血糖不能耐受, 模型组死亡2只, 实验组动物死亡1只.
实验开始前, 正常对照组与实验组大鼠体质量没有明显差别(P>0.05). 与NC组相比, DC组与DI组大鼠体质量明显下降(P<0.05); DI组大鼠体质量明显增加, 与DC组相比有统计学意义(P<0.05). 与NC组相比, DC组与DI组大鼠血糖﹑血脂水平明显升高(P<0.05); 与DC组相比, DI组大鼠血糖没有明显变化(P>0.05). 同样, 厄贝沙坦干预后, 大鼠TC、TG水平与DC组相比并没有显著差别(P>0.05). 厄贝沙坦治疗后大鼠血清肌酐含量, 与DC组相比明显下降(P<0.05); 而与NC组相比, DI组与DC组肌酐水平显著升高(P<0.05, 表1).
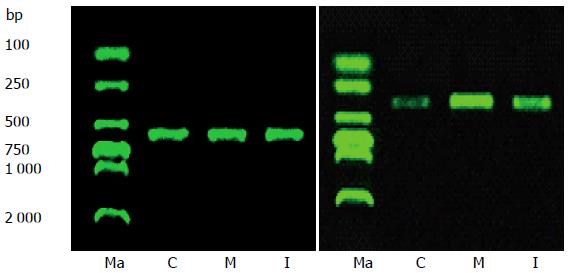
DC组与DI组的胃排空率较正常对照组明显下降(P<0.05), 与DC组比较, DI组胃排空率明显提高(P<0.05). 与NC组比较, 其余各组胃组织中ET-1含量明显增加(P<0.05); DI组胃组织中ET含量较DC组明显减少(P<0.05). NOS是由cNOS和iNOS组成, 实验结果显示: 与NC组相比, 所有糖尿病大鼠胃组织cNOS活性明显降低(P<0.05), iNOS活性明显升高(P<0.05), 而经厄贝沙坦治疗后的大鼠cNOS活性没有明显改善(P>0.05), iNOS活性却显著降低(P<0.05, 表2). 以相对密度值对AT1R mRNA表达进行半定量分析, 结果显示: 经厄贝沙坦治疗后大鼠胃组织AT1R mRNA表达与DC组相比明显下降(P<0.05), 但仍高于NC组(P<0.05, 图1, 表2).
糖尿病胃轻瘫是临床上糖尿病患者常见的一种慢性并发症, 其主要病理特点是胃动力下降、胃排空延迟、胃节律紊乱, 从而导致胃潴留. 常见的症状有早饱、恶心、腹胀、呕吐、食欲不振等, 也可以仅有胃动力的障碍而无明显临床症状. 近几年来随着医学检测技术的进步, DG的检出率随之上升, 因此其诊断和治疗也日益受到重视, 但是DG的发病机制尚未不完全清楚, 主要与神经病变、胃肠激素异常、高血糖、胃微血管和平滑肌病变、Cajal间质细胞缺失、幽门螺杆菌感染等有关[8]. 其中胃的微血管变引起的DG报道较少, 目前认为糖尿病微血管损伤常常是引起并发症的重要的病理生理基础. 糖尿病微血管病变可以见于眼、肾脏和神经等全身多处部位, 亦可见于胃肠道. 糖尿病性微循环障碍造成的局部缺血和神经营养的减弱或丧失可导致胃壁平滑肌细胞变性, 从而影响平滑肌的正常舒缩功能, 同时微循环障碍还可通过影响胃肠自主神经对DG的发生发展起促进作用[9].
血管内皮损伤是糖尿病微血管病变的重要病理基础, ET-1与NO是反映血管内皮功能的一对有价值的指标, 均由内皮细胞释放. 其中ET是21个氨基酸组成的肽家族, ET-1为主要亚型, 血管内皮细胞仅产生ET-1, 是至今发现的最强的缩血管物质, 且又能刺激血管内皮细胞及血管平滑肌细胞的生长; 而NO是一种高度活跃的自由基, 有脂溶性容易通过细胞膜, 具有舒张血管的功能, 能够抑制血管平滑肌细胞增殖, 他由NOS以左旋精氨酸(L-Arg)为底物催化生成, NOS同工酶分别为神经元型NOS(nNOS)、内皮型NOS(eNOS)和诱导型NOS(iNOS), 其中nNOS和eNOS为结构性NOS(cNOS). 一般认为, cNOS介导的NO的释放是生理的, 其产量少, 作用持续而缓和; iNOS产生的NO是病理性的, 产量多, 易产生细胞毒性作用. ET和NO作为维持血管舒缩功能的重要活性物质, 在正常的情况下均处于动态的平衡, 能够共同保持血管的正常状态和功能[10]; 当ET轴及NO系统信号通路异常, 两者平衡关系被打破, 将会引起血管内皮功能紊乱、内皮脱落坏死和内皮下层各种成分暴露等血管壁正常结构的破坏; 血管内局部的缺氧和代谢物的堆积、血小板聚集等等将最终导致微循环障碍[11]. 糖尿病状态下, 肾素-血管紧张素系统(renin-angiotensin system, RAS)异常活跃, 导致循环中AngⅡ含量及活性增加, AngⅡ同样作为最重要的缩血管活性物质之一, 可刺激其他收缩因子如ET1等的产生增多, 其机制与其能刺激血管细胞ET前体的转录有关[12]; 而且在AngⅡ刺激下, 内皮细胞病理性酶iNOS表达增高, 其催化产生NO能和O2-, 反应形成过氧亚硝基(ONOO-), 再快速分解成羟自由基(OH•), 在体内诱导巯基氧化和脂质过氧化而引起内皮细胞损伤[13]. AngⅡ导致血管内皮功能障碍的生物效应主要是通过与AT1R结合实现的, AT1R主要表达在血管平滑肌细胞(vascular smooth muscle cell, VSMCs)、内皮细胞等[14]. AT1R属G蛋白偶联家族, 与AngⅡ结合后,激活G蛋白, 通过三磷酸肌醇和乙酰甘油, 激活细胞内的两条信号通路: 一条是钙离子释放激活蛋白激酶C, 引起蛋白质合成; 另一条是通过蛋白激酶的级联放大激活丝裂原激活的蛋白激酶(mitogen-activated protein kinase, MAPK), MAPK进入细胞核内促进许多原癌基因的表达, 进一步促进细胞的分裂和增生[15], 又可介导内皮功能障碍[16]. 厄贝沙坦是高选择性AngⅡ受体抑制剂, 是临床糖尿病治疗的常用药, 能抑制AngⅠ转化为AngⅡ, 通过选择性地阻断AngⅡ与AT1R的结合, 抑制血管收缩和醛固酮的释放, 减轻肾脏的高灌注、高滤过状态, 减少蛋白尿, 延缓糖尿病肾病的进展[17], 同时能够改善胰岛素抵抗及糖、脂代谢紊乱[18], 可以保护血管内皮功能[19].
本实验结果显示: 应用厄贝沙坦后, DG大鼠胃排空率有一定改善, 但仍低于正常对照组; 胃组织ET-1含量明显减少, iNOS活性显著降低, AT1R mRNA表达明显减弱, 但仍高于正常对照组. 这表明, 厄贝沙坦通过阻断AngⅡ与其受体结合而抑制AngⅡ的生物学效应, 减少了ET-1及AT1R mRNA表达, 同时减弱iNOS活性以减少病理性NO的释放而减轻其对内皮细胞的损伤, 最终结果达到了厄贝沙坦对胃组织微循环的保护作用, 预防胃壁平滑肌细胞变性以维持平滑肌的舒缩功能而改善DG大鼠的胃排空. 本实验中糖尿病大鼠血清肌酐含量较模型组明显下降, 表明对其肾功能保护作用, 这与之前的文献报道一致[20]; 但是对糖尿病大鼠血脂并没有显著改善, 与之前的文献报道不一致[21], 可能与其用药剂量和时间有关; 另外厄贝沙坦干预后, DG大鼠体重明显增加, 可能与其改善胃排空后增加食量有关. 因此厄贝沙坦治疗DG大鼠胃动力障碍可能与其影响胃微循环障碍有关, 其机制有待于进一步探讨.
胃轻瘫是临床上糖尿病的常见并发症, 其临床表现为恶心、呕吐、早饱、腹胀、腹痛等,这些症状不仅严重影响患者的生活质量, 还会引起血糖波动, 促进糖尿病其他慢性并发症的发生和发展. 因此在探讨胃轻瘫的临床诊治有着重要意义. 厄贝沙坦是临床上治疗原发性高血压、糖尿病合并高血压及肾病常用药, 其是否能够改善糖尿病胃轻瘫, 国内外病未见相关报道.
郝丽萍, 副教授, 华中科技大学同济医学院公共卫生学院营养与食品卫生学系
糖尿病胃轻瘫治疗在临床上越来越受到重视, 其多采用在控制血糖的基础上应用促胃动力药物, 包括多巴胺受体拮抗剂、52羟色胺(52HT)4受体激动剂、胃动素受体激动剂和抗胆碱药等, 但是疗效并不十分理想, 因此糖尿病胃轻瘫的治疗是临床上一大难点.
翟振艳等指出血管紧张素受体拮抗剂除了有降压作用外, 对血管内皮细胞有确实的保护作用, 有助于减少微血管和大血管并发症的发生.
本文从厄贝沙坦改善血管内皮作用方面, 联系糖尿病胃轻瘫发病机制来探讨厄贝沙坦治疗胃轻瘫的发病机制.
本文从厄贝沙坦改善糖尿病胃轻瘫方面, 为厄贝沙坦临床应用提供新的思路.
胃排空: 食物由胃排入十二指肠的过程称为胃排空. 食物刺激胃壁是促进胃排空的动力, 当幽门括约肌开放, 胃运动加强, 胃内压大于十二指肠压时, 胃内容物即可进入十二指肠, 而进入十二指肠的胃内容物通过肠壁的各种感受器, 反射性引起胃运动减弱, 排空减慢, 对胃的运动和排空起抑制作用.
本文立意新颖, 有一定临床价值.
编辑: 田滢 电编: 鲁亚静
| 1. | Waseem S, Moshiree B, Draganov PV. Gastroparesis: current diagnostic challenges and management considerations. World J Gastroenterol. 2009;15:25-37. [PubMed] [DOI] |
| 3. | Kashyap P, Farrugia G. Diabetic gastroparesis: what we have learned and had to unlearn in the past 5 years. Gut. 2010;59:1716-1726. [PubMed] [DOI] |
| 4. | Ma J, Rayner CK, Jones KL, Horowitz M. Diabetic gastroparesis: diagnosis and management. Drugs. 2009;69:971-986. [PubMed] [DOI] |
| 5. | Schalkwijk CG, Stehouwer CD. Vascular complications in diabetes mellitus: the role of endothelial dysfunction. Clin Sci (Lond). 2005;109:143-159. [PubMed] [DOI] |
| 7. | Candido R, Allen TJ, Lassila M, Cao Z, Thallas V, Cooper ME, Jandeleit-Dahm KA. Irbesartan but not amlodipine suppresses diabetes-associated atherosclerosis. Circulation. 2004;109:1536-1542. [PubMed] [DOI] |
| 9. | 李 浩旭, 秦 晓民, 鲁 彦, 豆 兴成. 糖尿病胃轻瘫发病机制. 胃肠病学和肝病学杂志. 2003;12:88-90. |
| 10. | Kawanabe Y, Nauli SM. Endothelin. Cell Mol Life Sci. 2011;68:195-203. [PubMed] [DOI] |
| 12. | Park L, Thornhill J. Hypoxic modulation of striatal lesions induced by administration of endothelin-1. Brain Res. 2000;883:51-59. [PubMed] [DOI] |
| 14. | de Gasparo M, Catt KJ, Inagami T, Wright JW, Unger T. International union of pharmacology. XXIII. The angiotensin II receptors. Pharmacol Rev. 2000;52:415-472. [PubMed] |
| 15. | Duff JL, Marrero MB, Paxton WG, Schieffer B, Bernstein KE, Berk BC. Angiotensin II signal transduction and the mitogen-activated protein kinase pathway. Cardiovasc Res. 1995;30:511-517. [PubMed] |
| 16. | Schiffrin EL, Deng LY. Relationship between small-artery structure and systolic, diastolic and pulse pressure in essential hypertension. J Hypertens. 1999;17:381-387. [PubMed] [DOI] |
| 17. | Laverman GD, Navis G, Henning RH, de Jong PE, de Zeeuw D. Dual renin-angiotensin system blockade at optimal doses for proteinuria. Kidney Int. 2002;62:1020-1025. [PubMed] [DOI] |
| 18. | Kurtz TW, Pravenec M. Antidiabetic mechanisms of angiotensin-converting enzyme inhibitors and angiotensin II receptor antagonists: beyond the renin-angiotensin system. J Hypertens. 2004;22:2253-2261. [PubMed] [DOI] |
| 20. | Liu BC, Chen Q, Luo DD, Sun J, Phillips AO, Ruan XZ, Liu NF. Mechanisms of irbesartan in prevention of renal lesion in streptozotocin-induced diabetic rats. Acta Pharmacol Sin. 2003;24:67-73. [PubMed] |
| 21. | Zorad S, Dou JT, Benicky J, Hutanu D, Tybitanclova K, Zhou J, Saavedra JM. Long-term angiotensin II AT1 receptor inhibition produces adipose tissue hypotrophy accompanied by increased expression of adiponectin and PPARgamma. Eur J Pharmacol. 2006;552:112-122. [PubMed] [DOI] |