修回日期: 2013-01-28
接受日期: 2013-02-18
在线出版日期: 2013-03-28
目的: 观察人结肠癌细胞SW480增殖、凋亡及β-catenin、T细胞因子4(T cell factor 4, TCF-4)、C-myc、CyclinD1表达变化, 探讨健脾清热活血方防治结肠癌的可能机制.
方法: 将SW480细胞分为空白组、治疗组、对照组; 采用血清药理学方法, 空白组给予胎牛血清; 治疗组分别给予等比稀释不同浓度含药血清; 对照组给予美沙拉嗪含药血清干预体外培养的结肠癌细胞SW480(24 h), 应用MTT法检测细胞增殖, 流式细胞仪分析细胞凋亡率、细胞周期, 免疫荧光染色分析细胞β-catenin蛋白表达, Western blot及荧光定量PCR检测β-catenin、TCF-4、C-myc、CyclinD1蛋白及mRNA表达.
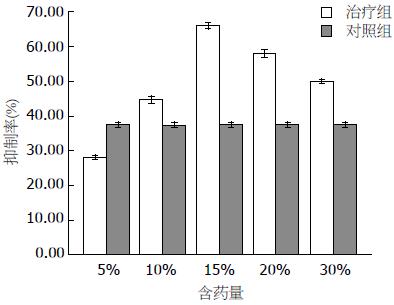
结果: 与空白组比较, 治疗组SW480细胞存活率明显下降(P<0.05), 稀释浓度为5%、10%、15%、20%、30%的不同剂量组细胞生长抑制率分别为28.00%、44.58%、65.86%、57.86%、49.89%, 但与药物浓度没有剂量依赖性(P>0.05); 与对照组比较, 治疗组S期细胞增多、G1期细胞减少, 且与药物浓度有剂量依赖性(P<0.05); 空白组β-catenin表达以核内表达为主, 治疗组β-catenin胞质/核异位表达下降(P<0.05), 以胞膜表达为主; 与空白组比较, 治疗组可明显下调β-catenin、TCF-4、C-myc、CyclinD1蛋白及mRNA表达并促进细胞凋亡(P<0.01), 以中剂量更为明显.
结论: 健脾清热活血方可能通过介导Wnt/β-catenin通路, 干预SW480细胞G1期, 诱导细胞凋亡, 发挥防治结肠癌的效应.
引文著录: 张保静, 张涛, 陈远能, 王小平, 潘怀耿. 健脾清热活血方介导Wnt/β-catenin通路对人结肠SW480细胞的影响. 世界华人消化杂志 2013; 21(9): 745-753
Revised: January 28, 2013
Accepted: February 18, 2013
Published online: March 28, 2013
AIM: To investigate the effect of treatment with Jian-pi-qing-re-huo-xue decoction on SW480 cell proliferation and apoptosis and the expression of β-catenin, TCF-4, c-myc and cyclin D1.
METHODS: SW480 cells were divided into a blank group, an intervention group and a control group, which were incubated with fetal calf serum, different concentrations of serum containing Jian-pi-qing-re-huo-xue decoction, or serum containing mesalamine for 24 h, respectively. The proliferation and apoptosis of SW480 cells were detected by MMT assay and flow cytometry, respectively. The mRNA and protein expression of β-catenin, TCF-4, c-myc, and cyclin D1 was assayed by real-time PCR and Western blot.
RESULTS: Compared to the blank group, the survival of SW480 cells was reduced in the intervention group (P < 0.05). When the dilution concentration of Jian-pi-qing-re-huo-xue decoction was 5%, 10%, 15%, 20% and 30%, the reduced rate of cell growth was 28%, 44.58%, 65.86%, 57.86% and 49.89%, respectively. However, this inhibitory effect was not concentration-dependent (P > 0.05). Intervention with Jian-pi-qing-re-huo-xue decoction significantly increased the percentage of cells at S phase and decreased that of cells at G1 in a concentration-dependent manner compared to the control group (both P < 0.05). β-catenin was more abundantly expressed in the nucleus in the blank group. In the intervention group, the ectopic expression of β-catenin in the cytoplasm and nucleus declined, and membrane expression increased (P < 0.05). Treatment with Jian-pi-qing-re-huo-xue decoction induced cell apoptosis and down-regulated the expression of β-catenin, TCF-4, c-myc, and cyclin D1 compared to the blank group (P < 0.01), and the effect was more significant when middle concentration of serum containing the decoction was used.
CONCLUSION: Jian-pi-qing-re-huo-xue decoction exerts a distinct preventive and therapeutic effect on colon cancer possibly by altering the expression of Wnt/β-catenin, affecting cell cycle progression and inducing cell apoptosis.
- Citation: Zhang BJ, Zhang T, Chen YN, Wang XP, Pan HG. Treatment with Jian-pi-qing-re-huo-xue detection regulates SW480 cell apoptosis by altering Wnt/β-catenin expression. Shijie Huaren Xiaohua Zazhi 2013; 21(9): 745-753
- URL: https://www.wjgnet.com/1009-3079/full/v21/i9/745.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i9.745
结肠癌与炎症密切相关, 80%结肠癌缺乏基因易感的依据, 2008年分别发表在《Nature》《Carcinogenesis》等杂志的研究文章也清楚表明: 炎症已成为致癌的第7大致癌因素[1,2]. 溃疡性结肠炎与结肠癌之间存在因果关系已得到消化界公认, 溃疡性结肠炎(ulcerative colitis, UC)患者结肠组织上皮异性增生(高级别或低级别)发生在进展期大肠癌之前, 内镜检查可见单发或多发腺瘤样假性息肉改变, 这些病理改变被看作是癌前状态[3]. 溃疡性结肠炎相关癌变(ulcerative colitis associated carcinogenesis, UCAC)是涉及多基因、多信号的复杂过程, Wnt通路调控β-catenin磷酸化(P-β-catenin)、β-catenin核内异常转录介导UCAC发生发展中具有重要地位[4]. 我们前期在体试验研究结论, 初步证实健脾清热活血类方药具有不良反应低, 提高溃疡性结肠炎溃疡愈合质量, 缓解溃疡性结肠炎临床疗效[5]. 为进一步揭示其防治结肠癌的可能机制, 课题组采用血清药理学方法, 以公认有效的美沙拉嗪为对照组, 观察其对SW480细胞增殖、凋亡及其关键通路Wnt/β-catenin的影响, 探讨健脾清热活血类方药防治人结肠癌的生物学机制.
人结肠癌细胞株SW480购自上海细胞库; SPF级♂大鼠, 200 g±20 g, 购自广西医科大学动物实验中心, 动物许可证号: SCXK桂2009-0002, 动物合格证号: 0001869; 健脾清热活血方购自广西中医学院第一附属医院仁爱分院; 美沙拉嗪肠溶颗粒剂(商品名: 艾迪莎)(批号: H20070727)购自广西中医学院附属瑞康医院; DMEM培养液、南美洲胎牛血清FBS(Hyclone); 总RNA提取试剂盒(离心柱型, DP419, 北京天根); MTT噻唑(Amresco)、二甲基亚砜(DMSO)(OACS Grade)(广西天地扬); 逆转录试剂盒(RevertAid First Strand cDNA Synthesis Kit)(Ferments)(#K1621 #K1622)、引物(上海生工); Alexa Fluor 488 annexinV/Dead Cell Apoptosis Kit with Alexa Fluor 488 annexin V and PI for Flow Cytometry(invitrogen)、凯基细胞DNA含量检测试剂盒(细胞周期)(广西阳光实验); FS Universal SYBR Grenn Mas(广州聚研);蛋白提取液(碧云天)、十二羟硫酸钠(sodium dodecyl sulfate, SDS)(广州威佳); 二硫苏糖醇(dithiothreitol, DTT)(Sigma); 甘油(glycerol)(国产); 丙烯酰胺(Acrylamide)(Sigma); N,N'-亚甲基丙烯酰胺(Bis-Acrylamide)(Sigma); 四甲基乙二胺(tetramethylethylenediamine, TEMED)(上海生工); 过硫酸铵(ammomium persulfate, AP)(国产 广州化学试剂厂); 甘氨酸(Glycine)(鼎国); Tris碱(Trisbase)(Sigma); 甲醇(methanol)(广州化学试剂厂); 吐温-20(Tween-20)(Sigma); 脱脂奶粉(伊利); PVDF膜(BIO RAD); 荧光一抗c-fos(sc-16743-R-FITC, santa-cruz, 美国); PBS(北京中杉金桥); Tween 20(Amresco 9005-64-5); 染核试剂DAPI(sigma, D9564, 美国); 倒置相差显微镜(Axiovert200, 德国Zeiss); 全自动酶标仪(BIO-RAD); 7500荧光PCR仪; CO2培养箱(HEPA FILTER): 多通道PCR扩增仪(PTC-220, 美国MJ); SZ-93自动双重纯水蒸馏器(上海亚荣); BIO-RAD电泳仪(Power/Pac300, 美国BIO-RAD); 凝胶成像分析系统(Bio-Rad Gel doc2000, 美国); 低速大容量离心机(LXJ-ⅡB, 上海安亭); 高速低温离心机(5810R Eppendorf Centrifuge, 德国); 细胞流式分析仪(FACSCalibur)及统计软件(FACSCalibur); 超声细胞破碎仪(上海天呈); 垂直电泳仪及转移系统(BIO RAD); 射线摄影暗匣(5×7英寸、富士X光片、发光暗盒, 广州艺佳), 脱色摇床(Rotomix公司); PVDF膜(BIO RAD)、内参抗体(广州艺佳); HRP标记二抗(武汉博士德); 蔡司激光共聚焦显微镜LSM 700.
1.2.1 实验药物制备: 健脾清热活血方药组方为救必应15 g、白术10 g、白芍15 g、水蛭10 g、三七10 g、炙甘草6 g. 用蒸馏水煎成健脾清热活血方药液, 浓缩配制成1 g原生药/1 mL的药液, 过滤分装4 ℃保存备用. 美沙拉嗪肠溶颗粒剂用蒸馏水配制成药液, 过滤分装4 ℃保存备用.
1.2.2 含药血清制备: 将20只SD大鼠, 按体质量随机分为对照组和治疗组, 每组10只. 给药剂量参照"人和动物按体表面积折算的等效剂量比率表"计算[6]. 参考公式: 给药剂量 = 临床常用量×动物等效剂量系数(按体表面积)×培养液内稀释度. 给药方式: 治疗组给予健脾清热活血中药, 对照组给予美沙拉嗪, 空白组给予等量的生理盐水, 以灌胃形式给予处理, 1次/d, 连续7 d. 采血时相: 末次给药2 h后, 用10%的水合氯醛以体重0.03 mL/100 g的比例行麻醉处理, 于腹主动脉取血, 室温下静置2 h, 于4 ℃、3 000 r/min、离心15 min后取得血清, 同种条件下血清混匀, 56 ℃、30 min灭活处理, 0.22 μm滤膜过滤除菌, 置于-20 ℃保存备用.
1.2.3 MTT法检测人结肠癌SW480细胞增殖: 将人结肠癌细胞SW480接种于含10%胎牛血清的DMEM培养液中, 置于含5%CO2、37 ℃的培养箱中培养. 取处于对数生长期的细胞, 用0.25%的胰酶消化下来, 用DMEM培养液制成细胞悬液, 200 μL/孔, 以4×103个/孔的密度接种于96孔板中, 继续培养24 h, 用微量移液器移去培养液, 血清添加方式参考文献[7], 略作修改, 治疗组分别加入不含胎牛血清的DMEM培养基200 μL、稀释浓度分别为5%、10%、15%、20%、30%的含药血清, 对照组加入不含胎牛血清的DMEM培养基2 mL、稀释浓度为0.5 mmol/L的美沙拉嗪含药血清, 空白组是含10%胎牛血清的DMEM培养液, 每组设5个复孔, 继续培养24、48、72 h后, 每孔加入20 μL的MTT溶液(5 mg/mL), 37 ℃孵育4 h后, 用1 mL注射器小心吸取每孔中的培养液, 再分别加入200 μL的DMSO, 于微型振荡器上振荡10 min后, 用全自动酶标仪测定各孔(570 nm)吸光度(A)值.
计算公式: 肿瘤细胞生长抑制率(%) = (对照孔平均A值-加药组平均A组)/对照孔的平均A值乘以100%.
1.2.4 流式细胞仪检测人结肠癌SW480细胞周期及凋亡: 取处于对数生长期的细胞, 用DMEM培养液制成细胞悬液, 2 mL/孔, 以3×105个/孔的密度接种于6孔板中, 培养24 h后给药. 移去培养液, 血清添加方式参考文献[7], 略作修改, 治疗组分别加入不含胎牛血清的DMEM培养基、稀释浓度分别为5%、15%、25%的含药血清, 对照组加入不含胎牛血清的DMEM培养基2 mL、稀释浓度为0.5 mmol/L的美沙拉嗪含药血清, 空白组加入含10%胎牛血清的DMEM培养液, 继续培养24 h后, 分别用0.25%的不含EDTA的胰酶消化, 收集细胞, 采用凯基细胞DNA含量检测试剂盒(细胞周期)和Invitrogen凋亡试剂盒, 严格按照说明书操作步骤操作. 用美国BD公司生产的FACSCalibur流式细胞仪检测, 以cell quest pro统计软件分析PI荧光直方图上细胞周期和凋亡细胞百分率.
1.2.5 免疫印光染色技术检测人结肠癌SW480细胞β-catenin蛋白表达: 将与流式细胞仪检测方法条件下处理过的细胞, 应用免疫印光染色技术检测β-catenin蛋白表达, 具体步骤严格按照试剂说明书进行操作, 以AlphaImager2200分析系统对蛋白条带进行含量分析.
1.2.6 Western blot技术检测人结肠癌SW480细胞β-catenin、TCF-4、C-myc、CyclinD1蛋白表达: 将与流式细胞仪检测方法条件下处理过的细胞, 应用Western blot技术检测β-catenin、TCF-4、C-myc、CyclinD1蛋白表达, 具体步骤严格按照试剂说明书进行操作. 同时以β-actin作为内参, 用光密度扫描仪对蛋白含量进行密度分析, 以目的蛋白与β-actin的密度比值作为目的蛋白的相对含量.
1.2.7 荧光定量PCR检测人结肠癌SW480细胞β-catenin、TCF-4、C-myc、CyclinD1 mRNA表达: 将与流式细胞仪检测方法条件下处理过的细胞, 应用实时荧光定量PCR法(Real-time PCR), 以β-actin为内参, 检测β-catenin、TCF-4、C-myc、CyclinD1的mRNA表达, 具体步骤严格按照试剂说明书进行操作, 各样品的荧光信号值由荧光定量PCR仪的支持软件ABI Prism7000SDS software实时产生并自动计算定量数值, 以目的基因与β-actin的mRNA表达比值作为目的基因的相对表达量. β-catenin、TCF-4、C-myc、CyclinD1引物序列见表1.
| 基因名称 | Forward (5'-3') | Reverse (5'-3') | 扩增长度(bp) |
| β-catenin | GGTGAAAATGCTTGGTTCACC | CGCACTGCCATTTTAGCTCC | 112 |
| TCF-4 | CCACAGCTATGCCTGGTGGT | AAGGCCGGTTCCATACCCT | 127 |
| C-myc | AGGCGAACACACAACGTCTTG | GGGCCTTTTCATTGTTTTCCA | 116 |
| CyclinD1 | ACCTGAGGAGCCCCAACAAC | GCTTCGATCTGCTCCTGGC | 132 |
| β-actin | GCATGGGTCAGAAGGATTCCT | TCGTCCCAGTTGGTGACGAT | 106 |
统计学处理 实验数据以mean±SD表示, 用SPSS11.5 for Windows软件进行数据处理与分析. Oneway Analysis Of Variance(One-way ANOVA)进行各组间方差分析, 方差齐同时用LSD法, 方差不齐时用Tambane'S T2法, P<0.05为有统计学意义. 检验水准为α = 0.05. 实验重复3遍以上.
治疗组与SW480细胞共同孵育24、48、72 h后, 10%的含药血清浓度24 h时出现明显的抑制作用(P<0.05), 其抑制率是57.86%, 半数抑制率的含药血清浓度是13.70%, 但48、72 h后没有明显的抑制的作用, 可能与含药血清本身的药理动力学有关, 故后续的实验都只取24 h这个时间段来检测各个指标(图1).
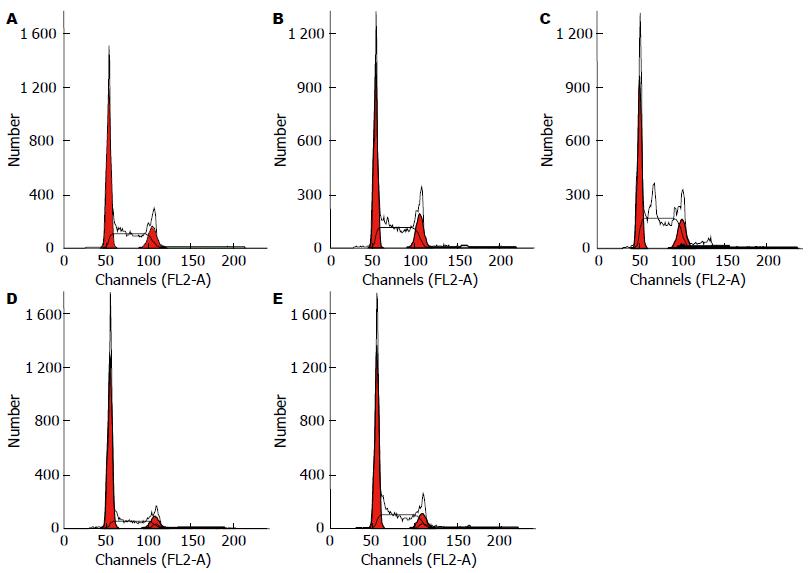
应用FCM定量分析, 治疗组SW480细胞的S期细胞增多、G1期细胞减少, 且与药物浓度有剂量依赖性(P<0.05), 与对照组比较有统计学差异(P<0.05, 图2).
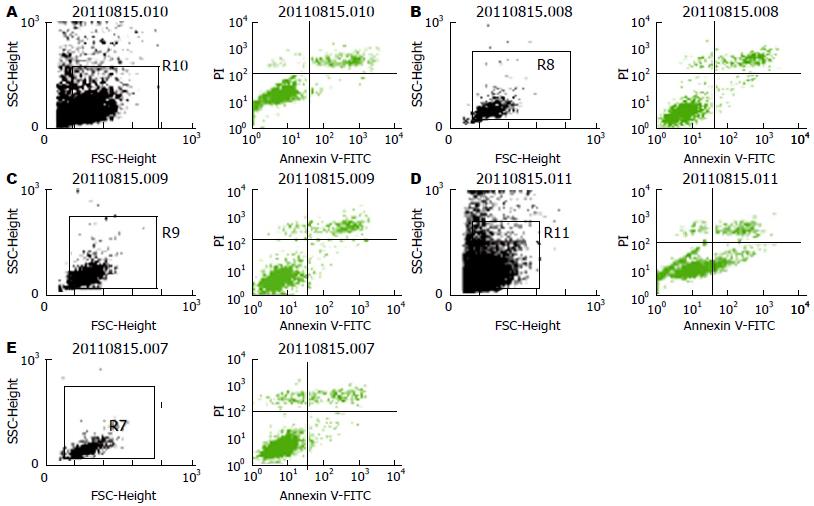
应用流式细胞仪检测, 治疗组干预SW480细胞作用24 h后, 治疗组细胞凋亡率较空白组增高(P<0.05), 但与剂量无依赖性. 这说明, 健脾清热活血中药可诱导细胞凋亡(表2, 图3).
| 分组 | 细胞凋亡率(%) | β-catenin mRNA | TCF-4 mRNA | C-myc mRNA | CyclinD1 mRNA |
| 空白组 | 10.74±0.93 | 2.23±0.13 | 2.77±0.47 | 2.54±0.19 | 2.61±0.13 |
| 对照组 | 22.71±1.90a | 1.39±0.12a | 1.62±0.21a | 1.52±0.16a | 1.41±0.12a |
| 低剂量组 | 13.50±1.31bc | 1.62±0.22bc | 1.83±0.24bc | 1.71±0.13bc | 1.71±0.23bc |
| 中剂量组 | 15.80±1.11bc | 1.53±0.21bc | 1.74±0.19bc | 1.63±0.27bc | 1.55±0.13bc |
| 高剂量组 | 14.47±1.27bc | 1.85±0.11bc | 2.04±0.12bc | 1.84±0.31bc | 1.89±0.11bc |
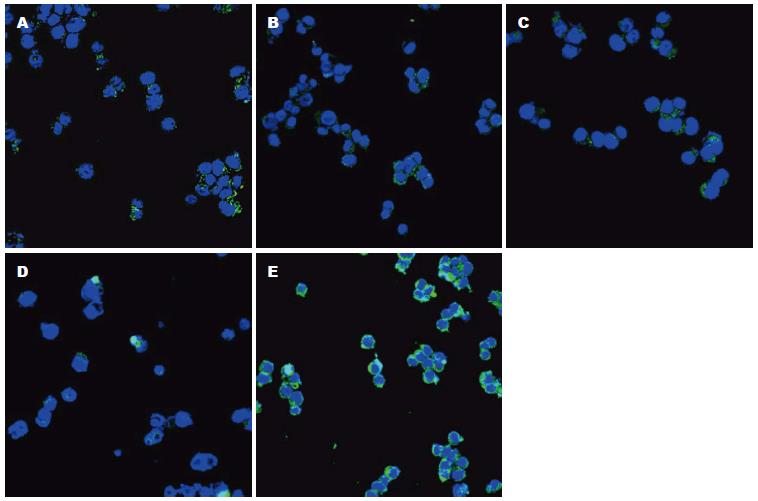
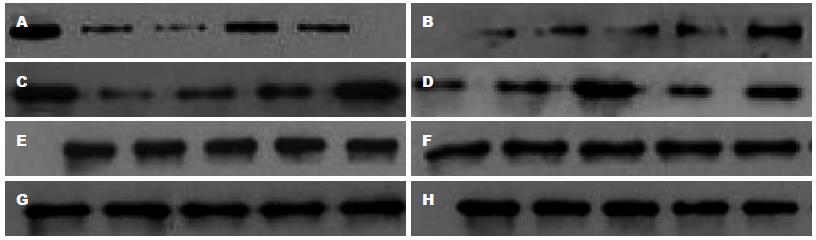
免疫荧光染色分析显示, 空白组β-catenin阳性表达以核内高表达为特点, 各治疗组β-catenin阳性表达呈下降趋势且以膜表达为主, 不存在膜缺失现象, 与空白组比较, 均有统计学差异(P<0.05). Western blot分析显示, 治疗组β-catenin、TCF-4、C-myc、CyclinD1蛋白表达均呈下降趋势, 与空白组比较有统计学意义(P<0.01), 其中低、中剂量调节作用更佳(P<0.01). β-catenin核内积聚, 下游靶基因TCF-4、C-myc、CyclinD1高表达可能是结肠癌变的关键所在, 健脾清热活血方药具有干预β-catenin核内积聚以及TCF-4、C-myc 、CyclinD1表达的作用. 这说明, 健脾清热活血方药可干预β-catenin核内积聚以及调节下游靶基因TCF-4、C-myc、CyclinD1表达的作用(图4, 5, 表3).
| 分组 | 细胞凋亡率(%) | β-catenin蛋白 | TCF-4蛋白 | C-myc 蛋白 | CyclinD1蛋白 |
| 空白组 | 10.74±0.93 | 2.02±0.03 | 2.16±0.33 | 2.15±0.35 | 2.02±0.15 |
| 对照组 | 22.71±1.91a | 1.33±0.14a | 1.59±0.12a | 1.35±0.31a | 1.36±0.17a |
| 低剂量组 | 13.50±1.31bc | 1.57±0.15bc | 1.75±0.07bc | 1.65±0.17bc | 1.69±0.11bc |
| 中剂量组 | 15.80±1.11bc | 1.46±0.18bc | 1.66±0.11bc | 1.44±0.13bc | 1.52±0.23bc |
| 高剂量组 | 14.47±1.27bc | 1.73±0.11bc | 1.89±0.14bc | 1.72±0.18bc | 1.73±0.25bc |
各治疗组β-catenin、TCF-4、C-myc 、CyclinD1 mRNA表达呈下降趋势, 与空白组比较均有统计学差异(P<0.01). 这说明, 结肠癌变存在β-catenin mRNA高表达, 导致下游靶基因β-catenin、TCF-4、C-myc 、CyclinD1过度转录的特点, 健脾清热活血方药可能干预上述靶点, 发挥治疗效应(表2).
健脾清热活血方是全国名老中医、广州中医药大学终身教授劳绍贤在总结多年治疗溃疡性结肠炎经验基础上, 精心筛制而成, 临床疗效确切[8,9]. 该方由白术、炙甘草、救必应、白芍、水蛭, 三七等药物组成, 诸药合用共奏健脾利湿、清热解毒、活血定痛之效. 我们前期临床研究结果提示健脾清热活血方可能通过促进结肠上皮细胞修复及杯状细胞分泌保护因子, 加快肠道黏膜重建, 促进溃疡修复过程; 下调过量表达的IKK-α蛋白水平, 从而抑制NF-κB活性, 调节机体免疫, 因而发挥干预溃疡性结肠炎相关癌变的治疗效应[10-13]. 为进一步阐明健脾清热活血方防治溃疡性结肠炎相关癌变的作用机制, 课题组采用血清药理学方法, 以公认有效的美沙拉嗪为对照组, 观察了不同浓度含药血清防治结肠癌的可能机制及其效应, 细胞增殖、周期及凋亡率均证实健脾清热活血方可以抑制SW480细胞增殖, 干预细胞G1期, 诱导细胞凋亡, 提示健脾清热活血方可有效防治结肠癌.
多项研究均已证实, UC长期患者发生癌变的危险性升高, 在确诊8-10年后, 癌变风险有逐年增长0.5%-1.0%之趋势, 一项荟萃分析显示, 10、20及30年UC患者癌变发生率分别为2%、8%、18%[14], 而因此所导致的死亡人数占总体患者的15%[15]. 尽管UC癌变机制目前尚未明确,但是现代研究已证实Wnt信号通路与UC癌变的发生有着密切的关系, 其中β-catenin核内异常转位及其下游靶基因过度转录被认为是UC癌变的关键事件之一. β-catenin是Wnt信号通路中最关键的转导子[16,17], 是一种多功能胞质蛋白, 在细胞内存在于细胞膜、细胞质及细胞核中, 含有781个氨基酸, 分子量在92-95 kDa, 其氨基末端含数个GSK-3β的磷酸化位点, 羟基末端有活化相应靶基因转录的功能, 中间区域形成α-螺旋和连接环结构, 含有Cadherin、APC蛋白及TCF结合的位点, 这些分子的结构特点决定了β-catenin在Wnt信号传导中起枢纽作用[18]. 结直肠癌与β-Catenin/T细胞因子(TCF)介导的特异转录有关, TCF和β-catenin形成复合物是靶基因激活的先决条件, β-Catenin缺少DNA结合活性, 却有转录活性区, 而Tcf兼有β-catenin结合域和结合DNA活性, 无转录活性, 两者结合形成具有转录功能的复合体, 在核内共同调控下游靶基因包括30多种调节细胞增殖和侵袭转移原癌基因如c-myc、cyclinD1等转录活性上调, 诱导细胞恶变, 从而完成Wnt信号的最终效应[19]. 临床研究也证实[20]大肠正常黏膜-腺瘤-腺癌中β-catenin 阳性表达分别以细胞膜、细胞浆、胞浆/核为主, 同时也证明了β-catenin首先在细胞浆内累积, 后转移到细胞核与转录因子TCF结合, 激活相关靶基因的理论. TCF-4作为结肠黏膜主要表达细胞因子和Wnt信号通路中的分子开关, 在调控细胞癌变过程中具有促进细胞增殖分化和抑制细胞过度生长、防止肿瘤发生的双重效应,其突变可致肿瘤发生[21], 更重要的是TCF-4-β-Catenin复合体及下游靶基因的转录激活是结直肠癌细胞恶性转化的一个标志, 且这些基因的构成性激活对维持恶性表现型来说是必需的[22]. 经研究证实的β-catenin/TCF最为重要的下游靶基因C-myc, 具有与染色体DNA结合特性, 可使细胞无限增殖和促进细胞分裂, 在调节细胞生长、分化及恶性转化中发挥作用[23], 并有着和其他癌基因协同的作用, 共同参与肿瘤的发生、发展. 研究表明细胞浆内β-catenin的聚集及c-myc的高表达与结肠癌的形成有关[24], 而且β-catenin的表达与c-myc呈正相关, 这可能与Wnt通路活化后细胞浆中β-catenin的增加从而调控c-myc的表达有关[25]. 因此, 逆转β-catenin核内聚集及抑制β-catenin、c-myc表达可达到抑制肿瘤发生目的. 肿瘤作为一种细胞周期性疾病, 细胞周期素1(cyclinD1)是细胞周期重要的正调控因子且在肿瘤的发生发展过程起着重要的作用[26-28], 其含量及活化程度在细胞增殖周期卡点G1/S期转换过程中起限速作用. 相关文献报道[29], CyclinD1于结肠癌细胞株中表达下调, 能抑制结肠癌细胞的增殖, 从而反证了CyclinD1过度表达能促进结肠癌细胞增殖的结论. 因此CyclinD1可能通过促进细胞周期而促进细胞增殖来参与结肠癌的发生, 通过抑制其基因表达, 可以达到抑制肿瘤生长目的. 综上可知, 这一复杂的Wnt/β-catenin -TCF/LEF信号通路, 其关键点在于多种因素对细胞内β-catenin水平的影响, β-catenin的高低最终决定靶基因的转录水平, 因此调控细胞内β-catenin水平, 介导β-catenin降解是干预Wnt信号通路防治溃疡性结肠炎癌变的关键事件之一. 临床研究表明[30,31], 既往未被用于治疗癌症的某些药物, 具有明确的化学预防结肠癌的效应, 可以抑制Wnt信号通路, 比如非甾体类抗炎药物舒林酸阿司匹林、异布洛芬上述药物可以提高结肠癌细胞内β-catenin的磷酸化水平, 稳定其转录失活状态, 阻滞Wnt/β-catenin-TCF/LEF对下游靶基因的转录活性调节, 发挥抗癌效应. 但由于上述药物副作用过大、患者耐受差, 往往限制临床使用. 本研究结果发现, 空白组β-catenin表达以核内表达为主, 各治疗组β-catenin以膜内表达为主, 不存在膜表达缺失现象, 而且各治疗组的β-catenin、C-myc、CyclinD1、TCF-4 mRNA和蛋白较空白组相比, 均呈现下降趋势, 其中以低、中剂量疗效最为明显. 上述变化与细胞增殖、周期与凋亡变化呈正相关. 因此, 我们可以相信, 健脾清热活血中药可以调控β-catenin、C-myc、CyclinD1、TCF-4基因表达, 发挥抑制结肠癌的效应.
总之, 课题组推测健脾清热活血中药复方具有明确防治结肠癌变效应, 其机制可能与通过介导Wnt/β-catenin通路, 干预SW480细胞G1期, 诱导细胞凋亡, 从而发挥防治结肠癌的效应. 同时本研究结果也弥补了现代抗癌药物的不足, 对防治溃疡性结肠炎相关癌变发生具有深远意义.
溃疡性结肠炎与结肠癌之间存在因果关系已得到消化界公认, Wnt通路调控β-catenin磷酸化(P-β-catenin)、β-catenin核内异常转录在介导溃疡性结肠炎相关癌变的(UCAC)发生发展中具有重要的作用. 健脾清热活血类方药在促进结肠上皮细胞修复及杯状细胞分泌保护因子, 加快肠道黏膜重建, 促进溃疡修复和抑制NF-κB活性及调节机体免疫方面显示了较好的效果, 但其对Wnt/β-catenin信号通路的影响尚未报道.
牛英才, 研究员, 齐齐哈尔医学院医药科学研究所
本研究采用血清药理学方法, 运用MTT法、流式细胞仪、实时荧光定量PCR、免疫印迹法、免疫印光染色法, 从基因转录和蛋白水平分析健脾清热活血方药对人结肠癌SW480细胞Wnt/β-catenin-TCF-4通路的影响, 阐明复方中药的作用机制.
曹俊等研究发现胃泌素与其受体作用后可使结肠癌细胞中β-catenin分布发生转移并激活β-catenin/Tcf-4通路来降低结肠癌细胞的黏附, 增加肿瘤细胞的侵袭和转移, 但上述研究主要集中在中药单体抗肿瘤作用与Wnt/β-catenin信号转导的关系, 本研究从中药复方调控Wnt/β-catenin信号通路干预UCAC入手, 研究结果将有助探讨中药复方干预溃疡性结肠炎癌变的靶点机制.
临床研究发现, 美沙拉嗪、阿司匹林等药物可通过抑制Wnt信号通路, 提高结肠癌细胞内β-catenin的磷酸化水平, 稳定其转录失活状态, 阻滞Wnt/β-catenin-TCF/LEF对下游靶基因的转录活性调节而发挥抗癌效应. 但由于不良反应过大、患者耐受差, 往往限制其临床使用. 中医药因其天然、疗效明确且具有不良反应低、价格低廉等优势日益受到青睐, 健脾清热活血方具有多环节、多靶点缓解溃疡性结肠炎的作用, 结合现代医学, 从分子水平深入探讨其防治溃疡性结肠炎癌变的作用机制, 具有重要的理论与应用价值.
本研究从体外细胞着手, 用含药血清干预人结肠癌细胞, 以不同浓度健脾清热活血方含药血清及公认治疗UCAC有效的西药美沙拉嗪作对照, 观察SW480细胞增殖、凋亡及其对Wnt/β-catenin-TCF-4通路的影响, 为阐明该复方中药治疗作用靶点提供理论依据.
根据世界卫生组织1980年专家会议将 "癌前病变的组织学定义"分为癌前状态和癌前病变两个范畴, 溃疡性结肠炎相关癌变包括两个方面: 一是溃疡性结肠炎为结肠癌癌前状态; 二是结肠上皮内瘤变(表现为内镜下单发或多发的腺瘤样假性息肉改变)为结肠癌前病变.
本文目标明确, 设计合理, 研究方法较先进, 实验数据可靠, 创新性较好, 有一定的科学意义.
编辑: 田滢 电编: 鲁亚静
| 1. | Mantovani A, Romero P, Palucka AK, Marincola FM. Tumour immunity: effector response to tumour and role of the microenvironment. Lancet. 2008;371:771-783. [PubMed] [DOI] |
| 2. | Colotta F, Allavena P, Sica A, Garlanda C, Mantovani A. Cancer-related inflammation, the seventh hallmark of cancer: links to genetic instability. Carcinogenesis. 2009;30:1073-1081. [PubMed] [DOI] |
| 3. | Goldacre MJ, Wotton CJ, Yeates D, Seagroatt V, Jewell D. Cancer in patients with ulcerative colitis, Crohn's disease and coeliac disease: record linkage study. Eur J Gastroenterol Hepatol. 2008;20:297-304. [PubMed] [DOI] |
| 4. | Risques RA, Lai LA, Brentnall TA, Li L, Feng Z, Gallaher J, Mandelson MT, Potter JD, Bronner MP, Rabinovitch PS. Ulcerative colitis is a disease of accelerated colon aging: evidence from telomere attrition and DNA damage. Gastroenterology. 2008;135:410-418. [PubMed] [DOI] |
| 5. | 李 华燕, 张 涛, 张 颖芹. 健脾清热活血方与美沙拉嗪治疗溃疡性结肠炎的对比研究. 中国中西医结合消化杂志. 2011;19:227-230. |
| 9. | 黄 志新, 劳 绍贤, 崔 琦珍, 王 汝俊, 胡 旭光. 溃结灵颗粒治疗活动期溃疡性结肠炎的临床与实验研究. 中国中西医结合消化杂志. 2003;11:141-143. |
| 14. | Eaden JA, Abrams KR, Mayberry JF. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut. 2001;48:526-535. [PubMed] [DOI] |
| 15. | Munkholm P. Review article: the incidence and prevalence of colorectal cancer in inflammatory bowel disease. Aliment Pharmacol Ther. 2003;18 Suppl 2:1-5. [PubMed] [DOI] |
| 16. | Schneikert J, Behrens J. The canonical Wnt signalling pathway and its APC partner in colon cancer development. Gut. 2007;56:417-425. [PubMed] [DOI] |
| 17. | Gregorieff A, Pinto D, Begthel H, Destrée O, Kielman M, Clevers H. Expression pattern of Wnt signaling components in the adult intestine. Gastroenterology. 2005;129:626-638. [PubMed] |
| 18. | Reya T, Clevers H. Wnt signalling in stem cells and cancer. Nature. 2005;434:843-850. [PubMed] [DOI] |
| 19. | Batlle E, Bacani J, Begthel H, Jonkheer S, Gregorieff A, van de Born M, Malats N, Sancho E, Boon E, Pawson T. EphB receptor activity suppresses colorectal cancer progression. Nature. 2005;435:1126-1130. [PubMed] [DOI] |
| 21. | Batlle E, Henderson JT, Beghtel H, van den Born MM, Sancho E, Huls G, Meeldijk J, Robertson J, van de Wetering M, Pawson T. Beta-catenin and TCF mediate cell positioning in the intestinal epithelium by Controlling the expression of EphB/ephriB. Cell. 2002;111:251-263. [PubMed] [DOI] |
| 22. | Fasolini M, Wu X, Flocco M, Trosset JY, Oppermann U, Knapp S. Hot spots in Tcf4 for the interaction with beta-catenin. J Biol Chem. 2003;278:21092-21098. [PubMed] [DOI] |
| 23. | Gregorieff A, Clevers H. Wnt signaling in the intestinal epithelium: from endoderm to cancer. Genes Dev. 2005;19:877-890. [PubMed] [DOI] |
| 24. | Valentini AM, Pirrelli M, Renna L, Armentano R, Caruso ML. P53 and beta-catenin in colorectal cancer progression. Current Pharmace-utical Design. 2003;9:1932-1936. [PubMed] [DOI] |
| 25. | 徐 晓, 陈 卫昌, 林 茂松, 张 宝峰, 方 静, 周 琼, 胡 莺, 郜 恒骏. β-catenin/c-myc在结肠癌组织中的表达及其临床意义. 中国现代医药杂志. 2007;9:1-4. |
| 26. | Zhou JX, Niehans GA, Shar A, Rubins JB, Frizelle SP, Kratzke RA. Mechanisms of G1 checkpoint loss in resected early stage non-small cell lung cancer. Lung Cancer. 2001;32:27-38. [PubMed] [DOI] |
| 27. | Moghaddam SJ, Haghighi EN, Samiee S, Shahid N, Keramati AR, Dadgar S, Zali MR. Immunohistochemical analysis of p53, cyclinD1, RB1, c-fos and N-ras gene expression in hepatocellular carcinoma in Iran. World J Gastroenterol. 2007;13:588-593. [PubMed] [DOI] |
| 28. | Rose SL, Buller RE. The role of p53 mutation in BRCA1-associated ovarian cancer. Minerva Ginecol. 2002;54:201-209. [PubMed] |
| 29. | Morisaki T, Uchiyama A, Yuzuki D, Essner R, Morton DL, Hoon DS. Interleukin 4 regulates G1 cell cycle progression in gastric carcinoma cells. Cancer Res. 1994;54:1113-1118. [PubMed] |
| 30. | Arber N, Levin B. Chemoprevention of colorectal neoplasia: the potential for personalized medicine. Gastroenterology. 2008;134:1224-1237. [PubMed] [DOI] |
| 31. | Terdiman JP, Johnson LK, Kim YS, Sleisenger MH, Gum JR, Hayes A, Weinberg VK, McQuaid KR. Chemoprevention of colonic polyps with balsalazide: an exploratory, double-blind, placebo-controlled study. Dig Dis Sci. 2009;54:2488-2496. [PubMed] [DOI] |