修回日期: 2013-03-05
接受日期: 2013-03-06
在线出版日期: 2013-03-28
目的: 研究肝纤维化小鼠肝细胞中核因子相关因子-2(NF-E2-related factor 2, Nrf2)核转移情况.
方法: 实验小鼠随机分为正常对照组(normal control, NC组)、模型组, 每组8只. 模型组腹腔注射四氯化碳(CCl4)石蜡油溶液建造肝纤维化模型, NC组给予同体积矿物油腹腔注射, 共10 wk. 收集肝脏标本HE染色及Masson染色观察肝脏炎症和纤维化程度; Western blot检测细胞内Nrf2、醌氧化还原酶1(quinone oxidoreductase, Nqo1)总蛋白及Nrf2核蛋白表达情况.
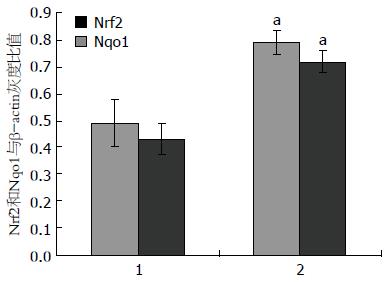
结果: 随CCl4肝损伤时间延长, 组织病理学结果显示模型组明显炎症反应及纤维间隔形成; Western blot结果显示, 与NC组Nrf2、Nqo1总蛋白及Nrf2核蛋白表达量分别为0.490±0.088、0.430±0.057、0.370±0.022比较, 模型组为0.790±0.045、0.720±0.040、0.670±0.044显著增高, 差异具有统计学意义(F = 2.027、0.772、1.552, P<0.05).
结论: 肝纤维化小鼠肝细胞中Nrf2核转移增多并上调细胞保护性蛋白Nqo1表达.
引文著录: 吴硕, 马兴彬, 周成军, 赵敬杰, 郭建强, 许伟华. Nrf2在肝纤维化小鼠肝细胞中的核转移. 世界华人消化杂志 2013; 21(9): 739-744
Revised: March 5, 2013
Accepted: March 6, 2013
Published online: March 28, 2013
AIM: To investigate the nuclear translocation of NF-E2-related factor 2 (Nrf2) in hepatocytes of mice with hepatic fibrosis.
METHODS: Mice were randomly divided into two groups: normal control group and model group. For the model group, carbon tetrachloride (CCl4) dissolved in mineral oil was injected intraperitoneally for 10 weeks, while the normal control group was injected with the same volume of mineral oil. At the end of the 10th week, specimens were collected to assess the degrees of hepatic fibrosis and inflammation by haematoxylin-eosin staining and Masson staining. Western blot was used to detect the protein expression of Nrf2 and NAD(P)H quinine oxidoreductase 1 (Nqo1) and nuclear translocation of Nrf2.
RESULTS: Compared to the normal control group, the degrees of hepatic inflammation and fibrosis in the model group were significantly increased. Western blot analysis showed that, compared to the normal control group (0.490 ± 0.088, 0.430 ± 0.057, 0.370 ± 0.022), the expression levels of Nrf2 and Nqo1 proteins, as well as nuclear translocation of Nrf2 were increased significantly in the model group (0.490 ± 0.088 vs 0.790 ± 0.045, 0.430 ± 0.057 vs 0.720 ± 0.040, 0.370 ± 0.022 vs 0.670 ± 0.044; F = 2.027, 0.772, 1.552, all P < 0.05).
CONCLUSION: In mice with hepatic fibrosis, the nuclear translocation of Nrf2 in hepatocytes is increased to up-regulate its target protein Nqo1.
- Citation: Wu S, Ma XB, Zhou CJ, Zhao JJ, Guo JQ, Xu WH. Nuclear translocation of Nrf2 in hepatocytes of mice with hepatic fibrosis. Shijie Huaren Xiaohua Zazhi 2013; 21(9): 739-744
- URL: https://www.wjgnet.com/1009-3079/full/v21/i9/739.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i9.739
慢性肝病损伤致肝脏自身组织免疫系统激活, 进行连续性修复反应过程是肝纤维化的共同通路. 肝纤维化演变过程中受损的肝细胞、炎性细胞和Kupffer细胞释放活性氧分子(reactive oxygen species, ROS)及多种细胞因子如肿瘤坏死因子α(tumor necrosis factor α, TNF-α)、白介素6(interleukin-6, IL-6), 通过旁分泌方式促进肝星状细胞(hepatic stellate cells, HSCs)活化增殖[1], 而HSCs活化并释放ROS形成持续恶化的病理微环境. 核因子相关因子2(NF-E2-related factor 2, Nrf2)属于CNC(Cap 'n' Collar)家族, 具有高度保守的碱性亮氨酸拉链bZIP结构. 生理状态下, 细胞浆内Nrf2与Kelch样EcH相关蛋白l(Kelch-like ECH-associated protein 1, Keapl)结合, 在氧化应激和亲电子物质刺激下, Nrf2与Keapl解耦联并转入胞核内, 与抗氧化反应元件(antioxidant response element, ARE)结合并转录一系列目标基因, 如醌氧化还原酶1(quinone oxidoreductase, Nqo1)表达, 发挥其抗氧化损伤、解毒、抑制化学致癌等作用. 本实验拟在观察肝纤维化时Nrf2表达及核转移情况, 为探讨肝脏疾病预防及治疗提供方向.
清洁级健康♀昆明小鼠16只, 6周龄, 体质量26 g±5 g, 由山东大学实验动物中心提供. CCl4(分析纯品)和矿物油购自中国医药集团济南凯琪生物技术有限公司. Nrf2抗体(ab31163)、Nqo1抗体(ab34173m)购自英国Abcam公司; 碱性磷酸酶标记的二抗购自北京中杉金桥生物技术有限公司; 总蛋白提取试剂盒、胞核蛋白提取试剂盒、BCA蛋白定量试剂盒购自上海碧云天生物科技研究所; ECL发光试剂盒购自美国Millipore公司.
1.2.1 动物分组与模型制备: 实验小鼠16只, 适应性饲养1 wk, 随机分为正常对照组(normal control, NC组)(n = 8)、模型组(n = 8). NC组给予同体积矿物油腹腔注射, 模型组腹腔注射石蜡油稀释的CCl4溶液(体积比1:10)0.25 mg/g, 1次/3 d, 共10 wk. 禁食不禁水12 h后称体质量, 水合氯醛0.3 mL/100 g麻醉, 摘取部分肝脏固定于10%甲醛, 剩余肝组织液氮冰冻后存于-80 ℃.
1.2.2 肝组织病理学检测: 肝组织标本经10%甲醛固定, 石蜡包埋, 切片机(RM2235型, 德国莱卡)4 µm厚连续切片, 二甲苯透明、梯度酒精水化后, 分别行HE染色、Masson染色, 显微镜(DM520型, 德国莱卡)下观察肝炎症状及纤维化病变.
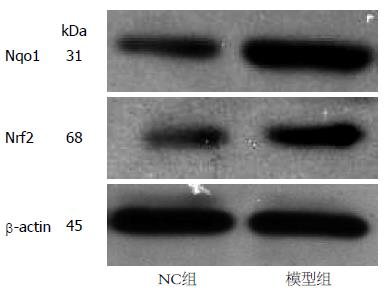
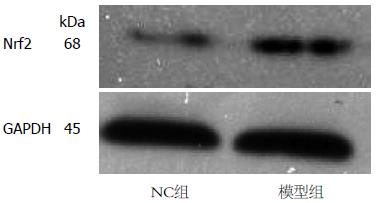
1.2.3 Western blot检测细胞内Nrf2的蛋白表达量、核转移情况及Nqo1蛋白表达水平: 按照说明书操作分别提取总蛋白及核蛋白后, BCA法蛋白定量. 取等量蛋白质样品体积1:6加入适量Loading buffer, 于100 ℃水浴变性5 min, 通过10%SDS-PAGE电泳分离蛋白质后电转移法转移蛋白至NC膜上, 5%脱脂奶粉封闭1.5 h, 加入一抗(Nrf2、Nqo1、β-actin、GAPDH, 浓度为1:1 000)4 ℃过夜; 次日碱性磷酸酶标记的二抗(浓度为1:5 000)孵育2 h, ECL显影液曝光显影. Quantity One图像分析系统测定每条带的灰度值进行分析, 用β-actin、GAPDH作为内参, 以相对灰度值进行统计学分析.
统计学处理 实验数据以mean±SD表示,组间比较采用t检验, 所有数据采用SPSS13.0软件包分析, P<0.05为差异统计学意义有显著性差异.
NC组小鼠体质量逐渐增加, 性情温和, 毛发顺滑; 模型组小鼠毛发干枯, 易激惹, 活动减少, 食量降低, 体质量较前减轻. 实验过程中, 模型组小鼠死亡2只, 死亡原因为CCl4毒性导致肝脏大面积坏死致肝脏功能衰竭, 其余小鼠均进入结果分析.
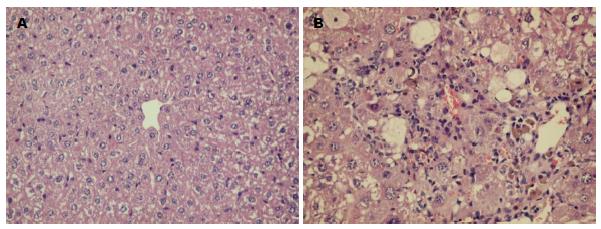
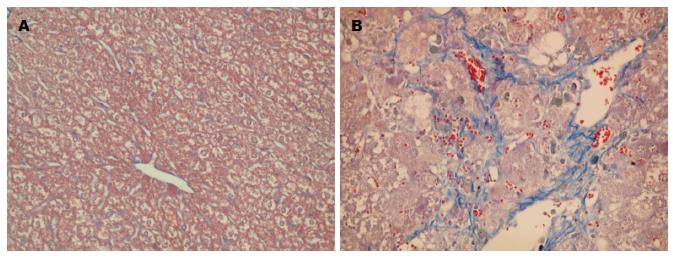
NC组肝细胞围绕中央静脉呈放射状排列, 小叶结构清晰, 未见明显炎性细胞浸润及胶原纤维沉积; 模型组弥漫的炎性细胞及脂肪变肝细胞浸润, 小叶结构严重破坏, 肝板破坏及中央静脉坍塌, 视野内广泛致密蓝染纤维间隔形成(图1, 2).
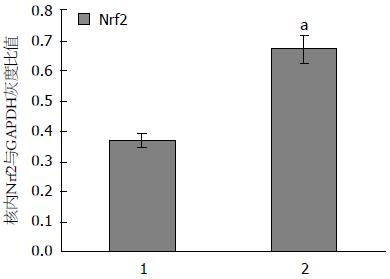
模型组Nrf2总蛋白表达量为0.790±0.045较NC组0.490±0.088显著增多, 差异具有统计学意义(F = 2.027, t = 6.101, P<0.05). 模型组Nqo1总蛋白表达量为0.720±0.040与NC组为0.430±0.057相比明显增多, 具有统计学差异(F = 0.772, t = 8.067, P<0.05). 模型组Nrf2核蛋白表达量为0.670±0.044较NC组0.370±0.022明显增多, 差异具有统计学意义(F = 1.552, t = 11.871, P<0.05, 图3-6).
随着世界范围发病率逐渐增加的慢性肝损伤, 如乙型和/或丙型病毒性肝炎、非酒精性脂肪肝、自身免疫性肝病等引起的肝纤维化病变是向终末期肝硬化病变发展的病理基础. CCl4注射是建立肝纤维化模型的经典方法, 其代谢产物也具有肝毒性, 引起线粒体损伤、肝细胞坏死等加剧氧化应激损伤, 释放大量炎性及纤维化细胞因子而导致肝纤维化发生[2]. 肝脏细胞是产生ROS的重要场所, 尤其当CCl4在内质网微粒体内生物转化过程产生大量ROS, 引起氧化应激、脂质过氧化损伤直接或间接加重肝细胞凋亡、炎性坏死、纤维化病变[3]. 本实验结果显示, 与NC组对比, 随着CCl4肝损伤时间延长小鼠一般情况渐差, 模型组通过持续10 wk腹腔注射矿物油稀释CCl4成功建立小鼠肝纤维化模型.
Nrf2转录因子通过清除机体细胞内外环境的氧化物质及亲电子物质, 抵抗氧化应激损害, 维持机体细胞的氧化还原稳态[4], 他几乎存在于各种细胞中[5], 属于具有高度保守的碱性亮氨酸拉链bZIP结构的CNC家族, 对机体细胞生存进行多向调节[6]. 静息状态下, Nrf2与胞浆蛋白伴侣分子Keap1蛋白结合[7], 存在于细胞浆内, 处于活性相对抑制状态, 维持在低水平表达. 当细胞内ROS增多或氧化应激发生时, Keap1的半胱氨酸功能亚基被修饰后与Nrf2解耦联[8], Nrf2胞核内转移增多, 其稳定性增高[9], 形成Maf-Nrf2二聚体与ARE结合后转录性调节其下游靶基因[10], 即促进肝内细胞Ⅱ相解毒酶和抗氧化酶基因的表达, 如Nqo1、超氧化物歧化酶、谷胱甘肽S转移酶等发挥抗氧化应激、减轻肝脏炎症、抗肝细胞凋亡、降低胰岛素抵抗[11-13]等作用. Nrf2-ARE通路的激活也可抑制Keap1蛋白介导的Nrf2泛素化降解[14], 解除对Nrf2表达的抑制作用, 进一步促进ARE启动子下游保护性基因的表达[15]. Keap1对Nrf2的细胞核内转移及转出均有调节作用, 其调节Nrf2的细胞核转移依赖输入蛋白α7与Keap1羧基端Kelch结构域的相互作用; 同时Keap1还具有强大的Nrf2核转出信号, 促进Nrf2-Keap1复合体输出胞核, 从而保持Nrf2活性剂ARE依赖性基因的有序表达[16]. Keap1介导的Nrf2降解对维持细胞的正常生理功能具有重要作用, 实验研究发现Keap1基因敲除小鼠Nrf2靶基因高水平表达, 却因角化过度于围产期死亡, 而Keap1、Nrf2基因均缺失的基因突变情况下上述现象被抑制[17]. 另外, 转录因子Nrf2也可通过与自身基因的ARE区域结合调节其自身活性[18]. 研究发现Nrf2基因敲除小鼠对CCl4所致肝损伤的修复明显延迟, Nrf2敲除小鼠肝纤维化及炎症明显加重, 这是由于肝细胞目标基因Nrf2及其编码酶的减少, 导致肝细胞对CCl4和其代谢产物的解毒作用减弱[19], 其对药物及金属毒性引起的肝损害更敏感[4]. 本实验Western blot证实模型组较NC组Nrf2总蛋白表达及核转移显著增多, 说明发生Nrf2在肝脏纤维化病变条件下不仅上调自身蛋白表达, 还促进其核内转移显著增加从而发挥生物学功能.
Nrf2肝保护机制之一通过促进Nqo1表达实现, Nqo1是细胞基质内的黄素蛋白, 主要发挥氧化还原、解毒代谢作用, 如催化双电子物质还原反应, 通过清除醌类及其衍生物等有害物质, 抵抗自由基、ROS及氧化应激等损伤所致的细胞损害[20]. Itoh等[21]研究发现Nrf2基因敲除小鼠Nqo1表达显著降低, 说明Nqo1主要受控于Nrf2的调节, Nrf2通过结合于Nqo1基因的ARE序列, 上调Nqo1蛋白的表达, Vasiliou等[22]从肝硬化的小鼠肝脏中分离HSCs, 检测出HSCs中Nqo1表达明显增多, 而Nqo1主要受控于Nrf2的调节, 因此Nrf2通过Nqo1来发挥其抗肝纤维作用. 本实验结果显示模型组Nqo1蛋白水平明显高于NC组, 提示肝纤维化条件下Nrf2增加自身表达及核内转移, 从而通过Nrf2-ARE通路上调保护性基因Nqo1表达, 进一步发挥抵抗肝损伤功能.
Keap1-Nrf2-ARE通路与多种药物对肝脏治疗作用都有着密切联系, 适当的药物干预可以通过促进Keap1-Nrf2-ARE通路激活因子表达从而提高药物的肝脏保护作用[23-26]. 本实验研究证实随着小鼠肝脏经腹腔注射CCl4时间延长, 肝脏纤维化病变持续进展, 肝细胞通过促进Nrf2核内转移, 上调细胞保护性基因Nqo1表达, 从而抵抗慢性肝损伤病理微环境中自由基、ROS及氧化应激等损伤所致的细胞损害, 起到肝脏保护作用. 因此, 通过药物激活Nrf2并促进其核转移是治疗肝脏纤维化的新方向, 而同时Keap1严格调控Nrf2胞核内表达, 从而避免药物促进作用下Nrf2过量表达及核内转移导致细胞损伤的相关机制仍需进一步研究.
慢性肝损伤, 如乙型和/或丙型病毒性肝炎、非酒精性脂肪肝、自身免疫性肝病等在全球的发病率逐年升高, 其引起的肝纤维化病变是向终末期肝硬化病变发展的病理基础. CCl4注射是建立肝纤维化模型的经典方法, 其代谢产物具有肝毒性, 能够引起线粒体损伤、肝细胞坏死等加剧氧化应激损伤, 释放大量炎性及纤维化细胞因子而导致肝纤维化发生.
鲁玉辉, 副教授, 福建中医药大学中医学院; 党双锁, 教授, 西安交通大学医学院第二附属医院感染科
Keap1-Nrf2-ARE通路与多种药物对肝脏治疗的作用密切相关, 适当的药物干预可以通过促进Keap1-Nrf2-ARE通路激活因子表达从而提高药物的肝脏保护作用.
Vasiliou等从肝硬化小鼠肝脏中分离出HSCs, 检测出HSCs中Nqo1的表达量明显增多, 而Nqo1主要受控于Nrf2的调节, 因此Nrf2通过Nqo1发挥其抗肝纤维化作用.
本实验结果显示, 与NC组对比, 随着CCl4肝损伤时间延长小鼠一般情况渐差, 模型组通过持续10 wk腹腔注射矿物油稀释CCl4成功建立小鼠肝纤维化模型.
本文设计合理, 内容具有一定意义.
编辑: 李军亮 电编: 鲁亚静
| 1. | Calvaruso V, Maimone S, Gatt A, Tuddenham E, Thursz M, Pinzani M, Burroughs AK. Coagulation and fibrosis in chronic liver disease. Gut. 2008;57:1722-1727. [PubMed] [DOI] |
| 2. | Williams AT, Burk RF. Carbon tetrachloride hepatotoxicity: an example of free radical-mediated injury. Semin Liver Dis. 1990;10:279-284. [PubMed] [DOI] |
| 3. | Bedossa P, Houglum K, Trautwein C, Holstege A, Chojkier M. Stimulation of collagen alpha 1(I) gene expression is associated with lipid peroxidation in hepatocellular injury: a link to tissue fibrosis? Hepatology. 1994;19:1262-1271. [PubMed] |
| 4. | Ma Q. Xenobiotic-activated receptors: from transcription to drug metabolism to disease. Chem Res Toxicol. 2008;21:1651-1671. [PubMed] [DOI] |
| 5. | Moi P, Chan K, Asunis I, Cao A, Kan YW. Isolation of NF-E2-related factor 2 (Nrf2), a NF-E2-like basic leucine zipper transcriptional activator that binds to the tandem NF-E2/AP1 repeat of the beta-globin locus control region. Proc Natl Acad Sci U S A. 1994;91:9926-9930. [PubMed] [DOI] |
| 6. | Owuor ED, Kong AN. Antioxidants and oxidants regulated signal transduction pathways. Biochem Pharmacol. 2002;64:765-770. [PubMed] [DOI] |
| 7. | Itoh K, Wakabayashi N, Katoh Y, Ishii T, Igarashi K, Engel JD, Yamamoto M. Keap1 represses nuclear activation of antioxidant responsive elements by Nrf2 through binding to the amino-terminal Neh2 domain. Genes Dev. 1999;13:76-86. [PubMed] [DOI] |
| 8. | Itoh K, Mimura J, Yamamoto M. Discovery of the negative regulator of Nrf2, Keap1: a historical overview. Antioxid Redox Signal. 2010;13:1665-1678. [PubMed] [DOI] |
| 9. | Motohashi H, Katsuoka F, Engel JD, Yamamoto M. Small Maf proteins serve as transcriptional cofactors for keratinocyte differentiation in the Keap1-Nrf2 regulatory pathway. Proc Natl Acad Sci U S A. 2004;101:6379-6384. [PubMed] [DOI] |
| 10. | Rushmore TH, Morton MR, Pickett CB. The antioxidant responsive element. Activation by oxidative stress and identification of the DNA consensus sequence required for functional activity. J Biol Chem. 1991;266:11632-11639. [PubMed] |
| 11. | Tanito M, Agbaga MP, Anderson RE. Upregulation of thioredoxin system via Nrf2-antioxidant responsive element pathway in adaptive-retinal neuroprotection in vivo and in vitro. Free Radic Biol Med. 2007;42:1838-1850. [PubMed] [DOI] |
| 12. | Beyer TA, Werner S. The cytoprotective Nrf2 transcription factor controls insulin receptor signaling in the regenerating liver. Cell Cycle. 2008;7:874-878. [PubMed] [DOI] |
| 13. | Stewart D, Killeen E, Naquin R, Alam S, Alam J. Degradation of transcription factor Nrf2 via the ubiquitin-proteasome pathway and stabilization by cadmium. J Biol Chem. 2003;278:2396-2402. [PubMed] [DOI] |
| 14. | Nguyen T, Sherratt PJ, Huang HC, Yang CS, Pickett CB. Increased protein stability as a mechanism that enhances Nrf2-mediated transcriptional activation of the antioxidant response element. Degradation of Nrf2 by the 26 S proteasome. J Biol Chem. 2003;278:4536-4541. [PubMed] [DOI] |
| 15. | Nguyen T, Yang CS, Pickett CB. The pathways and molecular mechanisms regulating Nrf2 activation in response to chemical stress. Free Radic Biol Med. 2004;37:433-441. [PubMed] [DOI] |
| 16. | Sun Z, Wu T, Zhao F, Lau A, Birch CM, Zhang DD. KPNA6 (Importin {alpha}7)-mediated nuclear import of Keap1 represses the Nrf2-dependent antioxidant response. Mol Cell Biol. 2011;31:1800-1811. [PubMed] [DOI] |
| 17. | Wakabayashi N, Itoh K, Wakabayashi J, Motohashi H, Noda S, Takahashi S, Imakado S, Kotsuji T, Otsuka F, Roop DR. Keap1-null mutation leads to postnatal lethality due to constitutive Nrf2 activation. Nat Genet. 2003;35:238-245. [PubMed] [DOI] |
| 18. | Xu W, Hellerbrand C, Köhler UA, Bugnon P, Kan YW, Werner S, Beyer TA. The Nrf2 transcription factor protects from toxin-induced liver injury and fibrosis. Lab Invest. 2008;88:1068-1078. [PubMed] [DOI] |
| 19. | Kensler TW, Wakabayashi N, Biswal S. Cell survival responses to environmental stresses via the Keap1-Nrf2-ARE pathway. Annu Rev Pharmacol Toxicol. 2007;47:89-116. [PubMed] [DOI] |
| 20. | Aleksunes LM, Goedken M, Manautou JE. Up-regulation of NAD(P)H quinone oxidoreductase 1 during human liver injury. World J Gastroenterol. 2006;12:1937-1940. [PubMed] |
| 21. | Itoh K, Chiba T, Takahashi S, Ishii T, Igarashi K, Katoh Y, Oyake T, Hayashi N, Satoh K, Hatayama I. An Nrf2/small Maf heterodimer mediates the induction of phase II detoxifying enzyme genes through antioxidant response elements. Biochem Biophys Res Commun. 1997;236:313-322. [PubMed] [DOI] |
| 22. | Vasiliou V, Qamar L, Pappa A, Sophos NA, Petersen DR. Involvement of the electrophile responsive element and p53 in the activation of hepatic stellate cells as a response to electrophile menadione. Arch Biochem Biophys. 2003;413:164-171. [PubMed] [DOI] |
| 23. | Zhao HD, Zhang F, Shen G, Li YB, Li YH, Jing HR, Ma LF, Yao JH, Tian XF. Sulforaphane protects liver injury induced by intestinal ischemia reperfusion through Nrf2-ARE pathway. World J Gastroenterol. 2010;16:3002-3010. [PubMed] [DOI] |
| 24. | Choi HK, Pokharel YR, Lim SC, Han HK, Ryu CS, Kim SK, Kwak MK, Kang KW. Inhibition of liver fibrosis by solubilized coenzyme Q10: Role of Nrf2 activation in inhibiting transforming growth factor-beta1 expression. Toxicol Appl Pharmacol. 2009;240:377-384. [PubMed] [DOI] |
| 25. | Lee HS, Li L, Kim HK, Bilehal D, Li W, Lee DS, Kim YH. The protective effects of Curcuma longa Linn. extract on carbon tetrachloride-induced hepatotoxicity in rats via upregulation of Nrf2. J Microbiol Biotechnol. 2010;20:1331-1338. [PubMed] [DOI] |
| 26. | Yates MS, Kwak MK, Egner PA, Groopman JD, Bodreddigari S, Sutter TR, Baumgartner KJ, Roebuck BD, Liby KT, Yore MM. Potent protection against aflatoxin-induced tumorigenesis through induction of Nrf2-regulated pathways by the triterpenoid 1-[2-cyano-3-,12-dioxooleana-1,9(11)-dien-28-oyl]imidazole. Cancer Res. 2006;66:2488-2494. [PubMed] [DOI] |