修回日期: 2013-02-17
接受日期: 2013-03-01
在线出版日期: 2013-03-18
目的: 研究神经纤毛蛋白1(neuropilin-1, NRP-1)在肝纤维化组织中的动态表达及其与细胞外基质成分的相关性.
方法: 将动物分为正常对照组和模型组, 用CCl4复制肝纤维化模型, 采用RT-PCR和免疫组织化学方法联合检测NRP-1、Ⅰ、Ⅲ型胶原和α-平滑肌肌动蛋白(α smooth muscle actin, α-SMA)在肝纤维化组织中的表达并进行统计学分析.
结果: 随着肝纤维化程度的加重, NRP-1、α-SMA和Ⅰ、Ⅲ型胶原的表达均逐步增加. 在2 wk时NRP-1与Ⅰ、Ⅲ型胶原的相关性不明显, 但与α-SMA呈显著相关, 其相关系数为0.621; 在4 wk时与Ⅰ、Ⅲ型胶原和α-SMA的相关系数分别为0.645、0.530和0.690; 在6 wk时与Ⅰ、Ⅲ型胶原和α-SMA的相关系数分别为0.834、0.613和0.820.
结论: NRP-1在肝纤维化的发生发展中起重要作用.
引文著录: 魏海艳, 潘亮, 黄华, 肖明兵, 陆翠华. NRP-1在大鼠肝纤维化组织中的表达及其与细胞外基质成分的相关性. 世界华人消化杂志 2013; 21(8): 685-689
Revised: February 17, 2013
Accepted: March 1, 2013
Published online: March 18, 2013
AIM: To investigate the expression of neuropilin-1 (NRP-1) in liver fibrosis in rats and to analyze its correlation with the expression of extracellular matrix components.
METHODS: Hepatic fibrosis was induced in rats using carbon tetrachloride. The mRNA and protein expression of NRP-1, collagen Ⅰ, collagen Ⅲ and α smooth muscle actin (α-SMA) in hepatic tissue of the rats was examined by reverse transcription-polymerase chain reaction (RT-PCR) and immunohistochemistry, respectively. Correlation between the expression of NRP-1 and that of collagen Ⅰ, collagen Ⅲ and α-SMA was analyzed.
RESULTS: The expression of NRP-1, α-SMA, collagen Ⅰ, and collagen Ⅲ proteins was low in the liver tissue of normal rats. In rats with experimental liver fibrosis, the expression of NRP-1, α-SMA, collagen Ⅰ, and collagen Ⅲ proteins increased with the progression of hepatic fibrosis. At weeks 4 and 6, the expression of the above four proteins were significantly higher in liver fibrosis than in normal hepatic tissue (all P < 0.05). NRP-1 mRNA expression in fibrotic liver tissue was significantly higher than that in normal hepatic tissue (P < 0.05). Expression of α-SMA, collagen Ⅰ, and collagen Ⅲ mRNAs was low in normal liver tissue but was significantly increased at weeks 2, 4, and 6 after injection of carbon tetrachloride. The expression of NRP-1, α-SMA, collagen Ⅰ, and collagen Ⅲ mRNAs was gradually increased with the progression of hepatic fibrosis. NRP-1 expression had no apparent correlation with collagen Ⅰ and collagen Ⅲ expression at week 2, but showed a significant correlation at weeks 4 (r = 0.645, 0.530) and 6 (r = 0.834, 0.613). NRP-1 expression had a significant correlation with α-SMA expression during the whole process of hepatic fibrosis (r = 0.621, 0.690, 0.820, all P < 0.05).
CONCLUSION: NRP-1 is overexpressed in hepatic fibrosis, which correlates with the expression of collagen Ⅰ and collagen Ⅲ.
- Citation: Wei HY, Pan L, Huang H, Xiao MB, Lu CH. Correlation between expression of neuropilin-1 and that of extracellular matrix components in liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2013; 21(8): 685-689
- URL: https://www.wjgnet.com/1009-3079/full/v21/i8/685.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i8.685
肝纤维化是各种慢性肝损伤后组织修复过程中的代偿反应, 以细胞外基质(extracellular matrix, ECM)的大量沉积为主要病理特征, 是各种慢性肝病的共同病理过程[1]. 肝星状细胞(hepatic stellate cells, HSC)的活化与增殖在肝纤维化发生发展中起主导作用[2,3], α-平滑肌收缩蛋白(α-smooth muscle actin, α-SMA)是HSC活化的标志[4]. Cao首次发现在体外培养的人和大鼠活化的HSC中, 神经纤毛蛋白(neuropilin-1, NRP-1)呈明显高表达. 为了进一步研究NRP-1在肝纤维化发生中的作用, 本研究在大鼠肝纤维化模型上, 检测NRP-1与α-SMA及Ⅰ、Ⅲ型胶原在肝纤维化组织中的动态表达, 以进一步探讨NRP-1在肝纤维化发生发展中的作用及其与细胞外基质的关系.
♂SD大鼠40只, 体质量150-180 g, 由南通大学动物实验中心提供; 兔抗大鼠α-SMA、Ⅰ、Ⅲ型胶原均购自武汉博士得生物工程公司; 兔抗大鼠NRP-1购自上海晶天生物工程公司.
1.2.1 分组: 随机分成正常对照组(8只)和模型组(32只). 肝纤维化制备: 用橄榄油配成60%CCl4溶液, 每100 g体质量0.3 mL大鼠皮下注射, 2次/wk, 共6 wk. 正常对照组用同样方法皮下注射橄榄油. 模型组动物第5周和第6周各死亡1只, 其余无死亡. 剩余大鼠在第2、4、6周末分批处死, 动物处死时距离末次CCl4注射时间为72 h, 动物被处死后取出肝组织, 一部分采用液氮快速冻存, 另一部分用40 g/L甲醛固定, 用于免疫组织化学检测及纤维化组织病理学观察.
1.2.2 免疫组织化学方法检测NRP-1、α-SMA及Ⅰ、Ⅲ型胶原的表达: 所需肝组织由40 g/L甲醛固定, 脱水, 石蜡切片, 脱蜡至水, 自动免疫组织化学染色仪染色, 苏木素复染, 0.1%HCl分化, 自来水冲洗, 蓝化, 切片经梯度乙醇脱水干燥, 二甲苯透明, 中性树胶封固. 显微镜观察以出现明显棕黄色或褐色为阳性. 在高倍镜下, 每张切片随机观察5个高倍视野, 每个视野计数至少200个细胞, 结果判定标准: 阴性(-): 阳性细胞数<5%; 弱阳性(+): 阳性细胞数5%-25%; 中等阳性(++): 阳性细胞数25%-50%; 强阳性(+++): 阳性细胞数> 50%. 同时设PBS为阴性对照.
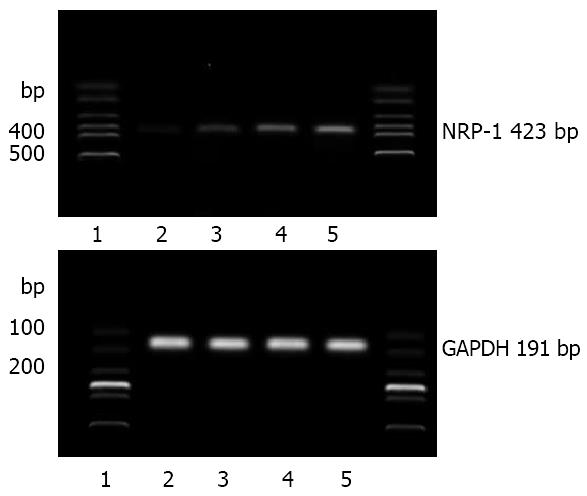
1.2.3 RT-PCR检测NRP-1与α-SMA、Ⅰ、Ⅲ型胶原基因的表达: TRIzol法提取肝组织总RNA, 每样本取RNA 5 μg为逆转录模板, NRP-1、α-SMA、Ⅰ、Ⅲ型胶原的引物各1对, 其序列分别为: NRP-1: 上游引物: 5'-CCGTCTTGGCTGTCCCGTCC-3', 下游引物: 5'-AAGGCCCGCAGGGTCTCTGT-3', 片段大小423 bp; α-SMA上游引物: 5'-CAGCGATAAACCAACAACA-3', 下游引物: 5'-ATAGGGACCTCAGCACAAA-3', 片段大小570 bp;Ⅰ型胶原: 上游引物: 5'- GGCAAGACAGTCATCGAATACA-3', 下游引物: 5'-GATTGGGATGGAGGGAGTTTA-3', 片段大小147 bp; Ⅲ型胶原上游引物: 5'- CCACCCTGAACTCAAGAGC-3', 下游引物: 5'-TGAACTGAAAGCCACCATT-3', 片段大小212 bp; 内参照GAPDH上游引物: 5'-AACGACCCCTTCATTGAC3', 下游引物: 5'-TCCACGACATACTCAGCAC-3', 片段大小191 bp. 按两步法RT-PCR试剂盒(美国GENMED公司产品)操作说明逆转录cDNA, 并进行PCR扩增, 反应条件: 95 ℃ 2 min; 95 ℃退火30 s, 55 ℃变性1 min, 70 ℃延伸30 s, 共35个循环; 70 ℃ 5 min. PCR产物经1.7%琼脂糖电泳采用灰度扫描经与内参照比较分析后计算NRP-1与α-SMA、Ⅰ、Ⅲ型胶原mRNA的表达水平.
统计学处理 所有数据由SPSS13.0统计软件进行分析. 免疫组织化学资料采用秩和检验分析统计. 计量数据以mean±SD表示, 采用t检验、方差分析进行统计学处理, 以P<0.05表示差异有统计学意义.
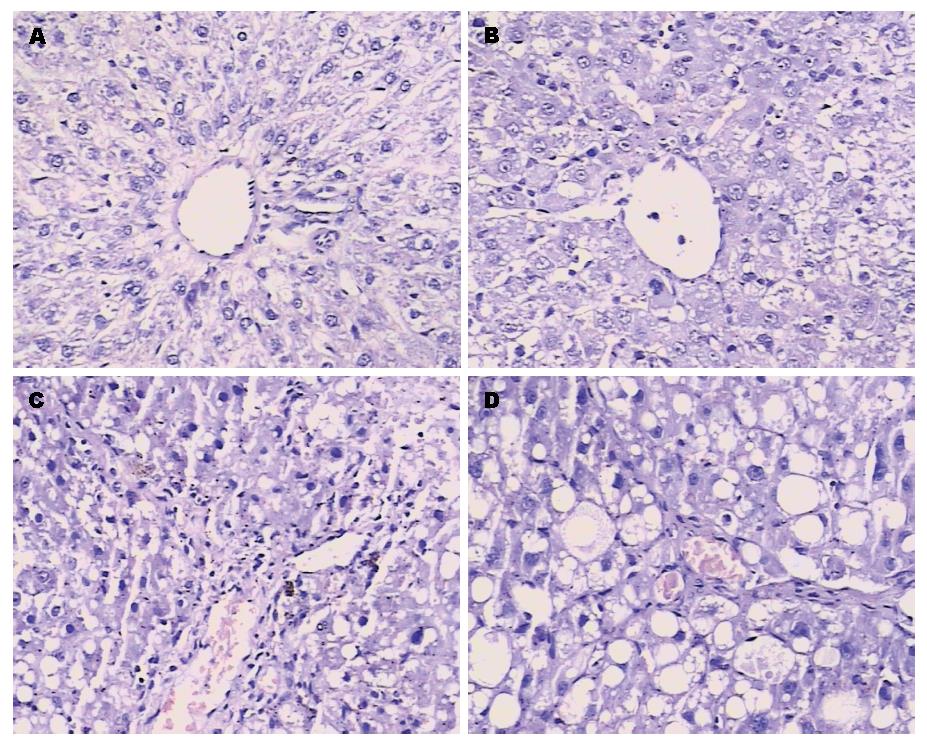
模型组随着CCl4注射时间的延长, HE染色显示大鼠肝细胞出现明显的脂肪变性坏死及炎细胞浸润, 逐渐出现汇管区扩大, 汇管区胶原纤维沉积, 结缔组织增生明显并自汇管区呈放射状扩展, 向小叶周围延伸(图1).
NRP-1与Ⅰ、Ⅲ型胶原在正常对照组均微量表达, 主要分布于门静脉、汇管区及中央静脉周围, 而α-SMA表达阴性. 至2 wk末, 上述4种蛋白表达开始增加, 并随着CCl4注射时间的延长, 肝纤维化程度的加重, 其表达亦逐渐增加, 至第6周时, 表达达高峰.
在正常对照组和各肝纤维化模型组, 均扩增出NRP-1 mRNA片段, NRP-1 mRNA在第2、4、6周表达逐渐增强. 经灰度扫描和与内参照比较分析, NRP-1 mRNA在正常组、2 wk、4 wk和6 wk各组中的相对含量分别为0.199±0.38、0.529±0.13、1.045±0.13和2.018±0.42, 模型第2、4、6周NRP-1 mRNA的表达与正常对照组相比较差异有显著性, P<0.05. 模型组各组间的比较差异均有显著性, P<0.05(图2).
在正常组和各肝纤维化模型组, 均分别扩增出α-SMA、Ⅰ、Ⅲ型胶原mRNA的条带, 其大小分别为570、147和212 bp, 内参照GAPDH扩增片段为191 bp. 上述3种mRNA在第2、4、6周表达逐渐增强. 经灰度扫描和与内参照比较分析, 其mRNA表达与正常对照组相比较均有显著差异, P<0.05. 模型各组间的两两比较差异均有显著性, P<0.05.
随着CCL4注射时间的延长, NRP-1表达的增加, α-SMA、Ⅰ、Ⅲ型胶原mRNA的表达逐渐增加, 到第6周时上述4种mRNA的表达达高峰, 第2周时NRP-1与Ⅰ、Ⅲ型胶原的相关性不明显, 但与α-SMA明显相关, 其相关系数为0.621; 第4周时其与Ⅰ、Ⅲ型胶原、α-SMA的相关系数分别为0.645、0.530和0.690; 第6周时其与Ⅰ、Ⅲ型胶原、α-SMA的相关系数分别为0.834、0.613和0.820, 上述相关均有显著性, P<0.05.
近年来随着细胞和分子生物学技术的发展, 已经证实肝纤维化的发生发展是一个涉及多种细胞和细胞因子的复杂过程[5], HSC是肝纤维化形成中起关键作用的细胞. 正常情况下HSC处于静止状态, α-SMA表达阴性, 在慢性损伤及炎症刺激下, HSC的表型发生转化, 由一般状况时的静止状态激活并向纤维母细胞转化, α-SMA开始表达[6-8], 他的激活和增殖引起肝脏ECM合成增加、降解减少, 还分泌层黏蛋白、蛋白多糖等其他ECM, 构成肝纤维化发生、发展的基础, 是整个肝纤维化发生发展的中心环节. 在这一过程中转化生长因子β1(transforming growth factor-β1, TGF-β1)、血小板衍生生长因子(platelet-derived growth factor, PDGF)以及肿瘤坏死因子(tumor necrosis factor-α, TNF-α)发挥着重要调控作用[9-12]. 目前临床研究仍致力于抑制HSC的活性、控制其增殖和减少其胶原蛋白的分泌, 达到抗肝纤维化的作用.
NRP-1是1995年Satoda等[13]首次报道的相对分子质量为1.3×105的一种跨膜糖蛋白, 他最初被发现于形成中的神经纤维轴突上, 是信号素3A(Sema3A)和血管内皮生长因子165(VEGF165)的受体, 他主要表达于神经系统、心血管系统及骨骼系统, 目前他与肿瘤的相关性研究很多, 但国内外关于NRP-1与肝纤维化关系的研究尚少.
本实验中分别采用RT-PCR法和免疫组织化学法联合检测NRP-1、α-SMA及Ⅰ、Ⅲ型胶原肝纤维化发展过程中的表达情况, 结合统计学分析显示, 随着肝纤维化程度的加重, NRP-1与α-SMA在肝组织中的表达均同步增加, 两者呈动态显著相关. 提示NRP-1可能与HSC的活化有关. Cao等[14]的研究表明, 在丙肝和脂肪肝引起的两种大鼠肝纤维化模型中, NRP-1高表达于肝纤维化组织中, 且与TGF-β1的高表达相伴, 结合本研究我们推测NRP-1可能通过上调TGF-β1而促进HSC的活化, 促进肝纤维化的发生. 本研究还发现, 在2 wk时NRP-1与Ⅰ、Ⅲ型胶原的相关性不明显, 表明在早期Ⅰ、Ⅲ型胶原尚存在着不同程度地降解, 4、6 wk时 NRP-1与Ⅰ、Ⅲ型胶原的相关系数分别为0.645、0.530及0.834、0.613, 进一步说明了NRP-1在肝纤维化发生发展中的作用. 有研究表明, NRP-1可以通过选择性地作用于小GTP蛋白的Rac-1, 促进PDGF受体β亚单位与HSC的结合, 促进PDGF在HSC内的信号转导, 增强Rac-1通路下游PDGF受体β亚单位的磷酸化作用, 发挥刺激HSC增殖和迁移的作用[13]. 因此我们推测, NRP-1一方面能增强TGF-β1的表达, 促进HSC的活化, 另外尚增强PDGF在HSC内的信号转导, 增强了HSC增殖活性. 因此, NRP-1有望为肝纤维化的治疗提供新的靶点.
肝纤维化是各种慢性肝损伤后组织修复过程中的代偿反应, 以细胞外基质(ECM)的大量沉积为主要病理特征, 是各种慢性肝病的共同病理过程. 肝星状细胞(HSC)的活化与增殖在肝纤维化的发生发展中起主导作用, α-平滑肌收缩蛋白(α-SMA)是HSC活化的标志.
吴俊华, 副教授, 南京大学医学院; 钱林学, 主任医师, 首都医科大学附属北京友谊医院
近年来随着细胞和分子生物学技术的发展, 已经证实肝纤维化的发生发展是一个涉及多种细胞和细胞因子的复杂过程, HSC在肝纤维化形成中起关键作用.
NRP-1有望成为肝纤维化治疗的新靶点.
本文内容很好, 具有一定指导意义.
编辑: 田滢 电编: 闫晋利
| 1. | Tsukada S, Parson CJ, Ripple RA. Mechanisms of liver fibrosis. Clin Clim Acta. 2006;364:33-60. [DOI] |
| 2. | Safadi R, Friedman SL. Hepatic fibrosis--role of hepatic stellate cell activation. MedGenMed. 2002;4:27. [PubMed] |
| 3. | Gäbele E, Brenner DA, Rippe RA. Liver fibrosis: signals leading to the amplification of the fibrogenic hepatic stellate cell. Front Biosci. 2003;8:d69-d77. [PubMed] [DOI] |
| 5. | Liu Y, Wang Z, Wang J, Lam W, Kwong S, Li F, Friedman SL, Zhou S, Ren Q, Xu Z. A histone deacetylase inhibitor, largazole, decreases liver fibrosis and angiogenesis by inhibiting transforming growth factor-β and vascular endothelial growth factor signalling. Liver Int. 2012; Oct 30. [Epub ahead of print]. [PubMed] |
| 6. | Qi Z, Atsuchi N, Ooshima A, Takeshita A, Ueno H. Blockade of type beta transforming growth factor signaling prevents liver fibrosis and dysfunction in the rat. Proc Natl Acad Sci U S A. 1999;96:2345-2349. [PubMed] [DOI] |
| 9. | Flisiak R, Maxwell P, Prokopowicz D, Timms PM, Panasiuk A. Plasma tissue inhibitor of metalloproteinases-1 and transforming growth factor beta 1--possible non-invasive biomarkers of hepatic fibrosis in patients with chronic B and C hepatitis. Hepatogastroenterology. 2002;49:1369-1372. [PubMed] |
| 10. | Campbell JS, Hughes SD, Gilbertson DG, Palmer TE, Holdren MS, Haran AC, Odell MM, Bauer RL, Ren HP, Haugen HS. Platelet-derived growth factor C induces liver fibrosis, steatosis, and hepatocellular carcinoma. Proc Natl Acad Sci U S A. 2005;102:3389-3394. [PubMed] [DOI] |
| 11. | Friedman SL, Arthur MJ. Activation of cultured rat hepatic lipocytes by Kupffer cell conditioned medium. Direct enhancement of matrix synthesis and stimulation of cell proliferation via induction of platelet-derived growth factor receptors. J Clin Invest. 1989;84:1780-1785. [PubMed] [DOI] |
| 12. | Wong L, Yamasaki G, Johnson RJ, Friedman SL. Induction of beta-platelet-derived growth factor receptor in rat hepatic lipocytes during cellular activation in vivo and in culture. J Clin Invest. 1994;94:1563-1569. [PubMed] [DOI] |
| 13. | Satoda M, Takagi S, Ohta K, Hirata T, Fujisawa H. Differential expression of two cell surface proteins, neuropilin and plexin, in Xenopus olfactory axon subclasses. J Neurosci. 1995;15:942-955. [PubMed] |
| 14. | Cao S, Yaqoob U, Das A, Shergill U, Jagavelu K, Huebert RC, Routray C, Abdelmoneim S, Vasdev M, Leof E. Neuropilin-1 promotes cirrhosis of the rodent and human liver by enhancing PDGF/TGF-beta signaling in hepatic stellate cells. J Clin Invest. 2010;120:2379-2394. [PubMed] [DOI] |