修回日期: 2013-01-20
接受日期: 2013-02-20
在线出版日期: 2013-03-18
目的: 探讨复方苦参汤对溃疡性结肠炎大鼠DOR-β-arrestin1-Bcl-2信号转导通路的干预作用.
方法: SD♂大鼠84只(体质量200 g±20 g)随机分为空白对照组、模型组、美沙拉嗪组、复方苦参汤大剂量组、复方苦参汤中剂量组和复方苦参汤小剂量组, 每组14只. 除对照组外, 其余5组均依据Morris等三硝基苯磺酸(trinitrobenzene sulfonic acid, TNBS)建立大鼠溃疡性结肠炎模型. 造模后观察记录大鼠的大便和精神状态, 并于第3天随机处死2只造模大鼠, 取结肠镜下观察其病理组织学变化发现: 大鼠结肠糜烂、充血及溃疡, 证明造模成功. 建立大鼠溃疡性结肠炎模型后给予美沙拉嗪组大鼠3 mL/d(0.5 g/L)美沙拉嗪混悬液灌胃, 复方苦参汤大、中、小剂量组分别按不同含生药浓度的复方苦参汤液3 mL/d(0.67、0.34、0.17 g/L)灌胃, 对照组和模型组给予等量的生理盐水3 mL/d灌胃, 连续灌胃15 d后, 禁食24 h, 处死大鼠, 取结肠组织石蜡包埋切片, HE染色比较各组结肠组织病理组织学改变, Real time-PCR和免疫组织化学技术检测实验大鼠结肠组织的Bcl-2、β-arrestin1及δ阿片受体(delta opioid receptor, DOR) mRNA和蛋白表达表达变化.
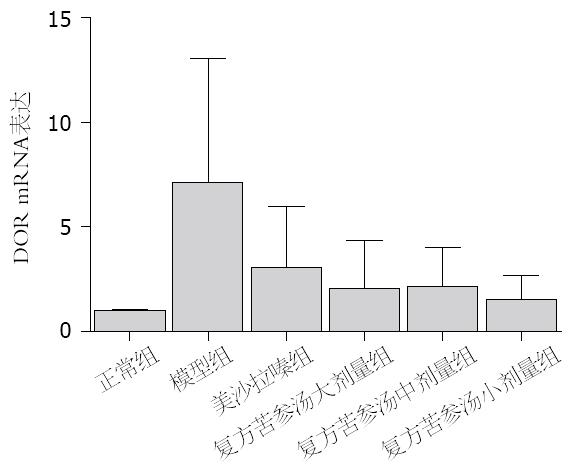
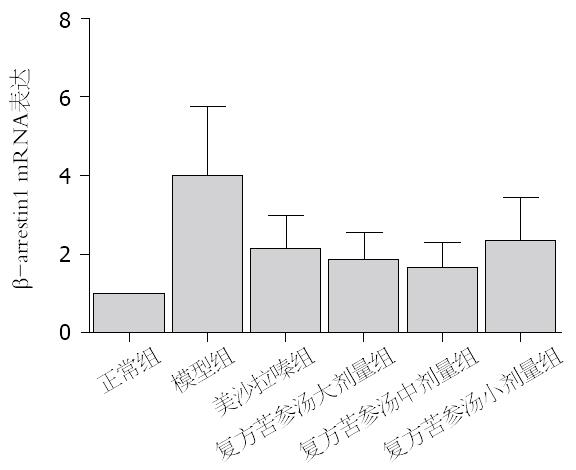
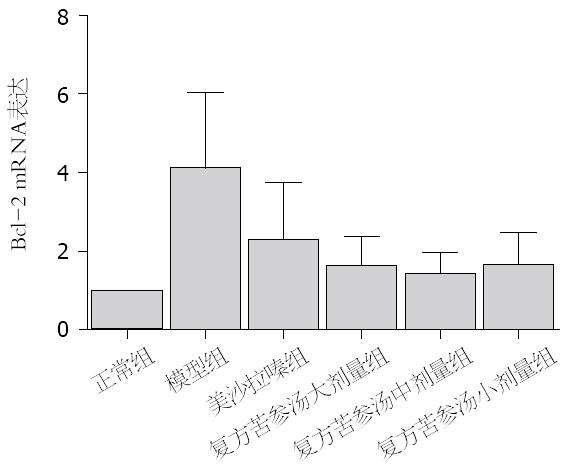
结果: 各组大鼠结肠组织中Bcl-2、β-arrestin1和DOR表达有显著差异(P<0.05). 与对照组比较, 模型组的大鼠结肠黏膜组织Bcl-2、β-arrestin1和DOR表达明显升高(24.11±12.61 vs 11.88±5.90, 38.90±5.30 vs 14.34±8.97, 23.57±9.96 vs 9.68±3.94, 均P<0.05); 与模型组比较, 美沙拉嗪组和复方苦参汤大、中、小剂量组的大鼠结肠黏膜组织Bcl-2、β-arrestin1、DOR表达均显著下降, 但美沙拉嗪组和复方苦参汤大、中、小剂量组之间比较Bcl-2、β-arrestin1、DOR表达无显著差异.
结论: 在实验性溃疡性结肠炎大鼠结肠组织中DOR、β-arrestin1和Bcl-2的表达升高, DOR-β-arrestin1-Bcl-2信号转导通路可能参与了溃疡性结肠炎的病理过程, 复方苦参汤可改善溃疡性结肠炎大鼠的结肠组织病理学改变, 机制可能与调节该信号通路有关.
引文著录: 范恒, 张丽娟, 钟敏, 刘星星, 段雪云, 左冬梅, 唐庆. 复方苦参汤对溃疡性结肠炎DOR-β-arrestin1-Bcl-2信号转导通路的干预作用. 世界华人消化杂志 2013; 21(8): 647-654
Revised: January 20, 2013
Accepted: February 20, 2013
Published online: March 18, 2013
AIM: To explore the intervention effect of Compound Sophorae Flavescentis decoction on the DOR-β-arrestin1-Bcl-2 signal transduction pathway in rats with ulcerative colitis.
METHODS: Eighty-four Sprague-Dawley rats were equally and randomly divided into normal control group, model group, mesalazine group, high-, medium-, and low-dose Compound Sophorae Flavescentis decoction groups. Except for the normal control group, ulcerative colitis was induced with trinitrobenzene sulfonic acid (TNBS) in rats of other groups. After induction of ulcerative colitis, bloody stools, mental state and diarrhea were observed and recorded daily. Two rats in the model group were randomly selected and executed on day 3 for observing pathological changes in the colon tissue. Rats in the mesalazine group and Compound Sophorae Flavescentis decoction groups were lavaged with mesalazine solution and Compound Sophorae Flavescentis decoction for 15 d, while those in the normal control group and model group were given equal volume of distilled water for the same duration. On day 16, the remaining rats were executed to detect histopathological changes in the colon tissue and the mRNA and protein expression of DOR, β-arrestin1 and Bcl-2 in the colon tissue by real-time PCR and immunohistochemistry, respectively.
RESULTS: The mRNA and protein expression of DOR, β-arrestin1 and Bcl-2 differed significantly among each group (P < 0.05). Compared to the normal control group, the mRNA and protein expression of DOR, β-arrestin1 and Bcl-2 protein was significantly increased (24.11 ± 12.61 vs 11.88 ± 5.90, 38.90 ± 5.30 vs 14.34 ± 8.97, 23.57 ± 9.96 vs 9.68 ± 3.94, all P < 0.05) in the colon mucosa in the model group. Compared to the model group, the mRNA and protein expression of DOR, β-arrestin1 and Bcl-2 in the colon mucosa was significantly decreased in the mesalazine group and Compound Sophorae Flavescentis decoction groups; however, the mRNA and protein expression of DOR, β-arrestin1 and Bcl-2 did not differ significantly between the mesalazine group and Compound Sophorae Flavescentis decoction groups.
CONCLUSION: The expression of DOR, β-arrestin1 and Bcl-2 is elevated in ulcerative colitis. The DOR-β-arrestin1-Bcl-2 signal transduction pathway may be involved in the pathogenesis of ulcerative colitis, and Compound Sophorae Flavescentis decoction may have a significant therapeutic effect against ulcerative colitis.
- Citation: Fan H, Zhang LJ, Zhong M, Liu XX, Duan XY, Zuo DM, Tang Q. Intervention effect of Compound Sophorae Flavescentis decoction on DOR-β-arrestin1-Bcl-2 signal transduction pathway in rats with ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2013; 21(8): 647-654
- URL: https://www.wjgnet.com/1009-3079/full/v21/i8/647.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i8.647
溃疡性结肠炎(ulcerative colitis, UC)的病因及发病机制尚不明确[1]. 目前认为溃疡性结肠炎是由环境、遗传、感染、肠黏膜屏障功能缺陷等多种因素相互作用导致的肠道黏膜免疫功能失调所致的复杂结果. 肠黏膜免疫调节功能紊乱在溃疡性结肠炎发病机制中起关键性作用, 在某些环境和遗传因素的作用下, 肠道微环境改变, 肠上皮细胞防御屏障遭到破坏, 肠腔抗原物质激活多种炎症相关信号转导通路, 引起肠黏膜异常免疫反应, 导致肠道炎症的发生. 活化的T淋巴细胞在肠黏膜内过度聚集是溃疡性结肠炎发病机制中的关键环节之一, 致使溃疡性结肠炎迁延不愈[2-4]. δ阿片受体(delta opioid receptor, DOR)是一种G蛋白偶联受体(G protein-coupled receptors, GPCR), 活化的DOR信号能诱导β-arrestin1向细胞核内转移, β-arrestin1募集组蛋白乙酰化酶p300至Bcl-2编码基因的启动子序列, 促进Bcl-2基因转录和Bcl-2表达, Bcl-2通过阻断半胱天冬酶(caspase)的活化和细胞色素C的释放抑制T细胞凋亡[5-10]. 复方苦参汤治疗溃疡性结肠炎取得了较好的治疗效果. 通过建立三硝基苯磺酸(trinitrobenzene sulfonic acid, TNBS)诱导的溃疡性结肠炎模型, 研究DOR-β-arrestin1-Bcl-2信号转导通路在溃疡性结肠炎发病机制中的作用, 探讨复方苦参汤对治疗溃疡性结肠炎的作用机制, 证明该通路参与了溃疡性结肠炎的发病机制, 复方苦参汤通过调节DOR-β-arrestin1-Bcl-2信号转导通路有效改善溃疡性结肠炎的组织病理学变化, 为治疗溃疡性结肠炎提供了新的治疗方法和途径.
健康成年SD♂大鼠84只, 清洁级, 体质量200 g±20 g, 由华中科技大学同济医学院动物中心提供[实验动物质量合格证SCXK(鄂)2004-0007及使用许可证SYXK(鄂)2004-0028]; 5%、2, 4, 6-TNBS(Sigma公司); 美沙拉嗪(法国爱的发制药集团), 规格500 mg×10袋/盒; 复方苦参汤中药饮片(购自武汉协和医院药剂科); 中药在湖北中医药大学药剂科经药用砂锅煎煮浓缩并消毒. β-arrestin1多克隆抗体(abcam, ab30299); DOR多克隆抗体(Enzo Life Sciences, ADI-905-745-100); Bcl-2多克隆抗体(BioVision, 3033-100); 即用型免疫组织化学Elivision plus试剂盒(鼠/兔)(迈新KIT-9901); 实时定量ToalRNA提取剂(D9108A), 逆转录(DRR036A)及PCR扩增试剂盒(DRR420A)均购自TaKaRa公司; 用Primer6.0软件设计DOR、Bcl-2、β-arrestin1及β-actin引物, 其序列如下: DOR上游: 5'-GCATCTGGGTCTTGGCTTCA-3', 下游: 5'-GCGAAGAGGAACACGCAGAT-3', 扩增产物片段长度151 bp; Bcl-2上游: 5'-TTTGATTTCTCCTGGCTGTCT-3', 下游: 5'-CTGATTTGACCATTTGCCTG-3', 扩增产物片段长度151 bp; β-arrestin1上游: 5'-GCTGTGGAACTGCCCTTTACC-3', 下游5'-CCATCATCCTCTTCGTCCTTG-3', 扩增产物片段197 bp; β-actin上游: 5'-CGTTGACATCCGTAAAGACCTC-3', 下游: 5'-TAGGAGCCAGGGCAGTAATCT-3', 扩增产物片段长度110 bp. 上述引物均由大连宝生物公司合成.
1.2.1 分组: 清洁级成年♂SD大鼠84只, 随机分为6组: (1)空白对照组; (2)模型对照组; (3)美沙拉嗪组; (4)复方苦参汤大剂量组; (5)复方苦参汤中剂量组; (6)复方苦参汤小剂量组, 每组14只.
1.2.2 模型建立及评价: 依据Morris等提出的方法采用TNBS灌肠建立大鼠溃疡性结肠炎模型[11-14], 操作如下: 各组大鼠禁食不禁水24 h, 用10%水合氯醛腹腔注射麻醉, 将直径为2 mm的橡胶软管经肛门缓缓插入8 cm, 用1 mL注射器注入5%TNBS 0.6 mL(溶于50%乙醇), 然后提起大鼠尾部倒立30 s防药液流出, 造模结束让大鼠平躺, 自然清醒后自由饮食.
1.2.3 药物干预和标本处理: 观察各组大鼠大便、精神状态及皮毛等变化3 d, 随机处死2只大鼠解剖, 镜下观察结肠组织大体病理变化情况, 造模成功后, 美沙拉嗪组的大鼠用美沙拉嗪悬液(0.5 g/L)3 mL/d灌胃, 复方苦参汤大、中、小剂量组的大鼠分别给予复方苦参汤药液(0.67、0.34、0.17 g/L)3 mL/d灌胃, 而模型组与正常对照组给予蒸馏水3 mL/d灌胃, 连续15 d. 每天观察记录实验大鼠的精神状态、大便和饮食情况. 第16天各组实验大鼠禁食不禁水24 h后处死, 选取距肛门8 cm处病变最明显结肠组织, 结肠组织分两部分, 一部分4%多聚甲醛固定, 石蜡包埋切片并HE染色, 镜下观察标本病理学改变; 另一部分标本组织液氮冰冻保存备用. 实验过程中各组均有因为灌胃操作、穿孔、误吸等死亡, 最后纳入统计为: 对照组11只、模型组12只、复方苦参汤大剂量组10只、中剂量组12只、小剂量组12只、美沙拉嗪组11只.
1.2.4 免疫组织化学法检测大鼠结肠黏膜组织DOR、β-arrestin1、Bcl-2蛋白表达: 常规石蜡包埋, 切片; 切片脱蜡和水化; 微波高压修复抗原, 冷却; 3%双氧水阻断内源性过氧化物酶; 正常山羊血清封闭液(5%BSA)孵育; 分别按稀释度1:400滴加兔抗鼠DOR多克隆抗体、1:200滴加兔抗鼠β-arrestin1多克隆抗体、1:500滴加兔抗鼠多克隆抗体, 4 ℃过夜; 每张切片滴加50 μL聚合酶增加剂A; 每张切片滴加50 μL试剂B酶标羊抗鼠兔抗IgG聚合物; 显色; 苏木素复染, 盐酸酒精分化, 切片脱水干燥, 透明, 中性树胶封片.在显微镜下观察免疫组织化学结果, 用图像分析软件Image-Pro Plus 6.0进行图像分析, 以黄色或棕黄色染色为阳性表达, 测定平均光密度值(mean density).
1.2.5 Real time-PCR检测结肠标本中Bcl-2、β-arrestin1及DOR mRNA表达: 将TRIzol 1 mL加入5 mL匀浆器, 然后将大约100 mg结肠组织放入匀浆器, 研磨; 将液体转入离心管中, 加入1/5RNAisoPlus体积量的氯仿, 上下颠倒充分混匀后, 冰上静置5 min, 4 ℃条件12 000 r/min离心, 15 min; 取上清液约300 μL于另一新的离心管内, 加入等体积异丙醇, 静置, 4 ℃条件12 000 r/min离心, 10 min; 弃上清, 向沉淀中加入现配75%冰乙醇1 mL清洗沉淀, 4 ℃条件7 500 r/min离心; 弃上清, 加入20 μL DEPC水溶解沉淀; 核酸分析仪检测RNA浓度. 逆转录(10 μL体系): 5×Prime Scrip Buffer 2 μL, Total RNA 0.5 μL, RNase 7.5 μL, 在逆转录PCR仪上设置反转录条件: 37 ℃ 15 min, 85 ℃ 5 s, 4 ℃, 运行程序, 将反转录合成的cDNA, 用SYBR Green荧光染料实时定量PCR 法检测. PCR扩增(10 μL体系): SYBR Premix ExTaq(2×)5 μL, 上下游引物(各0.2 pmol/μL)(10 μmol/L)0.4 μL, ROX Reference Dye(50×)0.2 μL, ddH2O 3.4 μL, cDNA(10倍稀释)1 μL; 反应条件: 95 ℃ 30 s, 95 ℃ 5 s, 60 ℃ 30 s, 40个循环, 4 ℃终止反应. PCR扩增使用Step OneTM Softwarev2.1 扩增仪用2-△△CT方法进行相对定量分析.
统计学处理 采用SPSS19.0统计软件进行统计学分析. 多组间两两比较采用单因素方差分析(One Way ANOVA)的LSD检验, P<0.05有统计学意义.
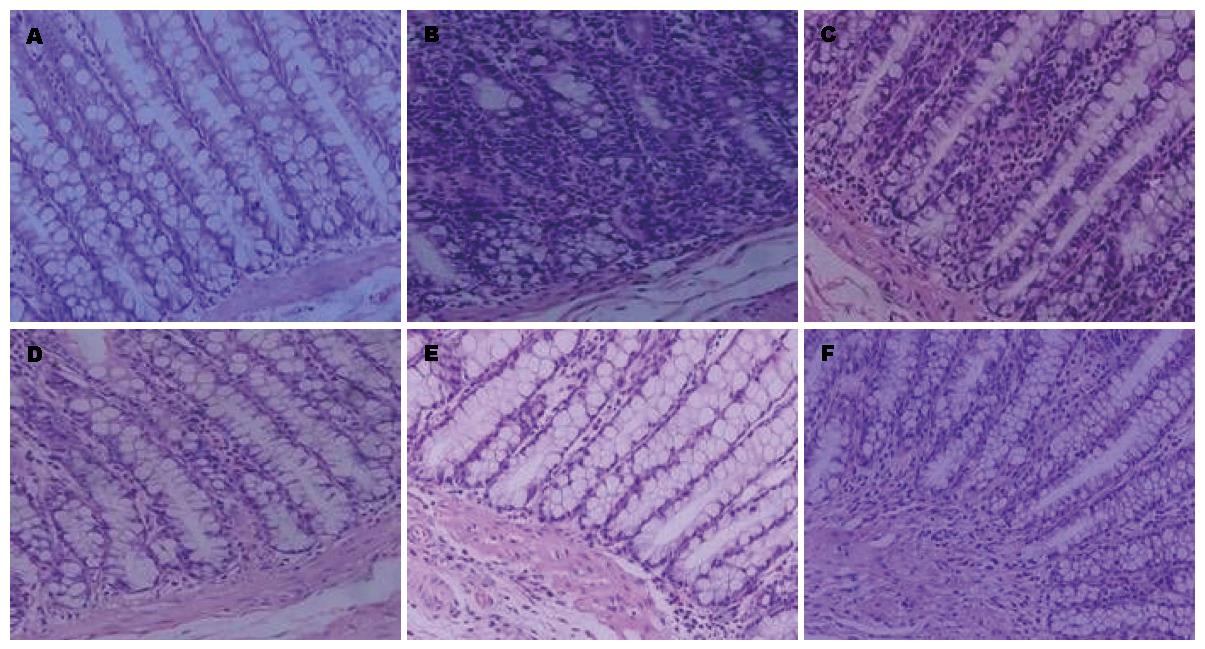
溃疡性结肠炎大鼠病变结肠组织切片常规HE染色后见正常对照组结肠组织黏膜纹理清晰, 结构完整, 腺体排列整齐, 无炎性细胞浸润; 模型组结肠黏膜腺体排列紊乱, 杯状细胞明显减少, 黏膜及黏膜下层充血水肿, 黏膜层可见炎性细胞浸润; 复方苦参汤大、中、小剂量组和美沙拉嗪组结肠黏膜结构尚完整, 黏膜层和固有层炎性细胞浸润减轻, 杯状细胞较模型组增多, 腺体排列较整齐(图1).
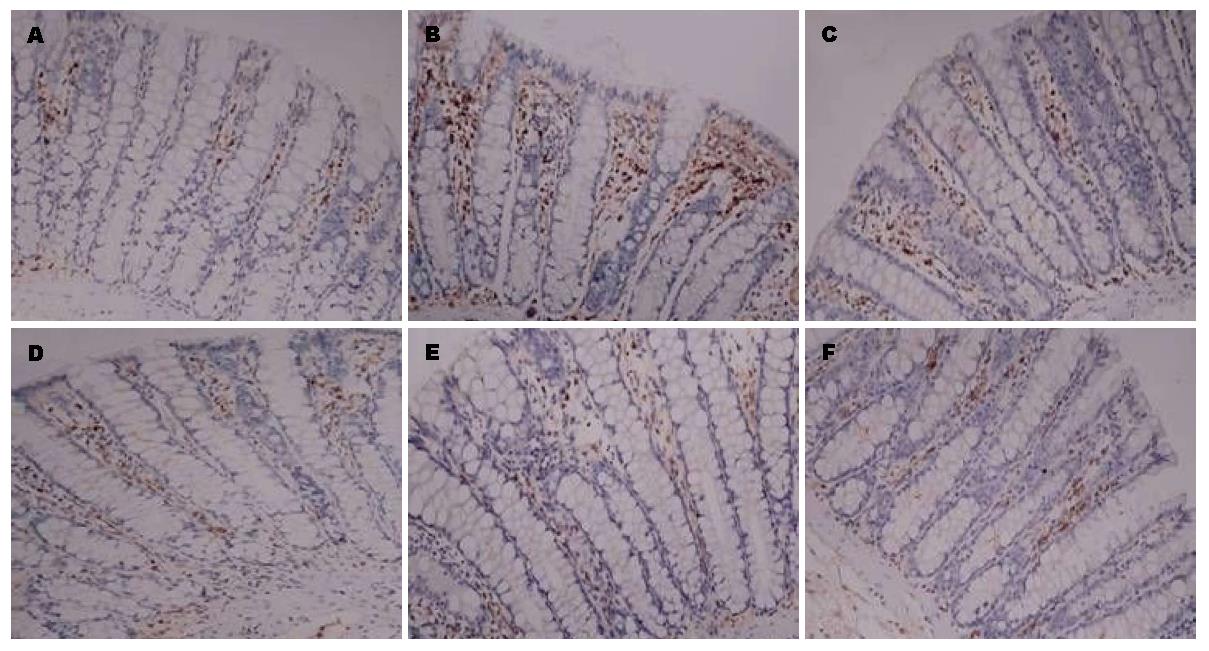
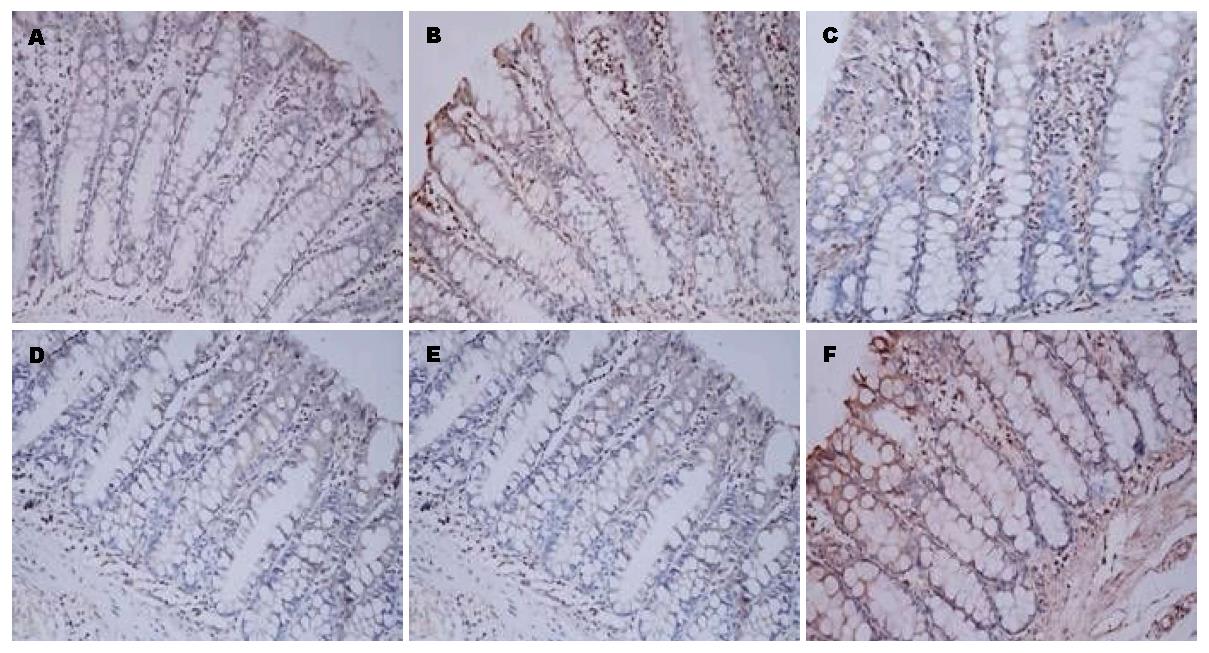
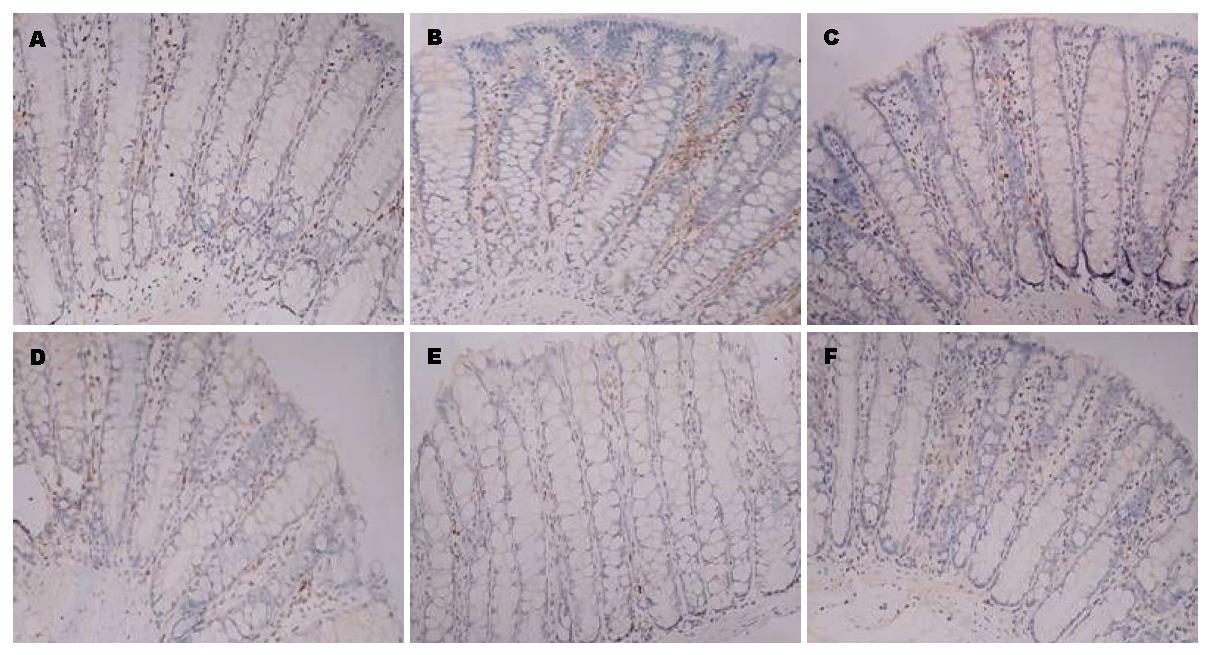
免疫组织化学技术研究证明与空白组比较, 模型组结肠组织中DOR、β-arrestin1和Bcl-2蛋白表达水平显著增高(P<0.05). 与模型组比较, 美沙拉嗪组和复方苦参汤大、中、小剂量组结肠组织中DOR、β-arrestin1和Bcl-2蛋白表达明显下降(P<0.05). 但美沙拉嗪组和复方苦参汤大、中、小剂量组4组间采取两两比较, DOR、β-arrestin1和Bcl-2蛋白表达无显著差异(图2, 图3, 图4, 表1).
与空白组比较, 模型组结肠组织中DOR、β-arrestin1和Bcl-2 mRNA表达水平显著增高(P<0.05). 与模型组比较, 美沙拉嗪组和复方苦参汤大、中、小剂量组脾脏和结肠组织中DOR、β-arrestin1和Bcl-2 mRNA表达明显下降(P<0.05). 但美沙拉嗪组和复方苦参汤大、中、小剂量组4组间采取两两比较, DOR、β-arrestin1和Bcl-2 mRNA表达无显著差异(图5, 图6, 图7).
目前, 溃疡性结肠炎与肠黏膜免疫功能失调相关, 主要表现为结肠黏膜表浅广泛缺失及固有层炎症改变, 与细胞坏死和细胞凋亡有关[15], 虽然其病因及发病机制尚未明确, 但是细胞凋亡在结肠黏膜的缺失及溃疡形成中的作用已达成共识[16]. DOR是GPCR家族成员[17]. β-arrestin1为arrestins家族的主要成员之一, 是一种可溶蛋白质, 在细胞质和细胞核内都有分布[18]. β-arrestin分子的经典功能是终止GPCR下游信号转导, 可以通过其下游的效应因子相互作用调节G蛋白信号, 同时, 其还是细胞质和细胞核之间传递GPCR信号的信使分子[19,20]. β-arrestin1不仅可以介导GPCRS的内吞[21-23], 还是其信号转导的转换者, 与G蛋白下游信号分子形成复合物, 调节G-蛋白偶联受体信号转导[24].
Bcl-2为凋亡相关基因, Bcl-2基因家族对细胞凋亡基因调控起着关键作用, Bcl-2基因位于染色体18q21, 其编码一个26 kDa的蛋白, 有延长细胞寿命, 增加细胞对多种凋亡刺激因素抗性的生物功能[25]. Bcl-2是一种细胞凋亡抑制蛋白, 同时Bcl-2也是β-arrestin1调控的靶基因. 当DOR激活, GPCR信号通路的细胞质和细胞核间信号传递分子β-arrestin1, 能将GPCR胞膜上的信号传递至细胞核中[26], 并在p27启动子区聚集, 使此区的组蛋白H4乙酰化, 促进p27和Bcl-2的基因转录, 并且介导组蛋白酰化酶p300在此区域的招募从而调控基因表达[27,28].
我们研究表明与正常对照组相比, 模型组实验大鼠结肠组织中DOR、β-arrestin1及Bcl-2蛋白和mRNA表达均明显升高(P<0.05), 可能通过激活DOR信号、调节β-arrestin1功能和促进抗凋亡蛋白Bcl-2表达, 抑制了溃疡性结肠炎肠黏膜的CD4+T细胞凋亡, 结肠黏膜内CD4+T细胞过度持续聚集, 致使溃疡性结肠炎反复发作, 故我们认为DOR-β-arrestin1-Bcl-2信号转导通路可能参与了溃疡性结肠炎的发病过程.
溃疡性结肠炎属于祖国医学"痢疾""泄泻"、"休息痢"等范畴, 《难经》称为"大瘕泄". 本病是本虚标实的病症, 急性期主要以表实为主, 即湿热蕴结、血热妄行为主, 故治以清热燥湿凉血, 通过实验和临床研究发现, 复方苦参汤治疗急性发作期疗效较好. 复方苦参汤(compound sophorae flavescentis decoction, CSFD)由苦参、地榆、青黛、白及、甘草等组成. 现代药理研究表明苦参的主要成分氧化苦参碱及苦参碱等具有抗炎、抗菌、抗病毒和抗肿瘤作用, 抑制体液免疫和调节细胞免疫, 并可直接用于治疗UC; 青黛能降低毛细血管的通透性, 对平滑肌有抑制作用, 可调节机体免疫功能, 具有类皮质激素样作用, 具有较强的抗肿瘤、抗病毒和抗菌功效, 能有效清除氧自由基, 稳定细胞膜通透性, 具有较好的镇痛作用, 为治疗UC提供了依据; 地榆能缩短凝血时间, 使烫伤面积减少, 有抗菌及收敛止泄作用; 白及能在溃疡面上形成保护膜, 促进肠黏膜的修复, 抑制病菌的生长, 止血作用明显, 较强的黏附能力, 能将药物黏附于病变组织发挥作用. CSFD具有生肌止血、消肿敛疮、清热解毒、燥湿、杀虫、凉血止血之功效[29-31]. 实验发现经复方苦参汤和美沙拉嗪治疗后, 实验大鼠体质量、饮食较前增加, 大便次数减少, 成形, 无脓血便, 毛发光滑等得到明显的改善, 与模型组相比, 4个治疗组实验大鼠结肠组织中Bcl-2、β-arrestin1及DOR mRNA和蛋白表达均明显降低(P<0.05). 美沙拉嗪组和复方苦参汤大、中、小剂量组之间比较Bcl-2、β-arrestin1及DOR mRNA和蛋白表达, 无显著差异, 表明复方苦参汤和美沙拉嗪可能通过对DOR-β-arrestin1-Bcl-2信号转导通路的干预, 对溃疡性结肠炎达到治疗的目的, 与西药相比中药汤剂价格便宜, 不良反应小, 故我们认为复方苦参汤可能通过对DOR-β-arrestin1-Bcl-2信号转导通路的干预, 促使肠道内T细胞的凋亡, 为复方苦参汤治疗溃疡性结肠炎提供新的分子机制理论.
总之, 在实验大鼠结肠黏膜组织中Bcl-2、β-arrestin1及DOR表达明显升高, 致使UC肠黏膜T细胞凋亡抑制, 在肠黏膜过度聚集致使UC反复发作. 经复方苦参汤治疗后, 实验大鼠体质量、饮食较前增加, 大便次数减少, 成形, 无脓血便, 毛发光滑等症状得到明显的改善, Bcl-2、β-arrestin1及DOR表达显著降低, 故复方苦参汤可能通过对DOR-β-arrestin1-Bcl-2信号通路活化环节的干预, 促进肠黏膜中T细胞凋亡, 减轻溃疡性结肠炎的症状, 达到治疗的效果.
溃疡性结肠炎(UC)是一种发病机制尚不明确的慢性非特异性炎症性肠道疾病. 近几十年来在我国其发病率逐年增加. 肠黏膜免疫调节功能紊乱, 在其发病中起关键性作用. 在遗传和环境作用下, 机体肠道菌群产生异常免疫反应, 最终导致肠道慢性炎症的发生. 治疗上目前也没有较成熟的方案. 因此, 对本病的发病机制和治疗上的研究显得十分必要.
张春虎, 副教授, 中南大学湘雅医院中西医结合研究所; 李勇, 副教授, 上海中医药大学附属市中医医院消化科
本研究运用实施荧光定量PCR和免疫组织化学的方法, 从基因和蛋白水平来分析δ阿片受体(DOR)、β-arrestin1及Bcl-2表达的作用机制, 阐明复方苦参汤对UC的治疗作用.
临床上本课题组用复方苦参肠溶胶囊治疗UC取得良好的临床效果.
本文通过研究大鼠结肠中DOR、β-arrestin1及Bcl-2的表达情况及DOR-β-arrestin1-Bcl-2信号通路作用机制, 为阐明复方苦参汤治疗作用靶点提供理论依据.
本研究发现复方苦参汤和美沙拉嗪均可以有效治疗溃疡性结肠炎, 特别复方苦参汤对该病有较好的治疗作用, 却没有西药的不良反应, 值得进一步研究和开发, 有一定的临床应用前景.
复方苦参汤: 由苦参、地榆、青黛、白及、甘草等组成.
本文实验动物模型选择合理, 实验命题明确, 研究方法选用得当, 讨论条理尚清晰, 结果尚客观, 有一定的学术价值.
编辑: 李军亮 电编: 闫晋利
| 1. | Ordás I, Eckmann L, Talamini M, Baumgart DC, Sandborn WJ. Ulcerative colitis. Lancet. 2012;380:1606-1619. [PubMed] [DOI] |
| 2. | Baumgart DC, Carding SR. Inflammatory bowel disease: cause and immunobiology. Lancet. 2007;369:1627-1640. [PubMed] [DOI] |
| 3. | Sartor RB. Mechanisms of disease: pathogenesis of Crohn's disease and ulcerative colitis. Nat Clin Pract Gastroenterol Hepatol. 2006;3:390-407. [PubMed] [DOI] |
| 4. | Monteleone G, Caprioli F. T-cell-directed therapies in inflammatory bowel diseases. Clin Sci (Lond). 2010;118:707-715. [PubMed] [DOI] |
| 5. | Filippi J, Roger PM, Schneider SM, Durant J, Breittmayer JP, Benzaken S, Bernard A, Dellamonica P, Hébuterne X. Infliximab and human immunodeficiency virus infection: Viral load reduction and CD4+ T-cell loss related to apoptosis. Arch Intern Med. 2006;166:1783-1784. [PubMed] [DOI] |
| 6. | Van den Brande JM, Koehler TC, Zelinkova Z, Bennink RJ, te Velde AA, ten Cate FJ, van Deventer SJ, Peppelenbosch MP, Hommes DW. Prediction of antitumour necrosis factor clinical efficacy by real-time visualisation of apoptosis in patients with Crohn's disease. Gut. 2007;56:509-517. [PubMed] |
| 7. | Kucharzik T, Maaser C, Lügering A, Kagnoff M, Mayer L, Targan S, Domschke W. Recent understanding of IBD pathogenesis: implications for future therapies. Inflamm Bowel Dis. 2006;12:1068-1083. [PubMed] [DOI] |
| 8. | Mudter J, Neurath MF. Apoptosis of T cells and the control of inflammatory bowel disease: therapeutic implications. Gut. 2007;56:293-303. [PubMed] [DOI] |
| 9. | Shi Y, Feng Y, Kang J, Liu C, Li Z, Li D, Cao W, Qiu J, Guo Z, Bi E. Critical regulation of CD4+ T cell survival and autoimmunity by beta-arrestin 1. Nat Immunol. 2007;8:817-824. [PubMed] [DOI] |
| 10. | Frederick TJ, Miller SD. Arresting autoimmunity by blocking beta-arrestin 1. Nat Immunol. 2007;8:791-792. [PubMed] [DOI] |
| 11. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] |
| 12. | Giriş M, Depboylu B, Doğru-Abbasoğlu S, Erbil Y, Olgaç V, Aliş H, Aykaç-Toker G, Uysal M. Effect of taurine on oxidative stress and apoptosis-related protein expression in trinitrobenzene sulphonic acid-induced colitis. Clin Exp Immunol. 2008;152:102-110. [PubMed] [DOI] |
| 13. | Fan H, Shen L, Tang Q, Xiong P, Shou Z, Liao Y, Liang L, Chen X. Effect of Wumeiwan on cytokines TNF-alpha, IL-6, IL-8, IL-10 and expression of NF-kappaBp65 in rats with ulcerative colitis. J Huazhong Univ Sci Technolog Med Sci. 2009;29:650-654. [PubMed] [DOI] |
| 14. | Fan H, Qiu MY, Mei JJ, Shen GX, Liu SL, Chen R. Effects of four regulating-intestine prescriptions on pathology and ultrastructure of colon tissue in rats with ulcerative colitis. World J Gastroenterol. 2005;11:4800-4806. [PubMed] |
| 15. | Seidelin JB, Nielsen OH. Epithelial apoptosis: cause or consequence of ulcerative colitis? Scand J Gastroenterol. 2009;44:1429-1434. [PubMed] |
| 16. | Li Z, Zhang de K, Yi WQ, Ouyang Q, Chen YQ, Gan HT. NF-kappaB p65 antisense oligonucleotides may serve as a novel molecular approach for the treatment of patients with ulcerative colitis. Arch Med Res. 2008;39:729-734. [PubMed] [DOI] |
| 17. | Piestrzeniewicz MK, Fichna J, Janecka A. [Opioid receptors and their selective ligands]. Postepy Biochem. 2006;52:313-319. [PubMed] |
| 18. | Ibrahim IA, Kurose H. β-arrestin-mediated signaling improves the efficacy of therapeutics. J Pharmacol Sci. 2012;118:408-412. [PubMed] [DOI] |
| 19. | Warren JS. Intrapulmonary interleukin 1 mediates acute immune complex alveolitis in the rat. Biochem Biophys Res Commun. 1991;175:604-610. [PubMed] [DOI] |
| 20. | Shenoy SK, Lefkowitz RJ. β-Arrestin-mediated receptor trafficking and signal transduction. Trends Pharmacol Sci. 2011;32:521-533. [PubMed] [DOI] |
| 21. | Alvarez CE. On the origins of arrestin and rhodopsin. BMC Evol Biol. 2008;8:222. [PubMed] [DOI] |
| 22. | Patel PA, Tilley DG, Rockman HA. Physiologic and cardiac roles of beta-arrestins. J Mol Cell Cardiol. 2009;46:300-308. [PubMed] [DOI] |
| 23. | Shenoy SK, Lefkowitz RJ. Seven-transmembrane receptor signaling through beta-arrestin. Sci STKE. 2005;2005:cm10. [PubMed] |
| 25. | Cvejic D, Selemetjev S, Savin S, Paunovic I, Petrovic I, Tatic S. Apoptosis and proliferation related molecules (Bcl-2, Bax, p53, PCNA) in papillary microcarcinoma versus papillary carcinoma of the thyroid. Pathology. 2008;40:475-480. [PubMed] [DOI] |
| 26. | Kang J, Shi Y, Xiang B, Qu B, Su W, Zhu M, Zhang M, Bao G, Wang F, Zhang X. A nuclear function of beta-arrestin1 in GPCR signaling: regulation of histone acetylation and gene transcription. Cell. 2005;123:833-847. [PubMed] [DOI] |
| 27. | Ulukaya E, Acilan C, Yilmaz Y. Apoptosis: why and how does it occur in biology? Cell Biochem Funct. 2011;29:468-480. [PubMed] [DOI] |
| 28. | Martinou JC, Youle RJ. Mitochondria in apoptosis: Bcl-2 family members and mitochondrial dynamics. Dev Cell. 2011;21:92-101. [PubMed] [DOI] |
| 30. | 范 恒, 寿 折星, 吕 建芳, 沈 霖, 杨 胜兰, 陈 瑞. 复方苦参结肠溶胶囊治疗溃疡性结肠炎11例临床研究. 中国中西医结合消化杂志. 2007;15:60, 61. |