修回日期: 2013-01-09
接受日期: 2013-01-18
在线出版日期: 2013-03-08
目的: 明确黄芪、三七及其配伍对萎缩性胃炎大鼠胃黏膜热休克蛋白70(heat shock protein 70, HSP70)及其转录因子GAF表达的影响.
方法: 清洁级Wistar大鼠54只, 随机分为空白组、模型组、替普瑞酮组、黄芪组、三七组、黄芪+三七组. 运用幽门弹簧配合高盐热淀粉糊灌胃法制备萎缩性胃炎模型后, 分别给予空白组、模型组(生理盐水2 mL/d)、黄芪组[黄芪水煎剂3.5 g/(kg·d)]、三七组[三七粉冲剂0.7 g/(kg·d)]、黄芪+三七组{黄芪三七溶液灌胃[其中黄芪3.5 g/(kg·d)、三七0.7 g/(kg·d)]}、替普瑞酮组[200 mg/(kg·d)]灌胃. 连续给药1 mo后, 取大鼠胃组织, 经量子点免疫荧光组织化学方法测定各组大鼠胃黏膜中HSP70蛋白及其转录因子GAF表达量.
结果: 同模型组相比, 黄芪组、三七组、黄芪+三七组以及替普瑞酮组胃黏膜中HSP70的表达有显著性差异(P = 0.0000, 0.0269, 0.0020, 0.006); 同时上述各组HSP70转录因子GAF的表达, 亦显著性高于模型组(P = 0.0000, 0.0000, 0.0010 0.0052); 黄芪组HSP70表达高于三七组(P = 0.0134), 但HSP70转录因子GAF的表达在两组间无统计学差异.
结论: 黄芪、三七及其配伍可以明显改善萎缩性胃炎大鼠胃黏膜状态; 通过诱导并增加转录因子GAF的表达, 促进热休克蛋白70的表达, 可能是黄芪、三七治疗萎缩性胃炎的作用途径之一.
引文著录: 张会存, 史瑞, 李健, 李晓红, 李军祥, 杨美娟. 黄芪、三七对萎缩性胃炎大鼠胃黏膜HSP70及其转录因子GAF表达的影响. 世界华人消化杂志 2013; 21(7): 559-566
Revised: January 9, 2013
Accepted: January 18, 2013
Published online: March 8, 2013
AIM: To evaluate the effect of astragalus, Panax notoginseng and their mixture on expression of heat shock protein 70 (HSP70) and GAF in atrophic gastritis in rats.
METHODS: Fifty-four healthy male Wistar rats were randomly divided into six groups: control group, model group, teprenone group, astragalus group, Panax notoginseng group and astragalus plus Panax notoginseng group. Atrophic gastritis was induced by implanting a pylorus spring and intragastrically administering hot salty starch paste. The control and model groups were given normal saline (2 mL) daily, while other groups were infused with water decoction of astragalus containing crude drug 3.5 g/(kg·d), the Panax notoginseng powder containing crude drug 0.7 g/(kg·d), Panax notoginseng powder and astragalus water decoction, and teprenone water suspension containing teprenone 200 mg/(kg·d) for one month by gavage, respectively. The expression of heat shock protein 70 and GAF in the rat gastric mucosa was measured using quantum dot immunofluorescence histochemical technology.
RESULTS: HSP70 protein expression in the astragalus, Panax notoginseng, astragalus plus Panax notoginseng and teprenone groups was significantly increased (all P < 0.05) compared to the model group. The expression of GAF in the astragalus, Panax notoginseng, astragalus plus Panax notoginseng and teprenone groups was also increased significantly compared to the model group (all P < 0.01). Although the expression of HSP70 in the astragalus group was higher than that in the Panax notoginseng group (P < 0.05), there was no significant difference in the expression of GAF between the two groups (P > 0.05).
CONCLUSION: Astragalus, Panax notoginseng and their combination can improve mucosal atrophy in rats with atrophic gastritis by increasing GAF and HSP70 expression. GAF and HSP70 may be potential therapeutic targets for atrophic gastritis.
- Citation: Zhang HC, Shi R, Li J, Li XH, Li JX, Yang MJ. Effect of astragalus and Panax notoginseng on expression of heat shock protein 70 and GAF in atrophic gastritis in rats. Shijie Huaren Xiaohua Zazhi 2013; 21(7): 559-566
- URL: https://www.wjgnet.com/1009-3079/full/v21/i7/559.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i7.559
萎缩性胃炎(atrophic gastritis, AG)是以胃黏膜的腺体萎缩或伴有不同程度的肠上皮化生与异型增生为病理特征的胃黏膜慢性炎症病变, 为我国消化系统常见病和疑难病, 恶性发生率约为2.5%-7.46%[1]. 其症状多以脾虚证的表现为主, 如胃脘隐痛、喜温喜按、面色不华、倦怠乏力、食少便溏、舌淡胖、边有齿痕、脉沉细无力等. 久病多瘀, AG患者也兼见胃脘隐痛、痛有定处, 舌有瘀斑, 舌下脉络曲张等血瘀证表现,胃镜下黏膜萎缩呈颗粒状、皱褶变平、血管透见、可有灰色肠上皮化生结节, 故脾胃气虚, 瘀血内停证为AG的常见证型之一. 黄芪、三七分别为健脾益气和活血化瘀药的代表药, 多用于治疗AG. 本课题组前期运用基因芯片技术研究[2]发现: 益气活血法能够通过促进热休克蛋白70(heat shock protein 70, HSP70)基因的转录, 改善AG大鼠胃黏膜病变. 因此, 为了进一步明确益气活血法在萎缩性胃炎治疗中对HSP70的调控作用, 本实验运用量子点免疫荧光组织化学技术研究了代表益气活血法的黄芪、三七及其配伍对萎缩性胃炎大鼠HSP70及其转录因子GAF的影响, 为其临床应用提供理论依据.
黄芪(产地内蒙古, 北京同仁堂药材有限公司, 北京中医药大学中药学院中药鉴定系张媛教授鉴定为蒙古黄芪), 三七粉(产地云南, 北京同仁堂药材有限公司), 替普瑞酮胶囊[施维舒, 卫材(中国)药业有限公司]. Wistar♂大鼠, 54只, 体质量200 g±20 g, SPF级, 北京维通利华实验动物技术有限公司[实验动物许可证编号: SCXK(京)2006-0009], 常规饲养于北京中医药大学SPF级动物房. 抗HSP70/72小鼠单克隆抗体(美国Assay Designs公司), 抗GAF抗体(美国Santa公司), 605 nm ODs-SA(605 nm量子点标记的链霉亲和素复合物)检测试剂盒(武汉珈源量子点技术开发有限公司).
1.2.1 造模: 造模时间为4 mo, 方法参考史瑞等[3]研究.
1.2.2 分组及给药: Wistar大鼠按质量随机区组设计法随机分为空白组、模型组. 空白组予生理盐水2 mL/d灌胃; 模型组模型制备参见史瑞等幽门弹簧置入联合高盐热淀粉糊灌胃法[3]. 模型成功后, 将模型组大鼠按体质量随机区组设计法随机分为模型组、黄芪组、三七组、黄芪+三七组、替普瑞酮组. 模型组予生理盐水2 mL/d灌胃; 黄芪组予黄芪水煎剂3.5 g/(kg·d)灌胃; 三七组予三七粉冲剂0.7 g/(kg·d)灌胃; 黄芪+三七组予黄芪三七溶液灌胃[其中黄芪3.5 g/(kg·d)、三七0.7 g/(kg·d)]; 替普瑞酮组予替普瑞酮200 mg/(kg·d), 治疗1 mo后处死, 取大鼠胃组织, 福尔马林固定.
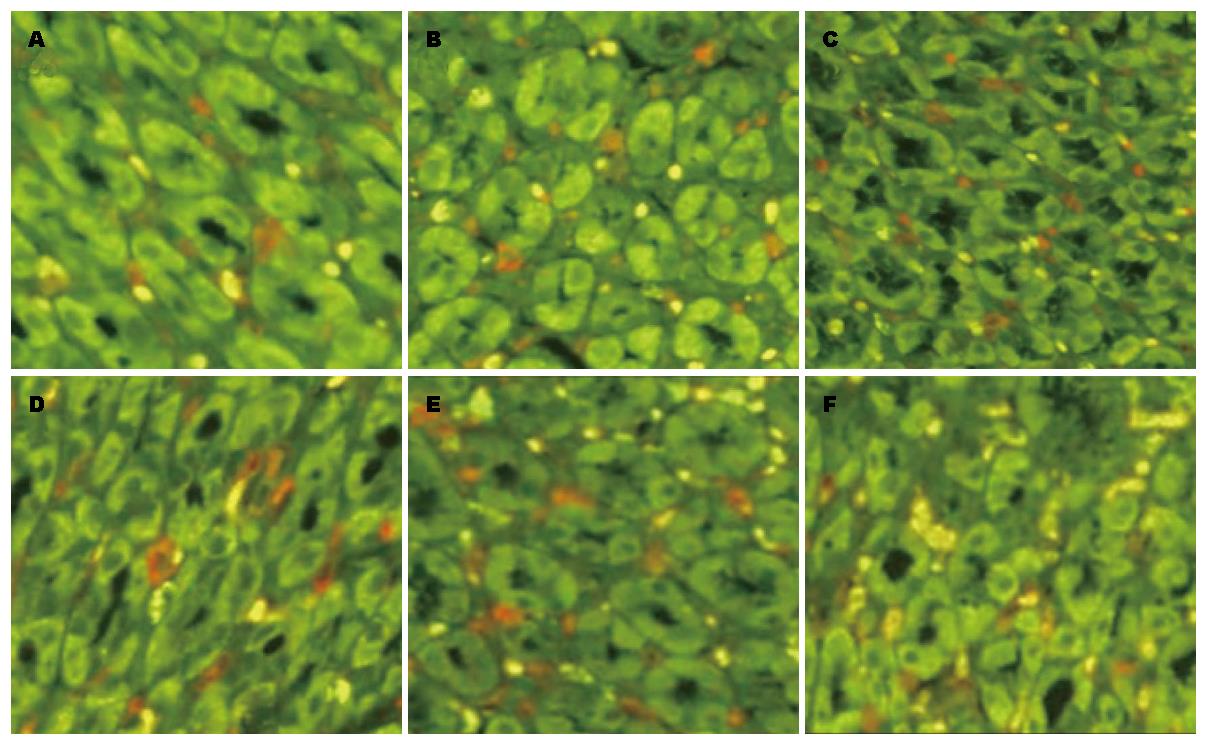
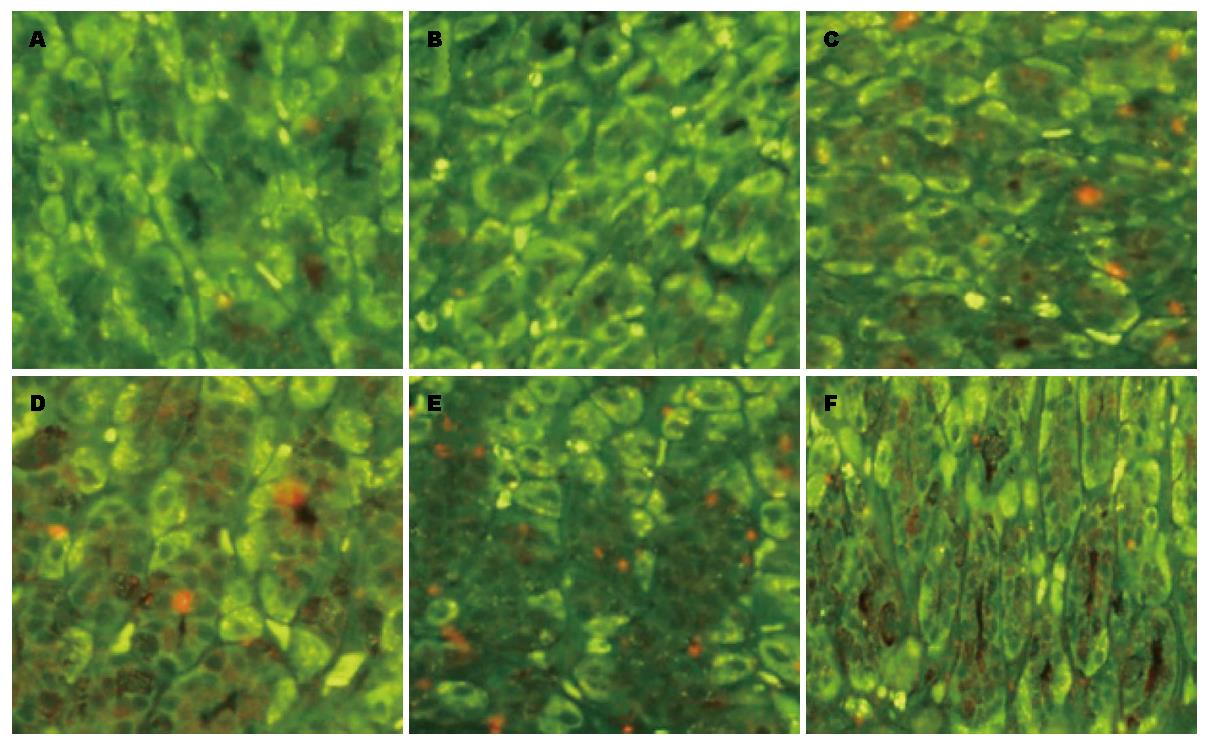
1.2.3 检测方法: 胃组织切片脱蜡、水化、微波抗原修复、TBS洗涤, 封闭缓冲液37 ℃湿盒孵育60 min, 分别滴加HSP70、GAF抗体, 37 ℃孵育2 h, TBS-T漂洗5 min/次×3次, 封闭缓冲液37 ℃湿盒孵育20 min, 滴加QDs-SA标记的二抗, 37 ℃湿盒孵育30 min, TBS-T漂洗5 min/次×3次, 滴加缓冲甘油封片剂封片. 荧光显微镜下观察, HSP70、GAF蛋白的阳性信号均为红色. 切片经奥林巴斯BX51荧光显微镜及其配备的奥林巴斯DP72相机(日本奥林巴斯光学工业有限公司)拍照.
统计学处理 图片经CRiNuance多光谱成像系统(美国剑桥研究与仪表公司), 进行图像分析后, 计量各组蛋白量子点荧光信号的荧光强度, 每组取5个视野进行统计. 实验数据采用统计软件SPSS13.0进行单因素方差分析, 实验结果采用mean±SD表示, P<0.05认为组间有统计学意义, P<0.01认为组间有显著性差异.
空白组与模型组相比较, 胃黏膜HSP70蛋白表达量相接近, 两组之间无统计学差异. 与模型组比较, 黄芪组、三七组、黄芪+三七组, 替普瑞酮组胃黏膜HSP70表达显著升高(P = 0.0000, 0.0269, 0.0020, 0.006); 黄芪组HSP70表达量高于空白组、模型组及三七组(P = 0.0000, 0.0000, 0.0134); 黄芪组与黄芪+三七组相比,HSP70表达差异无统计学意义(P = 0.1251, 图1, 表1).
热休克蛋白(heat shock protein, HSP)是生物有机体经外界的刺激后, 转录合成的蛋白质, 有人形象称其为应激蛋白(stress protein, SP). HSPs是一组具有重要生理功能、高度保守的蛋白质分子[4], 研究显示, 诱导性HSP70家族可以修复损伤的前核糖体、防止溶酶体破坏、稳定细胞膜, 从而维持细胞正常的形态和功能[5-7]. 热休克蛋白不但支持新生多肽和蛋白质的跨膜运输与折叠[8], 同时也参与调节免疫反应, 包括抗原提呈与交叉呈递. 当外界刺激存在时会显著上调热休克蛋白的表达, 以保护细胞免受致命伤害并防止病原体的传播[9,10].
根据分子量大小, 目前学术界将HSP分为4类: HSP90家族、HSP70家族、HSP60及小分子量HSP家族[11], 此外还有特性不同于上述家族的大分子量HSP. 热休克蛋白70(HSP70)是热休克蛋白70家族中的重要成员之一, 是目前研究的热点. 该蛋白在多种应激状态下, 如高温、缺氧、发热、炎症、放射、组织损伤、重金属、代谢性疾病、肿瘤等情况下均可被诱导表达, 具有多种生理功能, 包括分子伴侣功能、参与免疫反应、抗细胞凋亡、抗氧化、提高细胞应激耐受性、促进细胞增殖、参与细胞骨架的形成和修复等[12-18].
人类基因组编码HSP70家族的13个成员[19], 目前研究并了解最多的是诱导型HSP70/HSP72(HSPA1A), 组成型HSC70/HSP73/HSC73(HSPA8)存在于内质网, Grp78/BiP(HSPA5)和HSP75/mtHSP70/mortalin/TRAP-1(HSPA9), 主要定位在线粒体[20]. 目前研究主要集中于胞质中的诱导型HSP70介导的细胞保护、抗细胞凋亡与免疫调节作用等. 在中风、败血症、急性呼吸窘迫综合征、肾功能衰竭等实验模型中, 发现随着HSP70的表达增强, 不但可以减少脏器损伤, 而且在某些情况下, HSP70可以提高受试对象的生存率[21-23]. 此外, 在胚胎的正常发育过程中, HSP70防止有害应激对胚胎造成损害[24].
本课题组前期研究发现, 益气活血法代表药物能够逆转萎缩性胃炎大鼠胃黏膜萎缩, 并利用基因芯片已明确益气活血法代表药物可以上调HSP70基因表达, 提示HSP70基因的转录环节可能是益气活血法的靶点之一[2].
经典分子生物学关于基因转录调控的理论认为, 真核基因表达过程为: 基因结构活化→转录→翻译. 因为基因转录需要由RNA聚合酶Ⅱ、转录因子等组成的转录复合物与DNA模板结合, 而真核生物的染色体是由各2分子H2A、H2B、H3及H4组蛋白所构成的核心八聚体及其围绕的DNA分子所形成的致密核小体为基本组成单位所构成的, 因此未转录的DNA分子呈致密压缩状态, 而基因进行转录后, 首先要将核小体结构松解, 使DNA处于伸展的状态, 为转录做准备, 这一过程需要特殊的转录因子参与.
人类HSP70基因结构不含有内含子[25], 热休克蛋白的基因调控主要包括转录水平调控及翻译水平调控, 且热休克反应的调节主要发生于转录水平[26]. HSP70基因在正常状态下仅转录约25个核苷酸后就暂停. 应激状态下, HSP70的转录迅速被激活, 产生大量HSP70, 发挥细胞保护作用. 这一过程需要多种转录因子的参与才能顺利完成. 转录因子GAF参与了应激前的转录暂停, GAF可以利用ATP水解提供的能量, 使邻近核小体重新定位(重排), 活化启动子的基因结构, 转化为可转录状态, 即GAF转录因子可使HSP70的基因结构处于活化状态, 从而有利于激活的热休克转录因子(HSF)与相应的热休克反应元件(HSE)结合, 进而启动转录[27-35]. GAF是一种通用的、组成性表达的转录因子, 也是可引起RNA聚合酶II休止的关键因子. GAF与GAGA元件结合后影响下游的核小体结构, 使其下游序列中的启动子迅速与RNA聚合酶形成转录起始复合物后开始转录, GAGA元件的缺失可造成休止的RNA聚合酶Ⅱ水平下降, HSP基因的转录被明显抑制[36].
在现代分子生物学研究中荧光分析法具有重要作用, 但其检测灵敏度主要由标记物的发光强度和光化学稳定性所决定. 传统的有机荧光染料自身的一些缺陷, 例如, 激发光谱窄, 容易淬灭以及自身的毒性等, 限制了其在生命科学中的应用. Nie和Alivisatos等[37,38], 于1998年在Science上发表了关于量子点对细胞以及组织标记成像研究的成果, 从此开启了量子点技术在生物学领域的应用. 并随着技术的成熟, 量子点作为新型的标记物, 开始广泛应用在蛋白质DNA等生物大分子的标记以及活体动物靶细胞的追踪等一系列现代分子生物学领域, 并取得了令人满意的实验结果.
新型纳米荧光材料量子点又称半导体纳米晶, 是一类由Ⅱ-Ⅵ族和Ⅲ-Ⅴ族元素组成的纳米颗粒. 生物标记中常见的CdSe量子点粒径在1.8-7.0 nm变化时[39-41], 与传统荧光染料相比, 量子点具有独特的荧光性质, 其发射荧光可覆盖整个可见光区, 荧光发射波长可控、发射峰狭窄对称, 激发谱宽而连续, 消光系数大、荧光强度高, 光稳定性好、易与生物分子偶联. 可检测低丰度抗原表达, 能够更加准确地检测目标靶蛋白的表达情况, 特异性强, 信噪比高. 其在生物医学分析领域展示出极大的应用前景.
本研究采用特异性强, 具有上述优点的的量子点标记的免疫荧光法检测萎缩性胃炎大鼠胃组织HSP70及其转录因子GAF的表达, 应用计量资料的方差分析对不同中药干预组HSP70以及转录因子GAF表达荧光信号值进行统计分析. 结果显示, 模型组在造模措施下会使HSP70感受到异常刺激而迅速启动, HSP70蛋白表达略高于空白组, 但差异无统计学意义, 说明HSP70的表达量尚不足以抵御造模带来的胃黏膜损伤. 黄芪组与三七组的HSP70明显高于空白组, 说明补气药黄芪促进HSP70表达的能力优于活血中药三七, 作者认为这一结果, 部分解释并支持了补益脾胃之气为中医治疗萎缩性胃炎基本治疗方法.
传统中医理论认为, 萎缩性胃炎属于中医的痞满病, 是由外邪内陷、饮食不化、情志失调、脾胃虚弱等导致中焦气机不利或虚气留滞, 升降失常而成的胸腹间痞闷漫涨不适的一种自觉症状, 一般触之无形, 按之柔软, 压之无痛. 且常伴有胸膈满闷, 得食则胀, 嗳气则舒, 多为慢性起病, 时轻时重, 反复发作, 缠绵难愈. 发病和加重常与饮食、情志、起居、冷暖等诱因有关, 乃中焦气机阻滞, 升降失和而成. 痞满的成因有虚实之分, 实即实邪内阻, 包括外邪入里, 食滞中阻与痰湿阻滞; 虚即中虚不运, 责之脾胃虚弱. 实邪所以内阻, 多与中虚不运, 升降无力有关. 反之, 中焦转运无力, 最易招致实邪的侵扰, 两者常常互为因果. 如脾胃虚弱, 健运失司, 既可停湿生饮, 又可食滞内停; 而实邪内阻, 又会进一步损伤脾胃, 终致虚实夹杂[42].
气虚不能行血, 瘀血内停, 瘀血反之又能阻滞气机, 影响脾胃升降, 进而使脾失健运, 胃失和降, 导致脾胃功能受损, 胃腺体萎缩. 综合以上所述, 痞满最基本的病机可归结于脾胃之气的虚弱, 再加以血瘀之病理损伤, 最终导致痞满的发生与发展. 这表明中医气的生理功能紊乱在萎缩性胃炎的发病病理过程中具有重要的作用, 即中医认为痞满以中焦脾胃气机不利, 升降失和为基本病机, 而调理脾胃之气为基本治疗方法.
黄芪为豆科多年生草本植物黄芪和内蒙黄芪的根, 主产于内蒙古、山西等地, 性甘、微温, 归脾、肺经. 功能补气升阳, 益胃固表, 利水消肿, 托疮生肌. 主治脾胃气虚及中气下陷诸证, 肺气虚及表虚自汗、肺气虚及表虚自汗, 气虚外感诸证等[43].
三七为五加科植物人参三七的干燥根. 主产于云南、广西等地, 野生或栽培. 其性甘、微苦,温. 主入肝、胃、大肠经, 功效化瘀止血, 活血定痛, 主要用于各种内外出血证, 尤以有瘀者为宜, 以及用于跌打损伤, 瘀滞疼痛[43].
对于补气类中药黄芪较活血类中药三七能更多的促进HSP70的表达, 作者认为, 经典中医基础理论关于"气能生血"的理论能够部分解释上述实验结果. 即中医认为气对血有化生的作用, 即形成血液的物质基础是精, 而正是依靠气的作用, 精化为血液. 如脾气旺盛健运, 则化生血的功能亦强, 若脾气虚导致运化水谷功能失调, 则血无化源, 临床上表现为心血虚或肝血虚, 所以说"气旺则血充、气虚则血少". 治疗血虚证时, 在补血药中适当配伍益气药物, 其道理亦为"气能生血". 从而促进机体正气的快速恢复, 改善机体异常病理状态. 故作者推测, 补气类中药黄芪较活血类中药三七, 通过更多的促进细胞保护蛋白-HSP70的表达, 以及更进一步针对萎缩性胃炎脾胃气虚的基本病机, 而促进萎缩性胃炎模型大鼠的病理改善. 然而与黄芪或三七单药诱导HSP70蛋白表达量相比, 黄芪、三七联合应用并未表现出叠加效应, 考虑黄芪、三七配伍治疗萎缩性胃炎可能激活了其他细胞保护通路, 从而保证了最终疗效.
黄芪组、三七组和黄芪加三七组中胃黏膜HSP70及其转录因子GAF蛋白表达与模型组比较均显著升高, 提示黄芪、三七及其配伍均通过增加转录因子GAF的表达, 进而促进HSP70的表达, 从而保护受损的胃黏膜细胞并进行修复. 但HSP70转录因子GAF的表达在黄芪组与三七组之间无差异, 提示黄芪组可能通过增强其他转录因子活力促进HSP70的表达, 这有待于进一步研究.
萎缩性胃炎,西医主要采用保护胃黏膜、止痛等对症治疗, 此外缺乏有效的治疗手段. 中医依据辨证论治对该病的治疗近年来取得了可喜的临床疗效, 对其分子机制进行深入研究, 不但可以发展解释中医药理论, 同时可以指导临床用药.
杜雅菊, 教授, 哈尔滨医科大学附属第二医院消化内科
在胃黏膜屏障中HSP70具有重要作用, 因此针对HSP70的调控是今后研究的重点. 目前尚缺乏深层次的关于中医药治疗萎缩性胃炎作用机制的研究.
热休克蛋白增强胃黏膜细胞对各种损伤刺激的抵抗力, HSP70能稳定蛋白, 调节细胞免疫系统, 维持细胞的完整性, 平衡细胞的增殖与凋亡, 从而促进细胞的增殖修复与保护作用.
本实验应用量子点介导的荧光显微镜技术, 阐明益气活血法治疗萎缩性胃炎的作用靶点, 为益气活血法的临床应用提供科学依据, 并指导临床用药.
将量子点技术引入中医药治疗萎缩性胃炎的研究领域, 为今后采用该项新技术, 提供了很好的借鉴作用. 同时利用该技术深入研究HSP70基因转录调控的分子机制, 进一步丰富并验证了中医治疗萎缩性胃炎的理论知识.
本研究发现黄芪、三七及其配伍可以通过诱导并增加转录因子GAF的表达, 促进热休克蛋白70的表达, 明显改善萎缩性胃炎大鼠胃黏膜状态. 探讨了黄芪、三七治疗萎缩性胃炎作用的可能机制, 有一定的学术价值.
编辑: 翟欢欢 电编: 鲁亚静
| 3. | 史 瑞, 李 晓红, 方 蕾, 李 健, 蔡 大勇, 李 军祥, 刘 礼剑. 弹簧幽门植入术结合高盐热淀粉糊灌胃诱导大鼠萎缩性胃炎模型的方法及评价. 世界华人消化杂志. 2011;19:1001-1008. [DOI] |
| 4. | Wu T, Yuan Y, Wu Y, He H, Zhang G, Tanguay RM. Presence of antibodies to heat stress proteins in workers exposed to benzene and in patients with benzene poisoning. Cell Stress Chaperones. 1998;3:161-167. [PubMed] [DOI] |
| 5. | Aghdassi A, Phillips P, Dudeja V, Dhaulakhandi D, Sharif R, Dawra R, Lerch MM, Saluja A. Heat shock protein 70 increases tumorigenicity and inhibits apoptosis in pancreatic adenocarcinoma. Cancer Res. 2007;67:616-625. [PubMed] [DOI] |
| 6. | Todoroki I, Joh T, Watanabe K, Miyashita M, Seno K, Nomura T, Ohara H, Yokoyama Y, Tochikubo K, Itoh M. Suppressive effects of DNA vaccines encoding heat shock protein on Helicobacter pylori-induced gastritis in mice. Biochem Biophys Res Commun. 2000;277:159-163. [PubMed] [DOI] |
| 7. | Schmitt E, Gehrmann M, Brunet M, Multhoff G, Garrido C. Intracellular and extracellular functions of heat shock proteins: repercussions in cancer therapy. J Leukoc Biol. 2007;81:15-27. [PubMed] [DOI] |
| 8. | Cehovin A, Coates AR, Hu Y, Riffo-Vasquez Y, Tormay P, Botanch C, Altare F, Henderson B. Comparison of the moonlighting actions of the two highly homologous chaperonin 60 proteins of Mycobacterium tuberculosis. Infect Immun. 2010;78:3196-3206. [PubMed] [DOI] |
| 10. | Lindquist S, Craig EA. The heat-shock proteins. Annu Rev Genet. 1988;22:631-677. [PubMed] [DOI] |
| 11. | Vidal Magalhães W, Gouveia Nogueira MF, Kaneko TM. Heat shock proteins (HSP): dermatological implications and perspectives. Eur J Dermatol. 2012;22:8-13. [PubMed] |
| 12. | Kiang JG, Tsokos GC. Heat shock protein 70 kDa: molecular biology, biochemistry, and physiology. Pharmacol Ther. 1998;80:183-201. [PubMed] [DOI] |
| 13. | Isomoto H, Oka M, Yano Y, Kanazawa Y, Soda H, Terada R, Yasutake T, Nakayama T, Shikuwa S, Takeshima F. Expression of heat shock protein (Hsp) 70 and Hsp 40 in gastric cancer. Cancer Lett. 2003;198:219-228. [PubMed] [DOI] |
| 14. | Ullrich SJ, Robinson EA, Law LW, Willingham M, Appella E. A mouse tumor-specific transplantation antigen is a heat shock-related protein. Proc Natl Acad Sci U S A. 1986;83:3121-3125. [PubMed] [DOI] |
| 15. | Helmbrecht K, Zeise E, Rensing L. Chaperones in cell cycle regulation and mitogenic signal transduction: a review. Cell Prolif. 2000;33:341-365. [PubMed] [DOI] |
| 16. | 范 云霞, 黄 常志. 热休克蛋70与肿瘤. 国外医学·肿瘤学分册. 2000;27:196-199. |
| 17. | Isomoto H, Ohtsuru A, Braiden V, Iwamatsu M, Miki F, Kawashita Y, Mizuta Y, Kaneda Y, Kohno S, Yamashita S. Heat-directed suicide gene therapy mediated by heat shock protein promoter for gastric cancer. Oncol Rep. 2006;15:629-635. [PubMed] |
| 19. | Hageman J, Kampinga HH. Computational analysis of the human HSPH/HSPA/DNAJ family and cloning of a human HSPH/HSPA/DNAJ expression library. Cell Stress Chaperones. 2009;14:1-21. [PubMed] [DOI] |
| 20. | Tavaria M, Gabriele T, Kola I, Anderson RL. A hitchhiker's guide to the human Hsp70 family. Cell Stress Chaperones. 1996;1:23-28. [PubMed] [DOI] |
| 21. | Weiss YG, Maloyan A, Tazelaar J, Raj N, Deutschman CS. Adenoviral transfer of HSP-70 into pulmonary epithelium ameliorates experimental acute respiratory distress syndrome. J Clin Invest. 2002;110:801-806. [PubMed] [DOI] |
| 22. | Chen HW, Hsu C, Lu TS, Wang SJ, Yang RC. Heat shock pretreatment prevents cardiac mitochondrial dysfunction during sepsis. Shock. 2003;20:274-279. [PubMed] [DOI] |
| 23. | Jo SK, Ko GJ, Boo CS, Cho WY, Kim HK. Heat preconditioning attenuates renal injury in ischemic ARF in rats: role of heat-shock protein 70 on NF-kappaB-mediated inflammation and on tubular cell injury. J Am Soc Nephrol. 2006;17:3082-3092. [PubMed] [DOI] |
| 24. | Luft JC, Dix DJ. Hsp70 expression and function during embryogenesis. Cell Stress Chaperones. 1999;4:162-170. [PubMed] [DOI] |
| 25. | Pigłowski W, Nowak R, Krawczyk Z, Scieglińska D. The structural and functional analysis of the human HSPA2 gene promoter region. Acta Biochim Pol. 2007;54:99-106. [PubMed] |
| 26. | Evans TG, Belak Z, Ovsenek N, Krone PH. Heat shock factor 1 is required for constitutive Hsp70 expression and normal lens development in embryonic zebrafish. Comp Biochem Physiol A Mol Integr Physiol. 2007;146:131-140. [PubMed] [DOI] |
| 28. | Lee C, Li X, Hechmer A, Eisen M, Biggin MD, Venters BJ, Jiang C, Li J, Pugh BF, Gilmour DS. NELF and GAGA factor are linked to promoter-proximal pausing at many genes in Drosophila. Mol Cell Biol. 2008;28:3290-3300. [PubMed] [DOI] |
| 29. | Wu C. The 5' ends of Drosophila heat shock genes in chromatin are hypersensitive to DNase I. Nature. 1980;286:854-860. [PubMed] [DOI] |
| 30. | Shopland LS, Hirayoshi K, Fernandes M, Lis JT. HSF access to heat shock elements in vivo depends critically on promoter architecture defined by GAGA factor, TFIID, and RNA polymerase II binding sites. Genes Dev. 1995;9:2756-2769. [PubMed] [DOI] |
| 31. | Lee H, Kraus KW, Wolfner MF, Lis JT. DNA sequence requirements for generating paused polymerase at the start of hsp70. Genes Dev. 1992;6:284-295. [PubMed] [DOI] |
| 32. | Morimoto RI, Sarge KD, Abravaya K. Transcriptional regulation of heat shock genes. A paradigm for inducible genomic responses. J Biol Chem. 1992;267:21987-21990. [PubMed] |
| 33. | Boehm AK, Saunders A, Werner J, Lis JT. Transcription factor and polymerase recruitment, modification, and movement on dhsp70 in vivo in the minutes following heat shock. Mol Cell Biol. 2003;23:7628-7637. [PubMed] [DOI] |
| 34. | Lis JT, Mason P, Peng J, Price DH, Werner J. P-TEFb kinase recruitment and function at heat shock loci. Genes Dev. 2000;14:792-803. [PubMed] |
| 35. | Wang YV, Tang H, Gilmour DS. Identification in vivo of different rate-limiting steps associated with transcriptional activators in the presence and absence of a GAGA element. Mol Cell Biol. 2005;25:3543-3552. [PubMed] [DOI] |
| 36. | Mason PB, Lis JT. Cooperative and competitive protein interactions at the hsp70 promoter. J Biol Chem. 1997;272:33227-33233. [PubMed] [DOI] |
| 37. | Bruchez M, Moronne M, Gin P, Weiss S, Alivisatos AP. Semiconductor nanocrystals as fluorescent biological labels. Science. 1998;281:2013-2016. [PubMed] [DOI] |
| 38. | Chan WC, Nie S. Quantum dot bioconjugates for ultrasensitive nonisotopic detection. Science. 1998;281:2016-2018. [PubMed] [DOI] |
| 39. | Alivisatos AP. Perspectives on the Physical Chemistry of Semiconductor Nanocrystals. J Phys Chem. 1996;100:13226-13239. [DOI] |
| 40. | Alivisatos AP. Semiconductor Clusters, Nanocrystals, and Quantum Dots. Science. 1996;271:933-937 Available from: http://www.docin.com/p-252333373.html. |
| 41. | Remacle F, Levine RD. Quantum Dots as Chemical Building Blocks: Elementary Theoretical Considerations. Chem Phys Chem. 2001;2:20-36. [DOI] |