修回日期: 2013-01-23
接受日期: 2013-01-25
在线出版日期: 2013-02-28
目的: 初步探讨消化系黏膜下肿瘤的超声内镜实时组织弹性成像特征及其在良恶性鉴别中的价值.
方法: 2009-01/2011-10对34例消化系黏膜下肿瘤的患者进行超声内镜实时弹性成像, 按照弹性成像5分法对组织弹性成像进行评分, 后经手术或内镜下切除获取消化系黏膜下肿瘤病理诊断.
结果: 34例患者最终诊断为平滑肌瘤6例, 脂肪瘤、脂肪肉瘤和神经鞘瘤各1例, 胃肠道间质瘤25例, 其中间质瘤病理低度危险性12例, 中度危险性7例, 高度危险性6例. 弹性成像模式: 良性黏膜下肿瘤的弹性模式多表现为Ⅰ, Ⅱ和Ⅲ型; 所有的中高度危险性间质瘤表现为Ⅳ型; 弹性成像分级在良、恶性病变之间差异有统计学意义(P<0.001). 诊断恶性病灶的敏感度为92.86%, 特异度为95.00%, 准确率为94.12%. 间质瘤和平滑肌瘤的弹性成像没有明显差别.
结论: 消化系黏膜下肿瘤良恶性组织弹性成像呈不同的图像特征, 超声内镜实时组织弹性成像有助于消化系黏膜下肿瘤良恶性病变的鉴别.
引文著录: 邹传鑫, 谢明, 戴绍军, 汤绍迁. 超声内镜弹性成像在消化系黏膜下肿瘤诊断中的价值. 世界华人消化杂志 2013; 21(6): 484-489
Revised: January 23, 2013
Accepted: January 25, 2013
Published online: February 28, 2013
AIM: To summarize the real-time EUS elastographic patterns of gastrointestinal submucosal tumors (SMTs) and investigate the potential use of EUS elatography for the differentiation between benign and malignant conditions.
METHODS: Thirty-four patients who underwent EUS at our department for SMT between January 2009 and October 2011 were enrolled, and real-time elastography was carried out during conventional EUS examination. Elastographic images were scored 1 to 5 based on the elastographic pattern. The final diagnosis was made based on the histopathology of specimens resected by surgery or endoscopy.
RESULTS: The 34 lesions were finally diagnosed as leiomyoma (n = 6), lipoma (n = 1), liposarcoma (n = 1), neurilemmoma (n = 1), or gastrointestinal stromal tumors (GISTs) (n = 25). Among the 25 GIST cases with pathological results, 12 were low-risk GISTs, 7 were moderate-risk GISTs, and 6 were high-risk GISTs. The elatographic patterns of benign SMTs tended to be type Ⅰ, Ⅱ or Ⅲ. All moderate-/high-risk GIST showed an elatographic pattern of type IV. There was a significant difference in elastographic pattern between benign and malignant lesions (P < 0.001). The sensitivity, specificity and accuracy of real-time EUS elastography in the evaluation of malignant lesions were 92.86%, 95.00% and 94.12%, respectively. There was no significant difference in elastographic pattern between GISTs and leiomyoma.
CONCLUSION: There is an apparent difference in elastographic pattern between benign and malignant lesions of upper gastrointestinal SMTs. Real-time EUS elastography may be a promising method for the differentiation of benign and malignant lesions of upper gastrointestinal SMTs.
- Citation: Zou CX, Xie M, Dai SJ, Tang SQ. Diagnostic value of EUS elastography in detection of gastrointestinal submucosal tumors. Shijie Huaren Xiaohua Zazhi 2013; 21(6): 484-489
- URL: https://www.wjgnet.com/1009-3079/full/v21/i6/484.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i6.484
超声内镜(endoscopic ultrasonography, EUS)借助超声探头对消化系黏膜下肿瘤进行探查, 具有探测距离短、干扰小、组织分辨率高等优点, 已成为消化系黏膜下肿瘤的诊断和鉴别诊断的重要手段, 但EUS的B模式灰阶成像区分肿瘤良、恶性特异性差, 导致EUS的诊断价值受到限制. 超声内镜实时组织弹性成像技术(EUS real-time elastograph imaging)就是在EUS检查中对组织弹性量化和可视化的一种最近发展起来的影像技术[1], 在明确病变性质和鉴别病变良恶性方面为EUS提供了有效补充, 表现出优越的性能. 实时组织弹性成像技术已成功应用于甲状腺、前列腺、乳腺、肝脏、胰腺等疾病的诊断[2,3]. 该技术的临床应用在国内外尚处于起步阶段, 在消化系黏膜下肿瘤诊断中的应用目前还尚少, 本研究目的旨在初步探讨消化系黏膜下肿瘤的超声内镜弹性成像特征及其在良恶性病变鉴别诊断中的应用价值.
2009-01/2011-10对34例因发现消化系黏膜下肿瘤而于我科行EUS检查的患者同时行超声内镜实时弹性成像检查. 患者男20例, 女14例, 年龄40-89岁, 平均63.1岁; 黏膜下肿瘤直径0.8-13 cm, 平均3.6 cm; 其中食管黏膜下肿瘤5例, 胃黏膜下肿瘤23例, 十二指肠黏膜下肿瘤6例.
1.2.1 超声内镜弹性成像检查: 应用日立公司具有超声实时弹性成像功能的Hitachi EUB-8500型彩色多普勒超声诊断仪及PENTAX公司EG-3630 UR环扫型电子超声内镜(最大末端直径12.1 mm, 工作长度1 250 mm; 扫描范围270度, 超声频率5-10 MHz可变)和EG-3830 UT凸面线阵型电子超声内镜(最大末端直径12.8 mm, 工作长度1 250 mm; 扫描范围120度, 超声频率5-l0 MHz可变). 首先应用B模式灰阶成像进行常规探查, 了解病灶的部位、大小、形态及内部回声特征, 然后根据探查结果确定拟行超声弹性成像的目标区域, 将超声影像切换至实时弹性成像模式, 借助呼吸运动、胸、腹腔大动脉搏动及探头的压迫产生加压作用, 从而获取目标部位的弹性成像图像并记录, 以便分析.
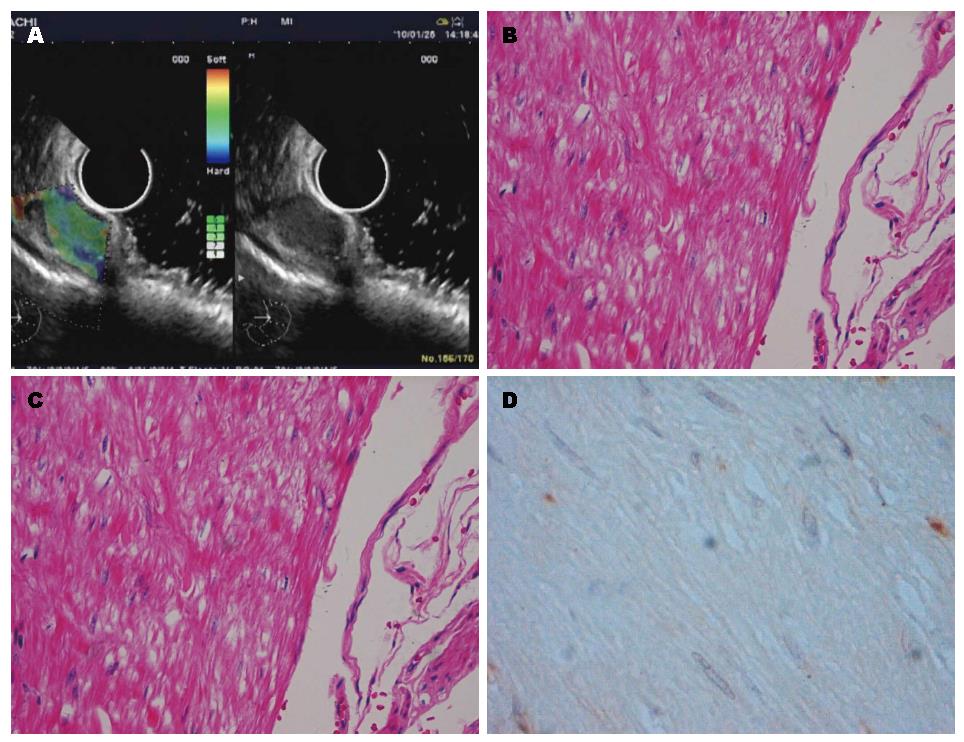
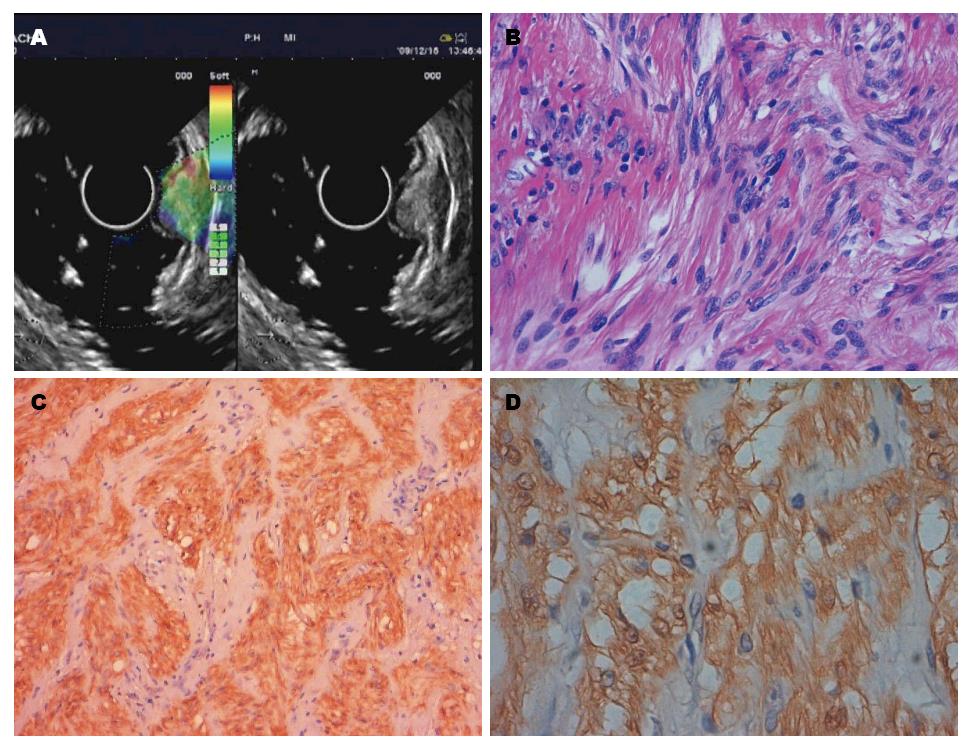
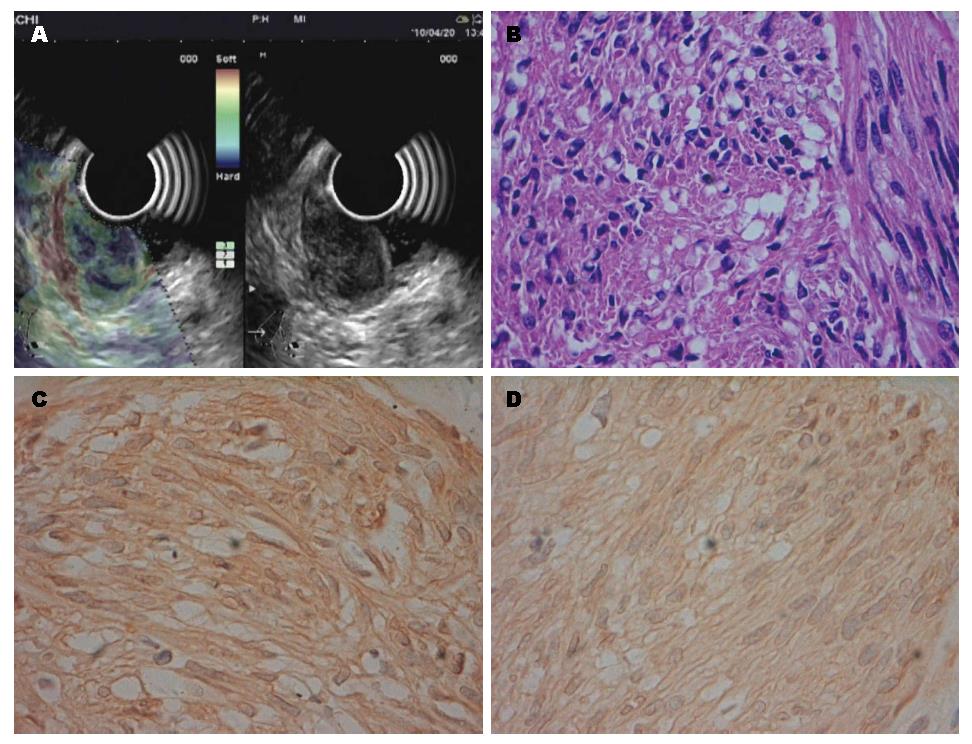
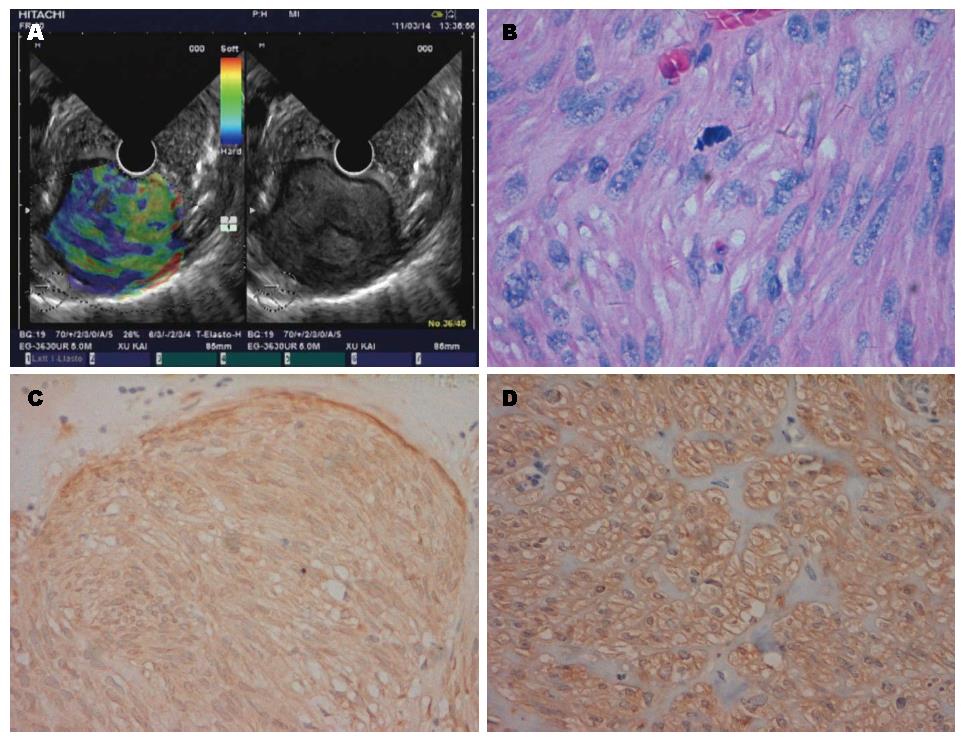
1.2.2 超声内镜弹性成像评价标准: 根据组织实时弹性成像的图像颜色类型对病变的软硬度做出判断, 其中蓝色代表硬, 红色代表软, 绿色及黄色则介于两者之间. 按照弹性成像5分法[4-6]对组织弹性成像进行评价: Ⅰ型表现为均质绿色, Ⅱ型表现为绿、黄、红混杂, Ⅲ型表现为蓝、绿、黄和红色混杂, Ⅳ型表现为以蓝色为主, 混杂其他颜色的非均质模式, Ⅴ型表现为均质蓝色模式.
统计学处理 应用SPSS16.0软件进行统计学分析. 良、恶性病变弹性成像分级之间的比较使用秩和检验; 病变直径与病变弹性成像分级之间的比较使用χ2检验. 以手术或经内镜切除获取消化系黏膜下肿瘤标本的病理学检查为金标准, 计算弹性成像诊断恶性病变的敏感度、特异度和准确率.
34例患者均成功进行了超声内镜实时弹性成像检查并获得了满意的弹性成像图像, 无操作相关并发症发生. 经手术或内镜切除获取消化系黏膜下肿瘤标本的病理学检查证实为胃肠道间质瘤25例, 平滑肌瘤6例, 脂肪瘤、脂肪肉瘤和神经鞘瘤各1例, 4种组织的超声内镜、病理及免疫组织图像分别见图1, 图2, 图3, 图4; 其中间质瘤低度危险性12例, 中度危险性7例, 高度危险性6例(表1).
| 病理结果 | 弹性成像评价 | |||
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| 脂肪瘤 | 1 | |||
| 神经鞘瘤 | 1 | |||
| 平滑肌瘤 | 4 | 1 | 1 | |
| 间质瘤(低危) | 3 | 3 | 5 | 1 |
| 间质瘤(中危) | 7 | |||
| 间质瘤(高危) | 6 | |||
| 脂肪肉瘤 | 1 | |||
参照国内外相关文献报道[7,8], 将病理提示为低度危险性的胃肠道间质瘤按良性病变归类; 而将病理提示为中、高度危险性的胃肠道间质瘤归类为恶性病变. 故我们在分组时, 将平滑肌瘤、脂肪瘤、神经鞘瘤和低度危险性胃肠道间质瘤归为良性, 脂肪肉瘤和中、高度危险性胃肠道间质瘤归为恶性病变. 以此标准, 消化系黏膜下肿瘤病理和弹性模式的对应关系如下: 良性黏膜下肿瘤的弹性模式多表现为Ⅰ、Ⅱ和Ⅲ型; 所有的中、高度危险性间质瘤表现为Ⅳ型(表1). 弹性成像分级在良、恶性病变之间差异有统计学意义(平均秩次分别为11.02、26.75, P<0.001). 14个恶性病变中, 13个表现为Ⅳ型, 诊断为恶性, 另有1个误诊为良性; 20个良性病变中, 有1个表现为Ⅳ型, 误诊为恶性, 19个诊断为良性, 诊断恶性病灶的敏感度为92.86%(13/14), 特异度为95.00%(19/20), 准确率为94.12%(32/34). 直径<2 cm的病变主要表现为Ⅰ和Ⅱ型; 直径>2 cm的病变多表现为Ⅲ和Ⅳ型(表2). 弹性成像分级与病变直径之间线性回归分析有统计学意义(χ2 = 13.24, P<0.01), 二者之间存在线性相关关系. 低度危险性间质瘤和平滑肌瘤的弹性成像没有明显差别.
| GIST直径(cm) | n | 弹性成像评价 | |||
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | ||
| 1-2 | 7 | 3 | 2 | 2 | |
| 2-3 | 6 | 2 | 4 | ||
| 3-4 | 5 | 1 | 2 | 2 | |
| >4 | 7 | 1 | 6 | ||
| 合计 | 25 | 3 | 3 | 5 | 14 |
消化系黏膜下肿瘤临床鉴别诊断仍比较困难, 无论其良恶性, 在内镜下表现都很相似, 多为表面光滑的隆起性病变, 普通胃镜的活检往往取材过小、过浅, 不足以确定诊断. 而挖掘式取材和圈套活检很不安全, 易出现出血和穿孔等并发症. EUS对诊断胃肠道黏膜下肿瘤和腔外肿瘤是一种敏感的方法, EUS诊断黏膜下肿瘤的敏感性和准确性分别为95%和87%[9], 然而仅从病变大小、形态、回声强度等方面区分肿瘤良、恶性, EUS检查结果却不能令人满意, 因而近年来开展EUS引导下细针穿刺(endoscopic ultrasonography guided fine needle aspiration, EUS-FNA)进行必要的细胞病理学诊断[10-14]. EUS-FNA诊断的总体准确率各文献报道为17%-94%[13], 但EUS-FNA技术为有创性检查, 具有操作难度大、有一定的并发症发生率等缺点, 并且需要在操作过程中有细胞病理学医师在场进行细胞快速固定、染色及病理学诊断, 以指导穿刺的次数及判定穿刺的效果. 分化好的肿瘤如消化道间质瘤和淋巴瘤有时单靠细胞学检查亦很难做出正确判断[14], 加之对于体积较小和位置不便于穿刺的肿瘤, 均使EUS-FNA诊断的可行性受到一定限制. 故近年来临床上出现了包括造影增强超声内镜及超声内镜弹性成像技术等一系列的新技术, 以提高超声内镜影像学诊断的准确性[4-6,15].
弹性成像技术是对组织物理特性进行描述, 对常规超声图像的信息补充[16]. 实时弹性成像是组织受到外来振动时进行的运动检测, 这种技术的应用进一步提高超声内镜在临床上的应用价值, 其借助呼吸运动、动脉搏动及适当移动超声探头使探头对目标部位形成压迫, 对采集图像内感兴趣区域进行多种声学参数的测定, 得到组织内部位移, 推算出其应变分布及弹性系数分布成像, 并以相应的颜色显示, 使组织弹性系数(软硬度)得以量化和可视化, 在明确病变性质和鉴别病变良恶性方面提供了有效补充, 有良好的应用前景. 肿瘤组织、炎症组织及正常组织因含脂肪和/或胶原的不同而表现出不同的弹性系数及顺应性, 恶性肿瘤更加僵硬而顺应性差, 故超声弹性成像可通过判断不同病变的组织软硬程度以明确病变的特性和鉴别良恶性[17]. 目前, 该技术国内外已在临床逐步展开, 国外Hirooka等[18]报道了超声内镜弹性成像在胆道及胰腺肿瘤诊断中的应用, 阐述了病变的弹性改变与其病理良恶性相关联. Giovannini等[4]报道超声内镜弹性成像在胰腺肿块良恶性鉴别诊断中的敏感度和特异度分别为92.3%和80.0%, 对转移性淋巴结的灵敏度和特异度分别达91.8%和82.5%.
我们对34例消化系黏膜下肿瘤的超声内镜弹性成像进行了初步探讨, 良性黏膜下肿瘤的弹性模式多表现为Ⅰ、Ⅱ和Ⅲ型; 多呈现均一绿色或以绿色为主的影像特征, 提示其组织具有良好的、均匀一致的柔韧性及弹性. 中高度危险性间质瘤表现为Ⅳ型, 以蓝色为主, 混杂其他颜色的非均质影像, 显示其组织僵硬, 弹性及顺应性均差, 而当其组织内存在局部的出血、坏死或液化时组织质地较软, 故影像呈现蓝色与其他颜色相混杂的特征. 上述结果显示良性和恶性黏膜下肿瘤的超声内镜弹性成像呈现出明显不同的影像特征及弹性评价. 上消化道黏膜下肿瘤弹性成像很少表现为胰腺肿瘤中出现的均质蓝色Ⅴ型模式, 这可能与较大病变内部中心发生出血、坏死、囊性变等继发性改变有关. 我们的研究显示直径<2 cm的病变主要表现为Ⅰ和Ⅱ型; 直径>2 cm的病变多表现为Ⅲ和Ⅳ型, 弹性成像分级与病变直径之间有线性相关关系. 国外文献[19,20]报道黏膜下肿瘤大小是判断良恶性的重要指标之一, 直径较大的肿瘤, 表现为形状不规则, 边界不清晰, 回声不均匀, 内部可见肿瘤坏死的无回声区域, 多提示肿瘤的恶性倾向. 我们的研究显示低度危险性间质瘤和平滑肌瘤的弹性成像没有明显差别. Gheorghe等[21]报道弹性成像有助于黏膜下肿瘤的良恶性鉴别, 但无法明确鉴别平滑肌瘤和间质瘤.
总之, 我们的研究初步显示了良恶性黏膜下肿瘤弹性成像差异明显, 超声内镜及实时组织弹性成像能有效诊断上消化道黏膜下肿瘤, 并能够有效评估其良恶性. 鉴于其对黏膜下肿瘤良恶性鉴别的准确度和特异度, 超声内镜及实时组织弹性成像应该常规用于黏膜下肿瘤的术前评估[21]. 但是, 超声内镜弹性成像仍是一种影像学手段, 并不能够完全替代细胞病理学检查, 然而在患者不愿或不能行EUS-FNA时, 该技术将为疾病的鉴别诊断提供更进一步的影像学依据. 该法简单, 并可追踪复查, 在患者可耐受的情况下对人体基本无创, 对消化系黏膜下肿瘤的诊断及治疗具有重要价值.
对消化系黏膜下肿瘤的患者进行术前超声内镜实时弹性成像, 按照弹性成像5分法对组织弹性成像进行评分, 经手术或内镜下切除获取消化系黏膜下肿瘤病理诊断.
毛高平, 教授, 中国人民解放军空军总医院
超声内镜实时组织弹性成像是近年来开始发展的一种技术, 可通过超声内镜检查反映组织的弹性情况. 有些疾病可导致组织硬度改变, 根据其弹性差异, EUS弹性成像可应用于良恶性淋巴结、胰腺或肝脏局灶病变的鉴别, 且对于胃肠道及周围实体性肿瘤的发现与鉴别亦有帮助.
超声内镜及实时组织弹性成像能有效诊断上消化道黏膜下肿瘤, 并能够有效评估其良恶性.
首先应用B模式灰阶成像进行常规探查, 了解病灶的部位、大小、形态及内部回声特征, 然后根据探查结果确定拟行超声弹性成像的目标区域, 将超声影像切换至实时弹性成像模式, 借助呼吸运动、胸、腹腔大动脉搏动及探头的压迫产生加压作用, 从而获取目标部位的弹性成像图像并记录.
超声内镜弹性成像: 对生物组织加压使其变形, 由于组织的弹性及软硬度存在差异, 在相同压力作用下, 质地柔软、弹性大的组织加压后变形度大, 质地硬、弹性小的组织行变小, 这种因加压变形所产生的组织位移度差异经量化分析后转化为不同的彩色图像, 弹性大的组织显示为红色, 弹性小的组织显示为蓝色, 弹性系数中等的组织显示为黄色、绿色, 从红色至蓝色的渐变代表组织质地从软到硬.
本文研究消化系黏膜下肿瘤的弹性成像特征与病变良恶性及病变直径之间的关系, 具有一定的临床意义.
编辑: 田滢 电编: 闫晋利
| 1. | Frey H. [Realtime elastography. A new ultrasound procedure for the reconstruction of tissue elasticity]. Radiologe. 2003;43:850-855. [PubMed] [DOI] |
| 2. | Gietka-Czernel M, Kochman M, Bujalska K, Stachlewska-Nasfeter E, Zgliczyński W. Real-time ultrasound elastography - a new tool for diagnosing thyroid nodules. Endokrynol Pol. 2010;61:652-657. [PubMed] |
| 3. | Dudea SM, Giurgiu CR, Dumitriu D, Chiorean A, Ciurea A, Botar-Jid C, Coman I. Value of ultrasound elastography in the diagnosis and management of prostate carcinoma. Med Ultrason. 2011;13:45-53. [PubMed] |
| 4. | Giovannini M, Thomas B, Erwan B, Christian P, Fabrice C, Benjamin E, Geneviève M, Paolo A, Pierre D, Robert Y. Endoscopic ultrasound elastography for evaluation of lymph nodes and pancreatic masses: a multicenter study. World J Gastroenterol. 2009;15:1587-1593. [PubMed] [DOI] |
| 6. | Giovannini M, Hookey LC, Bories E, Pesenti C, Monges G, Delpero JR. Endoscopic ultrasound elastography: the first step towards virtual biopsy? Preliminary results in 49 patients. Endoscopy. 2006;38:344-348. [PubMed] [DOI] |
| 7. | Okubo K, Yamao K, Nakamura T, Tajika M, Sawaki A, Hara K, Kawai H, Yamamura Y, Mochizuki Y, Koshikawa T. Endoscopic ultrasound-guided fine-needle aspiration biopsy for the diagnosis of gastrointestinal stromal tumors in the stomach. J Gastroenterol. 2004;39:747-753. [PubMed] [DOI] |
| 8. | Sakamoto H, Kitano M, Matsui S, Kamata K, Komaki T, Imai H, Dote K, Kudo M. Estimation of malignant potential of GI stromal tumors by contrast-enhanced harmonic EUS (with videos). Gastrointest Endosc. 2011;73:227-237. [PubMed] [DOI] |
| 9. | Brand B, Oesterhelweg L, Binmoeller KF, Sriram PV, Bohnacker S, Seewald S, De Weerth A, Soehendra N. Impact of endoscopic ultrasound for evaluation of submucosal lesions in gastrointestinal tract. Dig Liver Dis. 2002;34:290-297. [PubMed] [DOI] |
| 10. | Papanikolaou IS, Triantafyllou K, Kourikou A, Rösch T. Endoscopic ultrasonography for gastric submucosal lesions. World J Gastrointest Endosc. 2011;3:86-94. [PubMed] [DOI] |
| 11. | Chatzipantelis P, Salla C, Karoumpalis I, Apessou D, Sakellariou S, Doumani I, Papaliodi E, Konstantinou P. Endoscopic ultrasound-guided fine needle aspiration biopsy in the diagnosis of gastrointestinal stromal tumors of the stomach. A study of 17 cases. J Gastrointestin Liver Dis. 2008;17:15-20. [PubMed] |
| 12. | Varas MJ, Miquel JM, Abad R, Espinós JC, Cañas MA, Fabra R, Bargalló D. [Interventionist endoscopic ultrasonography. A retrospective analysis of 60 procedures]. Rev Esp Enferm Dig. 2007;99:138-144. [PubMed] [DOI] |
| 13. | Dumonceau JM, Polkowski M, Larghi A, Vilmann P, Giovannini M, Frossard JL, Heresbach D, Pujol B, Fernández-Esparrach G, Vazquez-Sequeiros E. Indications, results, and clinical impact of endoscopic ultrasound (EUS)-guided sampling in gastroenterology: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline. Endoscopy. 2011;43:897-912. [PubMed] [DOI] |
| 14. | Pungpapong S, Wallace MB. EUS-guided Trucut needle biopsy: is more tissue really better? Gastrointest Endosc. 2005;62:602-604. [PubMed] [DOI] |
| 16. | Konofagou EE. Quo vadis elasticity imaging? Ultrasonics. 2004;42:331-336. [PubMed] [DOI] |
| 18. | Hirooka Y, Itoh A, Kawashima H, Ohno E, Ishikawa T, Itoh Y, Nakamura Y, Hiramatsu T, Nakamura M, Miyahara R. Clinical oncology for pancreatic and biliary cancers: Advances and current limitations. World J Clin Oncol. 2011;2:217-224. [PubMed] |
| 19. | Belloni M, De Fiori E, Mazzarol G, Curti A, Crosta C. Endoscopic ultrasound and Computed Tomography in gastric stromal tumours. Radiol Med. 2002;103:65-73. [PubMed] |
| 20. | Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Endosonographic features predictive of benign and malignant gastrointestinal stromal cell tumours. Gut. 2000;46:88-92. [PubMed] [DOI] |
| 21. | Gheorghe L, Gheorghe C, Cotruta B, Carabela A. CT aspects of gastrointestinal stromal tumors: adding EUS and EUS elastography to the diagnostic tools. J Gastrointestin Liver Dis. 2007;16:346-347. [PubMed] |