修回日期: 2013-01-18
接受日期: 2013-01-25
在线出版日期: 2013-02-18
目的: 探讨Bmi-1和Mel-18基因在大肠癌中的表达及其临床意义.
方法: 收集我院68例大肠癌组织标本, 68例癌旁正常组织作为对照. 利用免疫组织化学的方法检测大肠癌及正常组织中的Bmi-1基因和Mel-18基因的表达, 并结合临床资料, 对该两种基因的表达与大肠癌患者临床表现的相关性进行分析.
结果: (1)Bmi-l在大肠癌组织中的表达明显高于正常组织(73.5% vs 23.5%, P<0.05), 且与大肠癌的侵袭深度、淋巴结转移及临床分期有关(P<0.05); (2)Mel-18基因在大肠癌组织中的表达明显低于正常组织(41.2% vs 66.2%, P<0.05), 且与大肠癌的淋巴结转移及临床分期呈负相关(P<0.05); (3)相关性分析发现, Bmi-1和Mel-18基因在大肠癌组织中的表达呈负相关(r = -0.545, P<0.05).
结论: Bmi-1和Mel-18基因与大肠癌的发展、转移关系密切, 检测Bmi-1和Mel-18对大肠癌的诊断及判断预后可能有重要意义.
引文著录: 邹艳芳, 田永, 徐峰. Bmi-1和Mel-18基因在大肠癌组织中的表达及意义. 世界华人消化杂志 2013; 21(5): 397-402
Revised: January 18, 2013
Accepted: January 25, 2013
Published online: February 18, 2013
AIM: To investigate the relationship between the expression of Bmi-1 and Mel-18 and clinicopathological features of colorectal carcinoma.
METHODS: Sixty-eight colorectal cancer samples and matched tumor-adjacent normal tissue samples were collected to detect the expression of Bmi-1 and Mel-18 using immunohistochemistry. The relationship between the abnormal expression of Bmi-1 and Mel-18 and the clinicopathological features of colorectal carcinoma was analyzed.
RESULTS: The positive rate of Bmi-1 expression was significantly higher in colorectal carcinoma than in normal colon tissue (P < 0.05), and expression of Bmi-1 was correlated with the depth of bowel wall invasion, lymph node metastasis and Dukes stage (all P < 0.05). The positive rate of Mel-18 expression was significantly lower in colorectal carcinoma than in normal colon tissue (P < 0.05), and expression of Mel-18 was negatively related to lymph node metastasis and Dukes stage (both P < 0.05). There was a negative correlation between the expression of Bmi-1 and Mel-18 in colorectal carcinoma (r = -0.335, P < 0.05).
CONCLUSION: The expression of Bmi-1 and Mel-18 proteins correlates with the progression, metastasis and prognosis of colorectal cancer. Combined detection of Bmi-1 and Mel-18 protein expression may be helpful to the diagnosis and evaluation of the malignancy of colorectal carcinoma.
- Citation: Zou YF, Tian Y, Xu F. Significance of expression of Bmi-1 and Mel-18 in colorectal carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(5): 397-402
- URL: https://www.wjgnet.com/1009-3079/full/v21/i5/397.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i5.397
大肠癌是人类最常见的恶性肿瘤之一, 其发病率位居全球恶性肿瘤第3位[1]. 在我国, 大肠癌的发病率呈上升趋势, 排在恶性肿瘤和致死因素的第4位[2], 其发病率在40岁开始上升, 至60-75岁时达到高峰, 发病率呈逐年上升趋势[1,3,4]. 大肠癌和其他恶性肿瘤一样, 病因尚未明确, 主要和环境、遗传等因素有关, 大肠癌的防治研究不断引起人们的重视, 通过对相关基因的检测, 对预测结肠癌的发生、发展、治疗效果及预后判断有一定的临床指导意义. Bmi-1(bcell-specific MLV integrationsite-1)基因属于多梳基因家族(polycomb group genes, PcG)成员, 首次被提出是在转基因鼠的淋巴瘤细胞传代中, 可与c-myc协同作用引起细胞转化和肿瘤形成[5]. PcG家族结构高度保守, 参与不同的信号通路, 调控细胞增殖、分化、衰老, 参与肿瘤细胞的形成[6]. Bmi-1是一种公认的癌基因, 已证实Bmi-1基因在非霍杰金细胞淋巴瘤[7]、胃癌、非小细胞肺癌、鼻咽癌、乳腺癌[8-11]等多种实体瘤中均高表达. Mel-18基因也属于多梳基因家族PcG成员之一, Mel-18基因最初是从小鼠黑素瘤B6细胞中克隆获得[12], 为哺乳动物PcG成员. 该基因第一次作为一种抑癌基因被提出来是在转基因鼠的淋巴细胞瘤细胞的传代中, 发现其可以抑制c-myc基因的转录, 从而引起细胞的衰老和肿瘤细胞的凋亡[5,13]. 本实验中我们分别检测了Bmi-1、Mel-18基因在大肠癌组织及癌旁正常组织中的表达情况, 以探讨Bmi-1、Mel-18基因的表达与大肠癌的病理学特征的相关性及其在大肠癌的发生发展中可能的作用及临床意义.
选择郑州大学第一附属医院2009-09/2012-06手术切除后的大肠癌标本及肿瘤癌旁正常大肠组织(距癌组织边缘≥5 cm)各68份, 所有病例均经术后组织病理学确诊, 组织标本的取得均获患者的书面知情许可, 研究获郑州大学第一附属医院伦理委员会批准. 所有组织标本均经10%甲醛固定, 常规石蜡包埋, 4 μm厚连续切片. 所有切除标本经病理学证实为大肠腺癌, 其中有淋巴结转移者28例, 无淋巴结转移者40例; 按组织学分级, 其中高+中分化45例, 中低+低分化为23例. 肿瘤临床分期参照2002年国际抗癌联盟UICC公布的恶性肿瘤TNM分期标准. 所有病例术前未经任何抗肿瘤治疗. 兔抗人多克隆抗体Bmi-1(1:100)、兔抗人多克隆抗体Mel-18(1:100)抗体及免疫组织化学试剂盒均购自北京博奥森生物有限公司. Bmi-1、Mel-18标记均采用免疫组织化学SP法染色, 枸椽酸盐高压锅热修复; DAB显色, 苏木素复染胞核. 用PBS代替一抗作阴性对照, 用已知阳性标本切片作阳性对照.
Bmi-1、Mel-18蛋白阳性反应为胞核内染色, 少数为胞浆内染色. 染色结果采用Thomas综合计分法计算, 即随机选取5个高倍镜视野, 计数阳性细胞占肿瘤细胞的平均数, 阳性细胞<10%计0分, 11%-25%计1分, 26%-50%计2分, 51%-75%计3分, 76%-100%计4分. 染色强度以多数阳性细胞呈现的染色特性计分, 淡黄色计1分, 棕黄色计2分, 棕褐色计3分. 将阳性细胞数和着色强度两者的计分相乘, 以中位数作为低表达和高表达的截断值.
统计学处理 利用SPSS17.0统计软件包进行统计学处理. 统计学方法采用Pearson卡方检验和Spearman等级相关分析, P<0.05认为差异有统计学意义.
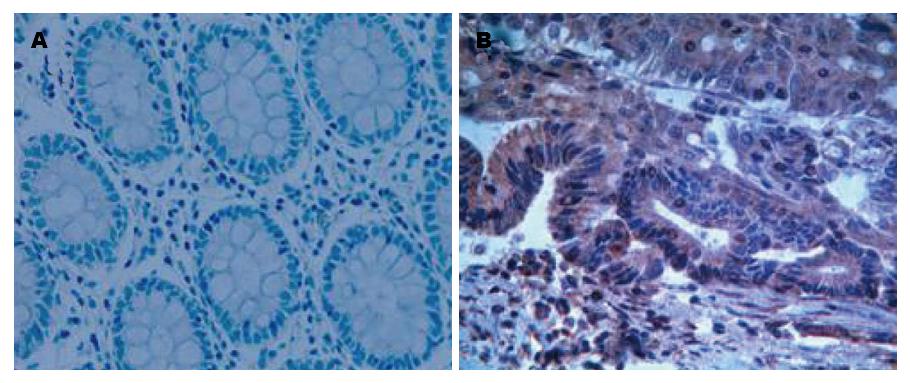
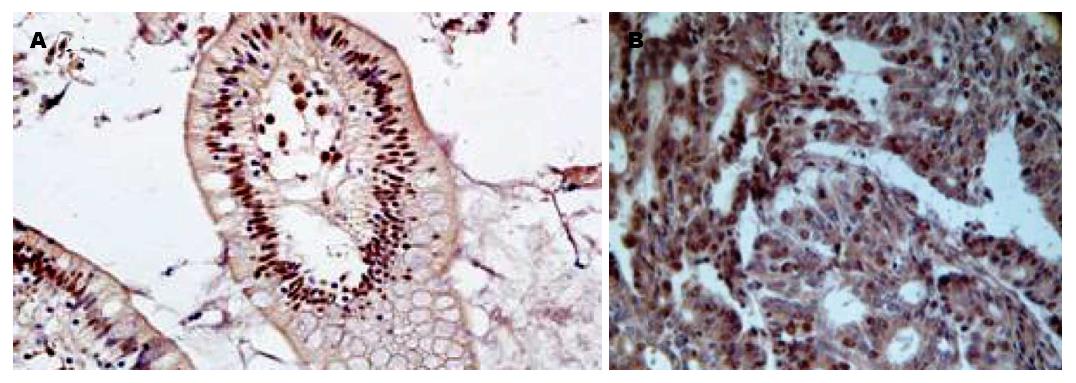
大肠癌组织及正常组织的Bmi-1、Mel-18基因主要在胞核内表达, 部分可在胞浆表达, 阳性表达者呈棕黄色或黄褐色颗粒, Bmi-1、Mel-18基因在大肠癌组织中表达的阳性率分别为73.5%、41.2%, 在正常组织表达阳性率分别为23.5%、66.2%(图1, 图2), Bmi-1在大肠癌组织中表达阳性率高于正常组织, 而Mel-18在大肠癌组织中表达阳性率明显低于正常组织, 两者的差异具有统计学意义(P<0.05, 表1).
| 组织类别 | Bmi-1 | Mel-18 |
| 大肠癌组织 | 50(73.5) | 28(41.2) |
| 正常组织 | 16(23.5) | 45(66.2) |
| χ2值 | 87.515 | 17.02 |
| P值 | 0.000 | 0.000 |
Bmi-1基因在大肠癌组织中的表达与癌组织的淋巴结转移、浸润深度及临床分期密切相关(P<0.05), 与患者性别、年龄无相关性(P>0.05, 表2), Mel-18基因在大肠癌组织中的表达与肿瘤组织的淋巴结转移、临床明显相关(P<0.05), 与患者性别、 年龄、肿瘤分化程度及浸润深度无关(P>0.05, 表2).
| 临床病理因素 | n | Bmi-1 | P值 | Mel-18 | P值 | ||
| 阳性 | 阴性 | 阳性 | 阴性 | ||||
| 性别 | |||||||
| 男 | 38 | 30(78.9) | 8(21.1) | >0.05 | 21(55.3) | 17(44.7) | P>0.05 |
| 女 | 30 | 21(70.0) | 9(30.0) | 14(46.7) | 16(53.3) | ||
| 年龄(岁) | |||||||
| <60 | 36 | 21(58.3) | 15(41.7) | >0.05 | 19(52.8) | 17(47.2) | P>0.05 |
| ≥60 | 32 | 20(62.5) | 12(37.5) | 15(46.9) | 17(53.1) | ||
| 淋巴结转移 | |||||||
| 有 | 28 | 22(76.9) | 6(23.1) | <0.05 | 9(32.1) | 19(67.9) | P<0.05 |
| 无 | 40 | 15(42.9) | 25(57.1) | 28(69.0) | 12(31.0) | ||
| 分化程度 | |||||||
| 高+中 | 45 | 26(57.8) | 19(42.2) | >0.05 | 21(46.7) | 24(53.3) | P>0.05 |
| 中低+低 | 23 | 10(43.5) | 13(56.5) | 11(47.8) | 12(52.2) | ||
| 浸润深度 | |||||||
| 未及外膜 | 28 | 22(78.6) | 6(21.4) | <0.05 | 16(57.1) | 12(42.9) | P>0.05 |
| 侵透外膜 | 40 | 13(32.5) | 27(67.5) | 22(55.0) | 18(45.0) | ||
| TNM分期 | |||||||
| Ⅰ、Ⅱ期 | 42 | 11(26.2) | 31(73.8) | <0.05 | 29(69.0) | 13(31.0) | P<0.05 |
| Ⅲ、Ⅳ期 | 26 | 21(80.7) | 5(19.3) | 9(34.6) | 17(65.4) | ||
本实验中, 我们检测了68例大肠癌组织和相应的68例正常组织中Bmi-1基因和Mel-18基因的表达水平, 结果均显示差异具有显著统计学意义(P<0.05). Bmi-1基因在大肠癌组织中的表达明显高于正常组织, 并且随着癌组织的淋巴结转移、浸润深度、临床分期的增加, 该基因表达的阳性率逐渐升高(P<0.05), 而与患者的性别、年龄、肿瘤的分化程度无相关性(P>0.05). 通过对Bmi-1基因的表达与大肠癌病理因素关系的分析发现, Bmi-1基因在大肠癌组织中高表达可以增加淋巴转移和组织浸润危险, 从而反映恶性程度越高的大肠癌, 其浸润扩散和远处转移越严重, 可能与Bmi-1基因的高表达有关. 而目前临床上正是通过肿瘤的大小、分化程度、淋巴转移等来判断大肠癌的预后. 因此我们认为通过检测Bmi-1基因的表达对判断大肠癌的预后可能有重要意义. Song等[10]研究证实, 在一组鼻咽癌患者中, Bmi-1基因表达阳性者的5年生存率明显低于Bmi-1表达阴性者, Bmi-1基因阳性表达为独立的鼻咽癌预后因素. 在胃癌、肺癌、肝细胞癌和乳腺癌中同样提示高表达Bmi-1与预后不良密切相关[8-10,14]. Bmi-1基因为PcG成员之一, 他与c-myc协同作用可以引起细胞转化和肿瘤形成, 并参与细胞增殖的调控. Bmi-1对于造血干细胞自我更新及分化潜能维持起着极其重要的角色, 并在部分血液系统恶性疾病, 包括白血病及淋巴瘤的发生和发展中发挥重要作用[15]. 近些年, 有文献报道Bmi-1基因在中心体复制扩增中起着重要的作用[16]. 最近研究发现Bmi-1在大部分人体正常组织中都不表达或呈低表达, 而其mRNA和蛋白在很多肿瘤组织或细胞中却表达上调, 并且与患者预后不良相关, 这些都提示Bmi-1可能与大肠癌预后有关, 因此被认为是一种潜在的癌基因[14,17,18].
本实验还发现, Mel-18基因在大肠癌组织中低表达, 甚至部分缺失, 而在正常组织中有较高表达, 以胞核内为主. 通过对Mel-18基因在大肠癌组织中的表达水平与大肠癌病理特征关系的分析发现, 该基因与肿瘤组织的淋巴结转移、临床分期呈负相关(P<0.05), 与患者的性别、年龄、肿瘤分化程度及浸润深度无相关性(P>0.05). 推测Mel-18基因可能作为一种抑癌基因, 抑制肿瘤的淋巴结转移. Mel-18基因自1991年被发现以来就成为研究的热点, 他第一次作为一种抑癌基因被提出来是在转基因鼠的淋巴细胞瘤细胞的传代中, 发现其可以下调c-myc, 从而引起细胞的衰老和肿瘤细胞的凋亡[9,14]. Mel-18基因在多种肿瘤组织中(胃癌、食管癌、乳腺癌、前列腺癌等)呈低表达[19-22], 郭宝红等[21]应用免疫组织化学的方法检测63例乳腺癌患者中Mel-18基因的表达, 发现在早期、无淋巴结转移、ER阴性的标本中, Mel-18基因的表达信号强, 反之, 在晚期、有淋巴结转移、ER阳性的患者, Mel-18基因的表达信号较弱, 等级相关分析表明Mel-18基因的表达与乳腺癌的淋巴结转移、临床分期呈负相关(P<0.05), 上述实验结果与本实验大肠癌中的表达情况基本一致. 临床分期与淋巴结转移是决定患者预后的两个最重要的因素, 临床分期愈晚, 手术根治的机会愈少, 预后愈差. 本研究中, Mel-18基因与肿瘤组织的淋巴结转移、临床分期呈负相关(P<0.05), 提示Mel-18基因可能与大肠癌预后有关, 有可能成为临床监测病情, 评估大肠癌患者预后的重要指标. 已有研究发现, Mel-18和Bmi-1基因结构高度同源, 在N端区域与Bmi-1相应区域有93%同源性[9]. Bmi-1在多种肿瘤中被证实为原癌基因[9,17,23-25]. 有研究表明, 两者在功能上可能存在重叠性, Mel-18亦可能存在癌基因的特性[26]. 但近年研究发现, Mel-18基因更多的表现为抑癌基因的性质[27]. 本实验中, 通过二者的相关性分析发现, Mel-18、Bmi-1蛋白在大肠癌组织中的表达水平呈负相关(r = -0.545, P<0.05), 进一步提示Bmi-1是癌基因, 促进大肠癌的发生发展; 而Mel-18可能是抑癌基因, 抑制大肠癌的生成和发展. 在成纤维细胞衰老的过程中, Mel-18在转录水平通过抑制c-myc下调Bmi-1的表达[28], 在乳腺癌细胞中Mel-18表达与Bmi-1的表达也是密切负相关的[29], 外源性Mel-18过表达也通过下调c-myc的表达来下调Bmi-1的水平[21,30]. 关于Bmi-1与Mel-18在大肠癌组织中的关系目前尚无报道, 在大肠癌组织中Bmi-1与Mel-18是否也存在这种关系, 即抑制c-myc的表达, 进而下调Bmi-1基因的表达, 他们的信号传导途径还需进一步研究.
综上所述, Bmi-1基因的高表达和Mel-18基因的低表达可能与大肠癌的发展、转移及预后相关. 本实验检测二者在大肠癌组织中的表达, 对于判断大肠癌的进展、恶性程度及预后可能具有重要意义, 为结直肠癌的治疗提供新的思路及理论依据, 然而Bmi-1基因和Mel-18基因在肿瘤发生发展过程是如何受调控的以及这些调控的重要程度和具体的机制目前尚不明确, 仍需要深入探索. 这些探索将为阐明大肠癌的分子发病机制提供重要参考.
感谢宋锐锋、李娅在本试验中给予的大力帮助.
肠易激综合征(IBS)是常见的功能性肠道疾病, 其病因及发病机制尚不明确, 缺乏特异性的生物学诊断指标. 近年来, miRNA在人类疾病中的广泛研究, 使得miRNA在IBS中的价值逐渐引起人们的重视.
潘秀珍, 教授, 主任医师, 福建省立医院消化科
明确IBS血循环miRNA的表达谱,进而探索IBS的发病机制及诊断标志, 是当前乃至今后的研究热点.
已有研究显示miRNA在IBS的发病中可能起重要作用, 但是研究的miRNA数量极少, 没有反映IBS miRNA表达谱的变化.
本文采用基因芯片技术分析IBS血循环miRNA的表达谱, 全面反映了IBS疾病过程中miRNA的表达变化.
IBS血循环miRNA的表达谱是今后研究IBS发病机制及诊断标志的分子基础, 从长远来看, 对IBS患者的临床诊治也有深远的意义.
本文研究起点高, 对IBS发病的研究和进一步对其进行临床诊疗均有一定的意义.
编辑: 田滢 电编: 鲁亚静
| 1. | Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin. 2005;55:74-108. [PubMed] [DOI] |
| 4. | Sung J. Does fecal occult blood test have a place for colorectal cancer screening in China in 2006? Am J Gastroenterol. 2006;101:213-215. [PubMed] [DOI] |
| 5. | Haupt Y, Alexander WS, Barri G, Klinken SP, Adams JM. Novel zinc finger gene implicated as myc collaborator by retrovirally accelerated lymphomagenesis in E mu-myc transgenic mice. Cell. 1991;65:753-763. [PubMed] [DOI] |
| 6. | Valk-Lingbeek ME, Bruggeman SW, van Lohuizen M. Stem cells and cancer; the polycomb connection. Cell. 2004;118:409-418. [PubMed] [DOI] |
| 7. | Beà S, Tort F, Pinyol M, Puig X, Hernández L, Hernández S, Fernandez PL, van Lohuizen M, Colomer D, Campo E. BMI-1 gene amplification and overexpression in hematological malignancies occur mainly in mantle cell lymphomas. Cancer Res. 2001;61:2409-2412. [PubMed] |
| 9. | Vonlanthen S, Heighway J, Altermatt HJ, Gugger M, Kappeler A, Borner MM, van Lohuizen M, Betticher DC. The bmi-1 oncoprotein is differentially expressed in non-small cell lung cancer and correlates with INK4A-ARF locus expression. Br J Cancer. 2001;84:1372-1376. [PubMed] [DOI] |
| 10. | Song LB, Zeng MS, Liao WT, Zhang L, Mo HY, Liu WL, Shao JY, Wu QL, Li MZ, Xia YF. Bmi-1 is a novel molecular marker of nasopharyngeal carcinoma progression and immortalizes primary human nasopharyngeal epithelial cells. Cancer Res. 2006;66:6225-6232. [PubMed] [DOI] |
| 12. | Asano H, Ishida A, Hasegawa M, Ono T, Yoshida MC, Taniguchi M, Kanno M. The mouse Mel-18 "RING-finger" gene: genomic organization, promoter analysis and chromosomal assignment. DNA Seq. 1993;3:369-377. [PubMed] |
| 13. | van Lohuizen M, Verbeek S, Scheijen B, Wientjens E, van der Gulden H, Berns A. Identification of cooperating oncogenes in E mu-myc transgenic mice by provirus tagging. Cell. 1991;65:737-752. [PubMed] [DOI] |
| 14. | Wang H, Pan K, Zhang HK, Weng DS, Zhou J, Li JJ, Huang W, Song HF, Chen MS, Xia JC. Increased polycomb-group oncogene Bmi-1 expression correlates with poor prognosis in hepatocellular carcinoma. J Cancer Res Clin Oncol. 2008;134:535-541. [PubMed] [DOI] |
| 15. | Haupt Y, Bath ML, Harris AW, Adams JM. bmi-1 transgene induces lymphomas and collaborates with myc in tumorigenesis. Oncogene. 1993;8:3161-3164. [PubMed] |
| 16. | 宋 立兵, 张 玲, 曾 木圣, 廖 雯婷, 李 满枝, 郭 宝红, 汪 慧民. 癌基因BMI-1对中心体复制的调节作用. 中山大学学报(医学科学版). 2005;26:377-379. |
| 17. | Kim JH, Yoon SY, Kim CN, Joo JH, Moon SK, Choe IS, Choe YK, Kim JW. The Bmi-1 oncoprotein is overexpressed in human colorectal cancer and correlates with the reduced p16INK4a/p14ARF proteins. Cancer Lett. 2004;203:217-224. [PubMed] [DOI] |
| 18. | van Lohuizen M, Frasch M, Wientjens E, Berns A. Sequence similarity between the mammalian bmi-1 proto-oncogene and the Drosophila regulatory genes Psc and Su(z)2. Nature. 1991;353:353-355. [PubMed] [DOI] |
| 20. | 张 振伟, 蒋 仲敏. Mel-18 mRNA在食管鳞癌中的表达及其临床意义. 山东大学学报(医学版). 2012;50:78-81. |
| 21. | 郭 宝红, 宋 立兵, 张 玲, 廖 文婷, 冯 艳, 刘 万里, 李 满枝, 曾 木圣. Mel-18在乳腺癌中表达的意义. 中山大学学报(医学科学版). 2006;23:27-30. |
| 23. | Reinisch C, Kandutsch S, Uthman A, Pammer J. BMI-1: a protein expressed in stem cells, specialized cells and tumors of the gastrointestinal tract. Histol Histopathol. 2006;21:1143-1149. [PubMed] |
| 24. | Feng Y, Song LB, Guo BH, Liao WT, Li MZ, Liu WL, Zeng MS, Zhang L. [Expression and significance of Bmi-1 in breast cancer]. Ai Zheng. 2007;26:154-157. [PubMed] |
| 26. | Wiederschain D, Chen L, Johnson B, Bettano K, Jackson D, Taraszka J, Wang YK, Jones MD, Morrissey M, Deeds J. Contribution of polycomb homologues Bmi-1 and Mel-18 to medulloblastoma pathogenesis. Mol Cell Biol. 2007;27:4968-4979. [PubMed] [DOI] |
| 27. | Zhang XW, Sheng YP, Li Q, Qin W, Lu YW, Cheng YF, Liu BY, Zhang FC, Li J, Dimri GP. BMI1 and Mel-18 oppositely regulate carcinogenesis and progression of gastric cancer. Mol Cancer. 2010;9:40. [PubMed] [DOI] |
| 28. | Guo WJ, Zeng MS, Yadav A, Song LB, Guo BH, Band V, Dimri GP. Mel-18 acts as a tumor suppressor by repressing Bmi-1 expression and down-regulating Akt activity in breast cancer cells. Cancer Res. 2007;67:5083-5089. [PubMed] [DOI] |
| 29. | Riis ML, Lüders T, Nesbakken AJ, Vollan HS, Kristensen V, Bukholm IR. Expression of BMI-1 and Mel-18 in breast tissue--a diagnostic marker in patients with breast cancer. BMC Cancer. 2010;10:686. [PubMed] [DOI] |
| 30. | Lee JY, Jang KS, Shin DH, Oh MY, Kim HJ, Kim Y, Kong G. Mel-18 negatively regulates INK4a/ARF-independent cell cycle progression via Akt inactivation in breast cancer. Cancer Res. 2008;68:4201-4209. [PubMed] [DOI] |