修回日期: 2012-01-17
接受日期: 2013-01-25
在线出版日期: 2013-02-18
目的: 探讨人类白细胞抗原Ⅰ类分子(human leukocyte antigen class Ⅰ, HLA-Ⅰ)类抗原及内质网分子伴侣在新疆哈萨克族食管癌中的表达水平及其与临床病理特征之间的关系.
方法: 用免疫组织化学法检测50例新疆哈萨克族食管鳞癌、癌旁石蜡包埋组织中HLA-Ⅰ类分子和内质网分子伴侣中的表达水平, 同时分析其蛋白表达下调和缺失与临床病理特征的关系.
结果: 在食管癌组织中, HLA-Ⅰ类抗原和内质网分子伴侣钙连接蛋白(CNX)、TAP相关蛋白(Tapasin)、蛋白质二硫异构体(Erp57)的表达下调和缺失率分别为24%/68%、20%/48%、20%/52%、16%/32%, 在癌旁组织中的表达下调和缺失率为4%/0%、10%/2%、8%/2%、16%/2%. 食管癌组织中HLA-Ⅰ分子及内质网分子伴侣较癌旁组织中有明显的表达下调或缺失, 其差异均有统计学意义(P<0.05). 在临床病理特征中, HLA-Ⅰ与肿瘤分化、淋巴结转移、肿瘤浸润深度密切相关; CNX与肿瘤分化、血管侵袭、淋巴结转移、肿瘤浸润深度密切相关; Erp57与淋巴结转移、血管侵袭、肿瘤浸润深度密切相关; Tapasin与肿瘤分化、肿瘤浸润深度密切相关, 表达差异均有统计学意义(P<0.05).
结论: 新疆哈萨克族食管癌中有明显的HLA-I类抗原及内质网分子伴侣的表达下调或缺失, 这与哈萨克族食管癌的发生及肿瘤的临床病理特征密切相关.
引文著录: 郑峰, 李德生, 居来提·安尼瓦尔, 张力为, 伊力亚尔·夏合丁. HLA-Ⅰ类抗原及内质网分子伴侣表达下调与新疆哈萨克族食管鳞癌的关系. 世界华人消化杂志 2013; 21(5): 386-391
Revised: January 17, 2012
Accepted: January 25, 2013
Published online: February 18, 2013
AIM: To investigate the expression of human leukocyte antigen class-Ⅰ(HLA-Ⅰ) and endoplasmic reticulum molecular chaperones and to analyze their relationship with clinicopathological features of esophageal squamous cell carcinoma (ESCC) in Kazakh patients.
METHODS: The expression of HLA-Ⅰand endoplasmic reticulum molecular chaperones was assessed by immunohistochemistry in 50 paraffin-embedded ESCC specimens and tumor-adjacent normal mucosal specimens. The associations of expression of HLA-Ⅰand endoplasmic reticulum molecular chaperones with clinicopathological features of ESCC were analyzed.
RESULTS: The rates of down-regulation or loss of expression of HLA-Ⅰprotein and endoplasmic reticulum molecular chaperones (CNX, Tapasin, and Erp57) were 24%/68%, 20%/48%, 20%/52% and 16%/32% in ESCC, and %/0%,10%/2%,8%/2% and 16%/2% in tumor adjacent normal mucosal specimens. The positive rates of HLA-Ⅰand endoplasmic reticulum molecular chaperones significantly decreased in ESCC compared with control tissue (P < 0.05). HLA-Ⅰexpression was significantly correlated with pathological grade, lymph node metastasis and depth of invasion. Erp57 expression was significantly correlated with vascular invasion, lymph node metastasis and depth of invasion. Tapasin expression was significantly correlated with lymph node metastasis and depth of invasion. Calnexin expression was significantly correlated with all above clinicopathological parameters (all P < 0.05).
CONCLUSION: Expression of HLA-Ⅰand endoplasmic reticulum molecular chaperones was significantly down-regulated in ESCC in Xinjiang Kazakh patients. The abnormal expression of HLA-I and endoplasmic reticulum molecular chaperones is closely related with the occurrence and clinicopathological features of ESCC.
- Citation: Zheng F, Li DS, Anwer J, Zhang LW, Sheyhidin I. Association of down-regulated expression of HLA-Ⅰ antigen and endoplasmic reticulum molecular chaperones with clinicopathological features of esophageal squamous cell carcinoma in Xinjiang Kazakh patients. Shijie Huaren Xiaohua Zazhi 2013; 21(5): 386-391
- URL: https://www.wjgnet.com/1009-3079/full/v21/i5/386.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i5.386
新疆是我国食管癌高发区之一, 发病率及死亡率具有明显的民族差异, 以哈萨克族发病率最高, 其死亡率为68.88/10万, 远高于全国平均水平(14.59/10万)[1]. 随着对肿瘤发病机制的深入研究, 发现人类白细胞抗原Ⅰ类分子(human leukocyte antigen class Ⅰ, HLA-Ⅰ)表达低下或缺失, 可导致肿瘤细胞逃逸宿主免疫监视, 从而与肿瘤发生密切相关[2]. HLA-Ⅰ类分子是机体免疫应答信息产生和传递的基础, 主要功能是将细胞内源性抗原肽呈递到细胞表面, 实现CD8+T细胞对自身抗原的识别和免疫监视[3]. 而此呈递过程必须在内质网分子伴侣钙连接蛋白(calnexin, CNX)、TAP相关蛋白(TAP-associated protein, tapasin)和蛋白质二硫异构体(Erp57)的协助下才能完成[4]. 在宫颈癌、头、颈部肿瘤、膀胱癌中已发现这些分子异常表达[5-7], 但食管癌有关这方面的报道甚少. 本研究通过免疫组织化学染色, 探讨新疆哈萨克族食管癌组织中HLA-Ⅰ类抗原和内质网分子伴侣表达情况以及其与肿瘤临床病理特征之间的关系.
选择新疆医科大学第一附属医院2007-2009手术切除哈萨克族食管鳞癌标本50例, 年龄36-79岁, 中位年龄50.5岁. 常规石蜡包埋, 切片, 选取距癌组织边缘≥5 cm处食管切缘组织标本作为"正常"对照. 组织病理学诊断由病理医生确诊. 按TNM标准对肿瘤进行病理分型. 50例组织全部为食管鳞癌, 其中病理分型高分化25例, 中分化11例, 低分化14例. 30例有淋巴结转移. 22例肿瘤浸润深度超过15毫米, 16例呈血管侵袭生长. SP试剂盒及DAB显色剂购自北京中杉金桥公司. 分子伴侣抗体分别为: 鼠抗人HLA-Ⅰ抗体(1:100稀释, Santa Cruz公司); 兔抗人CNX单抗(1:50稀释, Santa Cruz公司); 鼠抗人ERp57抗体(1:50稀释, Abcam公司); 鼠抗人tapasin抗体(1:100稀释, Abcam公司).
应用免疫组织化学SP法进行染色. 切片常规二甲苯脱蜡, 梯度乙醇水化后微波炉抗原修复, 滴加适量H2O2阻断内源性过氧化物酶, 然后滴加一抗, 4 ℃冰箱过夜(以PBS作为阴性对照). 第2天加二抗(各步间隔PBS缓冲液冲洗10 min). DAB显色, 苏木素复染, 常规脱水、透明封片. 阳性细胞为明显可辨的黄色或棕黄色. 采用双盲法由两位病理医师分别计数着色细胞数和染色强度. 光学显微镜下全视野观察,按阳性细胞数在上皮细胞内所占比例分为4个分值, 染色细胞数<5%视为0分, 5%-25%为1分, 6%-75%为2分; >75%者为3分. 染色强度判定: 不显色或显色不清为0分, 浅黄色为1分, 棕黄色为2分, 深棕色为3分. 综合积分按公式计算: 综合积分 = (染色细胞分数+染色强度分数)/2. 综合判定: 积分小于0.5分为表达缺失, 0.5-1.5分为表达下调, 大于1.6分为正常表达.
统计学处理 采用SPSS15.0软件对全部数据进行统计处理, 等级资料分析采用秩和检验. 以P<0.05为差异有统计学意义的检验标准.
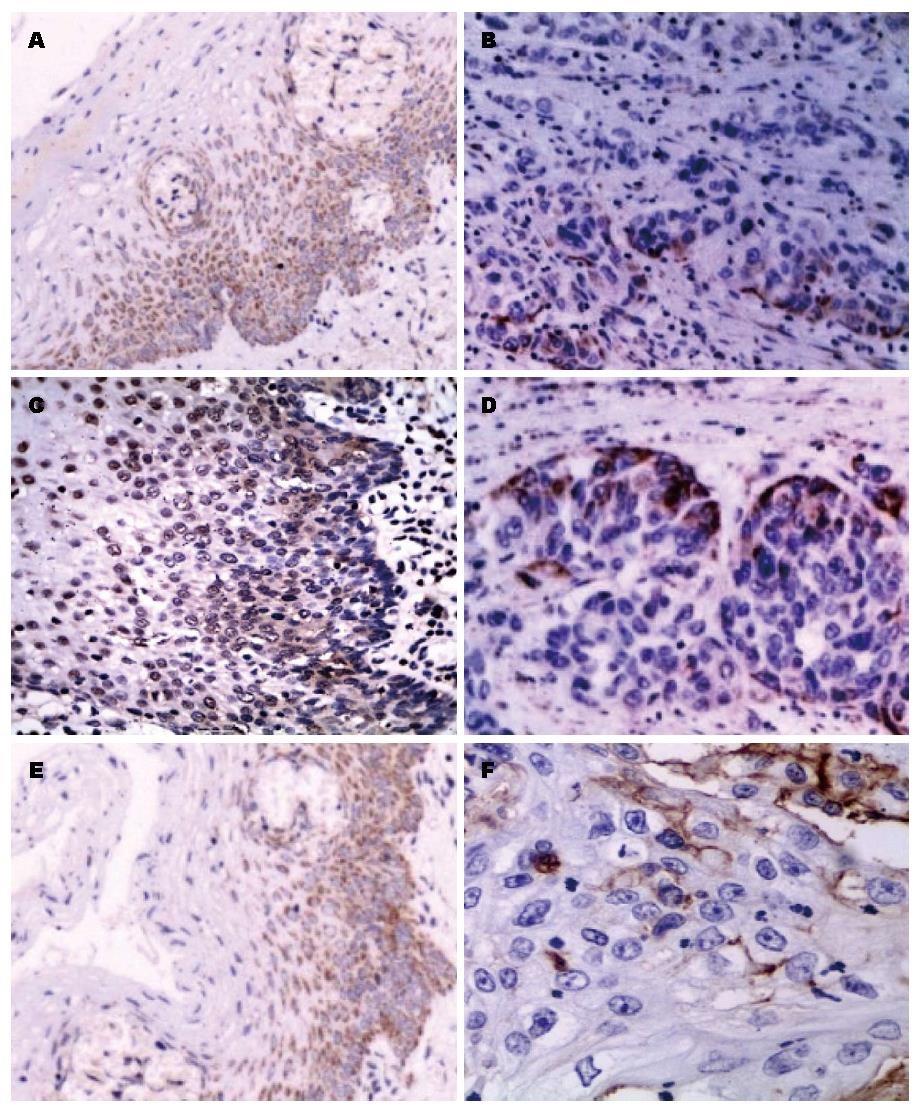
HLA-Ⅰ类分子阳性表达部位多为细胞膜, 少数为细胞质, 上皮细胞和间质淋巴细胞染色呈黄色或棕黄色. 内质网分子伴侣Tapasin、CNX和Erp57主要表达于细胞质(图1).
HLA-Ⅰ、CNX、Tapasin、Erp57各分子在癌组织中的表达下调和缺失率分别为24%/68%、20%/48%、20%/52%、16%/32%; 在癌旁组织中为4%/0%、10%/2%、8%/2%、16%/2%. 食管癌组织中HLA-Ⅰ分子及内质网分子伴侣Tapasin、CNX和Erp57均有明显的表达下调或缺失, 与癌旁组织相比有统计学意义(P<0.05, 表1).
| HLA-Ⅰ分子和内质网分子伴侣 | 表达水平 | 食管癌 | 癌旁组织 | P值 |
| HLA-Ⅰ | + | 4(8) | 48(96) | |
| +/- | 12(24) | 2(4) | ||
| - | 34(68) | 0(0) | 0.000 | |
| CNX | + | 16(32) | 44(88) | |
| +/- | 10(20) | 5(10) | ||
| - | 24(48) | 1(2) | 0.000 | |
| Tapasin | + | 14(28) | 45(90) | |
| +/- | 10(20) | 4(8) | ||
| - | 26(32) | 1(2) | 0.000 | |
| Erp57 | + | 26(52) | 41(82) | |
| +/- | 8(16) | 8(16) | ||
| - | 16(32) | 1(2) | 0.000 |
HLA-Ⅰ分子的表达下调与肿瘤分化程度、淋巴结是否转移、肿瘤侵犯深度密切相关. 内质网分子伴侣中CNX与所有病理特征均密切相关, Erp57与淋巴结是否转移、是否呈血管浸润生长、肿瘤侵犯深度密切相关, Tapasin与肿瘤分化程度、肿瘤侵犯深度密切相关, 表达差异均有统计学意义(P<0.05, 表2).
| 临床病理特征 | n | HLA-Ⅰ | CNX | Tapasin | Erp57 | ||||||||
| + | +/- | - | + | +/- | - | + | +/- | - | + | +/- | - | ||
| 肿瘤分化程度 | |||||||||||||
| 高 | 25 | 3(12) | 11(44) | 11(44) | 11(46) | 7(28) | 7(28) | 11(44) | 6(24) | 8(32) | 16(64) | 3(12) | 6(24) |
| 中 | 11 | 11(9) | 0(0) | 10(91) | 4(36) | 1(9) | 6(54) | 2(18) | 2(18) | 7(64) | 6(64) | 2(18) | 2(18) |
| 低 | 14 | 0(0) | 1(7) | 13(93) | 1(7) | 2(14) | 11(71) | 1(7) | 2(14) | 11(79) | 4(29) | 3(21) | 7(50) |
| P值 | 0.002 | 0.011 | 0.010 | 0.096 | |||||||||
| 淋巴结转移 | |||||||||||||
| 阳性 | 30 | 1(3) | 5(17) | 24(80) | 7(23) | 3(10) | 20(67) | 6(20) | 5(17) | 19(63) | 12(40) | 5(17) | 13(43) |
| 阴性 | 20 | 3(15) | 7(35) | 10(50) | 9(45) | 7(35) | 4(20) | 8(40) | 5(25) | 7(35) | 14(70) | 3(15) | 3(15) |
| P值 | 0.023 | 0.006 | 0.050 | 0.026 | |||||||||
| 肿瘤浸润深度(mm) | |||||||||||||
| ≥15 | 22 | 0(0) | 4(18) | 18(82) | 4(18) | 4(18) | 14(64) | 4(18) | 2(9) | 16(73) | 8(37) | 4(18) | 10(45) |
| <15 | 28 | 4(16) | 8(27) | 16(57) | 12(43) | 6(21) | 10(36) | 10(35) | 8(30) | 10(35) | 18(65) | 4(14) | 6(21) |
| P值 | 0.045 | 0.038 | 0.020 | 0.043 | |||||||||
| 侵袭血管生长 | |||||||||||||
| 是 | 16 | 1(6) | 2(13) | 13(81) | 1(6) | 3(18) | 12(76) | 2(12) | 4(25) | 10(63) | 5(31) | 3(19) | 8(50) |
| 否 | 34 | 3(9) | 10(29) | 21(62) | 15(44) | 7(21) | 12(35) | 12(35) | 6(18) | 16(47) | 21(61) | 5(15) | 8(24) |
| P值 | 0.196 | 0.004 | 0.171 | 0.037 | |||||||||
我国是世界上食管癌发病率和死亡率最高的国家. 随着肿瘤免疫学突破性的进展, 肿瘤特异性免疫治疗的研究成为最具应用潜力的研究领域. HLA-Ⅰ类抗原是免疫系统中的重要分子, 他参与机体递呈抗原, 决定免疫细胞对肿瘤的识别和杀伤, 与肿瘤的发生密切相关[8]. 内质网分子伴侣帮助HLA多肽链的正确折叠和组装, 对抗原的呈递过程发挥重要作用[9]. 本文分析新疆哈萨克族食管鳞癌组织中HLA-Ⅰ类抗原和内质网分子伴侣的表达, 以及他与临床病理学特征的关系, 为新疆哈萨克族食管癌的发生机制及免疫治疗研究提供实验依据.
结果显示, 新疆哈萨克族食管鳞癌组织中HLA-Ⅰ类抗原表达下调和缺失率达到24%/68%, 明显高于癌旁组织中的4%/0%, 并且这种异常表达与肿瘤分化、淋巴结转移、肿瘤侵犯深度等临床特征密切相关. HLA-Ⅰ类分子的下调和缺失率在高分化癌、中分化癌及低分化癌中是逐渐增高的. 随着肿瘤浸润的深度增加, 其下调与缺失率也增高. 在有淋巴结转移的病例中, HLA-Ⅰ类分子的下调和缺失率增高. 这与缪凤琴等[10]在汉族食管癌组织中报道结果相一致. 其研究发现在83例食管癌组织中, HLA-Ⅰ类分子有明显的表达下调或缺失. HLA B/C、HLA-A下调率为12.0%、25.3%, 丢失率为29.0%、33.7%, 且HLA-Ⅰ类分子的异常表达与肿瘤分化密切相关, 但未就表达下调与患者预后、淋巴浸润和侵袭性进行分析. 本研究进一步发现HLA-Ⅰ类分子表达下调和缺失与淋巴浸润和肿瘤侵袭性也密切相关. 证明HLA-Ⅰ类分子表达下调在新疆哈萨克族食管癌的整个演进过程以及预后中起到重要作用.
HLA-Ⅰ类抗原在细胞表面的正常表达是T淋巴细胞介导的抗原识别和自身免疫功能的基础. 为了到达细胞表面, HLA类分子必须在内质网分子伴侣CNX、Tapasin、Erp57的协助下正确折叠和组装, 才能完成对内源性抗原肽的呈递功能. 这3种分子的表达异常也是导致HLA-Ⅰ类抗原表达下调或缺失的重要原因之一[11]. 本实验检测显示CNX、Tapasin、Erp57各分子在癌组织中的表达下调和缺失率分别为20%/48%、20%/52%、16%/32%; 在癌旁组织中为10%/2%、8%/2%、16%/2%. 在癌组织中的表达下调和缺失率明显高于癌旁组织, 与HLA-Ⅰ类抗原下调和缺失保持一致. 提示内质网分子伴侣表达下调, 影响了HLA类分子的正确折叠和组装, 以及对抗原的呈递作用. 有研究者在宫颈癌中也发现内质网分子伴侣下调是早期事件, 且与临床进程相关[12]. 其中ERp57表达下调与宫颈癌的分化程度相关, Tapasin的表达下调与FIGO临床分期密切相关, CNX、Tapasin和ERp57表达下调与淋巴结转移密切相关. 本研究发现在新疆哈萨克族食管癌中CNX表达下调与食管癌的分化程度、淋巴结转移、是否呈血管浸润生长密切相关, Erp57与淋巴结是否转移、是否呈血管浸润生长、肿瘤侵犯深度密切相关, Tapasin与肿瘤分化程度、肿瘤侵犯深度密切相关. CNX是内质网中的一类重要的类凝集素分子伴侣, 其主要辅助糖蛋白的折叠和装配, 包括HLA-Ⅰ类分子的折叠和装配过程[13]. Erp57蛋白为蛋白质二硫化物异构酶成员之一, 与钙网蛋白介导的抗肿瘤免疫系统关系密切[14]. Tapasin在抗原提呈中起着重要作用, Tapasin的缺失可能会导致HLA-Ⅰ类分子细胞内装配不充分而影响其在细胞表面的表达[15]. 所以如果内质网分子伴侣表达下调, 会导致肿瘤抗原的加工递呈途径的障碍, 从而不利于机体的抗肿瘤免疫应答导致免疫逃逸, 从而影响患者的临床病理特征及预后.
本实验结果显示HLA-Ⅰ类抗原与内质网分子伴侣的下调和缺失和新疆哈萨克族食管癌的发生以及临床病理特征呈正相关, 但这种缺失是发生在基因水平还是转录水平还不清楚. 由于肿瘤的复杂性, 还可能存在其他导致HLA-Ⅰ类分子异常表达的机制, 且对于不同个体, 肿瘤发生的机制也各异, 因此还需要进一步对HLA-Ⅰ类抗原与内质网分子伴侣的下调和缺失的机制进行研究, 从而使食管癌患者取得满意的免疫治疗效果.
新疆是我国食管癌高发区之一. 食管癌的发病率具有明显的民族差异, 以哈萨克族发病率最高. 随着对肿瘤发病机制的深入研究, 发现人类白细胞抗原Ⅰ类分子(HLA-Ⅰ)表达低下或缺失, 可导致肿瘤细胞逃逸宿主免疫监视, 从而与肿瘤发生密切相关. 本文通过免疫组织化学染色, 探讨新疆哈萨克族食管癌组织中HLA-Ⅰ类抗原和内质网分子伴侣表达情况以及其与肿瘤临床病理特征之间的关系, 为新疆哈萨克族食管癌的发生机制及免疫治疗研究提供实验依据.
陈洪, 医学博士, 主任医师, 副教授, 东南大学附属中大医院消化科
HLA-Ⅰ类抗原是免疫系统中的重要分子, 他参与机体递呈抗原, 决定免疫细胞对肿瘤的识别和杀伤, 与肿瘤的发生密切相关. 内质网分子伴侣帮助HLA多肽链的正确折叠和组装, 对抗原呈递过程发挥重要作用.
缪凤琴等在83例汉族食管癌组织中研究发现HLA-Ⅰ类分子有明显的表达下调或缺失. HLA B/C、HLA-A下调率为12.0%、25.3%, 丢失率为29.0%、33.7%, 且HLA-Ⅰ类分子的异常表达与肿瘤分化密切相关. 刘巧在114/120例食管鳞癌和40/40例淋巴结转移灶癌细胞中研究发现, 有淋巴结转移的鳞癌组织中HLA-Ⅰ、TAP1的下调和丢失率明显高于无淋巴结转移的鳞癌组织, 提示这些分子表达下调与食管癌的转移密切相关.
本研究通过免疫组织化学染色, 探讨新疆哈萨克族食管癌组织中HLA-Ⅰ类抗原和内质网分子伴侣的表达情况, 以及其与肿瘤临床病理特征之间的关系, 为建立新疆哈萨克族食管癌肿瘤分子标志物及食管癌预后的判断提供理论依据.
本实验证实HLA-Ⅰ类抗原和内质网分子伴侣在新疆哈萨克族食管鳞癌组织中均出现表达下调和缺失, 明显高于癌旁组织, 并且这种异常表达与肿瘤分化、淋巴结转移、肿瘤侵犯深度等临床特征密切相关. 结合临床资料可作为判断肿瘤预后的指标, 为食管癌的病因学研究提供了理论依据.
本文选题新颖, 设计合理, 结果可信, 对于食管癌的发生及预后评价从分子生物学角度提出自己的观点, 但研究深度不足, 可进一步进行分子蛋白表达水平的研究.
编辑: 田滢 电编: 鲁亚静
| 2. | Lorente E, García R, López D. Allele-dependent processing pathways generate the endogenous human leukocyte antigen (HLA) class I peptide repertoire in transporters associated with antigen processing (TAP)-deficient cells. J Biol Chem. 2011;286:38054-38059. [PubMed] [DOI] |
| 3. | Ryschich E, Nötzel T, Hinz U, Autschbach F, Ferguson J, Simon I, Weitz J, Fröhlich B, Klar E, Büchler MW. Control of T-cell-mediated immune response by HLA class I in human pancreatic carcinoma. Clin Cancer Res. 2005;11:498-504. [PubMed] |
| 4. | Seliger B. Molecular mechanisms of MHC class I abnormalities and APM components in human tumors. Cancer Immunol Immunother. 2008;57:1719-1726. [PubMed] [DOI] |
| 5. | Vora AR, Rodgers S, Parker AJ, Start R, Rees RC, Murray AK. An immunohistochemical study of altered immunomodulatory molecule expression in head and neck squamous cell carcinoma. Br J Cancer. 1997;76:836-844. [PubMed] [DOI] |
| 6. | Kageshita T, Hirai S, Ono T, Hicklin DJ, Ferrone S. Down-regulation of HLA class I antigen-processing molecules in malignant melanoma: association with disease progression. Am J Pathol. 1999;154:745-754. [PubMed] [DOI] |
| 7. | Singh H, Derwas N, Poulos A. Very long chain fatty acid beta-oxidation by rat liver mitochondria and peroxisomes. Arch Biochem Biophys. 1987;259:382-390. [PubMed] [DOI] |
| 8. | Marincola FM, Jaffee EM, Hicklin DJ, Ferrone S. Escape of human solid tumors from T-cell recognition: molecular mechanisms and functional significance. Adv Immunol. 2000;74:181-273. [PubMed] [DOI] |
| 9. | Pavelko KD, Mendez-Fernandez Y, Bell MP, Hansen MJ, Johnson AJ, David CS, Rodriguez M, Pease LR. Nonequivalence of classical MHC class I loci in ability to direct effective antiviral immunity. PLoS Pathog. 2012;8:e1002541. [PubMed] [DOI] |
| 10. | 缪 凤琴, 张 建琼, 单 军, 蒋 芹, 陈 昊, 李 淑锋, 张 建民, 谢 维. 食管癌组织HLA-I类抗原及相关分子的表达及意义. 南京师大学报(自然科学版). 2004;27:76-79. |
| 11. | Campoli M, Ferrone S. HLA antigen and NK cell activating ligand expression in malignant cells: a story of loss or acquisition. Semin Immunopathol. 2011;33:321-334. [PubMed] [DOI] |
| 12. | 阿仙姑·哈斯木, 李巧稚, 马俊旗, 古丽扎热叶·艾库尔, 阿布力孜·阿布杜拉. 维吾尔族患者宫颈病变中内质网分子伴侣和HLA-I类分子表达与HPV16感染的关系研究. 实用妇产科杂志. 2011;27:102-105. |
| 13. | Brockmeier A, Brockmeier U, Williams DB. Distinct contributions of the lectin and arm domains of calnexin to its molecular chaperone function. J Biol Chem. 2009;284:3433-3444. [PubMed] [DOI] |
| 14. | Mehta AM, Jordanova ES, Kenter GG, Ferrone S, Fleuren GJ. Association of antigen processing machinery and HLA class I defects with clinicopathological outcome in cervical carcinoma. Cancer Immunol Immunother. 2008;57:197-206. [PubMed] [DOI] |