修回日期: 2013-01-10
接受日期: 2013-01-18
在线出版日期: 2013-02-08
目的: 评价局部进展期直肠癌术前全身静脉联合区域动脉灌注化疗栓塞的有效性和安全性.
方法: 对郑州大学第一附属医院自2008-01/2012-07收治的320例接受新辅助治疗后行经腹手术切除的局部进展期直肠癌的临床资料进行回顾性分析. 其中术前全身静脉联合区域动脉灌注化疗栓塞者148例(A组), 术前放疗+化疗者组172例(B组), 休息3-4 wk后手术. 比较分析两组术后组织病理学疗效、不良反应发生率及术后并发症发生率.
结果: 所有术后标本组织病理学评估均有效, A组的疗效满意率高于B组(60.81% vs 45.35%, P<0.05); 不良反应(除外恶心反应)和术后吻合口瘘、肠梗阻及切口愈合不良等并发症发生率均低于B组(均P<0.05), 而恶心反应发生率高于B组(χ2 = 31.16, P<0.001); 两组均无新辅助治疗相关死亡病例.
结论: 局部进展期直肠癌术前全身静脉联合区域动脉灌注化疗并栓塞的疗效确切, 可降低不良反应、术后并发症发生率.
引文著录: 郜永顺, 钱国武, 张云飞, 吴刚, 李甸源, 李文才, 赵武干, 赵阳阳. 局部进展期直肠癌术前全身静脉联合区域动脉灌注化疗栓塞的疗效评价. 世界华人消化杂志 2013; 21(4): 367-372
Revised: January 10, 2013
Accepted: January 18, 2013
Published online: February 8, 2013
AIM: To evaluate the effectiveness and safety of preoperative systemic vein chemotherapy combined with regional intra-arterial chemoembolization in the management of locally advanced rectal cancer.
METHODS: Clinical data for 320 patients with locally advanced rectal cancer treated at the First Affiliated Hospital of Zhengzhou University from January 2008 to July 2012 were retrospective. The patients were divided into two groups, patients who received preoperative systemic vein chemotherapy combined with regional intra-arterial chemoembolization (group A, n = 148) and those who received preoperative radiotherapy combined with chemotherapy (group B, n = 172). All cases involved in this study were treated with neoadjuvant therapy followed by anterior resection 3 to 4 weeks later. The overall effective rate, the incidence of adverse reactions and postoperative complications were compared between the two groups.
RESULTS: All patients had surgical specimens eligible for histopathological assessment. The overall satisfaction rate was significantly higher in group A than in group B (57.6% vs 44.8%, P < 0.05). The incidence of adverse reactions (except nausea) and postoperative complications such as anastomotic leakage, intestinal obstruction and poor wound healing were all lower in group A than in group B (all P < 0.05), while the incidence of nausea was higher in group A (χ2 = 31.16, P < 0.001). There was no perioperative mortality related to neoadjuvant therapy in both groups.
CONCLUSION: Preoperative systemic vein chemotherapy combined with regional intra-arterial chemoembolization is associated with better efficacy and fewer adverse reactions and postoperative complications in the management of locally advanced rectal cancer.
- Citation: Gao YS, Qian GW, Zhang YF, Wu G, Li DY, Li WC, Zhao WG, Zhao YY. Efficacy of preoperative systemic vein chemotherapy combined with regional intra-arterial chemoembolization in the management of locally advanced rectal cancer. Shijie Huaren Xiaohua Zazhi 2013; 21(4): 367-372
- URL: https://www.wjgnet.com/1009-3079/full/v21/i4/367.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i4.367
目前, 对局部进展期直肠癌的新辅助治疗受到广泛重视和认可, 但缺乏统一的治疗方案, 不同方案的疗效也参差不齐. 我们回顾分析2008-01/2012-07我院收治的320例术前接受全身静脉联合区域动脉灌注化疗栓塞和放疗联合化疗后行经腹手术切除的局部进展期直肠癌的临床资料, 比较两者术后组织病理学疗效、不良反应及术后并发症发生率, 评价其有效性和安全性.
2008-01/2012-07郑州大学第一附属医院收治的经病理证实的接受新辅助治疗的局部进展期直肠癌患者404例, 剔除84例未行肿瘤切除手术及行经腹会阴联合切除术(Mile's术)(其中43例未行手术, 18例行Hartmann术, 23例行Mile's术), 余320例作为研究对象. 其中术前接受全身静脉联合区域动脉灌注化疗栓塞者148例(A组), 术前接受放疗+化疗者组172例(B组), 两组患者一般临床资料均具有可比性(表1). 所有入组患者行新辅助治疗前影像学检查提示无远处转移; 经直肠腔内超声、CT或MRI提示: 肿瘤浸润程度为T3-4期; 行肠镜或直肠指诊提示: 肿瘤下缘距肛门缘<12 cm; Karnofsky评分≥70; 治疗前血常规、肝肾功能正常, 无严重心、肺疾病, 无肠梗阻、大出血表现; 既往未接受过放疗或化疗; 无碘剂及化疗药物过敏史; 本研究经我院道德伦理委员会批准. 患者接受新辅助治疗前均知情同意.
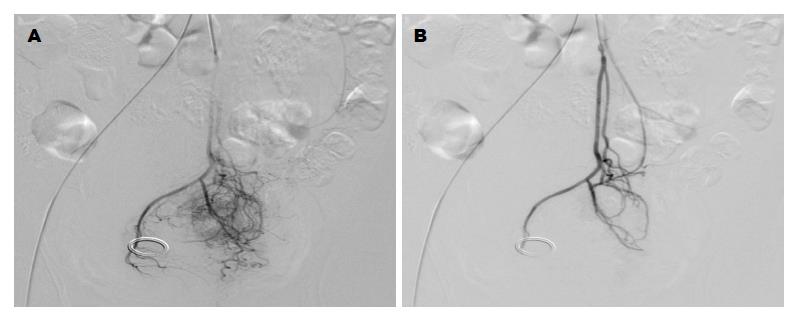
1.2.1 治疗: A组行全身静脉联合区域动脉灌注化疗栓塞: 氟尿嘧啶(5-Fluorouracil, 5-FU)370 mg/m2, 静脉滴注3 h, 1-5 d; 亚叶酸钙(leucovorin, LV)30 mg/m2, 静脉滴注3 h, 1-5 d; 于6 d行区域动脉灌注化疗栓塞, 采用Seldinger法经右侧股动脉插管, 经肠系膜下动脉行超选择至直肠上动脉或经双侧髂内动脉行超选择性直肠中、下动脉, 采用DSA技术进行动脉造影, 根据肿瘤供血动脉迂曲、紊乱血管团的特点定位后, 将奥沙利铂(Oxaliplatin, OXA)25 mg溶解于280 mmol/L葡萄糖100 mL中, 注入肿瘤直肠上动脉, 或分别以2/3-3/4、1/4-1/3量注入直肠中、下动脉的肿瘤富血供侧和乏血供侧, 然后以OXA 25 mg与40%碘化油乳化液共10 mL进行栓塞, 栓塞程度以肿瘤直肠动脉主干呈残根状未再见异常染色为止(图1); 每间隔2 wk重复, 2周期为1个疗程. B组行放疗+化疗: 放疗第1天与化疗第1天同步; 放疗方案为: 放疗总剂量为50 Gy, 2 Gy/次, 5次/周, 共25次, 为1个周期; 采用常规二维放疗技术, 照射野为: 包括直肠原发病灶及盆腔淋巴引流区域, 上界: L5-S1; 下界: 肿瘤下缘3 cm; 左右界超出骨盆缘外1 cm. 化疗方案(FOLFOX4)为: OXA 85 mg/m2, 静脉滴注2 h, 1 d, LV 200 mg/m2, 静脉滴注2 h, 1 d、2 d, 5-FU 400 mg/m2, iv, 1 d、2 d, 5-FU 600 mg/m2, 静脉滴注22 h, 1 d、2 d; 每间隔2 wk重复一次; 以1周期放疗+3周期化疗为1个疗程. 每疗程新辅助治疗结束后2 wk行CT评价其疗效, 按RECIST标准(2009年1.1版), 以靶病灶直径之和与基线水平对比的变化情况, 分为完全缓解(complete remission, CR): 全部肿瘤病灶消失; 部分缓解(partial remission, PR): 肿瘤病灶缩小30%以上; 疾病进展(progressive disease, PD): 肿瘤病灶增加至少20%或出现新的病灶; 疾病稳定(stable disease, SD): 介于PR和PD之间. 以CR+ PR为治疗有效. 治疗有效者, 如能手术切除则行手术治疗, 不能手术切除则继续原治疗方案; 呈SD者, 如能手术切除则行手术治疗, 如不能手术切除则根据病情继续原治疗方案或改行其他治疗; 呈PD者立即停止治疗, 改行其他治疗; 所有患者均于新辅助治疗结束后3-4 wk依据全直肠系膜切除原则行直肠癌根治术, 术中根据肿瘤浸润程度决定手术方式.
1.2.2 术后组织病理学评定: 参照胃癌化疗组织学疗效评定标准分为: 0级: 无效, 未见癌细胞和组织因治疗引起的变性坏死损害; Ⅰ级: 轻效, 其中Ⅰ1级为最轻效, 变性的癌细胞在1/3以下, Ⅰ2级为轻效, 1/3-2/3的癌细胞发生变性坏死和溶解; Ⅱ级: 轻显效, 2/3以上的癌细胞发生变性、坏死和溶解; Ⅲ级: 显效, 癌细胞全部变性、坏死、溶解或消失, 有时可见癌组织为肉芽组织或纤维组织所代替. 以Ⅰ级及以上为治疗有效, Ⅱ级及以上为疗效满意.
1.2.3 不良反应: 按美国国家癌症研究所(NCI)通用不良反应术语标准(4.0版)分为1-5级, 记录其级别最高的不良反应.1、2级反应为低级反应, 3、4级反应为严重反应. 低级反应时, 给予对症处理后继续原治疗方案; 严重反应时, 应立即停止相关治疗, 待降至1级以下时, 适当降低药物剂量并重新开始治疗.
1.2.4 术后并发症: 吻合口瘘、肠梗阻、切口愈合不良.
统计学处理 采用SPSS17.0进行统计分析, 连续性变量资料采用mean±SD表示, 应用Student's t检验; 分类资料采用率比较, 应用χ2检验; 以P<0.05为差异有统计学意义.
两组所有手术标本病理学评估均有效, A组疗效满意率高于B组, 其疗效满意率分别是60.81%和45.35%, 其差异均有统计学意义(P<0.05, 表2).
A组不良反应均为低级反应(1、2级), 而B组出现较多严重反应(3、4级), A组不良反应发生率(除外恶心反应)均明显低于B组, 恶心反应高于B组, 两组均无治疗相关死亡病例, 其不良反应发生的差异有统计学意义(均P<0.05, 表3).
| 不良反应 | A 组 | B 组 | χ2值 | P值 | ||||||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 0 | 1 | 2 | 3 | 4 | 5 | |||
| 白细胞减少 | 56 | 64 | 28 | 0 | 0 | 0 | 28 | 48 | 56 | 36 | 4 | 0 | 51.96 | <0.001 |
| 粒细胞减少 | 52 | 72 | 24 | 0 | 0 | 0 | 12 | 52 | 64 | 40 | 4 | 0 | 87.70 | <0.001 |
| 血小板减少 | 130 | 13 | 5 | 0 | 0 | 0 | 133 | 20 | 11 | 6 | 2 | 0 | 10.03 | 0.040 |
| 恶心 | 4 | 120 | 24 | 0 | 0 | 0 | 16 | 64 | 80 | 12 | 0 | 0 | 31.16 | <0.001 |
| 呕吐 | 132 | 16 | 0 | 0 | 0 | 0 | 112 | 24 | 20 | 12 | 4 | 0 | 29.76 | <0.001 |
| 腹泻 | 140 | 8 | 0 | 0 | 0 | 0 | 132 | 12 | 16 | 8 | 4 | 0 | 21.65 | <0.001 |
| 皮肤/黏膜 | 88 | 48 | 12 | 0 | 0 | 0 | 64 | 36 | 32 | 24 | 16 | 0 | 35.40 | <0.001 |
| 疲惫 | 124 | 24 | 0 | 0 | 0 | 0 | 96 | 76 | 0 | 0 | 0 | 0 | 28.97 | <0.001 |
| 感觉异常 | 132 | 16 | 0 | 0 | 0 | 0 | 12 | 120 | 40 | 0 | 0 | 0 | 5.147 | 0.023 |
| 浅表静脉炎 | 132 | 16 | 0 | 0 | 0 | 0 | 16 | 104 | 52 | 0 | 0 | 0 | 7.60 | 0.006 |
A、B组两组发生吻合口瘘、肠梗阻、切口愈合不良的情况分别为5例(3.38%) vs 20例(11.63%), (χ2 = 7.517, P = 0.006); 4例(2.70%) vs 16例(9.30%), (χ2 = 5.913, P = 0.015); 7例(4.73%) vs 21例(12.21%), (χ2= 5.574, P = 0.018), 其差异均有统计学意义.
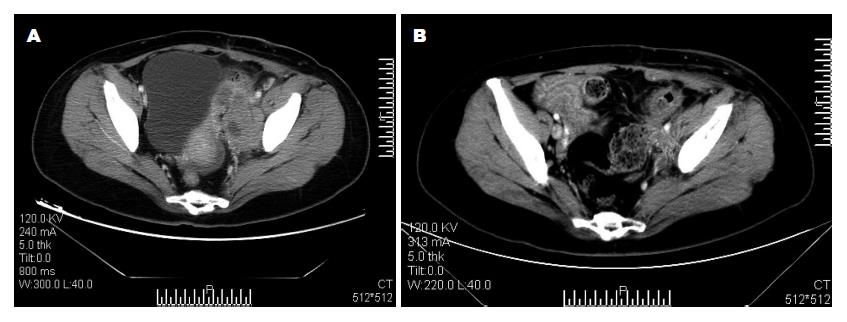
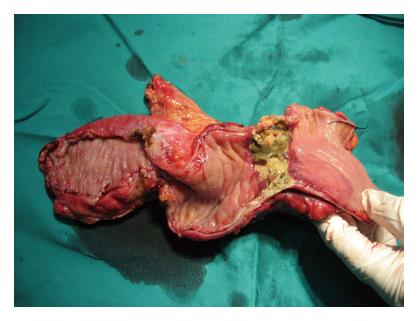
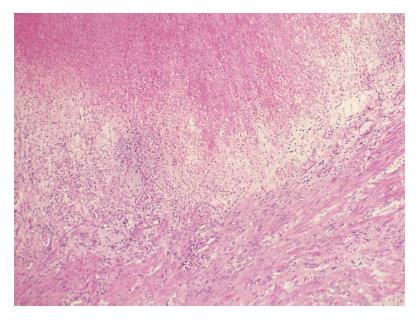
典型病例: 女, 36岁, 因"左下腹痛伴左下肢水肿20 d余"入院, 行CT检查提示: 左侧盆腔囊实性占位, 与左侧髂血管关系密切(图2A). 行电子肠镜示: 距肛门缘10-15 cm可见一环状狭窄, 黏膜表面糜烂、坏死, 内镜尚可通过. 取病理活检诊断: (直肠)中分化腺癌. 给予2个疗程全身静脉联合区域动脉灌注化疗栓塞后, 复查CT提示肿瘤较前明显缩小, 与左侧髂血管和左侧盆腔侧壁组织之间可见明显脂肪间隙(图2B), 行"直肠癌根治性切除术", 术后剖开标本见直肠肠腔局部环形缩窄, 黏膜坏死、瘢痕样改变, 而肿瘤滋养血管直肠支供血以外的直肠黏膜是正常的(图3). 术后病理镜下见坏死断裂达肠壁肌层, 肌层间可见大量炎性细胞浸润, 未见癌细胞(图4).
局部进展期直肠癌术前放化疗可降低肿瘤分期, 提高R0切除率、手术保肛率, 降低局部复发率[1], 已成为其综合治疗标准模式[2], 但未能提高其5年总生存率和无病生存率[3], 且增加了术后吻合口瘘、肠梗阻、切口愈合不良等并发症和不良反应发生率的危险性[2,4]. Swellengrebel等[5]报道: 放化疗导致直肠癌术后吻合口瘘发生率高达27.6%. Ceelen等[6]报道: 术前放化疗的3、4级不良反应发生率高达14.9%. 为降低这些不良反应的发生, Garcia-Aguilar等[7]通过减少放化疗的剂量, 实现了降低不良反应的目的, 但同时也降低了临床疗效.
术前区域动脉灌注化疗可提高局部进展期直肠癌的手术切除率、降低术后复发、转移的发生率, 提高患者远期疗效, 联合栓塞治疗可进一步提高疗效, 越来越受到重视和推广[8-11]. 鉴于此, 我们对局部进展期直肠癌术A组和B组对比性研究, 结果表明: 全身静脉联合区域动脉灌注化疗栓塞的疗效明显占优势. 两组所有手术病理标本组织病理学评估均有效, A组的疗效满意率高于B组(χ2 = 8.681, P<0.05); A组的不良反应(除外恶心反应)均低于B组(均P<0.05), 并表现出较少的3、4级反应, 恶心反应发生率高于B组(P<0.05), 但多为一过性的低级反应(1、2级), 给予止吐药物后可逐渐缓解, 患者均可耐受; A组术后吻合口瘘、肠梗阻及切口愈合不良的发生率均较B组明显降低(均P<0.05). 其优势在于: 我们采用了动静脉联合给药并化疗栓塞的治疗方法. 5-FU为细胞周期特异性药物, 对癌细胞的杀伤作用具有时间依赖性, 我们将其静脉滴注. OXA为细胞周期非特异性药物, 其药物浓度是影响对肿瘤细胞杀伤作用的主要原因, 我们通过动脉介入途径将化疗药物直接作用于肿瘤, 可使其于肿瘤边缘药物浓度是全身化疗的9-68倍[12], 同时由于药物的首过效应, 可显著提高药物对肿瘤细胞的杀灭作用. 这种动静脉联合、序贯用药的治疗方案, 可有效抑制肿瘤细胞的增殖、在多个环节上杀灭肿瘤细胞[13]. 术前肿瘤周围的各级血管未受到损伤, 区域动脉灌注化疗可使高浓度化疗药物直接接触肿瘤滋养动脉血管, 抑制血管内皮生长因子表达水平, 减少新生血管的形成, 降低微血管密度[14], 促使肿瘤滋养血管发生变性、坏死、纤维化增生; 同时, 对肿瘤滋养血管进行化疗栓塞, 有效阻断了肿瘤的血供, 提高了肿瘤部位药物浓度, 延长药物与肿瘤的接触时间, 造成肿瘤的缺血、坏死[15]. 区域动脉灌注化疗药物经肝脏代谢后进入体循环系统, 大大降低药物对全身的不良反应[16]. 超选择性区域动脉灌注化疗栓塞直接作用于肿瘤滋养血管直肠支, 引起直肠动脉供血区直肠黏膜出现糜烂、坏死、瘢痕样改变, 而肿瘤滋养血管直肠支供血以外的直肠黏膜是正常的, 有效提高了对靶病灶的治疗效果, 减少了对周围组织、器官的影响. 不但提高了肿瘤治疗效果, 而且降低了不良反应和术后吻合口瘘、肠梗阻及切口愈合不良等并发症发生率.
然而, 局部进展期直肠癌术前全身静脉联合区域动脉灌注化疗栓塞还存在一些其他不良反应和并发症发生的可能性: 在造影剂及化疗药物短时间注入动脉有引起恶心、呕吐、肝肾功能损害的可能, 动脉灌注化疗栓塞后肿瘤细胞坏死引起发热、疼痛等不适, 但这些症状较轻, 给予对症处理后可逐渐消失. 由于直肠上动脉与乙状结肠动脉最下一支之间一般无吻合[17], 需仔细分辨直肠肿瘤滋养血管进行超选择动脉灌注化疗栓塞, 以预防肠管缺血坏死. 股动脉穿刺拔管后需局部压迫、右下肢制动, 预防局部血肿的形成; 观察患者肢体浅表血管搏动, 有无肢体麻木、背痛等症状, 发现血栓形成和栓塞及时给予处理; 本研究中所有患者均未发生肠坏死和肢体血栓栓塞并发症.
术前全身静脉联合区域动脉灌注化疗栓塞对局部进展期直肠癌疗效确切, 可有效降低不良反应、术后并发症发生率. 另外, 有文献[11]报告: 区域动脉灌注化疗药物经门静脉直接进入肝脏, 可杀灭临床、亚临床的肝转移灶, 预防门脉系统引起的肝转移, 提高生存率; 但术前全身静脉联合区域动脉灌注化疗栓塞的远期疗效、总生存率、无病生存率是否更优于放化疗, 尚需进一步观察.
目前, 对局部进展期直肠癌的新辅助治疗可有效实现肿瘤降期, 提高R0切除率、手术保肛率, 降低局部复发率, 受到广泛重视和认可, 但缺乏统一的治疗方案, 不同方案的疗效也参差不齐.
高泽立, 副教授, 周浦医院消化科, 上海交大医学院九院周浦分院
术前放化疗已成为局部进展期直肠癌综合治疗标准模式, 但未能提高其5年总生存率和无病生存率, 且增加了治疗的不良反应和术后并发症发生率的危险性; 如何提高临床疗效, 降低治疗的不良反应和术后并发症成为肿瘤外科医生关注的焦点.
术前区域动脉灌注化疗可提高局部进展期直肠癌的手术切除率、降低术后复发、转移的发生率, 提高患者远期疗效, 联合栓塞治疗可进一步提高疗效, 越来越受到重视和推广.
本研究将细胞周期特异性药物(5-FU)和细胞周期非特异性药物(OXA), 分别经静脉、动脉联合、序贯用药, 在多个环节上杀灭肿瘤细胞; 同时对肿瘤滋养血管进行化疗栓塞, 有效阻断了肿瘤的血供, 提高了肿瘤部位药物浓度, 延长药物与肿瘤的接触时间, 显著提高临床疗效.
本研究对比观察局部进展期直肠癌术前全身静脉联合区域动脉灌注化疗栓塞和术前放疗+化疗的术后组织病理学疗效、不良反应发生率及术后并发症发生率, 结果表明: 全身静脉联合区域动脉灌注化疗栓塞的疗效明显占优势. 应用于临床安全、有效, 可作为一种新的新辅助治疗方案.
新辅助治疗: 又称为术前辅助治疗, 是恶性肿瘤患者在手术治疗前采用的一些治疗方法. 主要有新辅助化疗、新辅助放疗、新辅助放化疗等.
本文密切结合肿瘤治疗的热点, 选题得当, 实验设计合理, 文笔流畅, 统计分析正确, 参考文献较新, 值得广大临床医师及肿瘤科医师阅读.
编辑: 李军亮 电编: 闫晋利
| 1. | Vonk DT, Hazard LJ. Do all locally advanced rectal cancers require radiation? A review of literature in the modern era. J Gastrointest Oncol. 2010;1:45-54. [PubMed] [DOI] |
| 2. | Pucciarelli S, Del Bianco P, Efficace F, Serpentini S, Capirci C, De Paoli A, Amato A, Cuicchi D, Nitti D. Patient-reported outcomes after neoadjuvant chemoradiotherapy for rectal cancer: a multicenter prospective observational study. Ann Surg. 2011;253:71-77. [PubMed] [DOI] |
| 3. | Bonnetain F, Bosset JF, Gerard JP, Calais G, Conroy T, Mineur L, Bouché O, Maingon P, Chapet O, Radosevic-Jelic L. What is the clinical benefit of preoperative chemoradiotherapy with 5FU/leucovorin for T3-4 rectal cancer in a pooled analysis of EORTC 22921 and FFCD 9203 trials: surrogacy in question? Eur J Cancer. 2012;48:1781-1790. [PubMed] [DOI] |
| 4. | Kerr SF, Norton S, Glynne-Jones R. Delaying surgery after neoadjuvant chemoradiotherapy for rectal cancer may reduce postoperative morbidity without compromising prognosis. Br J Surg. 2008;95:1534-1540. [PubMed] [DOI] |
| 5. | Swellengrebel HA, Marijnen CA, Verwaal VJ, Vincent A, Heuff G, Gerhards MF, van Geloven AA, van Tets WF, Verheij M, Cats A. Toxicity and complications of preoperative chemoradiotherapy for locally advanced rectal cancer. Br J Surg. 2011;98:418-426. [PubMed] [DOI] |
| 6. | Ceelen W, Fierens K, Van Nieuwenhove Y, Pattyn P. Preoperative chemoradiation versus radiation alone for stage II and III resectable rectal cancer: a systematic review and meta-analysis. Int J Cancer. 2009;124:2966-2972. [PubMed] [DOI] |
| 7. | Garcia-Aguilar J, Shi Q, Thomas CR, Chan E, Cataldo P, Marcet J, Medich D, Pigazzi A, Oommen S, Posner MC. A phase II trial of neoadjuvant chemoradiation and local excision for T2N0 rectal cancer: preliminary results of the ACOSOG Z6041 trial. Ann Surg Oncol. 2012;19:384-391. [PubMed] [DOI] |
| 8. | 唐 云强, 谭 志明, 王 嘉康, 汤 日杰, 王 俊, 赵 宏宇, 麦 聪, 张 相良, 崔 书中. 术前区域动脉灌注化疗治疗进展期低位直肠癌的临床研究. 南方医科大学学报. 2008;28:1247-1248, 1253. |
| 9. | 夏 泽锋, 袁 野, 陶 凯雄, 韩 高雄, 帅 晓明, 蔡 开琳, 王 继亮, 杜 寒松, 邓 美洲, 王 国斌. 结直肠癌术前区域动脉灌注化疗疗效的组织学评价. 中华普通外科杂志. 2010;25:353-356. |
| 11. | Xu J, Zhong Y, Weixin N, Xinyu Q, Yanhan L, Li R, Jianhua W, Zhiping Y, Jiemin C. Preoperative hepatic and regional arterial chemotherapy in the prevention of liver metastasis after colorectal cancer surgery. Ann Surg. 2007;245:583-590. [PubMed] |
| 12. | Maurer CA, Borner MM, Läuffer J, Friess H, Z'graggen K, Triller J, Büchler MW. Celiac axis infusion chemotherapy in advanced nonresectable pancreatic cancer. Int J Pancreatol. 1998;23:181-186. [PubMed] |
| 14. | 王 荣江, 邵 四海, 石 麒麟, 赵 红星, 郑 银元, 李 辉, 陈 晓农. 化疗栓塞对膀胱肿瘤新生血管生成及血管内皮细胞生长因子表达的影响. 中华泌尿外科杂志. 2008;29:470-474. |
| 16. | 李 国立, 范 朝刚, 鲍 阳, 姜 军, 李 宁, 黎 介寿. 动静脉结合给药的FLEEOX方案对以淋巴结转移为主晚期胃癌的新辅助化疗. 中华外科杂志. 2009;47:1171-1174. |
| 17. | 张 启瑜. 钱礼腹部外科学. 第1版. 北京: 人民卫生出版社 2006; 435-435. |