修回日期: 2013-01-11
接受日期: 2013-01-18
在线出版日期: 2013-02-08
目的: 研究肥胖与正常大鼠胃肠组织NUCB2mRNA及NUCB2/nesfatin-1蛋白的表达.
方法: 30只健康♂Wistar大鼠随机均分为高脂高营养性肥胖组和正常对照组, 8 wk后取其胃、十二指肠、小肠、结肠组织, 分别采用实时荧光定量RT-PCR及免疫组织化学的方法检测NUCB2 mRNA及NUCB2/nesfatin-1蛋白的表达.
结果: (1)肥胖组大鼠胃、十二指肠、小肠NUCB2 mRNA表达量分别是对照组的2.02、1.49、1.23倍(t = 4.256, P = 0.000; t = 3.455, P = 0.002; t = 2.402, P = 0.026), 且NUCB2 mRNA表达量与大鼠Lee's指数均呈正相关(r = 0.677, P = 0.006; r = 0.561, P = 0.030; r = 0.538, P = 0.039); 两组大鼠结肠组织NUCB2 mRNA表达差异无统计学意义(t = 1.835, P = 0.077); (2)两组大鼠胃黏膜中下2/3、十二指肠布氏腺及潘氏细胞、小肠潘氏细胞中均检测到NUCB2/nesfatin-1蛋白的表达; 肥胖组大鼠胃NUCB2/nesfatin-1蛋白表达较对照组增多(Z = -2.955, P = 0.003), 表达量与大鼠Lee's指数呈正相关(r = 0.677, P = 0.008); 肥胖组大鼠十二指肠及小肠潘氏细胞中NUCB2/nesfatin-1蛋白表达较对照组减少(Z = -2.026, P = 0.043; Z = -2.648, P = 0.008), 表达量与大鼠Lee's指数均呈负相关(r = -0.557, P = 0.031; r = -0.617, P = 0.014).
结论: NUCB2/nesfatin-1在大鼠胃肠道中分布广泛, 肥胖大鼠胃组织NUCB2 mRNA及NUCB2/nesfatin-1蛋白表达上调、潘氏细胞NUCB2/nesfatin-1蛋白表达下调.
引文著录: 李伟娜, 田字彬, 魏良洲, 孙桂荣, 张翠萍, 葛银林, 徐珞. NUCB2/nesfatin-1在肥胖大鼠胃肠道组织中的表达. 世界华人消化杂志 2013; 21(4): 320-326
Revised: January 11, 2013
Accepted: January 18, 2013
Published online: February 8, 2013
AIM: To investigate the expression of the NUCB2 gene and NUCB2/nesfatin-1 protein in gastrointestinal tissues of obese and normal rats.
METHODS: Thirty male Wistar rats were randomly divided into two groups to be fed a high-fat diet or a normal diet. At the end of eight weeks, gastric, duodenal, small intestinal and colonic tissues were collected to detect the expression of NUCB2 mRNA and NUCB2/nesfatin-1 protein by real-time RT-PCR and immunohistochemistry, respectively.
RESULTS: The expression levels of NUCB2 mRNA in gastric, duodenal, and small intestinal tissues of obese rats were 2.02, 1.49 and 1.23 times higher than those in corresponding tissues of normal controls (t = 4.256, 3.455, 2.402; P = 0.000, 0.002, 0.026), showing a significant positive correlation with Lee's index (r = 0.677, 0.561, 0.538; P = 0.006, 0.030, 0.039); however, the expression level of NUCB2 mRNA in colonic tissue showed no significant difference between the two groups (t = 1.835, P = 0.077). NUCB2/nesfatin-1 protein was localized in the lower 2/3 of gastric mucosal glands, Brunner's glands and Paneth cells of the duodenum, and Paneth cells of the small intestine. The expression level of NUCB2/nesfatin-1 protein in gastric tissues was significantly increased in obese rats compared with normal controls (Z = -2.955, P = 0.003), and was positively correlated with Lee's index (r = 0.677, P = 0.008). The expression level of NUCB2/nesfatin-1 protein in Paneth cells of the duodenum and small intestine in obese rats significantly decreased compared with normal controls (Z = -2.026, -2.648; P = 0.043, 0.008), showing a significant negative correlation with Lee's index (r = -0.557, -0.617; P = 0.031, 0.014).
CONCLUSION: NUCB2/nesfatin-1 is widely expressed in gastrointestinal tissues of rats, and the expression of NUCB2 mRNA and NUCB2/nesfatin-1 protein is up-regulated in gastric tissues of obese rats, while NUCB2/nesfatin-1 protein is down-regulated in Paneth cells in obese rats.
- Citation: Li WN, Tian ZB, Wei LZ, Sun GR, Zhang CP, Ge YL, Xu L. Expression of nucleobindin-2/nesfatin-1 in gastrointestinal tissues of high-fat diet-induced obese rats. Shijie Huaren Xiaohua Zazhi 2013; 21(4): 320-326
- URL: https://www.wjgnet.com/1009-3079/full/v21/i4/320.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i4.320
肥胖是由于食欲及胃动力等的异常造成体质量过度增长并引起人体生理、病理改变的慢性代谢性疾病, 严重影响人类健康[1-4]. 引起食欲改变的摄食调节肽在肥胖调控过程中具有重要意义. nesfatin-1是Oh-Ⅰ等近年来新发现的来源于核组蛋白(nucleobindinⅡ, 简称NUCB2)的厌食肽[5], 在外周, 主要分布于胃、十二指肠、胰腺、小肠、结肠、食管、肝及脂肪组织等[6-8], 外源性给予nesfatin-1可明显降低食欲、减少摄食、减少皮下脂肪, 抑制胃动力及胃酸分泌[5,9-12]. 因此推测肥胖与正常大鼠胃肠道中NUCB2/nesfatin-1的表达可能存在差异. 本实验通过分子生物学及免疫组织化学的方法检测正常及肥胖大鼠胃肠组织中NUCB2 mRNA及NUCB2/nesfatin-1蛋白的表达分布特点, 探讨nesfatin-1对机体体质量及能量平衡的调节, 从而为肥胖的控制和能量失衡相关疾病的诊治提供理论基础.
逆转录试剂盒(DRR047A)、荧光染料试剂盒(DRR081A)及引物的设计合成(大连Takara公司); 兔抗大鼠nesfatin-1多克隆抗体(H-003-22, Phoenix Pharmaceuticals); 二步法免疫组织化学检测试剂(PV-6001, 北京中杉金桥生物技术有限公司); 实时荧光定量PCR仪(Rotor Gene 3000, 澳大利亚Corbett Research公司); 紫外线分光光度仪(NanoDrop 2000c, 美国Thermo公司); 凝胶成像分析系统(美国UVP公司); 多功能真彩色细胞图象分析系统(Image-Pro Plus, 美国Media Cybernetics公司); 显微镜(BX51T-PHD-J11型, 日本Olympus公司).
1.2.1 动物准备: 30只健康♂Wistar大鼠(青岛市药品检验所提供), 体质量110 g±10 g, 适应性饲养3 d后, 随机均分为正常对照组和高脂饮食诱导的肥胖组, 高脂配方为: 100 g基础饲料中加入全脂奶15 g、猪油5 g、鸡蛋黄50 g、黄豆15 g、鱼肝油10滴[13], 大鼠在造模期间自由摄食和饮水, 昼夜周期为12/12 h, 饲喂环境温度22 ℃±2 ℃, 相对湿度50%±5%. 每周定期观察大鼠进食量、饮水量, 测定体质量及身长, 8 wk末内眦取血检测甘油三酯, 高脂饮食组大鼠体质量高于对照组20%作为肥胖的标准[14]. 所有实验操作均遵循青岛大学动物饲养道德规范指导方针. 肥胖大鼠造模成功后, 经颈椎脱臼处死后快速取其相对固定部位的胃、十二指肠、小肠、结肠组织, 分为2部分: 装至盛有RNA样本保存液的EP管中, 并存入4 ℃冰箱以备总RNA的提取, 另一部分浸入10%甲醛固定24 h, 常规石蜡包埋、切片, 以备免疫组织化学实验.
1.2.2 实时荧光定量RT-PCR检测NUCB2 mRNA的表达: 按照TRIzol常规方法分别从100 mg胃、十二指肠、小肠、结肠组织中提取总RNA, 于紫外分光光度仪测定RNA浓度及纯度, 并于1%的凝胶进行电泳以鉴定RNA的完整性. 取1 μg总RNA按说明书进行逆转录获取cDNA, 并在Rotor Gene 3000上进行实时荧光定量PCR, 以β-actin为内参照. 引物序列如下: β-actin: 5'-GGAGATTACTGCCCTGGCTCCTA-3'(上游); 5'-GACTCATCGTACTCCTGCTTGCTG-3'(下游), 扩增片段长度为150 bp; NUCB2: 5'-CAGTTTGAACACCTGAACCACCA-3'(上游); 5'-TCATGCCGAGTCCGGTCATA-3'(下游), 扩增片段长度为113 bp. 反应条件: 95 ℃预变性30 s, 95 ℃变性5 s, 60 ℃退火30 s, 72 ℃延伸30 s, 共40个循环. 每个部位取3个样本重复上述步骤. 以2-△△Ct表示样本中NUCB2 mRNA的相对表达量.
1.2.3 免疫组织化学检测NUCB2/nesfatin-1蛋白的表达: 大鼠胃、十二指肠、小肠、结肠组织的石蜡切片经脱蜡、水化后, 置于0.01 mol/L枸橼酸盐缓冲液(pH 6.0)中加热进行抗原修复, 经3%过氧化氢孵育以消除内源性的过氧化物酶, 一抗为1:2000稀释的兔抗大鼠nesfatin-1多克隆抗体, 同时用磷酸盐缓冲液(PBS)代替一抗作阴性对照, 用已知的NUCB2/nesfatin-1阳性表达的下丘脑组织做阳性对照. 滴加山羊抗兔二抗, DAB显色后经苏木素复染, 脱水, 中性树脂封片, 于光学显微镜下观察结果. 在组织切片中, NUCB2/nesfatin-1阳性细胞表现为胞浆染为棕黄色. 结果判断标准: 在40×10的显微镜下, 每张切片随机选取5个互不重叠有代表性的视野, 结果由阳性细胞的百分比和染色强度两方面确定: (1)按Image-Pro Plus图象分析系统计数阳性细胞的百分比记分: 阳性细胞数<5%为0分, 6%-24%为1分, 25%-49%为2分, 50%-74%为3分, ≥75%为4分; (2)按染色强度记分: 未染色或染色不清为0分, 淡黄色为1分, 棕黄色为2分, 深棕色或褐色为3分. 每张切片记分等于以上两项记分的乘积: 0分为阴性(-), l-3分为弱阳性(+), 4-7分为阳性(++), 8-12分为强阳性(+++).
统计学处理 采用SPSS17.0统计学软件进行数据分析. 计量资料均经正态性及方差齐性检验, 采用两个独立样本均数的t检验; 计数资料采用等级秩和检验(Mann-Whitney法); NUCB2 mRNA及NUCB2/nesfatin-1蛋白与大鼠Lee's指数的相关性分别采用Pearson及Spearman相关分析; P<0.05为差异有统计学意义.
肥胖模型组大鼠在造模过程中摄食及饮水量较对照组明显增多, 体质量、身长、Lee's指数[(体质量)1/3×103/身长(cm)]及甘油三酯均高于对照组(t = 9.837, P = 0.000; t = 2.307, P = 0.029; t = 5.276, P = 0.000; t = 3.192, P = 0.003, 表1).
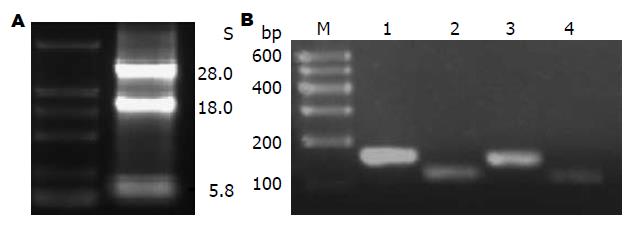
2.2.1 总RNA质量的检测: 各样本总RNA的浓度为200-2000 ng/μL, A260/280的比值为1.8-2.0, 提示RNA样本无蛋白质和DNA污染, 浓度及纯度较理想; 总RNA电泳条带出现核糖体RNA(rRNA)28S、18S及5.8S 3条亮度依次递减的条带, 且28S与18S两条带亮度之比为2:1, 说明提取的RNA较完整(图1A).
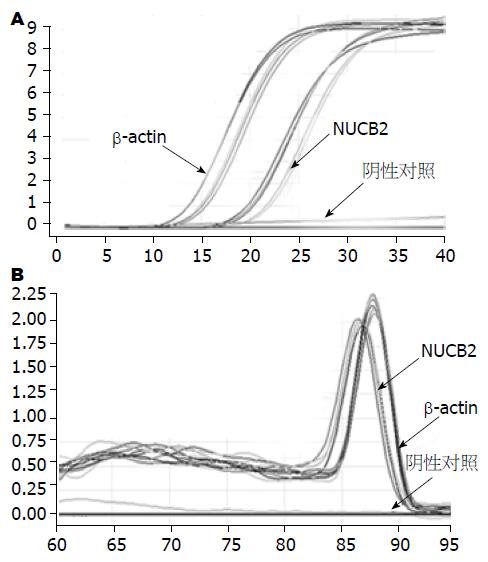
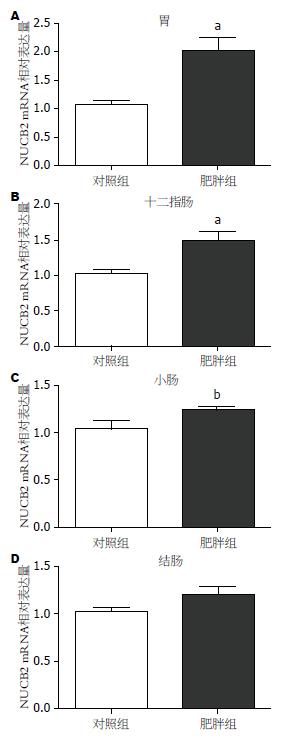
2.2.2 实时荧光定量PCR检测结果:NUCB2/β-actin基因表达阳性的标本, 荧光定量扩增呈现典型的S型曲线, 阴性对照标本则呈不规则波浪线(图2A); 每个扩增产物的融解曲线均为单峰, 提示无非特异性扩增及引物二聚体的形成(图2B). 将PCR产物于1.5%凝胶进行电泳, 提示扩增片段长度与设计一致, 各条带清晰无杂带(图1B). 肥胖组大鼠胃、十二指肠、小肠NUCB2 mRNA的表达量均高于对照组(t = 4.256, P = 0.000; t = 3.455, P = 0.002; t = 2.402, P = 0.026), 分别是对照组的2.02(0.88-3.69)倍、1.49(0.85-2.60)倍、1.23(0.95-1.60)倍; 两组大鼠结肠NUCB2 mRNA表达差异无统计学意义(t = 1.835, P = 0.077, 图3).
2.2.3 肥胖大鼠胃肠道NUCB2 mRNA表达量与Lee's指数的相关性分析: 以肥胖大鼠Lee's指数为因变量的Pearson相关分析显示, 胃、十二指肠及小肠组织NUCB2 mRNA相对表达量与大鼠Lee's指数均呈正相关(r = 0.677, P = 0.006; r = 0.561, P = 0.030; r = 0.538, P = 0.039).
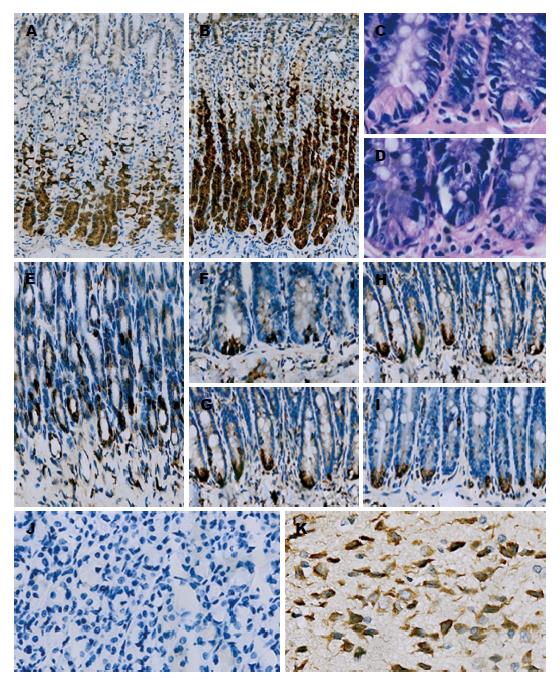
2.3.1 NUCB2/nesfatin-1蛋白在胃组织中的表达: NUCB2/nesfatin-1免疫阳性细胞分布于大鼠胃黏膜中下2/3, 且肥胖组胃NUCB2/nesfatin-1蛋白表达较对照组增多, 差异有统计学意义(Z = -2.955, P = 0.003, 图4A, B).
2.3.2 NUCB2/nesfatin-1蛋白在肠道组织中的表达: 在十二指肠, NUCB2/nesfatin-1免疫阳性细胞分布于黏膜下布氏腺(图4E), 两组大鼠布氏腺中NUCB2/nesfatin-1蛋白表达差异无统计学意义(Z = -0.727, P = 0.467); NUCB2/nesfatin-1蛋白表达于十二指肠及小肠腺窝部的潘氏细胞, 并经连续切片HE染色证实, 肥胖大鼠十二指肠及小肠潘氏细胞数量并未减少(t = 0.384, P = 0.704; t = 1.047, P = 0.304, 图4C, D), 而NUCB2/nesfatin-1蛋白表达量减少(Z = -2.026, P = 0.043; Z = -2.648, P = 0.008, 图4F-I).
2.3.3 肥胖大鼠胃肠道NUCB2/nesfatin-1蛋白表达量与Lee's指数的相关性分析: 以肥胖大鼠Lee's指数为因变量的Spearman等级相关分析显示, 胃组织NUCB2/nesfatin-1蛋白表达量与大鼠Lee's指数呈正相关(r = 0.677, P = 0.008); 十二指肠及小肠潘氏细胞中NUCB2/nesfatin-1蛋白表达量与大鼠Lee's指数均呈负相关(r = -0.557, P = 0.031; r = -0.617, P = 0.014).
nesfatin-1是新发现的摄食调节肽, 由其前体NUCB2在激素原转化酶(prohormone convertases, PC)作用下裂解而来. 在中枢, nesfatin-1广泛分布于与摄食调节相关的核团, 如室旁核(PVN)、视上核(SON)、弓状核(ARC)及孤束核(NTS)等[15,16]. 在外周, 胃组织中主要分布于黏膜泌酸腺内分泌细胞, 与Ghrelin共存于X/A样细胞, 与组氨酸脱羧酶(HDC)、生长抑素共存于胃黏膜腺基底部; 在十二指肠, NUCB2/nesfatin-1免疫活性细胞主要分布于布氏腺; 另外, 胰腺、小肠、结肠、食管、肝等部位也有NUCB2/nesfatin-1的表达[6,7]. NUCB2/nesfatin-1在消化系的表达特点提示其可能具有调节摄食、胃肠动力、胃酸分泌及营养物质的消化吸收等作用.
中枢及外周NUCB2/nesfatin-1的表达因代谢状态不同而异: 大鼠禁食24 h后, 室旁核(PVN)、视上核(SON)[17]以及胃黏膜[6]的NUCB2 mRNA的表达均下降, 再进食后表达上调. 另外, 通过等渗泵持续向大鼠脑室内灌注nesfatin-1, 可导致长期的摄食减少、体质量减轻, 表明NUCB2/nesfatin-1具有慢性、长期调节摄食的作用[5]. 大鼠脑室内注射nesfatin-1, 在引起摄食减少的同时能降低体质量, 减少皮下、附睾、肠系膜等部位的脂肪含量[5]. 神经性厌食症患者血浆中的nesfatin-1水平较低, 并与BMI呈正相关[18], 提示外周nesfatin-1表达水平受营养状态调节. Ramanjaneya等[8]也证实, 循环中NUCB2/nesfatin-1的水平与BMI呈正相关, 禁食24 h后脂肪细胞NUCB2/nesfatin-1表达减少, 高脂饮食小鼠的脂肪组织及循环中的NUCB2/nesfatin-1水平升高, 提示外周nesfatin-1可能参与体质量的调节. 小鼠脑室内注射nesfatin-1, 能降低胃窦部的胃动力指数, 延长十二指肠第三期收缩的启动时间[19], nesfatin-1还能抑制正常及肥胖大鼠在体及离体胃平滑肌的收缩, 提示其参与胃动力调节[11,20].
本实验证实肥胖大鼠胃组织NUCB2 mRNA及NUCB2/nesfatin-1蛋白表达均增加, 且与大鼠Lee's指数呈正相关, 推测nesfatin-1在胃组织的表达受不同营养状态的调控, 高脂饮食介导的肥胖大鼠营养过度, 由于机体负反馈机制的存在, 使内源性的厌食肽表达上调, 表现出抑制摄食的趋势, 但肥胖大鼠的食欲并无下降, 反而增加, 考虑可能与肥胖大鼠nesfatin-1受体表达下降或敏感性降低有关. 因此, 需进一步研究nesfatin-1的受体及其在中枢与外周的表达特点, 从而明确nesfatin-1的作用机制. 研究显示, 在高脂饮食介导的肥胖小鼠胃黏膜中NUCB2 mRNA及NUCB2/nesfatin-1蛋白的表达显著增加, 并受mTOR(哺乳动物雷帕霉素靶蛋白)信号通路调节[21]. 而血浆中的nesfatin-1可能来源于胃肠道的内分泌细胞, 高脂饮食的人及小鼠循环中的nesfatin-1升高, 且人血浆nesfatin-1水平与BMI呈正相关[5,8]. 这与肥胖大鼠胃组织中表达上调的趋势相一致, 从而进一步证实胃组织NUCB2/nesfatin-1作为血浆中的nesfatin-1来源的推测. 而NUCB2/nesfatin-1能以双向不饱和方式通过血脑屏障[22,23], 提示外周及中枢产生释放NUCB2/nesfatin-1可能同时具有降低食欲、抑制摄食从而达到调节体质量及能量平衡的作用.
肥胖大鼠十二指肠及小肠NUCB2 mRNA表达上调, 且与大鼠Lee's指数呈正相关, 而免疫组织化学方法并未检测到布氏腺中NUCB2/nesfatin-1蛋白表达上调, 提示nesfatin-1在基因转录水平的调控与胃组织类似, 经负反馈机制使其表达上调, 而在布氏腺中的蛋白翻译并无明显差异, 推测十二指肠中NUCB2/nesfatin-1蛋白可能参与营养物质吸收、肠黏膜保护等, 但并不直接参与体质量及能量平衡的调节.
潘氏细胞内含有防御素、溶菌酶、IgA等, 具有调节肠道菌群、保护肠黏膜等功能, 而防御素、溶菌酶等的表达与炎症性肠病的发生、发展密切相关; 潘氏细胞颗粒的积聚和释放受禁食及摄食的影响, 禁食后颗粒积聚, 再进食可使其颗粒释放[24-26]. 肥胖大鼠潘氏细胞中的防御素及溶菌酶在基因水平表达上调, 而受翻译拮抗剂的作用使二者在蛋白水平表达下调, 从而推测潘氏细胞分泌颗粒的异常导致肥胖相关疾病的发生[27]. 本实验首次在十二指肠及小肠潘氏细胞中检测到NUCB2/nesfatin-1蛋白的表达, 且在肥胖大鼠表达下调, 并与大鼠Lee's指数呈负相关, 提示潘氏细胞中的NUCB2/nesfatin-1可能参与摄食、能量调节等有关, 其详细机制有待进一步研究.
总之, 本实验提示肥胖大鼠外周NUCB2/nesfatin-1表达可能对摄食、能量代谢、胃肠动力等具有重要调节作用, 为进一步揭示肥胖相关的食欲异常、胃肠动力性疾病及炎症性肠病的发生机制提供了理论依据.
目前, 肥胖已成为严重影响人类健康的世界公共卫生问题, 各种引起食欲增强或降低的摄食调节肽在肥胖调控过程中具有重要意义. nesfatin-1是新发现的摄食调节肽,在中枢及外周分布广泛, 具有降低食欲、减少摄食等生理作用.
汤华, 研究员, 重庆医科大学感染性疾病分子生物学重点实验室
nesfatin-1在肥胖大鼠胃肠道表达分布的研究较少, 尤其是在小肠组织潘氏细胞中的表达, 其与正常大鼠胃肠道表达差异的原因及其外周的作用机制有待进一步研究.
Li等研究表明在高脂饮食介导的肥胖小鼠胃黏膜中NUCB2 mRNA及NUCB2/nesfatin-1蛋白的表达显著增加; Ramanjaneya等实验显示肥胖小鼠及人循环中的nesfatin-1水平升高.
本实验首次在十二指肠及小肠潘氏细胞中检测到NUCB2/nesfatin-1蛋白的表达, 且在肥胖大鼠体内表达下调, 提示潘氏细胞中的NUCB2/nesfatin-1可能参与摄食、能量调节等过程.
本文通过研究正常与肥胖大鼠胃肠道nesfatin-1在基因及蛋白水平的表达差异, 为肥胖相关的食欲异常、胃肠动力性疾病的临床诊治提供理论依据.
本文的先进性和科学性均好, 结果结论可靠.
编辑: 李军亮 电编: 闫晋利
| 1. | Djärv T, Wikman A, Nordenstedt H, Johar A, Lagergren J, Lagergren P. Physical activity, obesity and gastroesophageal reflux disease in the general population. World J Gastroenterol. 2012;18:3710-3714. [PubMed] [DOI] |
| 2. | Chin CC, Kuo YH, Yeh CY, Chen JS, Tang R, Changchien CR, Wang JY, Huang WS. Role of body mass index in colon cancer patients in Taiwan. World J Gastroenterol. 2012;18:4191-4198. [PubMed] [DOI] |
| 3. | Atabek ME. Non-alcoholic fatty liver disease and metabolic syndrome in obese children. World J Gastroenterol. 2011;17:4445-4446. [PubMed] [DOI] |
| 4. | Kim MC, Kim CS, Chung TH, Park HO, Yoo CI. Metabolic syndrome, lifestyle risk factors, and distal colon adenoma: a retrospective cohort study. World J Gastroenterol. 2011;17:4031-4037. [PubMed] [DOI] |
| 5. | Oh-I S, Shimizu H, Satoh T, Okada S, Adachi S, Inoue K, Eguchi H, Yamamoto M, Imaki T, Hashimoto K. Identification of nesfatin-1 as a satiety molecule in the hypothalamus. Nature. 2006;443:709-712. [PubMed] [DOI] |
| 6. | Stengel A, Goebel M, Yakubov I, Wang L, Witcher D, Coskun T, Taché Y, Sachs G, Lambrecht NW. Identification and characterization of nesfatin-1 immunoreactivity in endocrine cell types of the rat gastric oxyntic mucosa. Endocrinology. 2009;150:232-238. [PubMed] [DOI] |
| 7. | Zhang AQ, Li XL, Jiang CY, Lin L, Shi RH, Chen JD, Oomura Y. Expression of nesfatin-1/NUCB2 in rodent digestive system. World J Gastroenterol. 2010;16:1735-1741. [PubMed] [DOI] |
| 8. | Ramanjaneya M, Chen J, Brown JE, Tripathi G, Hallschmid M, Patel S, Kern W, Hillhouse EW, Lehnert H, Tan BK. Identification of nesfatin-1 in human and murine adipose tissue: a novel depot-specific adipokine with increased levels in obesity. Endocrinology. 2010;151:3169-3180. [PubMed] [DOI] |
| 9. | Shimizu H, Oh-I S, Hashimoto K, Nakata M, Yamamoto S, Yoshida N, Eguchi H, Kato I, Inoue K, Satoh T. Peripheral administration of nesfatin-1 reduces food intake in mice: the leptin-independent mechanism. Endocrinology. 2009;150:662-671. [PubMed] [DOI] |
| 10. | Atsuchi K, Asakawa A, Ushikai M, Ataka K, Tsai M, Koyama K, Sato Y, Kato I, Fujimiya M, Inui A. Centrally administered nesfatin-1 inhibits feeding behaviour and gastroduodenal motility in mice. Neuroreport. 2010;21:1008-1011. [PubMed] [DOI] |
| 12. | Xia ZF, Fritze DM, Li JY, Chai B, Zhang C, Zhang W, Mulholland MW. Nesfatin-1 inhibits gastric acid secretion via a central vagal mechanism in rats. Am J Physiol Gastrointest Liver Physiol. 2012;303:G570-G577. [PubMed] [DOI] |
| 14. | Chandler PC, Viana JB, Oswald KD, Wauford PK, Boggiano MM. Feeding response to melanocortin agonist predicts preference for and obesity from a high-fat diet. Physiol Behav. 2005;85:221-230. [PubMed] |
| 15. | Foo KS, Brismar H, Broberger C. Distribution and neuropeptide coexistence of nucleobindin-2 mRNA/nesfatin-like immunoreactivity in the rat CNS. Neuroscience. 2008;156:563-579. [PubMed] [DOI] |
| 16. | Goebel M, Stengel A, Wang L, Lambrecht NW, Taché Y. Nesfatin-1 immunoreactivity in rat brain and spinal cord autonomic nuclei. Neurosci Lett. 2009;452:241-246. [PubMed] [DOI] |
| 17. | Kohno D, Nakata M, Maejima Y, Shimizu H, Sedbazar U, Yoshida N, Dezaki K, Onaka T, Mori M, Yada T. Nesfatin-1 neurons in paraventricular and supraoptic nuclei of the rat hypothalamus coexpress oxytocin and vasopressin and are activated by refeeding. Endocrinology. 2008;149:1295-1301. [PubMed] [DOI] |
| 18. | Ogiso K, Asakawa A, Amitani H, Nakahara T, Ushikai M, Haruta I, Koyama K, Amitani M, Harada T, Yasuhara D. Plasma nesfatin-1 concentrations in restricting-type anorexia nervosa. Peptides. 2011;32:150-153. [PubMed] [DOI] |
| 19. | Tanaka R, Inui A, Asakawa A, Atsuchi K, Ataka K, Fujimiya M. New method of manometric measurement of gastroduodenal motility in conscious mice: effects of ghrelin and Y2 depletion. Am J Physiol Gastrointest Liver Physiol. 2009;297:G1028-G1034. [PubMed] |
| 20. | 李 娜, 田 字彬, 孙 桂荣, 魏 良洲, 徐 珞, 王 百惠, 孔 心涓, 丁 雪丽, 崔 铭娟. Nesfatin-1对肥胖大鼠胃排空及胃平滑肌条收缩性的影响. 世界华人消化杂志. 2012;20:631-637. [DOI] |
| 21. | Li Z, Xu G, Li Y, Zhao J, Mulholland MW, Zhang W. mTOR-dependent modulation of gastric nesfatin-1/NUCB2. Cell Physiol Biochem. 2012;29:493-500. [PubMed] [DOI] |
| 22. | Pan W, Hsuchou H, Kastin AJ. Nesfatin-1 crosses the blood-brain barrier without saturation. Peptides. 2007;28:2223-2228. [PubMed] [DOI] |
| 23. | Price TO, Samson WK, Niehoff ML, Banks WA. Permeability of the blood-brain barrier to a novel satiety molecule nesfatin-1. Peptides. 2007;28:2372-2381. [PubMed] [DOI] |
| 24. | Thomson AB, Chopra A, Clandinin MT, Freeman H. Recent advances in small bowel diseases: Part I. World J Gastroenterol. 2012;18:3336-3352. [PubMed] [DOI] |
| 25. | Bevins CL, Salzman NH. Paneth cells, antimicrobial peptides and maintenance of intestinal homeostasis. Nat Rev Microbiol. 2011;9:356-368. [PubMed] [DOI] |
| 26. | Grassia R, Bodini P, Dizioli P, Staiano T, Iiritano E, Bianchi G, Buffoli F. Neuroendocrine carcinomas arising in ulcerative colitis: coincidences or possible correlations? World J Gastroenterol. 2009;15:4193-4195. [PubMed] |