修回日期: 2013-10-29
接受日期: 2013-11-13
在线出版日期: 2013-12-28
目的: 探讨Mutl homolog1(MLH1)基因启动子甲基化对结肠癌(colorectal cancer, CRC)的影响.
方法: 以MLH1、Mutl homolog1、promoter methylation、Colon cancer、CRC为英文检索词, MLH1基因启动子甲基化、结直肠癌为中文检索词, 在Pubmed、Web of science、Embase、Cochrane Library、中国生物医学文献数据库、清华同方数据库、万方数据库及维普数据库收集截止至2013-08-01有关于研究MLH1基因启动子甲基化和结肠癌关系的文献, 应用Stata11.0软件对符合条件的研究结果进行统计分析.
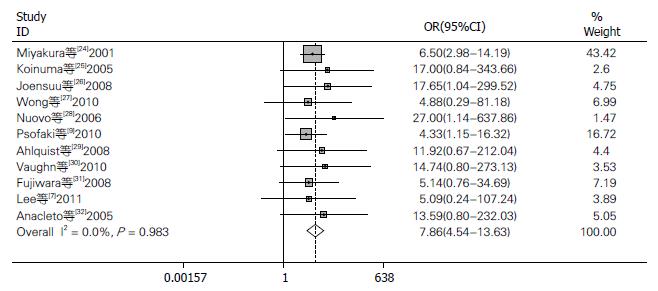
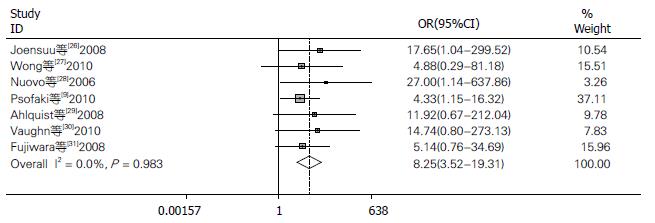
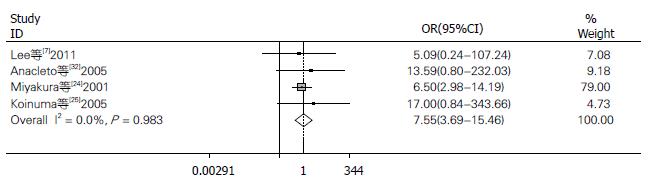
结果: 符合纳入标准的共11篇文献. 包含有结肠癌患者1496例, 对照382例. 数据合并结果显示: MLH1基因启动子甲基化在总病例组和总对照组的比值比(odds ratios, OR)为7.863, 95%的可信区间(95%CI): 4.537-13.627, P<0.05. 病例组和健康人组的OR = 8.246, 95%CI为3.522-19.307, P<0.05. 病例组和非癌组的OR为7.549, 95%CI: 3.685-15.464, P<0.05.
结论: MLH1基因甲基化和结肠癌的发生可能有密切关系, 在结肠癌的诊断中有一定的价值.
核心提示: 不论是总的对照组, 或是对照组中的癌旁组织、健康人组织, 结肠癌的Mutl homolog1(MLH1)基因启动子甲基化数目都大于对照组. 证实了MLH1基因启动子的甲基化和结肠癌的发生可能存在密切相关.
引文著录: 曾锦荣, 阮族明, 莫林芳, 陈晖. MLH1基因启动子甲基化和结肠癌关系的Meta分析. 世界华人消化杂志 2013; 21(36): 4204-4209
Revised: October 29, 2013
Accepted: November 13, 2013
Published online: December 28, 2013
AIM: To investigate the relationship between mutL homolog 1 (MLH1) promoter hy-permethylation and colorectal cancer (CRC).
METHODS: Relevant trials were identified by searching electronic databases including PubMed, Embase, Web of Science, Cochrane Library, CBM, CNKI, WANGFANG and VIP database updated to July 2013. The English search terms included MLH1, mutL homolog 1, promoter methylation, colon cancer and CRC, and the Chinese search terms included MLH1 gene promoter methylation and colorectal cancer. Stata11.0 software was used for statistical analysis.
RESULTS: A total of 11 articles involving 1496 CRC cases and 382 controls were analyzed in the study. Statistically significant odds ratios (OR) of MLH1 promoter methylation were obtained between total cases and controls (OR = 7.863, 95%CI: 4.537-13.627, P < 0.05), between tumor tissues of CRC patients and those of healthy persons (OR = 8.246, 95%CI: 3.522-19.307, P < 0.05), and between tumor tissues and non-tumorous tissues of CRC patients (OR = 7.549, 95%CI: 3.685-15.464, P < 0.05).
CONCLUSION: MLH1 promoter hypermethylation may contribute to the development of colon cancer and has appreciated value in the diagnosis of this malignancy.
- Citation: Zeng JR, Ruan ZM, Mo LF, Chen H. Relationship between MLH1 promoter methylation and colorectal cancer: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2013; 21(36): 4204-4209
- URL: https://www.wjgnet.com/1009-3079/full/v21/i36/4204.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i36.4204
结肠癌(colorectal cancer, CRC)在全世界具有高发病率, 尤其在西方发达国家, 其发病率位居肿瘤第2位. 世界范围内, 结肠癌的发病率居男性恶性肿瘤的第3位, 女性发病率仅次于乳腺癌, 居第2位[1]. 虽然我国结肠癌发病率远低于欧美等发达国家地区. 但近年来, 尤其是我国的大城市地区, 发病率明显上升, 且发病年轻化[2]. 结肠癌的发生发展是一个多步骤、多阶段及多基因参与的复杂过程. 结肠癌的病因至今还不是很明确, 但结肠癌的发生可认为三大原因: 第一是非典型增生; 第二是微卫星不稳定; 第三是基因的异常甲基化[3]. 第三种原因占了所有原因30%, 且被认为是后天逐渐发展形成的. 近年研究表明, Mutl homolog1(MLH1)基因是DNA错配修复基因的重要组成部分[4], MLH1基因启动子甲基化后, 导致DNA错配修复基因的失活, 使得错配的基因不能得到及时的修复, 导致基因突变, 进而导致结直肠肿瘤的发生[5,6]. 该机制被认为是结直肠癌的一种重要发病机制, 尤其见于遗传性非息肉型结肠癌. 但Lee研究认为, MLH1基因启动子的甲基化和结肠癌无明显关联[7]. Bai等[8]、Psofaki等[9]研究发现MLH1基因在腺瘤中仅低水平甲基化. 故本研究针对MLH1基因启动子甲基化和结肠癌的关系进行了Meta分析.
计算机检索Pubmed、Web of science、Embase、中国生物医学文献数据库、清华同方数据库、万方数据库及维普数据库, 英文检索词包括MLH1、Mutl homolog1、promoter methylation、Colon cancer、CRC, 中文检索词包括MLH1基因启动子甲基化、结直肠癌. 所有文章的搜索不设时间限制, 截止时间为2013-08-01. 为避免漏查, 对检索到文章中的参考文献进行补充检索.
1.2.1 文章的纳入标准: (1)必须是以人为研究对象、MLH1基因启动子甲基化和结直肠癌的关系为研究对象; (2)必须有病例组和对照组; (3)研究所用的标本为结直肠黏膜组织; (4)能获得全文且有综合的统计指标: 有效率的比值比(odds ratios, OR). 剔除标准: (1)病例组中没有MLH1基因启动子甲基化和非甲基化, 或对照组中没有MLH1基因启动子甲基化和非甲基化的文章; (2)数据不全; (3)无法获取全文者.
1.2.2 数据提取: 作者, 文章发表年限, 实验方法, 原始四格表数据.
统计学处理 采用Stata1111.0软件对资料进行统计分析. Meta分析之前, 先进行异质性检验分析, 若P>0.1, I2<50%, 表明异质性不明显, 则采用固定效应模型分析; 若P<0.1, I2>50%, 表明存在明显的异质性, 可采用随机效应模型估计合并效应量. 若异质性过于明显则需要对异质性的来源进行分析及敏感性分析. 计数资料的效应量表达采用Or值及95%CI, P<0.05表示有统计学意义. 若纳入的文献达11篇以上, 则绘制漏斗图, 用以发表偏倚分析.
最初检测到的结果129篇文献, 最终纳入标准的共11篇. 11篇入选的文献中, 有2篇文章有肿瘤组织和癌旁组织对照研究, 有7篇文章是肿瘤组织和健康人组织对照研究, 有2篇文章是肿瘤组织和非肿瘤组织对照研究. 其中病例组结肠癌患者1496例, 对照组共382例, 健康人组织134例, 非健康人组织248例(表1).
| 文献编号 | 作者 | 发表时间 | 国家 | CRC组/对照组 | 甲基化检测方法 | tp | fn | fp | tn |
| 1 | Miyakura等[24] | 2001 | 日本 | 肿瘤/癌旁组织 | PCR | 40 | 48 | 10 | 78 |
| 2 | Koinuma等[25] | 2005 | 日本 | 肿瘤/癌旁组织 | COBRA | 8 | 8 | 0 | 8 |
| 3 | Joensuu等[26] | 2008 | 芬兰 | 肿瘤/正常组织 | MSP | 19 | 89 | 0 | 40 |
| 4 | Wong等[27] | 2010 | 澳大利亚 | 肿瘤/正常组织 | PCR | 96 | 850 | 0 | 21 |
| 5 | Nuovo等[28] | 2006 | 美国 | 肿瘤/正常组织 | MSP | 4 | 3 | 0 | 10 |
| 6 | Psofaki等[9] | 2010 | 希腊 | 肿瘤/正常 | MSP | 13 | 7 | 6 | 14 |
| 7 | Ahlquist等[29] | 2008 | 挪威 | 肿瘤/正常 | MSP | 11 | 41 | 0 | 21 |
| 8 | Vaughn等[30] | 2010 | 美国 | 肿瘤/正常 | MethyLight | 11 | 19 | 0 | 12 |
| 9 | Fujiwara等[31] | 2008 | 日本 | 肿瘤/正常 | ABC | 4 | 7 | 2 | 18 |
| 10 | Lee等[7] | 2011 | 韩国 | 肿瘤/非肿瘤 | MSP | 2 | 110 | 0 | 112 |
| 11 | Anacleto等[32] | 2005 | 巴西 | 肿瘤/非肿瘤 | MSP | 19 | 87 | 0 | 30 |
2.2.1 MLH1基因在总病例组和总对照组中的甲基化: 11个研究病例组和对照组对MLH1基因启动子甲基化与结肠癌的关系进行比较, 共有结肠癌患者1496例, 对照382例. 其中有227例(15.17%)肿瘤组织和74例(4.71%)对照组发生甲基化. Meta分析显示: 异质性结果I2 = 0.0%, P>0.05, 不存在明显的异质性(图1), 采用固定效应模型分析: 得到合并的OR = 7.863, 95%CI: 4.537-13.627, P<0.05两组间差异有统计学意义.
2.2.2 MLH1基因在肿瘤组织和正常组织的甲基化: 7个研究实验组和对照组对MLH1甲基化与结肠癌的关系进行比较, 结肠癌组织1174例, 健康组织144 例. 其中有158例(13.46%)肿瘤组织和8例(5.56%)正常组织发生甲基化. Meta分析显示:异质性结果I2 = 0.00%, P>0.05(图2), 采用固定效应模型: 得到合并的OR = 8.246, 95%CI: 3.522-19.307, P<0.05两组间的差别有统计学意义.
2.2.3 MLH1基因在肿瘤组织和非健康人组织的甲基化: 4个研究实验组和对照组对MLH1甲基化与结肠癌的关系进行比较, 结肠癌肿瘤组织322例, 非健康人组织238例. 其中有69例(21.43%)肿瘤组织和10例(4.20%)癌旁组织发生甲基化. Meta分析显示: 异质性结果I2 = 0.0%, P>0.05, 不存在明显的异质性, 采用固定效应模型分析: 得到合并的OR = 7.549, 95%CI: 3.685-15.464, P<0.05两组间差异有统计学意义(图3).
对本研究的11篇文章数据采用Egger's test方法进行发表性检测, t = 2.16, P>0.05. 显示本研究发表性偏倚较小, 结论较可靠.
结肠癌是常见的恶性肿瘤之一, 随着近年来生活水平的提高, 饮食结构的改变, 其发病率逐年上升. 由于结肠癌的高发病率和高致死率, 因此对于结肠癌的发病机制的研究具有重要意义. DNA错配修复基因的失活被认为是结直肠癌的一种重要发病机制[10]. DNA错配修复系统由一系列特异性修复DNA碱基错配分子组成, 是人体修复DNA碱基错配的安全保障系统. DNA错配修复基因[主要是MLH1, MutS homolog 2(MSH2), MSH6, postmeiotic segregation increased 1(PMS1), PMS2]的突变或甲基化, 均会导致细胞DNA错配修复功能的缺陷, 产生遗传不稳定和肿瘤易感[11]. MLH1基因是由19个外显子组成, 定位于3p21.3, 是DNA错配修复的主要基因, 在多种组织中均有表达. MLH1基因启动区是一个CPG岛高密度分布区, 这里极易产生甲基化作用, 启动区CPG岛的甲基化后, 引起MLH1基因的沉默, 导致了错配修复(mismatch repair, MMR)的失活, 进而导致结直肠的肿瘤的发生[12-14]. 近年来国内外对MLH1基因启动子甲基化对结肠癌的影响的研究较多, 但各研究的结果并不一致. 国外Miyakura等[15]的研究中提示了MLH1基因启动子甲基化是结直肠癌重要发病机制. 国内吉敏等[16]研究也有同样观点. 但是Lee等[7]在韩国人中研究发现hMSH2和MGMT的CpG岛的甲基化和结直肠癌密切相关, 而不是MLH1基因. Bai等[8]、Psofaki等[9]研究发现MLH1基因在腺瘤中仅低水平甲基化. Kim等[17]研究发现MLH1在腺瘤、腺癌、转移性肿瘤中并无明显区别.
本研究按询证医学设计的要求, 筛选出的11篇文章, 并以此为依据利用了Meta分析软件进行分析. 为避免入选的文章存在异质性, 本研究对纳入的文章进行了发表性偏倚的估计, 结果显示本研究受发表性偏倚影响较小, 结论较可靠. 对MLH1基因甲基化和结肠癌的关系荟萃分析, 结果显示: 结肠癌病例组发生MLH1基因启动子甲基化的可能性是对照组的7.863倍, 95%CI: 4.537-13.627, 两组间差异有统计学意义(P<0.05); 结肠癌病例组发生MLH1基因启动子甲基化的可能性是正常组织的8.246倍, 95%CI: 3.522-19.307, 两组间差异有统计学意义(P<0.05); 结肠癌病例组发生MLH1基因启动子甲基化的可能性是非健康人组织的7.549倍, 95%CI: 3.685-15.464, 两组间的差别有统计学意义(P<0.05). 以上结果表明, 不论是总的对照组, 或是对照组中的癌旁组织、健康人组织, 结肠癌的MLH1基因启动子甲基化数目都大于对照组. 证实了MLH1基因启动子的甲基化和结肠癌的发生可能存在密切相关.
Meta分析本质上属于观察性研究, 所收集的文献及在对文献的统计分析过程中, 必然存在着偏倚, 偏倚对Meta分析结果的真实性和可靠性有很大影响. 关于MLH1基因启动子甲基化和结肠癌的文章较少, 本研究经过筛选后最终只有11篇文章入选, 但发表性偏倚检测P>0.05,提示发表性偏倚较小, 结论较可靠. 本研究纳入的文献均为英文文献, 未检测出国内和其余外语的国家对于MLH1基因启动子甲基化和结肠癌关系相类似的研究, 这是本研究的局限性. 且由于纳入的文献较少, 无法对MLH1基因启动子甲基化是否在腺瘤和腺癌中存在差别及是否和肿瘤的转移和分期有关进行研究. 另外, MLH1基因启动子甲基化受年龄、人种等因素影响[18,19], 及MLH1基因启动子甲基化可发生在多个基因位点, 陶卫平等[20]与Lipken等[21]研究认为MLH1基因415G/C多态性会增加结肠癌的易感性, Allan等[22]与Raptis等[23]研究认为MLH1基因93G/A多态性会增加结直肠癌的发病风险. 本文在文献检索时, 没有收集到更多关于MLH1基因启动子相关位点多态性对结直肠癌的影响的文献, 所以无法对MLH1启动子相关位点多态性对结直肠癌的影响进行进一步Meta的分析. 以后更多相关文献报道后, 可对年龄、人种等因素对MLH1基因启动子甲基化影响和不同位点多态性对结直肠癌的影响进行更深层次的研究.
总之, MLH1基因启动子甲基化和结肠癌的发生和发展有密切的关系, 对临床结肠癌的诊断和靶向治疗有临床指导意义. 随着甲基化技术的进步和检测水平的提高, Meta分析将对此做出更准确的评价, 以指导临床运用.
DNA错配修复基因的失活被认为是结直肠癌发生的一种重要发病机制, Mutl homolog1(MLH1)基因是DNA错配修复基因的主要基因, 其启动子的甲基化对于结直肠癌的发生和发展起重要作用. 但我国少有这方面的研究在证实这方面的关系.
白雪, 副主任医师, 中国人民解放军北京军区总医院普通外科
MLH1作为DNA错配修复基因的主要组成部分, 其基因的突变或甲基化, 均会导致细胞DNA错配修复功能的缺陷. 进而导致了结直肠癌的发生. 多项研究表明了, MLH1基因启动子甲基化对结直肠癌的发生、发展和转移都起重要作用.
美国国立综合癌症网络2013年发布的临床实践指南中指出, DNA错配修复基因(如MLH1, MSH2, MSH6)突变和修饰会导致错配修复(mismatch repair, MMR)蛋白缺失. Ⅱ期结肠癌患者中, MMR蛋白缺失是预后良好的标志. 专家组MMR蛋白检测应强烈建议在所有50岁以下的结肠癌患者中开展.
近年来国内外对MLH1基因启动子甲基化和结直肠癌的关系十分关注, 本研究采用Meta分析对近20年来已发表的有关MLH1基因启动子甲基化和结肠癌关系的研究文献进行综合分析, 对MLH1基因启动子甲基化在正常组织及非癌组织中表达差异进行评价. 并估计其危险值OR, 为结直肠癌的诊断提供依据.
MLH1基因启动子甲基化在正常组织及非癌组织中表达具有显著差异, 和结肠癌的发生和发展有密切的关系, 所以对MLH1基因启动子甲基化进行检测, 对临床结肠癌的诊断和靶向治疗有临床指导意义.
DNA错配修复(MMR)系统是人体修复DNA碱基错配的安全保障体系, 有一系列特异性错配修复基因组成(如MLH1, MSH2, MSH6), 错配修复基因发生甲基化或突变, 均会导致细胞的DNA错配修复功能缺陷, 产生遗传不稳定和肿瘤易感.
本文采取Meta分析的方法对MLH1基因启动子甲基化在结肠癌和非癌组织中表达的差异进行评价, 对临床结肠癌的诊断和靶向治疗有临床指导意义.
编辑: 郭鹏 电编:闫晋利
| 1. | Jemal A, Siegel R, Ward E, Murray T, Xu J, Smigal C, Thun MJ. Cancer statistics, 2006. CA Cancer J Clin. 2006;56:106-130. [PubMed] [DOI] |
| 2. | Fengju S, Guanglin W, Kexin C. Incidence of colon cancer in Tianjin, China, 1981-2000. Asia Pac J Public Health. 2005;17:22-25. [PubMed] [DOI] |
| 3. | Mirchev MB, Kahl P, Friedrichs N, Kotzev IA, Buettner R. DNA methylation in patients with colorectal cancer--correlation with some clinical and morphological features and with local tumour invasion. Folia Med (Plovdiv). 2010;52:22-30. [PubMed] [DOI] |
| 4. | Auclair J, Vaissière T, Desseigne F, Lasset C, Bonadona V, Giraud S, Saurin JC, Joly MO, Leroux D, Faivre L. Intensity-dependent constitutional MLH1 promoter methylation leads to early onset of colorectal cancer by affecting both alleles. Genes Chromosomes Cancer. 2011;50:178-185. [PubMed] [DOI] |
| 5. | Kuismanen SA, Holmberg MT, Salovaara R, Schweizer P, Aaltonen LA, de La Chapelle A, Nyström-Lahti M, Peltomäki P. Epigenetic phenotypes distinguish microsatellite-stable and -unstable colorectal cancers. Proc Natl Acad Sci U S A. 1999;96:12661-12666. [PubMed] [DOI] |
| 6. | Cunningham JM, Christensen ER, Tester DJ, Kim CY, Roche PC, Burgart LJ, Thibodeau SN. Hypermethylation of the hMLH1 promoter in colon cancer with microsatellite instability. Cancer Res. 1998;58:3455-3460. [PubMed] |
| 7. | Lee KH, Lee JS, Nam JH, Choi C, Lee MC, Park CS, Juhng SW, Lee JH. Promoter methylation status of hMLH1, hMSH2, and MGMT genes in colorectal cancer associated with adenoma-carcinoma sequence. Langenbecks Arch Surg. 2011;396:1017-1026. [PubMed] [DOI] |
| 8. | Bai AH, Tong JH, To KF, Chan MW, Man EP, Lo KW, Lee JF, Sung JJ, Leung WK. Promoter hypermethylation of tumor-related genes in the progression of colorectal neoplasia. Int J Cancer. 2004;112:846-853. [PubMed] [DOI] |
| 9. | Psofaki V, Kalogera C, Tzambouras N, Stephanou D, Tsianos E, Seferiadis K, Kolios G. Promoter methylation status of hMLH1, MGMT, and CDKN2A/p16 in colorectal adenomas. World J Gastroenterol. 2010;16:3553-3560. [PubMed] [DOI] |
| 10. | Liu J, Albarracin CT, Chang KH, Thompson-Lanza JA, Zheng W, Gershenson DM, Broaddus R, Luthra R. Microsatellite instability and expression of hMLH1 and hMSH2 proteins in ovarian endometrioid cancer. Mod Pathol. 2004;17:75-80. [PubMed] [DOI] |
| 12. | Kane MF, Loda M, Gaida GM, Lipman J, Mishra R, Goldman H, Jessup JM, Kolodner R. Methylation of the hMLH1 promoter correlates with lack of expression of hMLH1 in sporadic colon tumors and mismatch repair-defective human tumor cell lines. Cancer Res. 1997;57:808-811. [PubMed] |
| 14. | Herman JG, Umar A, Polyak K, Graff JR, Ahuja N, Issa JP, Markowitz S, Willson JK, Hamilton SR, Kinzler KW. Incidence and functional consequences of hMLH1 promoter hypermethylation in colorectal carcinoma. Proc Natl Acad Sci U S A. 1998;95:6870-6875. [PubMed] [DOI] |
| 15. | Miyakura Y, Sugano K, Akasu T, Yoshida T, Maekawa M, Saitoh S, Sasaki H, Nomizu T, Konishi F, Fujita S. Extensive but hemiallelic methylation of the hMLH1 promoter region in early-onset sporadic colon cancers with microsatellite instability. Clin Gastroenterol Hepatol. 2004;2:147-156. [PubMed] [DOI] |
| 16. | 吉 敏, 盛 剑秋, 付 蕾. 遗传性非息肉病性结直肠癌错配修复基因MLH1启动子甲基化研究. 胃肠病学和肝病学杂志. 2008;17:291-293. |
| 17. | Kim YH, Petko Z, Dzieciatkowski S, Lin L, Ghiassi M, Stain S, Chapman WC, Washington MK, Willis J, Markowitz SD. CpG island methylation of genes accumulates during the adenoma progression step of the multistep pathogenesis of colorectal cancer. Genes Chromosomes Cancer. 2006;45:781-789. [PubMed] [DOI] |
| 18. | Schafmayer C, Buch S, Egberts JH, Franke A, Brosch M, El Sharawy A, Conring M, Koschnick M, Schwiedernoch S, Katalinic A. Genetic investigation of DNA-repair pathway genes PMS2, MLH1, MSH2, MSH6, MUTYH, OGG1 and MTH1 in sporadic colon cancer. Int J Cancer. 2007;121:555-558. [PubMed] [DOI] |
| 19. | Nakagawa H, Nuovo GJ, Zervos EE, Martin EW, Salovaara R, Aaltonen LA, de la Chapelle A. Age-related hypermethylation of the 5' region of MLH1 in normal colonic mucosa is associated with microsatellite-unstable colorectal cancer development. Cancer Res. 2001;61:6991-6995. [PubMed] |
| 21. | Lipkin SM, Rozek LS, Rennert G, Yang W, Chen PC, Hacia J, Hunt N, Shin B, Fodor S, Kokoris M. The MLH1 D132H variant is associated with susceptibility to sporadic colorectal cancer. Nat Genet. 2004;36:694-699. [PubMed] [DOI] |
| 22. | Allan JM, Shorto J, Adlard J, Bury J, Coggins R, George R, Katory M, Quirke P, Richman S, Scott D. MLH1 -93G& gt; A promoter polymorphism and risk of mismatch repair deficient colorectal cancer. Int J Cancer. 2008;123:2456-2459. [PubMed] [DOI] |
| 23. | Raptis S, Mrkonjic M, Green RC, Pethe VV, Monga N, Chan YM, Daftary D, Dicks E, Younghusband BH, Parfrey PS. MLH1 -93G& gt; A promoter polymorphism and the risk of microsatellite-unstable colorectal cancer. J Natl Cancer Inst. 2007;99:463-474. [PubMed] [DOI] |
| 24. | Miyakura Y, Sugano K, Konishi F, Ichikawa A, Maekawa M, Shitoh K, Igarashi S, Kotake K, Koyama Y, Nagai H. Extensive methylation of hMLH1 promoter region predominates in proximal colon cancer with microsatellite instability. Gastroenterology. 2001;121:1300-1309. [PubMed] |
| 25. | Koinuma K, Kaneda R, Toyota M, Yamashita Y, Takada S, Choi YL, Wada T, Okada M, Konishi F, Nagai H. Screening for genomic fragments that are methylated specifically in colorectal carcinoma with a methylated MLH1 promoter. Carcinogenesis. 2005;26:2078-2085. [PubMed] [DOI] |
| 26. | Joensuu EI, Abdel-Rahman WM, Ollikainen M, Ruosaari S, Knuutila S, Peltomäki P. Epigenetic signatures of familial cancer are characteristic of tumor type and family category. Cancer Res. 2008;68:4597-4605. [PubMed] [DOI] |
| 27. | Wong JJ, Hawkins NJ, Ward RL, Hitchins MP. Methylation of the 3p22 region encompassing MLH1 is representative of the CpG island methylator phenotype in colorectal cancer. Mod Pathol. 2011;24:396-411. [PubMed] [DOI] |
| 28. | Nuovo GJ, Nakagawa H, Sotamaa K, Chapelle Ade L. Hypermethylation of the MLH1 promoter with concomitant absence of transcript and protein occurs in small patches of crypt cells in unaffected mucosa from sporadic colorectal carcinoma. Diagn Mol Pathol. 2006;15:17-23. [PubMed] |
| 29. | Ahlquist T, Lind GE, Costa VL, Meling GI, Vatn M, Hoff GS, Rognum TO, Skotheim RI, Thiis-Evensen E, Lothe RA. Gene methylation profiles of normal mucosa, and benign and malignant colorectal tumors identify early onset markers. Mol Cancer. 2008;7:94. [PubMed] [DOI] |
| 30. | Vaughn CP, Wilson AR, Samowitz WS. Quantitative evaluation of CpG island methylation in hyperplastic polyps. Mod Pathol. 2010;23:151-156. [PubMed] [DOI] |
| 31. | Fujiwara I, Yashiro M, Kubo N, Maeda K, Hirakawa K. Ulcerative colitis-associated colorectal cancer is frequently associated with the microsatellite instability pathway. Dis Colon Rectum. 2008;51:1387-1394. [PubMed] [DOI] |