修回日期: 2013-12-09
接受日期: 2013-12-11
在线出版日期: 2013-12-28
目的: 观察益生菌制剂对高脂饮食诱导的非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)大鼠的防治作用.
方法: 以高脂饲料喂养制备大鼠肥胖并发脂肪肝模型. 8 wk后将造模成功大鼠分为治疗组和脂肪肝对照组. 治疗组给予双歧杆菌三联活菌肠溶胶囊5g/(kg·d)灌胃; 脂肪肝对照组给予相同体积的生理盐水灌胃. 于16 wk末处死大鼠, 称量肝脏及脂肪质量, 计算肝指数, 肝脏组织制作石蜡切片行HE染色, 观察病理变化; 检测各组大鼠血清中血脂、肝功能、脂肪因子等指标.
结果: 模型组大鼠与对照组相比, 血脂、肝功能水平及肝指数增高, 血清中白介素6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、胰岛幕抵抗指数(homeostasis model assessment of insulin resistance, HOMA-IR)水平显著升高, 光镜下肝脏出现明显脂肪变性及炎细胞浸润; 益生菌干预后的大鼠, 与模型组大鼠比较, 肝指数、肝功能、血脂降低, 光镜下的肝脏脂肪变性及炎细胞浸润明显改善, 血清中脂联素水平明显上升, IL-6、TNF-α、HOMA-IR水平显著下降.
结论: 益生菌制剂可显著减轻NAFLD大鼠肝脏脂肪变性, 改善肝功能, 对NAFLD有显著治疗效果.
核心提示: 本研究应用高脂饮食诱导造成肥胖伴非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)大鼠模型, 通过不良反应少, 耐受性好的益生菌制剂-金双歧进行干预治疗, 证实了益生菌制剂可显著减轻NAFLD大鼠肝脏脂肪变性, 改善肝功能, 对NAFLD有显著治疗效果.
引文著录: 王丽, 李显辉. 益生菌对大鼠非酒精性脂肪肝的治疗作用及机制. 世界华人消化杂志 2013; 21(36): 4127-4132
Revised: December 9, 2013
Accepted: December 11, 2013
Published online: December 28, 2013
AIM: To assess the effect of probiotics treatment on rat non-alcoholic fatty liver disease (NALFD).
METHODS: SD rats were fed a high-fat diet to induce NAFLD. After 8 weeks, the model rats were randomly divided into a saline-treated group and a therapy group [bifidobacterium triple viable enteric-coated pills 5 g/(kg•d)]. At the end of 16 weeks, all rats were killed. Weight of the body and the liver, the indexes of serum lipid, liver enzyme and adenosine were measured. Pathological changes such as inflammatory cell infiltration and steatosis in the liver were observed.
RESULTS: Compared to the normal control group, serum levels of glutamic-oxalacetic transaminase (AST), glutamic-pyruvic transaminase (ALT), total cholesterol (TC), triglyceride (TG), liver mass index, interleukin-6 (IL-6), tumor necrosis factor-α (TNF-α), and homeostasis model assessment of insulin resistance (HOMA-IR) in the NAFLD model group markedly increased, and obvious steatosis and inflammatory cell infiltration were noted. After treatment with probiotics, TG, AST, ALT, liver mass index, steatosis and inflammatory cell infiltration were improved significantly, and the level of adiponectin was increased.
CONCLUSION: Probiotics can remarkably alleviate dyslipidemia and liver steatosis in a rat model of NAFLD.
- Citation: Wang L, Li XH. Effect of probiotics treatment on rat non-alcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2013; 21(36): 4127-4132
- URL: https://www.wjgnet.com/1009-3079/full/v21/i36/4127.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i36.4127
非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)是指除外酒精和其他明确的损肝因素, 以弥漫性肝细胞大泡性脂肪变为主要特征的临床病理综合征, 根据病变是否伴有炎症和纤维化分为单纯性脂肪肝、NAFLD及相关性肝硬化[1]. 目前认为NAFLD是代谢综合征的肝脏表现, 其发病机制尚未完全阐明, 近期研究发现其发生过程与肠道菌群的变化密切相关, 肠道菌群紊乱和肠壁通透性增加等通过免疫反应介导, 在NAFLD的发生、发展中有重要作用[2]. 有研究表明以乳酸菌、双歧杆菌为代表的益生菌与胆固醇代谢、胃肠道感染、细菌移位等有直接关系[3]. 目前益生菌制剂在NAFLD的应用上并不多见, 且对NAFLD的治疗效果及机制并不清楚.
本实验中我们应用高脂饮食喂养造成大鼠NAFLD模型, 应用益生菌制剂-金双歧进行干预治疗, 观察益生菌对肝功能、肝脏内脂肪沉积及炎症因子的影响, 为NAFLD的防治提供新的思路.
5周龄健康清洁级♂SD大鼠50只, 体质量150 g±10 g, 由天津医科大学实验动物中心提供, 清洁级实验动物编号: TJ23320130489. 双歧杆菌乳杆菌三联活菌片(商品名: 金双歧)为内蒙古双奇药业股份有限公司产品; 胰岛素放射免疫试剂盒购自上海森雄科技实业有限公司; 大鼠肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、脂联素、白介素6(interleukin-6, IL-6)放射免疫试剂盒(ELISA法)为武汉博士德生物科技有限公司提供. 基础饲料配方: 标准粉35%、麸皮15.5%、大豆粉20%、玉米粉20%、豆油0.5%、鱼粉5%、骨粉2.5%、酵母粉1%; 高脂饲料配方: 基础饲料60%、熟猪油15%、鸡蛋黄粉10%、脱脂奶粉8%、干酪素5%、白砂糖2%. 日本产日立U22000型双光束分光光度计, 7170型全自动生化分析仪, 旋涡混匀器, 低温高速离心机, OLYMPUS IX71型倒置显微镜.
1.2.1 实验动物分组及模型制备: 50只SD大鼠适应性喂养1 wk后, 随机取12只作为正常对照组, 喂以基础饲料; 其余38只用于建立肥胖并发脂肪肝模型, 喂以高脂饲料. 饲养环境控制温度22 ℃±2 ℃, 湿度40%-70%, 明暗周期为12 h, 自由摄食饮水. 8 wk末以造模大鼠体质量大于正常对照组平均体质量30%确定为肥胖大鼠, 未达到此标准的大鼠舍弃.
1.2.2 药物干预: 对照组与模型组各取2只处死行肝脏HE染色, 确定造模成功. 将造模成功的24只大鼠分为2组, 每组12只, 继续喂以高脂饲料. 对照组继续喂以基础饲料. 治疗组给予双歧杆菌乳杆菌三联活菌溶液(4片加入20 mL蒸馏水混合均匀)5 g/(kg•d)灌胃, 每日1次; 模型组给予相同体积的生理盐水灌胃. 药物干预8 wk, 第16周末, 处死大鼠, 取血待测.
1.2.3 标本的采集及处理: 给药8 wk末大鼠禁食水12 h后, 断头处死大鼠, 迅速打开腹腔, 经腹主动脉取血, 以12000 r/min分离血清, -80 ℃低温贮存备用, 用于检测血清中脂肪因子、血脂、肝功能; 取出肝脏, 称质量; 取固定部位小块肝组织,置于40 g/L中性甲醛液中固定, 常规石蜡包埋、切片后, 行HE染色, 用于病理观察; 其余肝脏即刻入液氮中冷冻, 并移至-80 ℃冰箱冻存备用.
1.2.4 指标检测: 肝指数: 分别称量肝脏湿质量与体质量, 计算肝/体比值, 即为肝指数; 总胆固醇(serum total cholesterol, TC)、甘油三酯(triglyceride, TG)、丙氨酸转氨酶(glutamic-pyruvic transaminase, ALT)、门冬氨酸转氨酶(glutamic-oxalacetic transaminase, AST)、空腹血糖(fasting blood-glucose, FBG)均由全自动生化分析仪测定. 空腹胰岛素(fasting insulin, FNS): 放免法测定, 计算胰岛素抵抗指数(HOMA-IR) = FPG×FNS/22.5, 血清中TNF-α、脂联素、IL-6采用ELISA法测定; 肝组织病理: 常规石蜡包埋、切片, 行苏木精-伊红(HE)染色. 光镜下对每张切片观察5个×400视野, 对肝脂肪变性程度和炎性细胞浸润程度进行分级. 由有经验的病理系教师盲法阅片做出诊断.
统计学处理 数据采用mean±SD描述. 应用SPSS16.0统计学软件进行分析, 两组间比较用t检验, 组间比较采用单因素方差分析, P<0.05为差异有统计学意义.
模型组大鼠血清中TC、TG、ALT、AST及肝指数与正常对照组相比均显著增高(P<0.01); 与模型组相比, 治疗组大鼠的TG、转氨酶及肝指数明显降低(P<0.05); 但与正常对照组比较仍然有所升高(P<0.05); 而治疗组TC水平较模型组无明显下降(P>0.05, 表1).
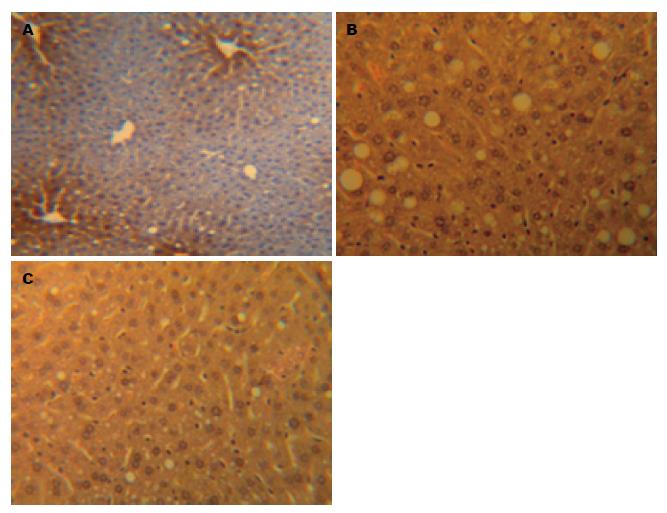
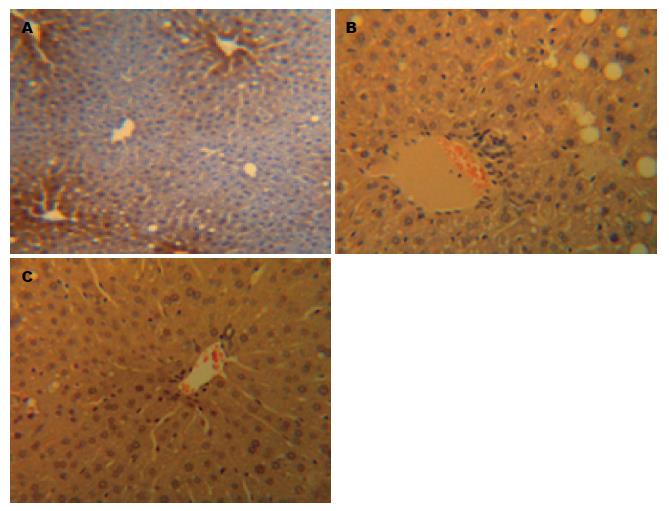
光镜下观察, 正常对照组大鼠肝小叶结构完整、清晰, 肝细胞围绕中央静脉呈放射状分布, 无脂质浸润, 汇管区及肝小叶内无炎细胞浸润(图1A). NAFLD模型组肝脏病理切片可见肝细胞排列紊乱、稀疏, 边界欠清晰, 肝小叶内呈现以大泡性为主的混合性脂肪变性. 同时可见局灶性汇管区炎细胞浸润, 炎细胞以淋巴细胞为主(图1B, 图2B), 与正常对照组相比有显著差异(P<0.01). 与对照组相比, 治疗组仍存在脂肪变性, 肝细胞排列较稀疏; 但脂滴较小, 且范围局限, 汇管区浸润的炎细胞数量明显下降, 与模型组相比有显著差异(P<0.01, 图1C, 图2C).
16 wk末, 相对于正常对照组大鼠, 模型组大鼠血清中IL-6、TNF-α及HOMA-IR显著升高, 而脂联素水平却明显降低(P<0.01). 原本为NAFLD大鼠, 经过8 wk的益生菌治疗, 血清中HOMA-IR及IL-6、TNF-α水平明显下降(P<0.05), 脂联素水平有所上升, 但仍未回到血清中正常水平(P>0.05, 表2).
近年来, 随着生活水平的提高, 我国NAFLD的发病率逐年增加. 对于NAFLD发病的具体机制尚无定论, 既往研究中被广泛接受的是"二次打击"学说, 其核心理论为胰岛素抵抗及脂肪的氧化应激[4]. 但该理论尚存争议. 基于解剖及功能上的相关性. "肠-肝轴"概念的提出, 指出肝脏与肠道存在多方面的相互作用, 共同为对方的免疫完整性提供条件[5]. 肠道屏障功能在NAFLD的发病机制的作用逐渐成为学者研究的重要方面. 肠道黏膜屏障是指肠道能防止肠腔内的有害物质如细菌和毒素等穿过肠黏膜进入体内其他组织器官和血液循环的结构和功能的总和[6]. 肠道屏障从功能上分类, 包括机械屏障、化学屏障、免疫屏障、生物屏障. 具体来说, 机械屏障即肠道正常解剖结构, 包括黏液层、肠道上皮细胞及上皮间紧密连接; 化学屏障主要包括胃酸、各种消化酶、胆汁等; 免疫屏障主要由淋巴细胞及肠道黏膜分泌的免疫球蛋白A组成; 生物屏障由正常菌群的平衡构成, 是能量吸收, 储存的重要环境因素[7]. 肠道屏障功能损伤主要表现为肠道菌群失调、小肠细菌过多生长、肠道黏膜通透性增高等. 肠道生物屏障保持着动态平衡. Spencer等[8]的人体实验显示, 在极短时间内予饮食结构改变, 不同个体的肠道菌群构成即存在变化. 目前在肠道屏障功能损伤已取得较多新进展. 研究证实[9], 在NAFLD的发病过程中存在小肠细菌过度生长现象. 正常情况下, 肠道黏膜可有少量细菌及内毒素移位; 而在肝功能受损, 小肠内细菌, 尤其是革兰阴性需氧菌出现过度生长, 导致肠道黏膜生物屏障功能障碍, 内毒素在经过肝脏时未被完全清除, 过量的内毒素随血液进入到体循环, 形成肠源性内毒素血症. 内毒素进入体循环后可通过对肝细胞的直接作用而损伤肝脏, 并进一步激活枯否细胞产生TNF-α、IL-6等炎症因子, 通过细胞因子的相互激活, 产生"瀑布效应", 增加肠道黏膜通透性, 进一步加重肠道菌群紊乱, 形成恶性循环. 当肠道内菌群平衡被打破时, 人体能量代谢也相应发生改变[10]. 正常人体肠道菌群发酵人的消化器官未消化的食物, 增加能量代谢效率, 从而给宿主提供更多能量[11]. 而肠道菌群平衡被打破时, 条件致病菌增多, 而相应正常菌群减少, 使得能量代谢发生障碍. 当然, NAFLD同时也反过来促进肠道的菌群失调. 在NAFLD的发展过程中, 伴随着多种炎症介质的产生. IL-1、干扰素可抑制摄食中枢, 使食欲下降, 反射性使胃肠运动减弱; 前列素2、血小板激活因子能引起肠道运动功能异常, 胃肠功能紊乱, 移型性运动复合减弱或者消失, 其最重要的后果是使小肠部内容物淤滞, 从而导致菌群失调[12].
本实验中, 我们应用高脂饮食诱导成功造成肥胖伴NAFLD大鼠模型, 照比应用药物损伤造模, 更接近于人类脂肪肝的成因. 本研究结果显示模型组大鼠与正常对照组大鼠相比出现了肥胖、血脂增高, 肝功能损害. 光镜下可见肝脏病理切片肝细胞排列紊乱, 广泛脂肪空泡及局灶性汇管区淋巴细胞浸润. NAFLD的发病机制错综复杂, 除了肠道菌群紊乱, 还有胰岛素抵抗及多种炎症因子都参与了其发生、发展过程. 多种致病因素在NAFLD中的作用及相互关系仍不清楚.
NAFLD的治疗目前尚无理想的药物, 近年来研究发现[13]益生菌制剂对NAFLD的治疗有一定疗效. 其治疗原理正是利用肠道-肝脏的相互影响, 促进正常微生物的生长繁殖以抑制治病菌的生长, 减少细菌内毒素、炎症因子等有害物质的产生, 快速构建胃肠道微生态平衡, 维持肠道生物黏膜屏障的稳固. 基于此, 越来越多的医师倾向于将益生菌等调整肠道屏障的药物用于防治NAFLD的临床实践, 但由于临床大规模实验研究较少, 且存在伦理学问题, 结果尚存争议[14,15].
本研究所应用的益生菌制剂是长型双歧杆菌、保加利亚乳杆菌和嗜热链球菌的活菌制剂. 三者组成了一个在不同条件下都能生长、作用快而持久的联合菌群.
本研究证实了益生菌制剂能够改善NADLD大鼠肝功能及血脂异常, 并能够显著改善肝细胞的脂肪变性, 其机制可能与其调节肠道菌群从而减少炎症因子, 改善胰岛素抵抗有关. 肠道菌群失调在NAFLD发病机制中的作用不容忽视, 而益生菌制剂有不良反应少, 耐受性好等众多优点, 但就脂肪肝的防治方面, 其远期疗效及与胰岛素抵抗的因果关系还有待更深入的研究.
在全球范围内, 非酒精性脂肪肝(nonalcoholic fatty liver disease, NAFLD)的高发病率及对人类的危害已成为全球医学关注和研究的热点, 但目前尚无良好治疗措施. 肠道菌群失调在NAFLD的发病机制中的作用逐渐成为关注的热点, 国内外不少学者都在进行"肠道屏障功能"的研究, 目前在此方面已取得较多新进展.
迟宝荣, 教授, 吉林大学第一医院消化内科; 郭永红, 副主任医师, 西安交通大学医学院第二附属医院感染科
越来越多的医师倾向于将益生菌制剂等调整肠道菌群平衡的药物用于防治NAFLD的临床实践, 但由于伦理条件所限, 目前此类研究尚少, 且缺少组织学变化结果支持.
Marshall等出了"肠-肝轴"的概念, 肝-肠为解剖上的"远亲", 功能上的"近邻", 屏障功能受损的肠道被认为是多脏衰的"发动者", 在NAFLD的发展过程中"肝-肠对话"扮演了重要角色. 肠道菌群在人体免疫、营养代谢等多方面起到重要作用.
本文从肠道生物屏障入手, 介绍导致肠道菌群在NAFLD机制中的作用, 又应用益生菌制剂, 进行肠道菌群的调节以观察肝脏的组织学改变, 具有较好的创新性和科研学术价值.
本实验从肠肝相互作用失调角度探讨益生菌对于由高脂饮食诱导的NAFLD的形成的预防作用, 为进一步研究NAFLD发病机制及药物治疗开辟了新的思路.
本文选题较新颖, 从体外实验探讨益生菌对大鼠NAFLD的防治作用及机制, 值得临床医生阅读.
编辑: 郭鹏 电编:闫晋利
| 1. | Fassio E, Alvarez E, Domínguez N, Landeira G, Longo C. Natural history of nonalcoholic steatohepatitis: a longitudinal study of repeat liver biopsies. Hepatology. 2004;40:820-826. [PubMed] |
| 2. | Shanab AA, Scully P, Crosbie O, Buckley M, O'Mahony L, Shanahan F, Gazareen S, Murphy E, Quigley EM. Small intestinal bacterial overgrowth in nonalcoholic steatohepatitis: association with toll-like receptor 4 expression and plasma levels of interleukin 8. Dig Dis Sci. 2011;56:1524-1534. [PubMed] [DOI] |
| 3. | Festi D, Colecchia A, Sacco T, Bondi M, Roda E, Marchesini G. Hepatic steatosis in obese patients: clinical aspects and prognostic significance. Obes Rev. 2004;5:27-42. [PubMed] [DOI] |
| 4. | Anstee QM, Goldin RD. Mouse models in non-alcoholic fatty liver disease and steatohepatitis research. Int J Exp Pathol. 2006;87:1-16. [PubMed] [DOI] |
| 5. | Compare D, Coccoli P, Rocco A, Nardone OM, De Maria S, Cartenì M, Nardone G. Gut--liver axis: the impact of gut microbiota on non alcoholic fatty liver disease. Nutr Metab Cardiovasc Dis. 2012;22:471-476. [PubMed] |
| 8. | Spencer MD, Hamp TJ, Reid RW, Fischer LM, Zeisel SH, Fodor AA. Association between composition of the human gastrointestinal microbiome and development of fatty liver with choline deficiency. Gastroenterology. 2011;140:976-986. [PubMed] [DOI] |
| 9. | Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. An obesity-associated gut microbiome with increased capacity for energy harvest. Nature. 2006;444:1027-1031. [PubMed] [DOI] |
| 10. | Panchal SK, Poudyal H, Waanders J, Brown L. Coffee extract attenuates changes in cardiovascular and hepatic structure and function without decreasing obesity in high-carbohydrate, high-fat diet-fed male rats. J Nutr. 2012;142:690-697. [PubMed] [DOI] |
| 11. | Cao JJ, Gregoire BR, Gao H. High-fat diet decreases cancellous bone mass but has no effect on cortical bone mass in the tibia in mice. Bone. 2009;44:1097-1104. [PubMed] [DOI] |
| 12. | Gadaleta RM, van Mil SW, Oldenburg B, Siersema PD, Klomp LW, van Erpecum KJ. Bile acids and their nuclear receptor FXR: Relevance for hepatobiliary and gastrointestinal disease. Biochim Biophys Acta. 2010;1801:683-692. [PubMed] |
| 13. | Yokota A, Fukiya S, Islam KB, Ooka T, Ogura Y, Hayashi T, Hagio M, Ishizuka S. Is bile acid a determinant of the gut microbiota on a high-fat diet? Gut Microbes. 2012;3:455-459. [PubMed] [DOI] |
| 14. | Loguercio C, De Simone T, Federico A, Terracciano F, Tuccillo C, Di Chicco M, Cartenì M. Gut-liver axis: a new point of attack to treat chronic liver damage? Am J Gastroenterol. 2002;97:2144-2146. [PubMed] [DOI] |
| 15. | Loguercio C, Federico A, Tuccillo C, Terracciano F, D'Auria MV, De Simone C, Del Vecchio Blanco C. Beneficial effects of a probiotic VSL#3 on parameters of liver dysfunction in chronic liver diseases. J Clin Gastroenterol. 2005;39:540-543. [PubMed] [DOI] |