修回日期: 2013-11-06
接受日期: 2013-11-25
在线出版日期: 2013-12-28
目的: 本研究拟明确miR-126对胃癌细胞血管内皮生长因子A(vascular endothelial growth factor-A, VEGFA)及其下游磷脂酰肌醇3激酶/蛋白激酶B(phosphatidylinositol-3 kinase/protein kinase B, PI3K/Akt)和丝裂原活化蛋白激酶/细胞外调节蛋白激酶(mitogen-activated protein kinases/extracellular regulated protein kinases, MAPK/Erk)两条信号通路上核心蛋白Akt、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycinprotein, mTOR)和细胞外调节蛋白激酶(extracellular regulated protein kinases, Erk1/2)表达的调控作用, 从而来初步探讨miR-126影响胃癌细胞恶性表型的可能机制.
方法: 选取人胃腺癌细胞SGC-7901作为实验细胞, 分空白组(mock)、miR-126慢病毒实验组(Lenti-miR-126)、慢病毒对照组(Lenti-control)、miR-126寡核苷酸抑制组(locked nucleic acid anti miR-126 oligonucleotides group, LNA-miR-126)与寡核苷酸对照组(LNA-control)共5组. 利用miR-126慢病毒和miR-126 LNA power inhibitor探针转染SGC-7901细胞系, 转染后72 h观察绿色荧光蛋白(green fluorescent protein, GFP)的表达情况, 感染效率>70%, 提取细胞总小RNA和总蛋白, 利用实时定量PCR检测miR-126的表达情况, 同时通过Western blot检测VEGFA及下游信号通路上核心蛋白Erk、Akt、mTOR的表达.
结果: Western blot显示miR-126慢病毒实验组的VEGFA及其下游靶蛋白Akt、mTOR、Erk1/2表达较空白组明显降低(1.00±0.00 vs 1.60±0.19, 1.00±0.00 vs 1.89±0.23, 1.00±0.00 vs 2.11±0.38, 1.00±0.00 vs 1.52±0.36, 均P<0.01), miR-126寡核苷酸抑制组的VEGFA及其下游靶蛋白Akt、mTOR、Erk1/2表达较空白组明显升高(2.46±0.31 vs 1.60±0.19, 3.09±0.44 vs 1.89±0.23, 3.83±0.64 vs 2.11±0.38, 2.26±0.30 vs 1.52±0.36, 均P<0.01).
结论: miR-126可调控胃癌细胞VEGFA及其下游靶蛋白的表达, 胃癌中可能存在miR-126/VEGFA信号通路调控胃癌的血管新生.
核心提示: 本文探讨了miR-126对胃癌细胞血管内皮生长因子A(vascular endothelial growth factor-A, VEGFA)及其下游靶蛋白的调控作用, 同时结合大量的前人研究及本课题组前期的研究, 初步推测胃癌中可能存在miR-126/VEGFA信号通路调控胃癌的血管新生.
引文著录: 雷宇鹏, 陈红霞, 周晓东. miR-126调控胃癌细胞VEGFA及其下游靶蛋白Akt、mTOR、Erk1/2的表达. 世界华人消化杂志 2013; 21(36): 4116-4120
Revised: November 6, 2013
Accepted: November 25, 2013
Published online: December 28, 2013
AIM: To determine the regulatory effect of miR-126 on expression of vascular endothelial growth factor A (VEGFA)and its downstream proteins including protein kinase B (Akt), mammalian target of rapamycin protein (mTOR) and extracellular regulated protein kinases (Erk1/2) in gastric cancer cells.
METHODS: Recombinant lentivirus LV-miR-126 and miRCURY LNA™ miR-126 inhibitor were used to up-regulate or down-regulate the miR-126 expression in SGC-7901 cells. The cells were divided into a mock group, a lenti-miR-126 group, a lenti-control group, a locked nucleic acid (LNA)-antimiR-126 oligonucleotides group and a LNA-control group. Real-time PCR was used to confirm the relative expression of miR-126, and Western blot was used to detect the expression levels of Akt, mTOR, Erk and VEGFA proteins in different groups.
RESULTS: Western blot analysis demonstrated that the expression of VEGFA and its downstream proteins Akt, mTOR and Erk1/2 was significantly decreased in the lenti-miR-126 group than in the mock group (1.00 ± 0.00 vs 1.60 ± 0.19, 1.00 ± 0.00 vs 1.89 ± 0.23, 1.00 ± 0.00 vs 2.11 ± 0.38, 1.00 ± 0.00 vs 1.52 ± 0.36, all P < 0.01). In contrast, the expression of VEGFA and its downstream proteins Akt, Erk1/2 and mTOR was significantly increased in the LNA-miR-126 group than in the mock group (2.46 ± 0.31 vs 1.60 ± 0.19, 3.09 ± 0.44 vs 1.89 ± 0.23, 3.83 ± 0.64 vs 2.11 ± 0.38, 2.26 ± 0.30 vs 1.52 ± 0.36, all P < 0.01).
CONCLUSION: Our results indicate that miR-126 could regulate the expression of VEGFA and its downstream proteins Akt, Erk1/2 and mTOR. These findings suggest that there may be a miR-126/VEGFA signaling pathway regulating angiogenesis in gastric cancer.
- Citation: Lei YP, Chen HX, Zhou XD. MiR-126 regulates the expression of vascular endothelial growth factor A and its downstream target proteins Akt, mTOR and Erk1/2 in gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2013; 21(36): 4116-4120
- URL: https://www.wjgnet.com/1009-3079/full/v21/i36/4116.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i36.4116
胃癌的发病率和死亡率居我国恶性肿瘤之首, 占胃恶性肿瘤的95%. 目前研究发现, 肿瘤血管的新生在胃癌的发生和发展中可能有重要的地位, 但尚未找到有效靶点. 大量的研究包括我们前期的研究发现, 胃癌(gastric cancer, GC)过高表达血管内皮生长因子(vascular endothelial growth factor, VEGF)和血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR), 其过表达与胃癌的血管新生及恶性表型密切相关[1-5]. 丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、磷脂酰肌醇3激酶(phosphatidylinositol-3 kinase, PI3K)是VEGF/VEGFR信号通路重要的下游靶蛋白, 经VEGF介导的MAPK/ERK和PI3K/蛋白激酶B(protein kinase B, Akt)两条信号通路在调节肿瘤细胞和内皮细胞的存活、稳定、增殖、迁移乃至血管新生中发挥着重要作用[6,7]. Feng等[8]研究发现, 与正常组织相比较, miR-126在胃癌组织中有着明显的低表达. 在SGC-7901胃癌细胞中miR-126的异位表达能够通过诱导细胞进入G0/G1期来抑制细胞的生长, 说明了在胃癌中miR-126扮演着抑制肿瘤的角色. miR-126在生理性血管生长中具有强大的调控功能, 他能否抑制肿瘤的血管新生仍不清楚. 故此, 我们提出: GC细胞下调表达miR-126与高表达VEGF/VEGFR可能存在某种负调控关联? 刘博等[9]通过生物信息学研究发现, miR-126和VEGF的3'端非编码区域(untranslated region, 3'UTR)存在互补序列, 并通过报告基因方法初步证明了miR-126可通过与VEGFA 3'UTR的互补而抑制VEGFA的翻译, 因此VEGFA可能是miR-126负调控的靶基因. 因此, 本课题将通过体外实验来诱导胃癌细胞miR-126过表达和miR-126低表达来观察VEGFA的变化及下游PI3K/Akt和MAPK/Erk两条信号通路上核心蛋白的表达变化, 以明确miR-126对GC细胞VEGFA的靶向调控作用及其对VEGFA下游关键信号通路的影响, 从而初步探讨胃癌细胞中miR-126的表达与胃癌血管新生的关系.
中分化的人胃腺癌细胞系SGC-7901为南昌大学第一附属医院消化研究所保存; 鼠抗人Akt、兔抗人mTOR和鼠抗人Erk1/2多克隆抗体购自Cell Signaling公司; 鼠抗人VEGFA多克隆抗体购自Abcam公司; has-miR-126慢病毒产品购自上海吉凯基因化学技术有限公司; miRCURY LNA Power inhibitor探针购自EXIQON公司; Lipofectamine 2000购自Invitrogen公司; Small RNA提取试剂盒、cDNA逆录试剂盒及Real-time PCR反应试剂盒购自宝生物工程(大连)有限公司.
1.2.1 miR-126慢病毒转染SGC-7901细胞(miR-126慢病毒组): 细胞40%融合时, 将miR-126慢病毒感染SGC-7901细胞, 同时取空病毒载体实验作为阴性对照, 非感染细胞为空白对照. 感染12 h后观察细胞状态, 待48 h更换为正常培养基, 感染72 h观察绿色荧光蛋白GFP的表达情况, 一般感染效率>70%即可进入后续实验.
1.2.2 miRCURY LNA Power inhibitor探针转染SGC-7901细胞(miR-126探针组): 细胞40%融合时, 将miR-126 LNA Power inhibitor探针转染SGC-7901细胞, 按Exiqon miRCURYTM LNA Power inhibitor转染试剂盒操作说明, Lipofectamine 2000作为转染媒介, 取无关ir-antagomir转染作为对照, 非转染细胞为空白对照, 感染12 h后更换新鲜培养基, 感染72 h观察绿色荧光蛋白GFP的表达情况, 一般感染效率>70%即可进入后续实验.
1.2.3 实时定量PCR检测miR-126表达: 采用实时定量PCR对5组细胞的miR-126进行检测, 操作按Small RNA提取试剂盒、cDNA逆录试剂盒及Real-time PCR反应试剂盒说明书进行.
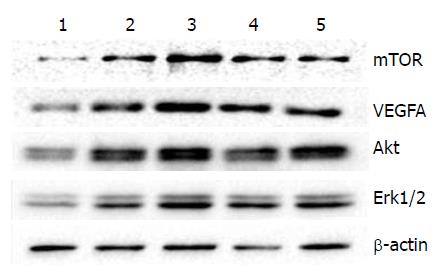
1.2.4 Western blot蛋白印迹检测VEGFA及下游信号通路上核心蛋白Akt、mTOR、Erk的表达: 用冰PBS清洗细胞2次, 以去除死细胞和培养基, 用滤纸尽量吸干残余的PBS. 加入含蛋白酶抑制剂与磷酸酶抑制剂的蛋白提取液400 μL, 反复在冰上摇匀, 使提取液与细胞充分接触30 min. 离心12000 r/min, 30 min, 回收并分装上清液, 分别提取5组细胞总蛋白. 以β-actin的水平作为等量蛋白质上样对照, 每个样本至少重复3遍, 取50 μg蛋白质样品进行SDS-PAGE电泳, 并转至硝酸纤维膜上, 室温封闭2 h后, 用TBST缓冲液漂洗3次, 分别加入相应的一抗4 ℃孵育过夜, TBST漂洗3次后加入辣根过氧化物酶标记的羊抗兔或羊抗鼠二抗(1:2000), 室温摇床孵育2 h, 增强化学发光显色系统显色, 使用分子成像仪成像, 条带灰度值分析(图1).
1.2.5 图像分析: 采用美国Image Lab图像分析系统对Western blot印迹结果进行图像分析, 以miR-126慢病毒实验组设为参考条带, 计算各条带的相对灰度值.
统计学处理 实验数据由SPSS17.0统计软件处理, 计量资料用mean±SD表示. 应用Student's t检验、方差分析(ANOVA)对实验结果进行统计分析. P<0.05为差异有统计学意义.
实时定量PCR检测5组细胞miR-126的表达水平显示, miR-126慢病毒实验组的miR-126的表达是空白组的9.57倍(9.567±1.243 vs 1.000±0.000, P<0.01), 慢病毒对照组miR-126的表达与空白组无明显差异(P>0.05); miR-126探针组miR-126的表达明显低于空白组(0.037±0.012 vs 1.000±0.000, P<0.01), 寡核苷酸对照组miR-126的表达与空白组无明显差异(P>0.05)(表1).
SGC-7901细胞中, miR-126慢病毒实验组的VEGFA表达明显低于空白组(1.00±0.00 vs 1.60±0.19, P<0.01), miR-126探针组的VEGFA表达明显高于空白组(2.46±0.31 vs 1.60±0.19, P<0.01)(表2).
SGC-7901细胞中, miR-126慢病毒实验组的Akt、mTOR、Erk1/2表达明显低于空白组(1.00±0.00 vs 1.89±0.23, 1.00±0.00 vs 2.11±0.38, 1.00±0.00 vs 1.52±0.36, P<0.01), miR-126探针组的Akt、mTOR、Erk1/2表达明显高于空白组(3.09±0.44 vs 1.89±0.23, 3.83±0.64 vs 2.11±0.38, 2.26±0.30 vs 1.52±0.36, P<0.01)(表2).
miRNAs是一类长度在22 nt左右的内源性、非编码RNA基因产物, 通过与mRNA的3'端非翻译区(3'UTR)互补结合而抑制翻译, 或通过与mRNA翻译区结合而直接引起mRNA的剪切, 从而负调控靶基因[10]. 前期本课题组综合运用miRNAs靶基因预测软件TargetScan和miRanda等对miR-126进行了分析和刘博等[9]通过生物学信息研究均发现miR-126和VEGF的3'UTR存在多个互补位点, 这预示着miR-126可通过与VEGFA 3'UTR的互补而抑制VEGFA的翻译, 因此VEGFA可能是miR-126负调控的靶基因. 在本研究中, 抑制胃癌细胞miR-126的表达, VEGFA及相应的下游靶蛋白明显的升高; 相反, 诱导胃癌细胞miR-126的表达, VEGFA及其相应的下游靶蛋白明显的降低. 因此, 我们推测, 在胃癌细胞中miR-126表达下调, 对VEGFA表达的抑制作用减弱, VEGFA表达量增加, 其下游信号通路PI3K/Akt及MAPK/Erk上的核心靶蛋白表达量也随之增加; 相反, miR-126表达上调, 对VEGFA表达的抑制作用增强, VEGFA表达量减少, 其下游信号通路PI3K/Akt及MAPK/Erk上的核心靶蛋白表达量也随之减少.
既往的研究已证实VEGF是目前发现促进肿瘤血管新生作用最强大的因子, VEGFA是VEGF家族中调控血管生成最重要的一员. VEGF/VEGFR胞内信号途径主要有两条[11]: MAPK/Erk与PI3K/Akt. Claesson-Welsh等[12]综述了VEGFA和肿瘤血管的关系, 其发现VEGFA主要是通过MAPK/ERK、MAPK/P38、PI3K/AKT及FAK等来调控肿瘤血管新生. 甚至包括我们前期对GC的研究证实, GC中存在VEGF/PI3K/Akt信号通路调控GC细胞的凋亡、增殖、化疗耐药及血管新生[13-15]. 因此, 我们推测VEGFA可能通过PI3K/Akt和/或MAPK/Erk信号通路参与胃癌血管新生的调控.
Nicoli等[16]在对经典的斑马鱼生理性血管生长模型中的实验发现, miR-126在血管生长中扮演着"分子开关"的角色. Li等[17]和Feng等[8]的研究成果显示, miR-126在胃癌中呈下调表达. Chen等[18]在1194例亚洲胃癌患者与1618例正常对照组做了一项荟萃分析, 结果发现, 与对照组相比, VEGF在患有胃癌的亚洲患者体内表达显著增高. 加之我们前期研究发现, GC过高表达VEGF和VEGFR[1-3]. 结合本研究的研究结果, 我们推测胃癌中可能存在miR-126/VEGFA信号通路调控胃癌的血管新生.
胃癌的发病率和死亡率居我国恶性肿瘤之首. 目前研究发现, 肿瘤血管的新生在胃癌的发生和发展中可能有重要的地位, 但尚未找到有效靶点.
黄颖秋, 教授, 本溪钢铁(集团)总医院消化内科
目前已有大量的研究证实血管内皮生长因子(vascular endothelial growth factor, VEGF)在胃癌的发生和发展中的重要作用, 但是其具体的作用机制及潜在靶点尚不明确, 尚需进一步研究.
目前已有许多研究显示VEGF主要通过介导MAPK/Erk和/或PI3K/Akt两条信号通路调控肿瘤血管生长, 同时也有研究报道miR-126参与血管新生, 具体机制仍不清楚.
本文第一次证实了胃癌细胞中miR-126对VEGFA的调控作用, 其作用机制有待进一步研究.
VEGF在胃癌血管新生发挥至关重要的作用, 肿瘤的血管新生在肿瘤的发生发展中扮演着重要角色, 本文阐述了miR-126与VEGFA的关系, 为如何调控胃癌恶性表型提供了新的研究方向.
miRCURY LNA™ miRNA: 是一种寡核苷酸RNA抑制剂, 可以抑制靶细胞相应RNA的表达.
本文初步探讨了miR-126对胃癌细胞VEGFA及其下游靶蛋白的调控作用, 对该领域的进一步研究提供了实验依据, 有一定学术价值.
编辑:郭鹏 电编:闫晋利
| 2. | Liu J, Yu HG, Yu JP, Wang XL, Zhou XD, Luo HS. Overexpression of cyclooxygenase-2 in gastric cancer correlates with the high abundance of vascular endothelial growth factor-C and lymphatic metastasis. Med Oncol. 2005;22:389-397. [PubMed] [DOI] |
| 3. | Zhou XD, Yu JP, Liu J, Luo HS, Chen HX, Yu HG. Overexpression of cellular FLICE-inhibitory protein (FLIP) in gastric adenocarcinoma. Clin Sci (Lond). 2004;106:397-405. [PubMed] [DOI] |
| 4. | Iordache S, Saftoiu A, Georgescu CV, Ramboiu S, Gheonea DI, Filip M, Schenker M, Ciurea T. Vascular endothelial growth factor expression and microvessel density--two useful tools for the assessment of prognosis and survival in gastric cancer patients. J Gastrointestin Liver Dis. 2010;19:135-139. [PubMed] |
| 5. | Wang X, Cao W, Mo M, Wang W, Wu H, Wang J. VEGF and cortactin expression are independent predictors of tumor recurrence following curative resection of gastric cancer. J Surg Oncol. 2010;102:325-330. [PubMed] [DOI] |
| 6. | Graupera M, Guillermet-Guibert J, Foukas LC, Phng LK, Cain RJ, Salpekar A, Pearce W, Meek S, Millan J, Cutillas PR. Angiogenesis selectively requires the p110alpha isoform of PI3K to control endothelial cell migration. Nature. 2008;453:662-666. [PubMed] [DOI] |
| 7. | Kerbel RS. Tumor angiogenesis. N Engl J Med. 2008;358:2039-2049. [PubMed] [DOI] |
| 8. | Feng R, Chen X, Yu Y, Su L, Yu B, Li J, Cai Q, Yan M, Liu B, Zhu Z. miR-126 functions as a tumour suppressor in human gastric cancer. Cancer Lett. 2010;298:50-63. [PubMed] [DOI] |
| 9. | 刘 博, 秦 永文, 吴 弘, 马 莉萍. miR-126的表达谱分析及其功能的初步研究. 上海: 第二军医大学 2009; . |
| 10. | Doench JG, Sharp PA. Specificity of microRNA target selection in translational repression. Genes Dev. 2004;18:504-511. [PubMed] [DOI] |
| 11. | Esquela-Kerscher A, Slack FJ. Oncomirs - microRNAs with a role in cancer. Nat Rev Cancer. 2006;6:259-269. [PubMed] [DOI] |
| 12. | Claesson-Welsh L, Welsh M. VEGFA and tumour angiogenesis. J Intern Med. 2013;273:114-127. [PubMed] [DOI] |
| 14. | Yu HG, Ai YW, Yu LL, Zhou XD, Liu J, Li JH, Xu XM, Liu S, Chen J, Liu F. Phosphoinositide 3-kinase/Akt pathway plays an important role in chemoresistance of gastric cancer cells against etoposide and doxorubicin induced cell death. Int J Cancer. 2008;122:433-443. [PubMed] [DOI] |
| 15. | Zhou XD, Chen HX, Guan RN, Lei YP, Shu X, Zhu Y, Lv NH. Protein kinase B phosphorylation correlates with vascular endothelial growth factor A and microvessel density in gastric adenocarcinoma. J Int Med Res. 2012;40:2124-2134. [PubMed] |
| 16. | Nicoli S, Standley C, Walker P, Hurlstone A, Fogarty KE, Lawson ND. MicroRNA-mediated integration of haemodynamics and Vegf signalling during angiogenesis. Nature. 2010;464:1196-1200. [PubMed] [DOI] |
| 17. | Li X, Zhang Y, Zhang Y, Ding J, Wu K, Fan D. Survival prediction of gastric cancer by a seven-microRNA signature. Gut. 2010;59:579-585. [PubMed] [DOI] |
| 18. | Chen J, Li T, Wu Y, He L, Zhang L, Shi T, Yi Z, Liu M, Pang X. Prognostic significance of vascular endothelial growth factor expression in gastric carcinoma: a meta-analysis. J Cancer Res Clin Oncol. 2011;137:1799-1812. [PubMed] [DOI] |