修回日期: 2013-07-25
接受日期: 2013-11-19
在线出版日期: 2013-12-18
目的: 在前期实验中, 我们通过体外构建干扰人源性ETS变异基因1(human ETS variant gene 1, hETV1)基因shRNA的载体, 干扰ETV1表达, 进而影响胃肠间质瘤细胞的侵袭作用, 在此, 我们继续通过上述方法, 观察胃肠间质瘤细胞增殖与凋亡的影响.
方法: 体外构建干扰hETV1基因shRNA的慢病毒载体, 感染GIST-T1细胞. 实验分成3组: 空白组、阴性对照组[PLVX(逆转录病毒)-shRNA组]、实验组(PLVX-shRNA-ETV1组),用Western blot方法对合成的靶点进行筛选, 采用体外增殖培养试验(MTT法)和流式细胞凋亡检测感染前后细胞增殖与凋亡的情况.
结果: 在MTT实验的前期阶段, 实验组细胞增殖数量未见明显下降, 与空白组(P = 0.539、P = 0.188)及阴性对照组(P = 0.877、P = 0.992), 无显著性差异, 而在后期阶段, 实验组细胞增殖数量明显受到抑制, 与空白组(P = 0.014、P = 0.000、P = 0.020)及阴性对照组(P = 0.011、P = 0.000、P = 0.003), 有显著性差异; 同时在细胞凋亡试验中, 实验组其凋亡率比空白组(P = 0.000)及阴性对照组(P = 0.000)明显增高, 有显著性差异.
结论: 通过体外干扰ETV1转录因子, 导致GIST-T1细胞在实验后期阶段有明显抑制作用, 细胞凋亡明显增加, 从而影响胃肠间质瘤细胞的进展.
核心提示:ETS变异基因1(ETS variant gene 1, ETV1)转录因子的表达, 在一定程度上可以促进胃肠间质瘤细胞的增殖, 同时抑制了胃肠间质瘤细胞的凋亡进程. 通过对ETV1转录因子研究证明, ETV1转录因子可能成为新的胃肠间质瘤(gastrointestinal stromal tumors)治疗靶点.
引文著录: 李强, 徐龙, 刘先发. ETV1转录因子在胃肠间质瘤中的作用. 世界华人消化杂志 2013; 21(35): 4037-4042
Revised: July 25, 2013
Accepted: November 19, 2013
Published online: December 18, 2013
AIM: To investigate the role of ETV1 in the proliferation and apoptosis of gastrointestinal stromal tumor (GIST) cells.
METHODS: A recombinant lentiviral vector carrying the small interfering RNA targeting ETV1 was constructed and used to infect GIST-T1 cell. GIST cells were divided into three groups: a blank control group, a negative control group (PLVX-shRNA group), and an experimental group (PLVX-shRNA-ETV1 group). After infection, ETV1 expression was detected by Western blot. GIST cell proliferation and apoptosis were detected by MTT assay and flow cytometry, respectively.
RESULTS: In the early stages after lentiviral infection, cell proliferation in the experimental group showed no significant differences compared to the blank control group (P = 0.539, 0.188) and negative control group (P = 0.877, 0.992). However, in the late stages, cell proliferation in the experimental group showed significant decreases compared to the blank control group (P = 0.014, 0.000, 0.020) and negative control group (P = 0.011, 0.000, 0.003). The rate of apoptosis in the experimental group was significantly higher compared to the blank control group (P = 0.000) and negative control group (P = 0.000).
CONCLUSION: ETV1 transcription factor may play an important role in the proliferation and apoptosis of GIST cells.
- Citation: Li Q, Xu L, Liu XF. Role of ETV1 transcription factor in gastrointestinal stromal tumor cells. Shijie Huaren Xiaohua Zazhi 2013; 21(35): 4037-4042
- URL: https://www.wjgnet.com/1009-3079/full/v21/i35/4037.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i35.4037
胃肠间质瘤(gastrointestinal stromal tumor, GIST)是胃肠道最常见的间叶组织肿瘤, 其形成机制主要由kit又名SCFR/CD117, stem cell factor receptor或pdgfra(platelet-derived growth factor receptor alpha, 血小板源性生长因子受体α多肽)基因突变(kit或pdgfra是酪氨酸激酶受体), 从而导致酪氨酸激酶的过度活化, 引起细胞增生和凋亡失衡, 导致其肿瘤的形成及恶变行为[1]. 目前, 甲磺酸伊马替尼等一些靶向治疗药可以有效阻止kit受体的持续活化, 抑制GIST的生长, 对GIST的转移和复发均有显著疗效, 因长期服用甲磺酸伊马替尼等一些靶向治疗药, 有部分病人出现耐药现象, 进一步研究证实, 由于kit基因的二次突变或多次突变, 从而导致临床上耐药的发生[2,3]. 前期实验我们发现, ETS变异基因1(ETS variant gene 1, ETV1)是转录因子高表达于GIST, 抑制GIST的侵袭作用, 在此, 我们继续前期实验[4], 干扰ETV1基因表达, 观察其对GIST的增殖与凋亡的影响, 进一步证实ETV1基因可能成为GIST治疗的新靶点.
人胃肠间质瘤细胞株GIST-T1由上海拜力生物科技有限公司提供. 高糖的DMEM培养基、胎牛血清(美国Hyclone公司). 慢病毒的构建由深州市百恩维生物科技公司提供. 检测的试剂MTT(美国Solarbio公司), ANNEXIN V-FITC凋亡试剂盒(美国Solarbio公司). CO2培养箱(Sanyo公司), 超净工作台(苏州半导体设备厂), Olympus倒置显微镜及成像系统IX71(日本Olympus公司), M5/M5e多功能酶标仪[美国Molecular Devices(MD)公司], 流式细胞仪Flow Cytometer-FACSAria Ⅱ(美国BD公司).
1.2.1 细胞培养: GIST-T1用含10%胎牛血清的高糖DMEM培养基, 置于37 ℃恒温、5%CO2的饱和湿度培养箱中进行培养.
1.2.2 观察细胞增殖实验: 调整细胞数大约为5×104个/mL接种于96孔板中, 每孔中加入200 µL的细胞悬液, 以只加不含细胞培养液作为调零孔, 每组设6个复孔, 接种96孔板后分别与1、4、7、10、14 d检测. 检测时每孔加入5 mg/mL MTT 20 µL, 继续置于37 ℃恒温、5%CO2的培养箱孵育4 h, 吸弃培养液, 每孔加入150 µL DMSO, 振荡10 min, 用酶标仪测定490 nm波长吸光度值(A490), 实验重复3次. 采用Compare Means/One-way ANOVA检验, 分析空白组、阴性对照组和实验组之间的差异.
1.2.3 细胞凋亡实验: 采用流式细胞仪Annexin V-FITC[Annexin A5-green fluorescein/propidium iodide, 膜联蛋白A5-绿色荧光素/碘化丙啶(propidium iodide, PI)]/PI双染色法, 贴壁生长的细胞用含有0.02%EDTA的0.25%胰蛋白酶消化成单细胞悬液, 调整待测细胞的浓度为5×105-1×106个/mL. 取1 mL细胞, 1000 r/min, 4 ℃离心10 min, 弃上清. 加入1 mL预冷的PBS, 轻轻震荡使细胞悬浮, 1000 r/min, 4 ℃离心10 min, 弃上清. 重复步骤3次. 将细胞重悬于200 µL Binding Buffer. 加入10 µL Annexin V-FITC和10 µL PI, 轻轻混匀, 避光室温反应15 min或者4 ℃反应30 min. 加入300 µL Binding Buffer, 在1 h内上机检测. 观察: Annexin V-FITC结合到凋亡细胞后, 在蓝色光的激发下, 发出绿色荧光, 可区分凋亡细胞与正常细胞, 碘化丙啶是一种核酸染料, 他不能穿透完整细胞膜, 但对凋亡晚期细胞和死细胞的破损细胞膜能够穿透, 并使细胞核染成红色, Annexin V-FITC与PI匹配使用, 可以将凋亡早期的细胞和晚期的细胞区分开来. 结果判断: 左上象限显示坏死细胞(FITC-/PI+); 右上象限显示晚期凋亡细胞(FITC+/PI+); 左下象限显示正常细胞(FITC-/PI-); 而右下象限显示早期凋亡细胞(FITC+/PI-). 采用Compare Means/One-Way ANOVA检验, 分析空白组、阴性对照组及实验组之间的差异.
统计学处理 采用mean±SD表示, 样本均数比较采用方差分析, 用SPSS13.0统计软件进行方差分析. P<0.05为差异有统计学意义.
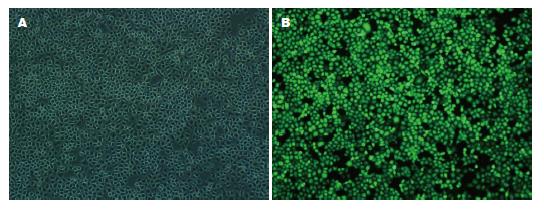
如图1所示, 经慢病毒转染的GIST-T1细胞, 转染率达90%以上, 表明已合成的干扰序列90%以上转入到GIST-T1(胃肠间质瘤细胞)细胞核中.
2.2.1 观察干扰前后细胞的生长曲线变化: GIST-T1细胞呈梭形细胞、非普通型上皮样细胞(表1). 通过转染GIST-T1细胞后分别于第1、4、7、10、13天通过MTT法测其吸光度(A值), 通过测得的数值并描述其生长曲线.
| 分组 | 第1天 | 第4天 | 第7天 | 第10天 | 第13天 |
| 空白组 | 0.1683±0.0237 | 0.4390±0.0638 | 0.9470±0.0761 | 1.1383±0.1095 | 1.1353±0.1045 |
| 阴性对照组 | 0.1633±0.0180 | 0.4715±0.0339 | 0.9218±0.0499 | 1.1228±0.0573 | 1.1357±0.1193 |
| 实验组 | 0.1605±0.0153 | 0.4733±0.0355 | 0.8108±0.1214 | 0.9123±0.1342 | 0.9877±0.1065 |
| F值 | 0.586 | 1.716 | 7.034 | 17.201 | 8.103 |
| P值 | 0.562 | 0.195 | 0.003 | 0.000 | 0.001 |
表1中, 空白组、阴性对照组和实验组随着时间的延长, 其测定的吸光度也逐渐增加. 在第1-7天之间, 阴性对照组与试验组相比较, 无明显差异性(P>0.05), 无统计学意义; 实验组与空白组及实验组与阴性对照组相比较, 均无显著性差异(P>0.05), 无统计学意义. 然而在第7天开始以后, 阴性对照组与试验组相比较, 无明显差异性(P>0.05), 无统计学意义; 实验组与空白组(P = 0.000和P = 0.001)及实验组与阴性对照组(P = 0.000和P = 0.001)相比较均有显著性差异(P<0.05), 有统计学意义.
如表2示, 阴性对照组分别与第1-13天, 细胞无明显死亡; 实验组于第1-7天, 细胞无明显死亡, 然而, 在第7天之后, 大约有25%的细胞出现了死亡.
| 分组 | 第1天 | 第4天 | 第7天 | 第10天 | 第13天 |
| 阴性对照组 | 97.03 | 107.40 | 97.34 | 99.03 | 100.04 |
| 实验组 | 95.37 | 107.81 | 85.62 | 80.15 | 87.00 |
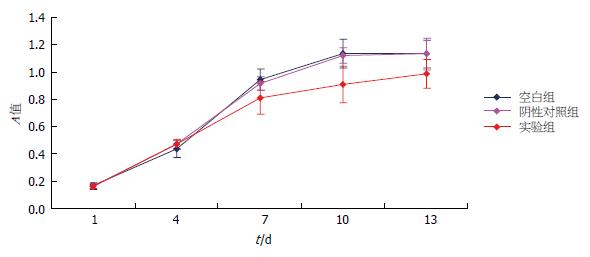
通过表1结果, 采用第1、4、7、10、13天所测的吸光度平均值, 绘制出GIST-T1细胞生长曲线(图2, 3). 图3示, 实验组、空白组和阴性对照组在第1-6天时, 其描述的生长曲线基本重叠, 然而在第6天开始以后实验组的生长曲线与空白组、阴性对照组相比, 有所下降, 其下降幅度不十分明显.
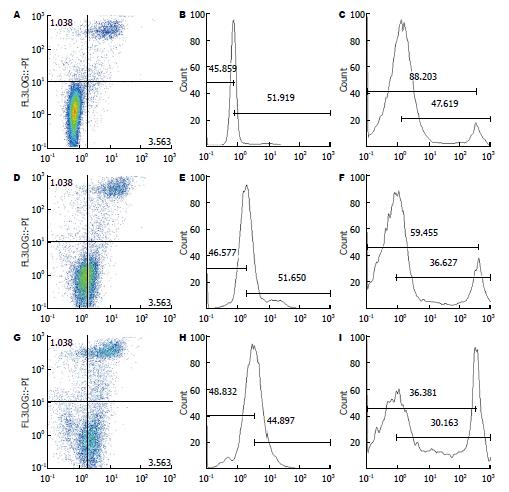
2.2.2 观察干扰前后细胞凋亡情况: 通过慢病毒转染GIST-T1细胞72 h后, 阴性对照组与空白组相比较, 出现了早期凋亡及晚期凋亡现象; 实验组与空白组相比, 其早期凋亡及晚期凋亡显著增多, 实验组与阴性对照组相比, 早期凋亡及晚期凋亡也明显增多(图4).
通过慢病毒转染GIST-T1细胞72 h后, 空白组、阴性对照组及实验组其早期凋亡率及晚期凋亡率组内相比较, 阴性对照组与空白组相比较, 出现早期凋亡率及晚期凋亡率均有差异(P<0.05), 有统计学意义. 试验组与空白组、实验组与阴性对照组相比较, 出现的早期凋亡率及晚期凋亡率均有显著性差异(P<0.05), 有统计学意义, 其主要表现为一个早期凋亡过程(表3).
| 分组(区域) | % | P值 |
| 空白组 | ||
| 坏死细胞 | 2.8563±0.0853 | |
| 晚期凋亡细胞 | 3.8540±0.1347 | |
| 早期凋亡细胞 | 0.9090±0.0146 | |
| 正常细胞 | 92.3806±0.2215 | |
| 阴性对照组 | ||
| 坏死细胞 | 3.1353±0.1082 | |
| 晚期凋亡细胞 | 9.3180±0.1298 | 0.000 |
| 早期凋亡细胞 | 32.8277±1.5802 | 0.000 |
| 正常细胞 | 54.7190±1.5691 | |
| 实验组 | ||
| 坏死细胞 | 6.4520±0.1820 | |
| 晚期凋亡细胞 | 10.9580±0.4358 | 0.000 |
| 早期凋亡细胞 | 61.9930±1.3725a | 0.000 |
| 正常细胞 | 20.5970±1.9096 |
GIST是一类起源于胃肠道间叶组织的肿瘤, 他们好发于胃、小肠和结肠, 其他消化系较为少见[5,6], 没有典型的临床表现[7], 现认为, GIST主要起源于胃肠道肌间神经丛周围的Cajal间质细胞[8,9]. 在胃肠间质瘤中, 由于c-kit原癌基因的突变, 导致其下游的酪氨酸激酶在没有配体的情况下, 持续活化, 导致其GIST细胞增殖分化失控, 从而引发肿瘤形成. 因此, 抑制酪氨酸激酶的持续活化成为控制GIST研究的靶标[8]. 甲磺酸伊马替尼等一些抗肿瘤靶向药可以有效地阻止酪氨酸激酶的持续激活, 抑制肿瘤的生长, 对GIST患者均有一定的疗效[10,11]. 因长期服用此类药物, 导致临床上部分出现耐药现象, 研究发现, 在出现对耐药患者的基因分析发现, 耐药病人的基因的kit基因出现新的突变或者存在二次或多次突变现象发生, 从而解释了临床上耐药现象的发生. 为了进一步解决对于临床耐药患者的治疗, 我们必须进一步寻找新的靶点, 进行靶向干预治疗.
在人类中, ETS域的转录因子家族包括27种蛋白质, ETV1因子是其中之一, 我们前期实验发现, ETV1转录因子与GIST的侵袭和转移存在密切关系, 他可以促进GIST的侵袭和转移[12-14]. 同时Chi等[15]研究发现, ETV1普遍高表达在胃肠道间质瘤和伊马替尼的敏感和耐药的GIST细胞株中, 促进其的生长和增殖.
我们继续通过采用基因干扰技术, 沉默掉GIST-T1细胞株的hETV1转录因子, 对其进行生长和凋亡研究, 在其结果示, 干扰hETV1基因的实验组和空白组及阴性对照组相比较, 在前期阶段GIST-T1细胞生长没有出现一个明显的抑制状态, 而到后期阶段, 可以看见经沉默掉hETV1基因的实验组较空白组及阴性对照组有一个明显的生长抑制, 可能GIST-T1细胞株的生长在早期阶段, hETV1转录因子只是部分参与肿瘤的生长, 可能存在另外的基因共同参与GIST-T1细胞的生长和分化, hETV1对于早期胃肠间质瘤的生长只是起一个次要地位. 但是在后期阶段, hETV1转录因子对GIST-T1细胞存在明显的抑制, 证实说明, 此阶段hETV1起主要作用; 另外我们对GIST-T1细胞凋亡加以研究也发现, 经沉默hETV1基因的实验组较空白组及阴性对照组有一个明显的凋亡现象, 说明hETV1转录因子在调控胃肠间质瘤的凋亡起着主要的作用. 经大量文献证实, c-kit基因的高表达与突变导致酪氨酸激酶持续的活化, 导致胃肠间质瘤增生与凋亡失衡, 从而导致肿瘤过度增殖, 减缓凋亡的发生. 我们在前期试验中在此对发现, 经过沉默掉hETV1基因的GIST-T1细胞行免疫化学, 经沉默掉hETV1基因的实验组较空白组及阴性对照组相比, 其染色度明显变浅, 说明沉默hETV1基因的GIST-T1细胞体外C-KIT蛋白表达明显降低, 从而让我们联想到, hETV1转录因子与c-kit基因存在着某种密切的联系, 很大可能程度上通过抑制hETV1转录因子, 抑制c-kit在胃肠间质瘤中的过表达, 稳定其基因, 减少突变的发生率, 从而抑制胃肠间质瘤生长, 加速其凋亡的进程.
胃肠间质瘤(gastrointestinal stromal tumor, GIST)是一类起源胃肠道间叶组织的肿瘤, 主要发生于消化管道, 是胃肠道最常见的间叶组织肿瘤, 多见于胃和小肠. 主要由kit或pdgfra(kit或pdgfra是酪氨酸激酶受体)基因突变, 导致酪氨酸激酶持续的活化引起细胞增殖分化失控导致GIST.
王文跃, 主任医师, 中日友好医院普通外科
因临床上对于胃肠间质瘤的靶向药物, 其作用靶点是kit基因的下游信号分子酪氨酸激酶, 因kit基因存在二次突变现象, 从而导致临床上耐药的发生, 继而寻找新的干预靶点, 现世界范围一些相关蛋白及信号通路研究较多, 对于转录因子研究相对较少, 很可能成为今后的热点和难点, 本文对其做简单试探性的研究, 需要广大医务工作研究者进行更深入的研究, 为以后的临床治疗及药物的研发提供新的思路.
EST家族参与调节细胞的增生分化, 与肿瘤的侵袭和迁移关系十分密切, 据最新Ping等研究发现, 通过对转录因子hETV1和对kit研究证明其共同影响GIST的分化与进展, 如果干扰hETV1, 从而影响GIST的kit基因表达, 将有可能降低突变后KIT蛋白的合成, 这种作用不会受kit基因外显子突变种类的影响, 有望彻底纠正减少酪氨酸激酶的过度活化. 类似对于EST家族的一些成员, 与肿瘤关系密切, 其相关报道也有一些相关文献.
针对ETS家族的研究报道很多, 而对于ETV1(转录因子)对于胃肠间质瘤方面的相关报道比较少, 同时因kit基因存在二次突变现象, 从而针对临床上抑制kit基因的下游信号分子酪氨酸激酶的靶向药物耐药的发生, 继而寻找新的干预靶点, Ping Chi等通过对转录因子hETV1和对KIT研究证明其共同影响GIST的分化与进展, 但对于对其胃肠间质瘤的增值、分化及如何影响其肿瘤的转移能力未进行进一步研究, 所以在此本文针对hETV1影响胃肠间质瘤的增值、分化及凋亡进行研究, 但对其影响其侵袭能力, 在前面已经做了研究.
临床针对突变kit或pdgfra基因为干扰靶点研发的药物, 比如伊马替尼等抗肿瘤药物, 由于突变的kit或pdgfra基因存在多位点和二次突变的现象, 从而导致抗肿瘤药物的耐药, 本研究体外构建干扰ETV1基因shRNA的载体, 干扰ETV1表达, 观察其对GIST的增值、分化的影响, 以寻找新的GIST治疗靶点,为临床胃肠间质瘤的治疗提供新的思路.
本文设计合理, 具有一定的学术价值, 具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | Al-Batran SE, Hartmann JT, Heidel F, Stoehlmacher J, Wardelmann E, Dechow C, Düx M, Izbicki JR, Kraus T, Fischer T. Focal progression in patients with gastrointestinal stromal tumors after initial response to imatinib mesylate: a three-center-based study of 38 patients. Gastric Cancer. 2007;10:145-152. [PubMed] [DOI] |
| 2. | Nishida T, Kanda T, Nishitani A, Takahashi T, Nakajima K, Ishikawa T, Hirota S. Secondary mutations in the kinase domain of the KIT gene are predominant in imatinib-resistant gastrointestinal stromal tumor. Cancer Sci. 2008;99:799-804. [PubMed] [DOI] |
| 3. | Zhu MJ, Ou WB, Fletcher CD, Cohen PS, Demetri GD, Fletcher JA. KIT oncoprotein interactions in gastrointestinal stromal tumors: therapeutic relevance. Oncogene. 2007;26:6386-6395. [PubMed] [DOI] |
| 5. | Miettinen M, Monihan JM, Sarlomo-Rikala M, Kovatich AJ, Carr NJ, Emory TS, Sobin LH. Gastrointestinal stromal tumors/smooth muscle tumors (GISTs) primary in the omentum and mesentery: clinicopathologic and immunohistochemical study of 26 cases. Am J Surg Pathol. 1999;23:1109-1118. [PubMed] [DOI] |
| 6. | Reith JD, Goldblum JR, Lyles RH, Weiss SW. Extragastrointestinal (soft tissue) stromal tumors: an analysis of 48 cases with emphasis on histologic predictors of outcome. Mod Pathol. 2000;13:577-585. [PubMed] [DOI] |
| 7. | 贺 慧颖, 方 伟岗, 钟 镐镐, 李 燕, 郑 杰, 杜 娟, 衡 万杰, 吴 秉铨. 165例胃肠道间质瘤中c-kit和PDGFRA基因突变的检测和临床诊断意义. 中华病理学杂志. 2006;35:262-266. |
| 8. | 林 苏, 刘 懿. 胃肠道间质瘤. 国外医学•消化系疾病分册. 2005;25-28. |
| 10. | Li Y, Jiang Z, Xu L, Yao H, Guo J, Ding X. Stability analysis of liver cancer-related microRNAs. Acta Biochim Biophys Sin (Shanghai). 2011;43:69-78. [PubMed] [DOI] |
| 11. | Xu J, Wu C, Che X, Wang L, Yu D, Zhang T, Huang L, Li H, Tan W, Wang C. Circulating microRNAs, miR-21, miR-122, and miR-223, in patients with hepatocellular carcinoma or chronic hepatitis. Mol Carcinog. 2011;50:136-142. [PubMed] [DOI] |
| 12. | Keld R, Guo B, Downey P, Gulmann C, Ang YS, Sharrocks AD. The ERK MAP kinase-PEA3/ETV4-MMP-1 axis is operative in oesophageal adenocarcinoma. Mol Cancer. 2010;9:313. [PubMed] [DOI] |
| 13. | Dissanayake K, Toth R, Blakey J, Olsson O, Campbell DG, Prescott AR, MacKintosh C. ERK/p90(RSK)/14-3-3 signalling has an impact on expression of PEA3 Ets transcription factors via the transcriptional repressor capicúa. Biochem J. 2011;433:515-525. [PubMed] [DOI] |
| 14. | Keld R, Guo B, Downey P, Cummins R, Gulmann C, Ang YS, Sharrocks AD. PEA3/ETV4-related transcription factors coupled with active ERK signalling are associated with poor prognosis in gastric adenocarcinoma. Br J Cancer. 2011;105:124-130. [PubMed] [DOI] |