修回日期: 2013-08-06
接受日期: 2013-11-19
在线出版日期: 2013-12-18
目的: 通过观察落新妇甙对肝脏热缺血再灌注损伤中血红素加氧酶1(heme oxygenase-1, HO-1)表达的影响, 探讨其缺血再灌注保护作用的分子机制.
方法: C57BL/6小鼠随机分为4组(n = 8): 假手术组(Sham)、模型组(I/R)、落新妇甙小剂量(10 mg/kg)干预组和落新妇甙大剂量(40 mg/kg)干预组. 缺血前24和1 h干预组小鼠腹腔注射分别给予10或40 mg/kg的落新妇甙, 建立肝左、中叶70%部分肝缺血再灌注模型, 模型组和假手术组给予同样体积的生理盐水. 小鼠肝脏左叶缺血90 min、再灌注6 h后各实验组采集血液和肝脏组织样本. 检测血清中丙氨酸转氨酶(alanine transaminase, ALT)活性, Western blot检测肝组织中核因子kB(nuclear factor kB, NF-kB)和HO-1蛋白含量, 半定量RT-PCR检测上述分子mRNA表达情况.
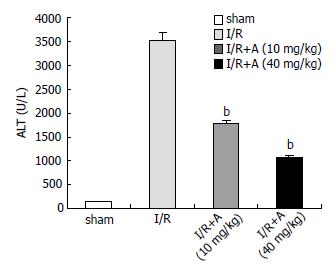
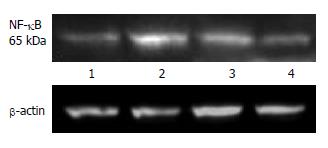
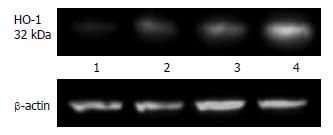
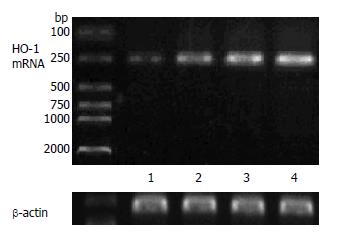
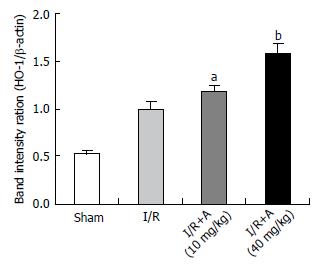
结果: 落新妇甙小、大剂量干预后血清ALT含量较I/R对照组均明显下降(假手术组: 142 U/L±25 U/L; 模型组: 3521 U/L±270 U/L; 落新妇甙小剂量干预组: 1766 U/L±179 U/L; 落新妇甙大剂量干预组: 1067 U/L±101 U/L, P<0.01); 落新妇甙小、大剂量干预组肝组织中NF-kB蛋白表达与I/R模型对照组比较均渐次降低; 落新妇甙小、大剂量干预组肝组织中HO-1蛋白表达与I/R模型对照组比较均渐次升高, 亦与半定量RT-PCR结果相符(假手术组: 0.53 U/L±0.07 U/L; 模型组: 1.00 U/L±0.11 U/L; 落新妇甙小剂量干预组: 1.17 U/L±0.16 U/L; 落新妇甙大剂量干预组: 1.57 U/L±0.07 U/L小剂量干预组P<0.05; 大剂量干预组P<0.01).
结论: 落新妇甙干预能降低缺血再灌注损伤(ischemia/reperfusion injury, IRI)引起的血清ALT水平升高; 落新妇甙干预能降低IRI肝组织中NF-kB蛋白的高表达, 促进IRI肝组织HO-1蛋白和mRNA的表达, 显示其保护作用与促进HO-1的表达密切相关.
核心提示: 落新妇甙对小鼠肝脏热缺血再灌注损伤具有保护作用, 落新妇甙干预能降低缺血再灌注损伤肝脏核因子κB(nuclear factor κB)蛋白的高表达, 显示其对Toll样受体4(Toll like receptor-4, TLR-4)炎症信号通路具有抑制作用. 同时落新妇甙干预能促进缺血再灌注损伤(ischemia/reperfusion injury, IRI)肝组织血红素加氧酶1(heme oxygenase-1, HO-1)蛋白和mRNA的表达, 显示其对TLR-4通路的抑制与促进HO-1的表达密切相关.
引文著录: 慕宁, 江艺, 吕立志. 落新妇甙对缺血再灌注损伤肝脏HO-1表达的影响. 世界华人消化杂志 2013; 21(35): 4019-4023
Revised: August 6, 2013
Accepted: November 19, 2013
Published online: December 18, 2013
AIM: To study the molecular mechanism behind the effects of astilbin in protecting the liver against warm ischemia-reperfusion injury.
METHODS: C57BL/6 mice were randomly divided into four groups (n = 8 for each): a sham-operated group (Sham), a model control group (I/R), a low dose astilbin treatment group (10 mg/kg) and a high dose astilbin (40 mg/kg) treatment group. At 24 h and 1 h before ischemia, mice in the two treatment groups were intraperitoneally injected with 10 and 40 mg/kg astilbin, respectively. Then 70% hepatic ischemia-reperfusion, including the left and middle hepatic lobes, were induced. The I/R model control group and the sham-operated group were administered with equal volume of normal saline. After 90 min ischemia and 6 h reperfusion of the partial hepatic lobe, blood and liver tissue samples were collected. Serum ALT activity was detected, and the levels of NF-kB and HO-1 in liver tissues were detected by Western blot. The mRNA expression of these molecules was detected by semiquantitative RT-PCR.
RESULTS: Compared with the I/R model control group, serum ALT in both low and high dose treatment groups significantly decreased (sham: 142 U/L ± 25 U/L; I/R: 3521 U/L ± 270 U/L; low dose group: 1766 ± 179U/L; high dose group: 1067 U/L ± 101 U/L, P < 0.01), and the decline was more significant in the high dose group than in the low dose group (P < 0.01). The protein content of NF-kB in liver tissues gradually decreased in both treatment groups compared with the I/R model control group, and was lower in the high dose group than in the low dose group. HO-1 levels gradually increased in treatment groups, and the increase was more significant in the high dose group than in the low dose group. The results of mRNA expression showed a similar trend (sham: 0.53 ± 0.07; I/R: 1.00 ± 0.11; low dose group: 1.17 ± 0.16; high dose group: 1.57 ± 0.07, P < 0.05 or < 0.01).
CONCLUSION: Intervention with astilbin can reduce the high levels of serum ALT caused by ischemia-reperfusion injury, down-regulate the high expression of NF-kB protein and up-regulate the expression of HO-1 protein and mRNA in IRI liver tissues. The protective effect of astilbin against liver IRI is possibly related to the promotion of the expression of HO-1.
- Citation: Mu N, Jiang Y, Lv LZ. Effect of astilbin on HO-1 expression in hepatic warm ischemia-reperfusion injury. Shijie Huaren Xiaohua Zazhi 2013; 21(35): 4019-4023
- URL: https://www.wjgnet.com/1009-3079/full/v21/i35/4019.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i35.4019
血红素加氧酶1(heme oxygenase-1, HO-1)是热休克蛋白32成员, 肝脏HO-1最初由Kupffer细胞产生, 作为Toll样受体4(Toll like receptor 4, TLR-4)的配体之一, 通过阻抑TLR-4信号通路产生较强的抗氧化、抗炎症功能[1]从而起到保护肝脏缺血再灌注损伤(ischemia/reperfusion injury, IRI)的作用.
落新妇甙(astilbin)是从土茯苓的乙醇提取液中分离得到的3个二氢黄酮醇甙之一, 黄酮类化合物有较强的抗氧化作用, 可作为递氢体清除氧自由基, 从而在抗炎、减轻缺血再灌注损伤等方面发挥作用. 本课题前期研究发现落新妇甙对小鼠肝脏热缺血再灌注损伤具有保护作用, 显著降低肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)的生成并提高白细胞介素10(interleukin-10, IL-10)含量[2,3]. 本文继续探讨落新妇甙对HO-1和核因子-kB(nuclear factor-kB, NF-kB)在蛋白和/或mRNA水平上的影响, 以期深入探讨其肝脏IRI保护作用的分子机制.
分析纯落新妇甙粉剂由杭州华东医药有限责任公司提供. 实验中落新妇甙粉剂首先用二甲基亚砜溶解(40 mg/mL), 使用时用生理盐水稀释至所需浓度. 戊巴比妥钠(上海国药集团化学试剂有限公司); 抗小鼠NF-kB多抗(美国CST公司); 抗小鼠HO-1单抗(StressGen Biotechnologies Canada); 抗b-actin抗体(Santa Cruz); 羊抗鼠IgG二抗(KPL); SuperSignal West Femto超敏底物(Pierce); BCA法蛋白浓度检测试剂盒(凯基公司); TRIzol Reagent(Invitrogen); RNA PCR kit(AMV)Ver3.0试剂盒(TaKaRa); DNA Marker(宝生物工程大连有限公司).
1.2.1 动物分组及处理: 清洁级♂C57BL/6小鼠40只, 体质量22-25 g(由中国人民解放军第二军医大学实验动物中心提供)用于实验. 动物分笼饲养于第二军医大学免疫教研室, 提供标准饮食. 动物实验遵守学校及实验室相应的动物实验有关规定. 随机分为4组(每组8只): 假手术组(假手术)、模型组(I/R), 落新妇甙小剂量(10 mg/kg)干预组、落新妇甙大剂量(40 mg/kg)干预组. 于缺血前24和1 h, 分别给落新妇甙干预组小鼠腹腔注射10或40 mg/kg的落新妇甙, 模型组和假手术组给予同样体积生理盐水. 再灌注时干预组经尾静脉注射第3次给同样剂量落新妇甙干预, 模型组和假手术组给予同样体积生理盐水.
1.2.2 建立动物模型: 采用70%部分肝脏缺血再灌注损伤模型, 按Zhai等[4]报道的方法操作.
1.2.3 肝功检测: 缺血90 min, 再灌注6 h后, 采集小鼠血液0.3-0.5 mL于1.5 mL EP管中, 3000 r/min离心5 min, 小心吸取上层血清装于干净EP管中, 检测丙氨酸氨基转移酶(alanine transaminase, ALT)的活性.
1.2.4 肝脏组织样品准备: 缺血90 min, 再灌注6 h后各实验组小鼠左叶肝组织取样, 分为3部分. 一部分固定于甲醛溶液, 切片用于组织病理学检测(HE染色); 另一部分肝组织制成匀浆, 用于酶学指标; 第3部分肝组织于液氮中保存, 用于Western blot及RT-PCR分析.
1.2.5 Western blot检测肝组织HO-1和NF-kB蛋白表达: 取各组冻存的缺血90 min, 再灌注6 h肝组织100 mg, 用研钵粉碎组织块, 按照3 mL/g加入放射免疫沉淀测定(radio immunoprecipitation assay, RIPA)缓冲液及苯甲基磺酰氟, 以12000 r/min, 4 ℃高速离心30 min, 小心收集上清, 按照凯基公司BCA法蛋白浓度检测试剂盒说明书进行蛋白定量, 空白对照采用RIPA. 调整各组样品蛋白浓度至一致, 常规电泳、转膜、封闭. 按说明书要求加入一抗、二抗, 将Western印迹发光检测试剂中的A液和B液等体积混匀, 室温孵育5 min, 于凝胶成像分析检测仪上进行检测.
1.2.6 半定量RT-PCR检测肝组织HO-1 mRNA表达: (1)总RNA的抽提与纯度鉴定: 取各组冻存的小鼠肝脏组织100 mg. 按TRIzol试剂说明书进行抽提. 紫外分光光度仪在波长260和280 nm的紫外吸光度(A)值, 计算A260/280的比值, 鉴定mRNA浓度和纯度, 根据所测浓度加入DEPC水稀释成0.5 g/L浓度, 保存于-80 ℃; (2)RT-PCR: 应用TaKaRa公司RT-PCR扩增试剂盒扩增目的基因. 各基因引物序列: HO-1正义5'- AAG CCG AGA ATG CTG AGT TCA -3'; 反义5'- CAG TGA GGC CCA TAC CAG AA -3'; β-actin正义5'- AGT GTG ACG TTG ACA TCC GT -3'; 反义5'- GCA GCT CAG TAA CAG TCC GC -3'; 引物合成由上海生工生物技术公司完成. 反应条件: 94 ℃预变性2 min后, 94 ℃变性30 s, 退火30 s 72 ℃延伸1 min, 共35个循环, 最后72 ℃延伸10 min. HO-1扩增片段223 bp, 退火温度50 ℃, 循环次数35次; (3)电泳及扩增产物成像分析: PCR产物9 μL加1 μL含溴酚蓝指示剂的缓冲液(10×)混匀, 置于1.2%琼脂糖凝胶中, 其中包括DNA marker, 稳定电压80 V, 电泳1 h. 紫外透射仪下查看, 再用Gel-Pro IMAGER 60-2517型成像分析系统进行分析, 测定各条带A值, 计算各产物与β-actin的A值比值, 即为目的RNA的相对表达量, 计算公式: 相对产物电泳条带A值/β-action产物电泳条带A值.
统计学处理 实验数据以mean±SD表示. 采用SSPS10.0软件进行所有数据的统计学处理. 多组间比较采用完全随机方差分析, SNK法分析组间差异, 检验水准a = 0.05, P<0.05为差异有统计学意义.
实验选用C57BL/6小鼠40只, 分为4组, 进入结果分析32只.
10和40 mg/kg落新妇甙干预组血清ALT含量与模型组相比均明显下降(P<0.01), 大剂量干预组(40 mg/kg)较小剂量组更明显(P<0.01)(图1).
Western blot检测肝组织中NF-kB蛋白水平的表达, 结果显示: I/R对照组与Sham组比较, NF-kB表达明显增强, 落新妇甙小、大剂量干预后, NF-kB表达渐次减弱(图2).
2.4.1落新妇甙对肝组织HO-1蛋白表达的影响: Western blot检测肝组织中HO-1蛋白水平的表达, 结果显示: 与I/R对照组比较, 落新妇甙小、大剂量干预后, HO-1表达渐次增强(图3).
2.4.2 落新妇甙对肝组织HO-1 mRNA表达的影响: 半定量结果显示, Sham组HO-1表达较低(0.53±0.07), 与I/R对照组比较(1.00±0.11), 落新妇甙(A)小剂量干预能上调HO-1 mRNA表达(1.17 ±0.16, P<0.05), 大剂量则明显增强HO-1 mRNA表达(1.57±0.07, P<0.01)(图4, 5).
肝脏缺血再灌注损伤涉及复杂的分子机制, 诸多分子通道与炎症因子产物相互反馈、作用, 产生一系列的级联效应, 导致肝组织的严重损伤. 研究发现激活的肝脏非实质细胞(尤其Kupffer细胞)通过TLR-4信号通路在肝脏热缺血再灌注损伤中发挥重要作用[5]. 肝脏热缺血再灌注过程中的炎症和损伤部分的依赖于TLR-4信号通路[4,6]. 本课题前期研究发现落新妇甙对小鼠肝脏热缺血再灌注损伤具有保护作用, 显著降低TNF-α的生成并提高白介素10(interleukin-10, IL-10)含量. 文献报道[7], 在刀豆球蛋白A(concanavalin A, Con A)诱导肝炎后, 落新妇甙能够显著降低TNF-α的生成和肝脏Kupffer细胞的增殖. 提示落新妇甙对肝脏IRI保护作用的机制可能是通过干预TLR-4信号通路实现的.
HO-1是热休克蛋白32成员, 而热休克蛋白正是TLR-4的内源性配体之一. 因其具有较强的抗氧化、抗炎症功能而在IRI研究中得到关注. Tsuchihashi等[8]利用钴原卟啉(cobalt protoporphyrin, CoPP)诱导HO-1过表达, 过表达的HO-1下调信号转导子及转录激活子(signal transducer and activator of transcription-1, STAT-1)的表达及其所触发的CXCL-10的产生, 而CXCL-10是TLR4活化下游Ⅰ型IFN途径的主要产物. HO-1的上述作用带来了明显改善的小鼠肝脏热缺血再灌注损伤的保护效果. 本研究结果观察到落新妇甙干预能明显促进肝组织HO-1蛋白和mRNA的表达, 这种促进作用在大剂量给药时更为明显, 提示其对肝脏IRI的保护作用与促进HO-1的表达密切相关.
NF-kB属于NF-kB/Rel蛋白家族, 是TLR-4信号通路中的关键分子. NF-kB可能通过多个方式和途径参与肝缺血再灌注损伤. 组织缺血再灌注时伴有NF-kB活性增高, 并可诱发和加重组织的损伤[9]; 而阻断NF-kB的活性可明显减轻组织器官的再灌注损伤[10,11]. 白介素-10、糖皮质激素、水杨酸类等药物预处理, 均可通过下调NF-kB活性拮抗肝缺血再灌注损伤, 发挥保护效应[12,13]. 本研究结果亦观察到肝脏IRI导致肝脏NF-kB蛋白表达增强, 落新妇甙干预能显著降低肝脏NF-kB增强表达的趋势, 显示出落新妇甙可能通过抑制NF-kB炎症反应通路发挥对肝脏IRI的保护作用.
缺血再灌注损伤是外科临床时常面对的难题, 肝脏是对缺血再灌注损伤最敏感的器官之一. 多种信号通路参与其中, 肝脏热缺血再灌注过程中的炎症和损伤部分的依赖于Toll样受体4(Toll like receptor 4, TLR-4)信号通路, 因此通过抑制该信号通路达到减轻肝脏IRI的目的就显得前景诱人. 血红素加氧酶1(heme oxygenase-1, HO-1)是热休克蛋白32成员, 肝脏HO-1最初由Kupffer细胞产生, 作为TLR-4的配体之一, 通过阻抑TLR-4信号通路产生较强的抗氧化、抗炎症功能从而起到保护肝脏缺血再灌注损伤(ischemia/reperfusion injury, IRI)的作用.
门秀丽, 教授, 河北联合大学(原华北煤炭医学院)病理生理学教研室
祖国传统医药对缺血再灌注损伤的保护作用是研究的热点. 有研究表明葛根素可显著抑制缺血再灌注诱导的Caspase23的活化, 减少缺血再灌注诱导的N2a细胞的凋亡程度, 而人参皂甙Rb1被认为可以通过上调葡萄糖转运体1表达以维持脑组织的能量供给而发挥缺血再灌注脑损伤保护作用. 落新妇甙属天然药物, 口服吸收好, 高效无不良反应, 有文献报道落新妇甙能够通过干预氧自由基和脂质过氧化物生成, 明显减轻四氯化碳引起的肝损伤; 在刀豆球蛋白A(concanavalin A, Con A)诱导肝炎后, 落新妇甙能够显著降低肿瘤坏死因子-α的生成和肝脏Kupffer细胞的增殖.
有研究报道落新妇甙在接触性皮炎模型中能显著促进IL-10、SOCS1和SOCS3的表达, 减轻炎症反应. 在肾缺血再灌注损伤中, 研究发现落新妇苷通过抑制巨噬细胞的趋化和活化发挥保护作用.
本文探讨落新妇甙对HO-1和核因子-kB(nuclear factor-kB, NF-kB)在蛋白和/或mRNA水平上的影响, 研究发现落新妇甙干预能降低NF-kB蛋白的高表达, 显示其对TLR-4炎症信号通路具有抑制作用. 同时落新妇甙干预能促进IRI肝组织HO-1蛋白和mRNA的表达, 显示其对TLR-4通路的抑制与促进HO-1的表达密切相关. 探讨了落新妇甙在肝脏缺血再灌注保护作用的分子机制, 从而为其进一步应用于临床提供了理论依据节的, 本文较全面的阐述了Notch与HSC活化的关系, 有助于肝纤维化研究者更好的分析实验数据、解释实验现象及把握实验方向.
本文内容较新颖, 具有一定的应用价值.
编辑: 田滢 电编:鲁亚静
| 1. | Ben-Ari Z, Issan Y, Katz Y, Sultan M, Safran M, Michal LS, Nader GA, Kornowski R, Grief F, Pappo O. Induction of heme oxygenase-1 protects mouse liver from apoptotic ischemia/reperfusion injury. Apoptosis. 2013;18:547-555. [PubMed] [DOI] |
| 2. | 慕 宁, 江 艺, 张 绍庚, 陈 少华, 吕 立志, 张 坤, 杨 芳, 张 小进, 蔡 秋程, 潘 凡. 落新妇甙对肝缺血再灌注损伤的保护作用. 中国组织工程研究与临床康复. 2011;15:865-869. |
| 3. | 慕 宁, 王 海梁, 傅 宏, 林 峰, 施 晓敏, 邹 绍武, 王 全兴, 傅 志仁. 落新妇苷通过促进IL-10表达保护小鼠缺血再灌注损伤肝脏. 第二军医大学学报. 2008;12:1429-1432. |
| 4. | Zhai Y, Shen XD, O'Connell R, Gao F, Lassman C, Busuttil RW, Cheng G, Kupiec-Weglinski JW. Cutting edge: TLR4 activation mediates liver ischemia/reperfusion inflammatory response via IFN regulatory factor 3-dependent MyD88-independent pathway. J Immunol. 2004;173:7115-7119. [PubMed] |
| 5. | Tsung A, Hoffman RA, Izuishi K, Critchlow ND, Nakao A, Chan MH, Lotze MT, Geller DA, Billiar TR. Hepatic ischemia/reperfusion injury involves functional TLR4 signaling in nonparenchymal cells. J Immunol. 2005;175:7661-7668. [PubMed] |
| 6. | Uchida Y, Ke B, Freitas MC, Yagita H, Akiba H, Busuttil RW, Najafian N, Kupiec-Weglinski JW. T-cell immunoglobulin mucin-3 determines severity of liver ischemia/reperfusion injury in mice in a TLR4-dependent manner. Gastroenterology. 2010;139:2195-2206. [PubMed] [DOI] |
| 7. | Wang J, Zhao Y, Xu Q. Astilbin prevents concanavalin A-induced liver injury by reducing TNF-alpha production and T lymphocytes adhesion. J Pharm Pharmacol. 2004;56:495-502. [PubMed] |
| 8. | Tsuchihashi S, Zhai Y, Bo Q, Busuttil RW, Kupiec-Weglinski JW. Heme oxygenase-1 mediated cytoprotection against liver ischemia and reperfusion injury: inhibition of type-1 interferon signaling. Transplantation. 2007;83:1628-1634. [PubMed] |
| 9. | Sun K, Chen Y, Liang SY, Liu ZJ, Liao WY, Ou ZB, Tu B, Gong JP. Effect of taurine on IRAK4 and NF-kappa B in Kupffer cells from rat liver grafts after ischemia-reperfusion injury. Am J Surg. 2012;204:389-395. [PubMed] [DOI] |
| 10. | Xia Y, Rao J, Yao A, Zhang F, Li G, Wang X, Lu L. Lithium exacerbates hepatic ischemia/reperfusion injury by inhibiting GSK-3β/NF-κB-mediated protective signaling in mice. Eur J Pharmacol. 2012;697:117-125. [PubMed] [DOI] |
| 11. | Shi J, Li XH, Sun BC, Lin XT, Zhang XY, Zhang F, Ou K, Chen QP. [Protective functions of recombinant protein targeted at RANKL against hepatic ischemia/reperfusion injury transfected by retrovirus in mice]. Zhonghua Yixue Zazhi. 2011;91:2719-2724. [PubMed] |
| 12. | Yun N, Kang JW, Lee SM. Protective effects of chlorogenic acid against ischemia/reperfusion injury in rat liver: molecular evidence of its antioxidant and anti-inflammatory properties. J Nutr Biochem. 2012;23:1249-1255. [PubMed] [DOI] |