修回日期: 2013-10-12
接受日期: 2013-10-31
在线出版日期: 2013-12-18
目的: 探讨自身免疫性肝炎(autoimmune hepatitis, AIH)患者肝组织炎症分级和纤维化分期相关的血清学指标.
方法: 收集2003-04/2013-03在我院行肝穿刺活检的146例AIH患者的血清学指标与肝组织活检病理资料, 分析其血清学指标与肝组织分期分级的相关性.
结果: 血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、谷氨酰转肽酶(gamma-glutamyl transpeptidase, γ-GT)、碱性磷酸酶(alkaline phosphatase, ALP)、直接胆红素(direct bilirubin, DBIL)和部分凝血活酶时间(activated partial thromboplastin time, APTT)随肝脏炎症程度的加重而增高[相关系数(r)分别为0.232、0.245、0.204、0.255、0.241和0.236, P均<0.05], 血清白蛋白(albumin, ALB)与白蛋白/球蛋白(albumin-globulin ratio, A/G)随肝脏炎症程度的加重而降低(r分别为-0.245和-0.187, P均<0.05). 血清碱性磷酸酶、总蛋白、球蛋白、DBIL、凝血酶原时间、部分凝血活酶时间随肝脏纤维化程度加重而增高(r分别为0.224、0.184、0.419、0.197、0.290和0.382, P均<0.05), ALB和A/G随肝脏纤维化程度的加重而降低(r分别为-0.387和-0.526, P均<0.05). 分别将上述指标与AIH患者肝脏炎症分级和纤维化分期绘制ROC曲线, ALB和A/G在S0期受试者工作特征曲线(receiver operating characteristic curve, ROC)曲线下面积(area under curve, AUC)分别为0.755和0.809, 其余各项指标与肝脏炎症分级和纤维化分期绘制的AUC均<0.7.
结论: 血清学指标有助于判定AIH患者肝脏组织病理的分期和分级, 但存在较大局限性.
核心提示: 本研究发现, 对自身免疫性肝炎(autoimmune hepatitis, AIH)患者在无法行肝穿病理时, 密切监测血清学指标在一定程度上有助于判断疾病的进展, 但要确诊AIH患者肝组织炎症分级及纤维化分期, 从而选择合理的治疗方案, 肝活检是必不可少的.
引文著录: 郑聪, 褚燕君, 张芳宾, 李娅, 孙静. 自身免疫性肝炎患者血清学指标与肝活检病理的关系. 世界华人消化杂志 2013; 21(35): 3999-4005
Revised: October 12, 2013
Accepted: October 31, 2013
Published online: December 18, 2013
AIM: To explore the correlation of serum indexes with the degree of hepatic inflammation and fibrosis in patients with autoimmune hepatitis (AIH).
METHODS: Routine pathological examination of liver biopsies was performed in 146 patients with AIH) from 2003 to 2013, and serum liver function and coagulation function indexes were also recorded in these patients. The correlations between serum indexes and hepatic biopsy histopathology were assessed.
RESULTS: Serum alanine aminotransferase, aspartate aminotransferase, gamma-glutamyl transpeptidase, alkaline phosphatase, direct bilirubin and activated partial thromboplastin time were positively correlated with inflammatory grade [correlation coefficient (r) = 0.232, 0.245, 0.204, 0.255, 0.241 and 0.236, all P < 0.05], and serum albumin and albumin-globulin ratio were negatively correlated with inflammatory grade (r = -0.245 and -0.187, both P < 0.05). Serum alkaline phosphatase, total bilirubin, globulin, direct bilirubin, prothrombin time and activated partial thromboplastin time were positively correlated with fibrosis stage (r = 0.224, 0.184, 0.419, 0.197, 0.290 and 0.382, all P < 0.05), and serum albumin and albumin-globulin ratio were negatively correlated with fibrosis stage (r = -0.387 and -0.526, both P < 0.05). The receiver operating characteristic (ROC) curve was drawn between the above indicators and inflammation grade and fibrosis stage in patients with AIH. The area under the curve (AUC) of serum albumin and albumin-globulin ratio in S0 stage disease were 0.75 and 0.809, and the remaining indications had an AUC value < 0.7.
CONCLUSION: Serum indexes have limited but appreciated value in estimating inflammatory grade and fibrosis stage in patients with AIH.
- Citation: Zheng C, Chu YJ, Zhang FB, Li Y, Sun J. Correlation between serum indexes and hepatic biopsy histopathology in patients with autoimmune hepatitis. Shijie Huaren Xiaohua Zazhi 2013; 21(35): 3999-4005
- URL: https://www.wjgnet.com/1009-3079/full/v21/i35/3999.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i35.3999
自身免疫性肝炎(autoimmune hepatitis, AIH)是一种由自身免疫反应介导的慢性进行性肝脏炎症性疾病, 女性易患, 以不同程度的血清转氨酶升高、高γ-球蛋白、自身抗体阳性、肝组织学特征性改变和对免疫抑制治疗应答为特点. 本研究通过分析146例AIH患者肝功能、凝血功能各项指标与肝脏组织炎症分级和纤维化分期的关系, 以期找到有助于判定肝脏组织炎症分级和纤维化分期的血清学指标.
收集2003-04/2013-03郑州大学第一附属医院确诊为AIH并接受肝穿刺活检患者, 诊断标准依据国际自身免疫性肝炎小组(International Autoimmune Hepatitis Group, IAIHG)传统评分系统进行积分诊断[1], 总分在治疗前超过15分、治疗后超过17分为确定诊断的AIH, 治疗前10-15分、治疗后12-17分为可能的AIH. 剔除标准: (1)合并有大量饮酒(男>40 g/d, 女>20 g/d); (2)高血脂; (3)服用可引起肝功能损伤药物者; (4)合并遗传性代谢性肝病者; (5)肝炎病毒标记物阳性; (6)合并其他自身免疫性疾病者; (7)临床资料不全者.
登记患者性别、年龄、肝穿刺同期肝功能及凝血功能相关指标. 分别由本院2位病理科医师对患者病理切片进行复片, 按照慢性肝炎分期分级标准将标本分为G0-G4级和S0-S4期[2].
统计学处理 采用SPSS17.0软件对数据进行统计分析, 符合正态分布的变量以mean±SD表示, 非正态分布变量以中位数(最低值-最高值)表示, 等级资料间的比较采用Spearman秩相关分析, 多组均数间的比较采用方差分析, 非正态分布数据转换为正态分布后行方差分析、无法转换为正态分布时行非参数检验, 同时对各有意义指标在各分期分级行ROC曲线(receiver operating characteristic curve)分析, 以P<0.05为差异有统计学意义.
共有收集351例AIH患者, 146例接受了肝穿刺活检. 其中, 男性27例, 女性119例, 年龄12-75岁, 平均年龄47.48±15.75岁.
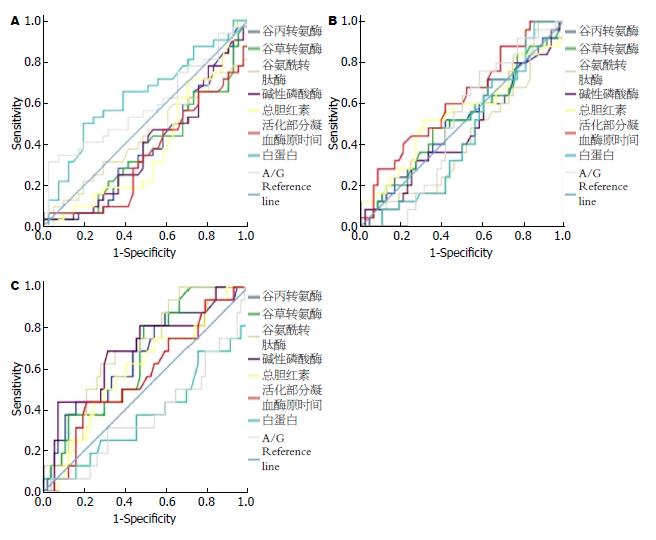
血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、谷氨酰转肽酶(gamma-glutamyl transpeptidase, γ-GT)、碱性磷酸酶(alkaline phosphatase, ALP)、直接胆红素(direct bilirubin, DBIL)和部分凝血活酶时间(activated partial thromboplastin time, APTT)随肝脏炎症程度的加重而增高[相关系数(r)分别为0.232、0.245、0.204、0.255、0.241和0.236, P值分别为0.005、0.003、0.013、0.002、0.003和0.004], 血清白蛋白(albumin, ALB)与白蛋白/球蛋白(albumin-globulin ratio, A/G)随肝脏炎症程度的加重而降低(r分别为-0.245和-0.187, P值分别为0.003和0.024). 而血清总胆红素(total bilirubin, TBIL)、间接胆红素(indirect bilirubin, IDBL)、总蛋白(total protein, TP)、球蛋白(globulin, GLB)、凝血酶原时间(prothrombin time, PT)、凝血酶原活动度(prothrombin activity, PTA)和纤维蛋白原(fibrinogen, FIB)与肝脏炎症程度无显著相关性(表1).
| 分级 | n | ALT(U/L) | AST(U/L) | γ-GT(U/L) | ALP(U/L) | TP(g/L) | ALB(g/L) | GLB(g/L) | A/G | TBIL(μmol/L) | DBIL(μmol/L) | IBIL(μmol/L) | PT(s) | PTA(%) | APTT(s) | FIB(g/L) |
| G0+1 | 64 | 59.5 (9.0-1585.0) | 63.0 (16.0-1317.0) | 78.0 (8.0-670.0) | 108.0 (44.0-903.0) | 76.3 (57.0-110.4) | 40.5 (27.8-47.5) | 37.5 (23.4-82.4) | 1.13± 0.39 | 13.6 (6.3-193.3) | 5.5 (2.0-108.0) | 9.0 (3.4-35.0) | 13.3 (10.1-17.7) | 94.0 (60.0-150.0) | 37.2 (22.5-58.5) | 2.8 (1.5-6.1) |
| G2 | 50 | 91.0 (6.0-806.0) | 94.0 (17.0-760.0) | 88.0 (19.0-538.0) | 114.0 (45.0-616.0) | 73.9 (56.9-106.1) | 37.1 (29.7-45.6) | 34.7 (25.8-70.4) | 1.02± 0.20 | 24.2 (4.0-390.4) | 8.5 (1.2-270.9)a | 14.4 (1.9-119.5) | 13.1 (10.6-16.0) | 91.2 (65.8-150.0) | 38.5 (28.4-59.1)a | 2.7 (1.7-5.5) |
| G3+4 | 32 | 116.5 (10.0-1051.0)ac | 91.0 (34.0-600.0)a | 166.5 (42.0-911.0)ac | 151.5 (68.0-400.0)ac | 76.2 (61.6-89.7) | 34.9 (23.1-51.4)a | 38.4 (27.6-56.5) | 0.94± 0.33a | 25.1 (7.4-173.8) | 8.8 (2.2-137.0)a | 12.8 (2.5-39.4) | 13.3 (11.7-20.1) | 97.0 (48.0-129.0) | 38.7 (25.6-52.2)a | 2.8 (1.3-4.0) |
| F值 | 4.48 | 4.678 | 8.3 | 5.178 | 0.61 | 3.565 | 1.481 | 3.356 | 2.356 | 4.785 | - | - | - | - | - | |
| P值 | 0.013 | 0.011 | 0.001 | 0.007 | 0.545 | 0.033 | 0.233 | 0.04 | 0.099 | 0.01 | 0.075 | 0.262 | 0.965 | 0.005 | 0.55 |
进一步分析显示血清ALT、AST、γ-GT、ALP、DBIL和APTT在肝脏组织炎症分级为G3+4组患者的中位值均显著高于G0+1组(P分别为0.003、0.003、0.002、0.002、0.007和0.020); 血清ALT、γ-GT和ALP在G3+4组患者中的中位值均显著高于G2组(P分别为0.040、0.003和0.026); DBIL和APTT在G2组患者中的中位值均显著高于G0+1组(P分别为0.019和0.003). 而ALB与A/G在G3+4组患者中的中位值显著低于G0+1组患者(P值分别为0.033和0.040)(表1).
分别将上述指标与AIH患者肝脏各级炎症绘制ROC曲线, 曲线下面积(AUC)均<0.7(图1).
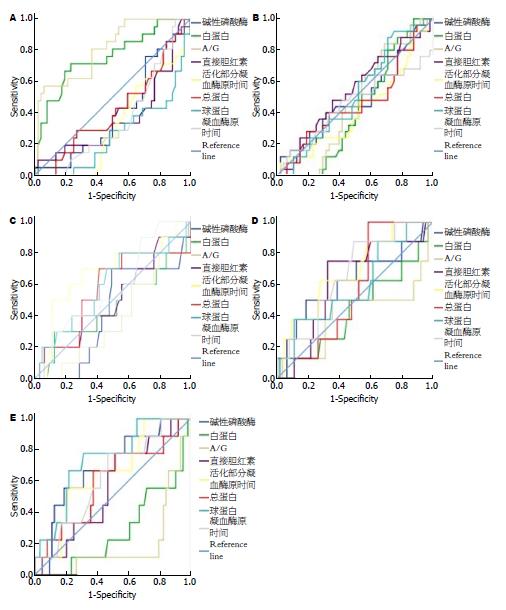
血清ALP、TP、GLB、DBIL、PT和APTT随肝脏纤维化程度加重而增高(r分别为0.224、0.184、0.419、0.197、0.290和0.382, P分别为0.006、0.026、0.000、0.017、0.000和0.000), 血清ALB、A/G随肝脏纤维化程度加重而降低(r分别为-0.387和-0.526, P分别为0.000和0.000). 而血清ALT、AST、γ-GT、TBIL、IBIL、PTA和FIB与肝脏纤维化程度无显著相关性(表2).
| 分期 | n | ALT(U/L) | AST(U/L) | γ-GT(U/L) | ALP(U/L) | IBIL(μmol/L) | TP(g/L) | ALB(g/L) | GLB(g/L) | A/G | TBIL(μmol/L) | DBIL(μmol/L) | PT(s) | PTA(%) | APTT(s) | FIB(g/L) |
| S0 | 42 | 66.0 (9.0-1585.0) | 63.0 (16.0-474.0) | 74.0 (8.0-670.0) | 103.0 (44.0-903.0) | 9.0 (1.9-119.5) | 74.6 (59.1-85.9) | 41.3 (30.9-47.5) | 30.1 (23.4-45.6) | 1.31± 0.33 | 13.0 (4.7-390.4) | 4.3 (2.2-270.9) | 12.6 (11.1-14.8) | 94.7 (76.0-150.0) | 37.2 (22.5-41.2) | 2.8 (1.4-6.1) |
| S1 | 50 | 91.0 (6.0-806.0) | 84.0 (20.0-1317.0) | 113.0 (10.0-771.0) | 112.0 (58.0-616.0) | 11.0 (2.1-33) | 72.7 (60.6-90.7) | 38.1 (29.3-41.7) | 36.3 (26.2-51.9)a | 1.00± 0.19a | 17.1 (4.0-233.4) | 6.9 (1.9-217.7) | 13.3 (10.1-17.7) | 94.0 (60.0-150.0) | 37.2 (25.5-58.5) | 2.7 (1.5-5.5) |
| S2 | 20 | 90.5 (8.0-215.0) | 101.5 (17.0-298.0) | 115.5 (19.0-290.0) | 120.5 (45.0-175.0)ab | 7.0 (2.5-35) | 78.5 (56.9-95.2)ac | 37.6 (23.1-45.6)ac | 40.1 (25.8-56.5)a | 0.94± 0.24a | 12.3 (6.8-193.3) | 6.0 (1.2-108.8)ac | 13.3 (11.9-16.0)ac | 87.5 (69.0-123.0) | 43.5 (26.5-48.3)ac | 2.2 (2.0-4.6) |
| S3 | 16 | 103.0 (25.0-1051.0) | 87.5 (32.0-600.0) | 104.0 (35.0-297.0) | 169.5 (61.0-344.0)ab | 16.0 (5.0-39.4) | 76.2 (72.9-106.1)ac | 37.4 (26.8-51.4)ac | 38.0 (29.4-70.4)a | 0.96± 0.42a | 26.5 (9.0-120.9) | 10.3 (2.2-81.5)ac | 14.1 (12.0-17.5)ac | 86.5 (57.0-124.0) | 41.2 (33.6-52.2)ac | 2.8 (1.3-3.7) |
| S4 | 18 | 66.0 (26.0-283.0) | 84.0 (33.0-361.0) | 138.0 (60.0-911.0) | 205.0 (72.0-336.0)ab | 9.0 (2.7-37.0) | 78.5 (61.6-110.4)ac | 34.5 (24.4-41.6)ac | 43.3 (32.9-82.4)ac | 0.77± 0.24ac | 16.9 (6.3-173.8) | 6.4 (2.9-137)ac | 13.8 (11.7-20.1)ac | 94.0 (48.0-129.0) | 41.7 (34.7-59.1)ac | 3.2 (1.4-4.8) |
| F值 | 1.04 | 2.352 | 2.349 | - | - | - | - | 8.518 | 13.105 | - | - | 5.375 | 1.536 | - | - | |
| P值 | 0.389 | 0.057 | 0.065 | 0.009 | 0.376 | 0.029 | 0 | 0 | 0 | 0.112 | 0.016 | 0.001 | 0.195 | 0 | 0.653 |
进一步分析显示, 血清ALP、TP、DBIL、PT和APTT在肝脏纤维化分期为S2、S3和S4期的患者中的中位值均显著高于纤维化分期S0和S1期(P均<0.05); 血清ALB在纤维化分期S2、S3和S4期患者中的中位值均显著低于S0和S1期患者(P均<0.000); 血清GLB在肝脏纤维化分期为S1、S2、S3和S4期的患者中的中位值均显著高于纤维化分期S0期(P分别为0.003、0.001、0.000和0.000), 在纤维化分期为S4期患者中位值显著高于S1期(P = 0.003); 血清A/G在肝脏纤维化分期为S1、S2、S3和S4期的患者的中位值均显著低于纤维化分期S0期(P = 0.000、0.046、0.000和0.000), 在纤维化分期为S4期患者中位值显著低于S1期(P = 0.010)(表2).
分别将上述指标与AIH患者肝脏纤维化分期绘制ROC曲线, ALB和A/G在S0期AUC分别为0.755和0.809(P均<0.000). 95%置信区间分别为(0.665-0.845)和(0.733-0.884), 提示ALB和A/G对S0期AIH患者诊断价值较高. 根据ROC曲线得出ALB和A/G分别为40.05和1.27 g/L时Youden指数最高, 可作为S0期的诊断指标, 判定S0期的敏感度分别为71.4%和57.1%, 特异度分别为76.9%和94.2%. 其余各项指标与肝脏纤维化分期绘制的ROC下面积均<0.7(图2).
肝纤维化是肝脏在对损伤慢性修复过程中细胞外基质过度增生与异常沉积所致肝脏结构和肝功能异常改变的一种病理过程. 反复的肝组织炎症活动导致并加重肝纤维化的形成.
AIH临床表现及诊断复杂, 有时因难以判断病情而延误治疗. 肝组织病理学检查是诊断AIH的必备条件[3,4], 但由于肝活检创伤性较大、患者依从性差以及取样误差等问题, 其临床应用受到限制[5]. 鉴于肝活检在临床上推广与应用的局限性, 目前国内外很多专家学者正致力于无创性肝纤维化诊断模型的研究, 并已建立多个肝纤维化非创伤性综合指标诊断模型, 主要的预测模型有FT和AT指标[6], PRI模型[7]、FibroSpect Ⅱ模型[8]、欧洲肝纤维化组(European Liver Fibrosis Group, ELFG)模型[9]、上海肝纤维化组(SLFG)模型[10]、Fibrolndex模型[11]等, 上述模型对于AIH患者诊断的准确率、灵敏度和特异度还有待于深入研究. 而对AIH患者血清学指标与肝组织炎症及纤维化程度关系的分析的研究尚未见报道. 作者试图通过本研究找到有助于判定肝脏组织病理分级分期的血清学指标, 作为AIH患者肝脏炎症及纤维化的早期预测、判断疾病进展及评估疗效的参考.
本研究结果显示, 在血清学的各项指标中, ALT、AST、γ-GT、ALP、DBIL、ALB、A/G和APTT有助于判断AIH患者肝脏炎症程度, ALP、TP、ALB、GLB、A/G、DBIL、PT和APTT对纤维化进展有评估作用, 同时对于AIH患者, 当ALB<40.05 g/L和A/G<1.27时应注意早期肝硬化的发生, 需及时行抗纤维化治疗, 延缓和阻断肝硬化进程. 本研究也发现上述指标对炎症分级及纤维化分期谱的两极辨别作用较好, 而对中等程度的炎症及纤维化鉴别能力欠佳, 并不能进行精确的分级和分期, 这与Bissell的对肝纤维化的研究一致[12]. 同时, 通过对肝脏病理分级分期ROC曲线分析可见, 只有ALB和A/G对S0期AIH患者诊断价值较高(AUC>0.7), 其余各指标对分期分级的诊断价值较低(AUC<0.7). 基于此, 我们认为上述血清学指标对AIH患者肝组织炎症分级及纤维化分期的评估有一定的意义, 但仍存在较大局限性. 这与一些学者对慢性乙型肝炎的研究一致[13-15].
总之, 我们认为, 对AIH患者在无法行肝穿病理时, 密切监测血清学指标在一定程度上有助于判断疾病的进展, 但要确诊AIH患者肝组织炎症分级及纤维化分期, 从而选择合理的治疗方案, 肝活检是必不可少的.
自身免疫性肝炎(autoimmune hepatitis, AIH)临床表现及诊断复杂, 肝活检在临床应用较局限, 作者试图通过本研究找到有助于判定肝脏组织病理分级分期的血清学指标.
胡国信, 主任医师, 副教授, 南昌大学第一附属医院传染科
目前国内外很多专家学者正致力于无创性肝纤维化诊断模型的研究, 并已建立多个肝纤维化非创伤性综合指标诊断模型, 而对AIH患者血清学指标与肝组织炎症及纤维化程度关系的分析的研究尚未见报道.
目前国内外很多专家已建立多个肝纤维化非创伤性综合指标诊断模型, 如Imbert-Bismut等的FT和AT指标, Wai等的PRI模型, Patel等的FibroSpect Ⅱ模型等.
本文对AIH患者血清学指标与肝组织炎症及纤维化程度关系的研究, 以期通过临床最常见的血清学指标评价AIH患者肝脏炎症及纤维化程度.
监测血清学指标在一定程度上有助于判断AIH患者疾病的进展, 但肝活检仍是必不可少的.
本文对临床有一定的指导意义, 是一篇较好论文.
编辑: 郭鹏 电编:鲁亚静
| 1. | Alvarez F, Berg PA, Bianchi FB, Bianchi L, Burroughs AK, Cancado EL, Chapman RW, Cooksley WG, Czaja AJ, Desmet VJ. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatol. 1999;31:929-938. [PubMed] [DOI] |
| 3. | Johnson PJ, McFarlane IG. Meeting report: International Autoimmune Hepatitis Group. Hepatology. 1993;18:998-1005. [PubMed] [DOI] |
| 4. | Czaja AJ. The variant forms of autoimmune hepatitis. Ann Intern Med. 1996;125:588-598. [PubMed] [DOI] |
| 6. | Imbert-Bismut F, Ratziu V, Pieroni L, Charlotte F, Benhamou Y, Poynard T. Biochemical markers of liver fibrosis in patients with hepatitis C virus infection: a prospective study. Lancet. 2001;357:1069-1075. [PubMed] [DOI] |
| 7. | Wai CT, Greenson JK, Fontana RJ, Kalbfleisch JD, Marrero JA, Conjeevaram HS, Lok AS. A simple noninvasive index can predict both significant fibrosis and cirrhosis in patients with chronic hepatitis C. Hepatology. 2003;38:518-526. [PubMed] [DOI] |
| 8. | Patel K, Gordon SC, Jacobson I, Hézode C, Oh E, Smith KM, Pawlotsky JM, McHutchison JG. Evaluation of a panel of non-invasive serum markers to differentiate mild from moderate-to-advanced liver fibrosis in chronic hepatitis C patients. J Hepatol. 2004;41:935-942. [PubMed] [DOI] |
| 9. | Rosenberg WM, Voelker M, Thiel R, Becka M, Burt A, Schuppan D, Hubscher S, Roskams T, Pinzani M, Arthur MJ. Serum markers detect the presence of liver fibrosis: a cohort study. Gastroenterology. 2004;127:1704-1713. [PubMed] |
| 10. | Zeng MD, Lu LG, Mao YM, Qiu DK, Li JQ, Wan MB, Chen CW, Wang JY, Cai X, Gao CF. Prediction of significant fibrosis in HBeAg-positive patients with chronic hepatitis B by a noninvasive model. Hepatology. 2005;42:1437-1445. [PubMed] [DOI] |
| 11. | Koda M, Matunaga Y, Kawakami M, Kishimoto Y, Suou T, Murawaki Y. FibroIndex, a practical index for predicting significant fibrosis in patients with chronic hepatitis C. Hepatology. 2007;45:297-306. [PubMed] [DOI] |
| 12. | Bissell DM. Assessing fibrosis without a liver biopsy: are we there yet? Gastroenterology. 2004;127:1847-1849. [PubMed] |