修回日期: 2013-10-04
接受日期: 2013-11-11
在线出版日期: 2013-12-18
目的: 近年来, 电子显微技术在生物学领域得到了广泛的应用. 本文利用生物电镜技术对福氏志贺氏菌外膜结构进行了研究, 并对比不同制样方法对电镜照片的影响.
方法: 将各志贺氏菌分别在30 ℃和37 ℃的环境中培养, PCR检测毒力大质粒是否在传代中丢失. 培养至稳定期后, 收集菌液, 分别用非高渗和高渗固定液固定, 制备切片, 使用电子显微镜观察细菌外膜结构.
结果: 在高渗透压环境下制样能使细胞质发生皱缩, 有利于对细胞表面超微结构的观察. 通过电镜图片对比, 发现在37 ℃时, 三株福氏志贺氏菌外膜脂多糖丰度均少于30 ℃.
结论: 高渗透压方法比普通制样方法更有利于对细菌表面超微结构进行观察. 通过对电镜照片的观察, 可以认为福氏志贺氏菌在不同培养温度下脂多糖的相对密度有所差异.
核心提示: 在高渗透压环境下制样能使细胞质发生皱缩, 比普通制样方法更有利于对细菌表面超微结构进行观察. 通过电镜图片对比, 发现在37 ℃时, 三株福氏志贺氏菌外膜脂多糖丰度均少于30 ℃. 可以认为福氏志贺氏菌在不同培养温度下脂多糖的相对密度有所差异.
引文著录: 牛小羽, 牛畅, 冯尔玲, 刘先凯, 朱力, 张玫. 高渗透压法制备细菌外膜扫描电镜样品. 世界华人消化杂志 2013; 21(35): 3994-3998
Revised: October 4, 2013
Accepted: November 11, 2013
Published online: December 18, 2013
AIM: To compare different methods for preparation of samples for electron microscopic observation of Shigella flexneri surface structures.
METHODS: Three Shigella flexneri strains were cultured and used to prepare samples for electron microscopy. Samples were prepared in different osmotic environments. The obtained electron micrographs were compared to obtain the optimal sample preparation conditions.
RESULTS: Hyperosmotic environment in sample preparation often makes cytoplasmic shrinkage occur, which is beneficial for cell surface ultrastructure observation. By comparing the electron microscopic pictures of the three strains of Shigella flexneri, we found that the abundance of bacterial lipopolysaccharides (LPS) was less at 37 ℃ than that at 30 ℃.
CONCLUSION: High osmotic pressure sample preparation is better than common methods in observing bacterial cell surface ultrastructures. Using this sample preparation method, electron microscopy analysis revealed that the relative density of LPS of Shigella flexneri varied among different culture temperatures.
- Citation: Niu XY, Niu C, Feng EL, Liu XK, Zhu L, Zhang M. Preparation of samples for electron microscopy by high osmotic pressure method. Shijie Huaren Xiaohua Zazhi 2013; 21(35): 3994-3998
- URL: https://www.wjgnet.com/1009-3079/full/v21/i35/3994.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i35.3994
由于当前大部分的分子生物学研究是在体外进行的, 而真正的生物学现象发生在个体和细胞内部. 因此, 利用生物电镜技术在细胞水平对生物形态、结构以及功能进行研究, 促进了生物科学研究的发展, 也为电子显微技术开辟了新的天地. 目前, 生物电镜技术已在细胞病理诊断、免疫抗原定位以及胞内基因及其产物定位等方面开展了研究.
志贺氏菌属(Shigella Spp.)是人类细菌性痢疾最为常见的病原菌, 通过Ⅲ型系统分泌蛋白于人类细胞中, 导致炎症应答. 痢疾持续的高发病率和不断出现的多重耐药菌株意味着志贺氏菌病仍是一个尚未解决的全球性健康问题[1], 已有研究将生物电镜技术应用于志贺氏菌表面脂多糖(lipopolysaccharides, LPS)抗原定位[2]以及Ⅲ型分泌系统(type three secretion system, T3SS)的形态结构分析[3]. LPS是革兰氏阴性菌外膜的重要组成成分, 是细菌的一层保护性屏障, 防御外界环境中的不利因素对细菌的杀伤作用[4]. 志贺氏菌LPS的结构从内到外依次为脂质A(lipid A)、内核(core oligosaccharide)和暴露在细菌表面的O-抗原(O-antigen)多糖链三部分. 其中O-抗原由多个拷贝的寡糖重复单位(repeat unit, RU)聚合而成, 构成了病原菌的一个重要的致病因子[5-7]. O-抗原连接酶由位于核心寡糖core合成途径中的相关基因组成的waa基因簇中的基因waaL编码, 他负责将O-PS连接到脂质A-核心寡糖上形成LPS[8-10]. 因此, 在志贺氏菌中waaI基因的缺失, 会导致LPS合成失败.
本实验室的前期工作揭示了一种全新的福氏志贺氏菌LPS合成的调控机制, 即不同培养温度下LPS合成的相对密度有所差异. 但研究对象仅涉及一株福氏志贺氏菌, 为了验证这一现象是否在不同菌株间存在共性, 本研究利用高渗透压方法对三株福氏志贺氏菌外膜LPS进行了分析.
福氏2a型志贺氏菌2457T、福氏2a型志贺氏菌301、福氏5a型志贺氏菌M90T以及301ΔwaaI均由本实验室保存. 胰酪胨大豆琼脂(tryptose soya agar, TSA)固体培养基: 4%TSA、0.01%刚果红. LB(Luria-Bertani)培养基: 1%NaCl、1%胰蛋白胨、0.5%酵母提取物. NaI抗生素溶液(30 mg/mL). 固定液A(用于制备非高渗透压样品): 10 mL 40%戊二醛, 用0.1 mol/L PBS缓冲液(pH 7.2)稀释至100 mL. 固定液B(用于制备高渗透压样品): 10 mL 40%戊二醛, 用1 mol/L PBS缓冲液(pH 7.2)稀释至100 mL.
1.2.1 细菌培养: 将各菌株分别在含有0.01%刚果红的TSA平板上划线30 ℃培养箱培养24 h, 挑取单克隆接入按照1:1000加入抗生素的5 mL新鲜LB培养基中, 30 ℃ 220 r/min摇床振荡培养12 h, 转接2次, 并分别用IpaA、IpgB、MixD、VirG 4个毒力相关基因的引物进行PCR, 检测毒力大质粒是否在传代中丢失. 验证正确后按1/100的接种量接种于5 mL新鲜LB培养基中, 37 ℃ 220 r/min摇床振荡培养至稳定期.
1.2.2 样品制备: 收集在不同温度下培养至稳定期的菌液1 mL, 3000 g离心5 min, 0.1 mol/L的PBS缓冲液(pH 7.2)洗1次, 同一温度培养的菌体分别在固定液A或固定液B中室温固定1 h. 固定后样品用0.1 mol/L PBS缓冲液清洗5次, 1%(W/V)的四氧化锇再次固定2 h, 0.1 mol/L PBS缓冲液清洗5次. 样品通过不同浓度梯度酒精(500、750、850及950 mL/L)脱水, 每个浓度15 min, 然后在无水乙醇中洗3次, 每次15 min. 样品包埋在树脂中, 切片后用乙酸双氧铀和枸橼酸铅染色.
1.2.3 电镜观察: 样品在电子显微镜80 kV下观察.
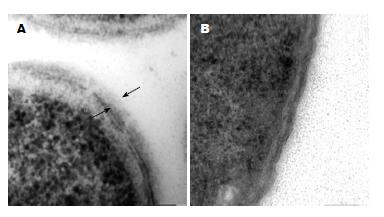
前面已经介绍缺失waaI基因后301菌株无法合成LPS, 因此我们首先在电镜下观察了301ΔwaaI以及相应的301野生株细胞表面LPS的合成情况. 结果与我们预期的一致301ΔwaaI菌株细胞外膜表面是裸露的, 而301野生株细胞壁表面覆盖了绒毛状的一层, 两个箭头间即为菌株LPS层(图1).
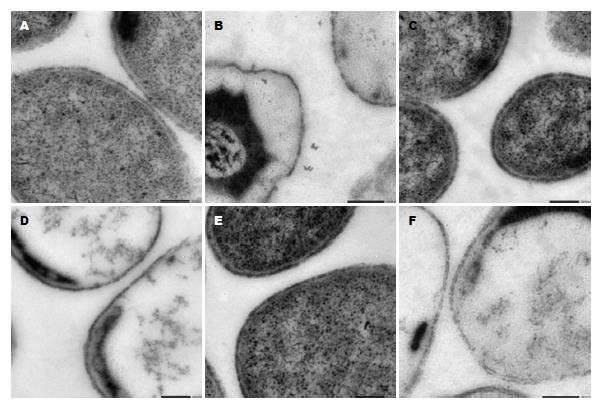
由于LPS和T3SS都位于细胞表面, 为了更清晰的观察细胞表面的超微结构, 我们对生物电镜制样方法进行了改进, 首次在高渗透压环境中制样. 我们采用了1 mol/L的PB缓冲液配制戊二醛固定液, 从而形成高渗透压的环境, 使细胞质发生皱缩, 与细胞壁分离开来. 同时也用0.1 mol/L的PB缓冲液制备了正常环境条件下的细胞样品作为对照, 观察高渗透压环境是否会对细胞表面结构产生影响. 结果如图2所示, 在高渗透压环境下细胞质与细胞壁分离, 更便于观察细胞表面结构. 而在非高渗透压环境下细胞质与细胞壁连接在一起, 不能够清晰的辨识细胞表面超微结构, 同时高渗透压环境并未对细胞表面结构产生影响.
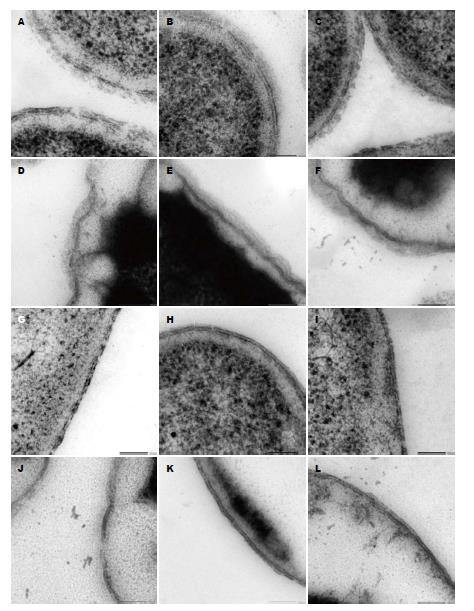
已有文献报道, 志贺氏菌在37 ℃时具有完整的侵袭能力, 而在30 ℃时不能够侵袭上皮细胞[11]. 从图3高渗透压环境制样照片中可以看出, 30 ℃培养时, 细胞表面LPS更容易看到.
为了便于观察志贺氏菌细胞表面的T3SS, 2005年Kenjale等[3]就采用了释放细胞内溶物的方法进行制样. 我们在本文中采用的高渗透压使胞质皱缩的制样方法与释放内溶物的制样方法有异曲同工之妙, 而且省去了释放内溶物方法的繁琐步骤, 更为简化有效.
本实验室成功构建的waaI缺失突变株银染后没有一长串的阶梯状条带, 而且缺失突变株不能引起豚鼠角膜炎症反应, 表明了LPS的缺失的确影响了志贺氏菌的侵袭能力[12]. West等[13]的研究发现, 志贺氏菌通过糖基化改变LPS的结构调节T3SS针状结构暴露在膜外的长度, 从而促进对靶细胞的侵袭能力, 同时若LPS分子太短又无法发挥自身防御的功能, 因此LPS的合成受到复杂而精密的调控. Martinić等[14]也证实了O-抗原的长度、分布以及糖基化都与肠道菌抗酸性相关, 同时pH值也会影响LPS的长度. LPS和T3SS功能间的关系就像剑和盾一样, 要调整好LPS糖链对病原菌逃避宿主胃部极酸环境和免疫系统伤害的保护作用(盾)与T3SS针状结构的侵袭功能(剑)之间的平衡关系, 因为二者对于志贺氏菌毒力的发挥都是必不可少的[15]. 我们的研究揭示了一种全新的细菌LPS合成的调控机制, 即不同培养温度下LPS合成的相对密度有所差异. 这一现象的一种可能解释是: 37 ℃时T3SS针筒的组装占据了细胞壁上很多空间, 因此降低了LPS的表达. 同时, 通过对普通扫描电镜制样方法的简单改进, 我们发现在高渗透压环境下制备样品, 细胞质发生皱缩, 从而更便于观察细菌细胞表面的LPS.
由细菌、病毒或寄生虫病原体引起的腹泻性疾病是主要的公共健康问题. 据世界卫生组织(WHO)统计, 2002年全世界有4.5亿例患腹泻性疾病, 共造成180万例死亡. 卫生条件差和污染的饮用水促进了肠道疾病的传播, 营养不良和缺乏适当的医疗条件造成了高死亡率. 志贺氏菌属是最常见的引起腹泻的病原菌, 其死亡率高且患者多为5岁以下儿童. 不断出现的多重耐药菌株和持续的高发病率意味着志贺氏菌病仍是一个尚未解决的全球性健康问题.
谭周进, 教授, 湖南中医药大学
LPS和T3SS功能间的关系就像剑和盾一样, 二者对于志贺氏菌毒力的发挥都是必不可少的, 因此要调整好LPS糖链对病原菌逃避宿主胃部极酸环境和免疫系统伤害的保护作用(盾)与T3SS针状结构的侵袭功能(剑)之间的平衡关系. 近年来, 电子显微技术在生物学领域得到了广泛的应用. 已有研究利用释放细胞内溶物的制样方法, 观察志贺氏菌细胞表面的T3SS以及LPS.
志贺氏菌通过糖基化改变LPS的结构调节T3SS针状结构暴露在膜外的长度, 从而促进对靶细胞的侵袭能力, 同时若LPS分子太短又无法发挥自身防御的功能, 因此LPS的合成受到复杂而精密的调控. O-抗原的长度、分布以及糖基化都与肠道菌抗酸性相关, 同时pH值也会影响LPS的长度. 已有研究将生物电镜技术应用于志贺氏菌表面LPS抗原定位以及T3SS的形态结构分析.
我们的研究揭示了一种全新的细菌LPS合成的调控机制, 即不同培养温度下LPS合成的相对密度有所差异. 同时我们对生物电镜制样方法进行了改进, 首次在高渗透压环境中制样, 使细胞质发生皱缩与细胞壁分离开来, 更便于观察细胞表面结构.
本文对高渗透压法制备扫描电镜样品与普通方法制备扫描电镜样品的优越性进行了比较, 为细菌外膜的电镜观察提供了一种实用的好制样方法, 实验设计正确, 分析透彻, 书写流畅.
编辑: 郭鹏 电编:鲁亚静
| 2. | Robinson EN, McGee ZA, Kaplan J, Hammond ME, Larson JK, Buchanan TM, Schoolnik GK. Ultrastructural localization of specific gonococcal macromolecules with antibody-gold sphere immunological probes. Infect Immun. 1984;46:361-366. [PubMed] |
| 3. | Kenjale R, Wilson J, Zenk SF, Saurya S, Picking WL, Picking WD, Blocker A. The needle component of the type III secreton of Shigella regulates the activity of the secretion apparatus. J Biol Chem. 2005;280:42929-42937. [PubMed] [DOI] |
| 4. | Trent MS, Stead CM, Tran AX, Hankins JV. Diversity of endotoxin and its impact on pathogenesis. J Endotoxin Res. 2006;12:205-223. [PubMed] [DOI] |
| 5. | Freudenberg MA, Tchaptchet S, Keck S, Fejer G, Huber M, Schütze N, Beutler B, Galanos C. Lipopolysaccharide sensing an important factor in the innate immune response to Gram-negative bacterial infections: benefits and hazards of LPS hypersensitivity. Immunobiology. 2008;213:193-203. [PubMed] [DOI] |
| 6. | Beutler B. LPS in microbial pathogenesis: promise and fulfilment. J Endotoxin Res. 2002;8:329-335. [PubMed] [DOI] |
| 7. | Hug I, Feldman MF. Analogies and homologies in lipopolysaccharide and glycoprotein biosynthesis in bacteria. Glycobiology. 2011;21:138-151. [PubMed] [DOI] |
| 8. | Feldman MF, Wacker M, Hernandez M, Hitchen PG, Marolda CL, Kowarik M, Morris HR, Dell A, Valvano MA, Aebi M. Engineering N-linked protein glycosylation with diverse O antigen lipopolysaccharide structures in Escherichia coli. Proc Natl Acad Sci U S A. 2005;102:3016-3021. [PubMed] [DOI] |
| 9. | Wacker M, Feldman MF, Callewaert N, Kowarik M, Clarke BR, Pohl NL, Hernandez M, Vines ED, Valvano MA, Whitfield C. Substrate specificity of bacterial oligosaccharyltransferase suggests a common transfer mechanism for the bacterial and eukaryotic systems. Proc Natl Acad Sci U S A. 2006;103:7088-7093. [PubMed] [DOI] |
| 10. | Whitfield C, Amor PA, Köplin R. Modulation of the surface architecture of gram-negative bacteria by the action of surface polymer: lipid A-core ligase and by determinants of polymer chain length. Mol Microbiol. 1997;23:629-638. [PubMed] |
| 11. | Zhu L, Zhao G, Stein R, Zheng X, Hu W, Shang N, Bu X, Liu X, Wang J, Feng E. The proteome of Shigella flexneri 2a 2457T grown at 30 and 37 degrees C. Mol Cell Proteomics. 2010;9:1209-1220. [PubMed] [DOI] |
| 13. | West NP, Sansonetti P, Mounier J, Exley RM, Parsot C, Guadagnini S, Prévost MC, Prochnicka-Chalufour A, Delepierre M, Tanguy M. Optimization of virulence functions through glucosylation of Shigella LPS. Science. 2005;307:1313-1317. [PubMed] [DOI] |
| 14. | Martinić M, Hoare A, Contreras I, Alvarez SA. Contribution of the lipopolysaccharide to resistance of Shigella flexneri 2a to extreme acidity. PLoS One. 2011;6:e25557. [PubMed] [DOI] |
| 15. | Martinez-Argudo I, Blocker AJ. The Shigella T3SS needle transmits a signal for MxiC release, which controls secretion of effectors. Mol Microbiol. 2010;78:1365-1378. [PubMed] [DOI] |