修回日期: 2013-10-17
接受日期: 2013-10-30
在线出版日期: 2013-12-18
目的: 研究非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)家兔肠道菌群的改变, 并分析菌群与肠黏膜Toll样受体4(Toll-like receptor 4, TLR4)间的关系.
方法: 14只♂新西兰家兔随机分成对照组及模型组, 对照组给以普通饲料, 模型组给以高脂饲料, 喂养12 wk后处死. 取肝脏组织行HE染色观察肝脏, 取回肠组织行免疫组织化学观察肠黏膜TLR4的定位及表达, 取肠内容物行实时荧光定量-聚合酶链反应(RT-PCR)检测肠内容物中大肠杆菌、乳酸杆菌、双歧杆菌拷贝数的变化. 用多元线性回归分析肠道菌群的改变对肠黏膜TLR4表达的影响.
结果: 与对照组相比, 模型组家兔肠腔中大肠杆菌数量增多(t = -3.492, P = 0.008), 而乳酸杆菌(t = -1.848, P = 0.089)、双歧杆菌(t = -1.059, P = 0.311)数量无明显改变, 肠黏膜TLR4表达升高(t = -4.089, P = 0.002), 回归分析显示大肠杆菌、双歧杆菌对肠黏膜TLR4表达有明显影响(R2 = 0.598, F = 8.167, P = 0.007); 双歧杆菌与TLR4呈负相关(标准化β = -0.475), 大肠杆菌与TLR4呈正相关(标准化β = 0.554). 而乳酸杆菌与TLR4无明显相关性.
结论: NAFLD家兔存在肠道菌群失调, 且对肠道TLR4的表达有显著影响.
核心提示: 非酒精性脂肪肝(non-alcoholic fatty liver disease, NAFLD)家兔存在肠道菌群失调, 这与肠黏膜Toll样受体4(Toll-like receptor 4)表达上调有密切关系, 可能对NAFLD发病及进展有一定作用.
引文著录: 王海昆, 杨涛, 姚萍. NAFLD家兔肠道菌群与肠黏膜Toll样受体4的关系. 世界华人消化杂志 2013; 21(35): 3988-3993
Revised: October 17, 2013
Accepted: October 30, 2013
Published online: December 18, 2013
AIM: To explore the alterations in intestinal flora and analyze the association of intestinal flora with intestinal mucosa Toll-like receptor 4 (TLR4) in rabbits with nonalcoholic fatty liver disease (NAFLD).
METHODS: Fourteen male New Zealand rabbits were randomly divided into two groups: a control group and a NAFLD group. The control group was given a normal diet while the NAFLD group was given a high fat diet. The rabbits were sacrificed 12 weeks later. Immunohistochemical staining was performed to observe the location and expression of TLR4 in ileal tissue. Real-time fluorescence quantitative polymerase chain reaction was used to detect the number of Escherichia coli (E. coli), bifidobacteria, and lactobacilli in the ileum. Stepwise multiple linear regression was performed to analyze the relationship between intestinal flora and TLR4.
RESULTS: Compared with the control group, the number of E. coli in the NAFLD group increased significantly (t = -3.492, P = 0.008), but the number of bifidobacteria (t = -1.059, P = 0.311) and lactobacilli (t = -1.848, P = 0.089) had no significant differences between the two groups. The expression of TLR4 was significantly increased (t = -4.089, P < 0.01) in the NAFLD group. Regression analysis revealed that E. coli and bifidobacteria were closely related to TLR4 expression (R2 = 0.598, F = 8.167, P = 0.007). Although the number of E. coli had a positive correlation with TLR4 expression (standardized beta = 0.554) and that of bifidobacteria had a negative correlation with TLR4 expression (standardized beta = -0.475), the number of lactobacilli had no significant correlation with TLR4 expression.
CONCLUSION: Intestinal flora imbalance was observed in rabbits with NAFLD, and it had an obvious influence on the expression of TLR4.
- Citation: Wang HK, Yang T, Yao P. Association between intestinal flora and Toll-like receptor 4 in rabbits with nonalcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2013; 21(35): 3988-3993
- URL: https://www.wjgnet.com/1009-3079/full/v21/i35/3988.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i35.3988
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是指除外酒精和其他明确肝脏损伤因素所致的, 以弥漫性肝细胞大泡性脂肪变性为病理特征的临床综合征. 其疾病谱包括单纯性脂肪肝、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH)及与之相关的肝硬化、肝细胞癌[1]. 该病目前在西方人群中患病率约20%-30%, 亚太地区患病率接近12%-24%[2], 是目前重要的公共健康问题之一. 许多研究均指出肠道菌群失调与NAFLD发病有密切的关系, 肠道中革兰阴性菌代谢产物脂多糖可诱发肠源性内毒素血症, 进而导致胰岛素抵抗(insulin resistance, IR). 多项动物实验已证实, 脂多糖-Toll样受体4(Toll-like receptor 4, TLR4)-CD14通路参与了IR的形成过程[3], 而IR在NAFLD发病中的作用已被证实, 本文通过分析NAFLD家兔肠道菌群改变与TLR4之间的关系以探讨肠道菌群对肠道免疫的影响, 进而为研究NAFLD的防治提供一定思路.
体质量1.7-2.0 kg的纯种♂新西兰兔14只(购自新疆医科大学实验动物中心). 普通饲料(新疆维吾尔自治区实验动物中心)、高脂饲料配制方法为基础饲料85%(新疆维吾尔自治区实验动物中心), 猪油8%(市售板油自制), 胆固醇2%(Amresco进口分装), 蛋黄粉5%(Amresco进口分装), QIAamp DNA Stool Mini Kit(QIAamp Germany)试剂盒, 细菌基因组DNA快速提取试剂盒(TIANGEN公司), 琼脂糖凝胶DNA回收试剂盒(离心柱型)(TIANGEN公司), 2×Taq PCR Master Mix(Biomed公司), 即用型兔抗TLR4多克隆抗体BA1717(武汉博士德), PV6001兔二步法免疫组织化学试剂盒(北京中杉金桥), 标准菌株[大肠埃希菌(Escherichia coli, E. coli), 1.356]、嗜酸乳杆菌(Lactobacillus acidophilus, 1.1878)、双歧杆菌(Bifidobacteria longum, 1.2186)由中国科学院微生物研究所普通微生物菌种保藏管理中心购买的冻干粉, 并在6 ℃-10 ℃冰箱保存备用.
1.2.1 动物模型建立及取材: 将14只♂新西兰兔适应性喂养2 wk, 观察无异常后随机分为2组, 模型组及正常对照组各7只, 对照组用普通饲料喂养, 模型组用高脂饲料喂养, 整个实验期间均饲养于新疆医科大学动物实验中心兔饲养室, 以笼卡标记, 单笼饲养, 模拟自然光照, 饮水不限, 饲养12 wk后处死. 于肝右叶中部切取小块组织, 以10%多聚甲醛固定, 准备行HE染色. 取回盲部上端10 cm左右处回肠组织, 10%多聚甲醛固定, 石蜡包埋并切片准备行免疫组织化学, 提取该处肠内粪便3 g置于2 mL无菌离心管内, 用于检测各菌群含量.
1.2.2 观察指标及方法: (1)肝脏组织HE染色: 以40g/L甲醛固定肝脏组织后, 经石蜡包埋、切片, HE染色, 在光镜下观察肝脏病理学改变, 以平均每个肝小叶内脂肪变性的肝细胞所占比例表示肝脏脂肪变性程度; (2)免疫组织化学测肠黏膜TLR4: 回肠组织石蜡切片常规脱蜡水化, 3%H2O2孵育10 min, PBS冲洗, 0.01 mol/L枸橼酸抗原修复液, 微波修复(92 ℃-98 ℃)10 min, PBS冲洗, 兔抗兔多克隆TLR4抗体4 ℃过夜, PBS冲洗, 二抗37 ℃ 30 min, PBS冲洗. DAB显色, 镜下控制显色时间(3-5 min). PBS代替一抗做空白对照. 显微镜下观察, 每张切片取5个视野采集图像, 用Image-Pro Plus 6.0软件分析各图像特异性着色区域累计光密度(integral optical density, IA)值; (3)实时荧光定量PCR检测粪便中菌群: 将收集的粪便标本按QIAamp DNA Stool Mini Kit试剂盒的操作说明提取细菌基因组DNA, 置于-20 ℃冰箱保存. 复活标准菌株(LBS培养基, 37 ℃, 3-5 d)并提取标准菌基因组DNA, 根据16SrDNA V3可变区基因序列设计3种菌群特异性引物(由上海生工生物工程技术有限公司合成, 引物序列如表1), 用3种菌群标准菌株基因组DNA与正常对照组粪便细菌基因组DNA进行常规PCR反应以检测引物特异性(反应条件: 94 ℃预变性3 min, 94 ℃变性30 s, 49.3 ℃退火30 s, 72 ℃延伸1 min, 共35个循环, 72 ℃复性5 min. 2.0%琼脂糖凝胶电泳, 110 V 35 min; 反应体系: 20 µL: 2×Taq PCR Master Mix 10 µL, 上、下游引物10 µmol/L各0.5 µL, DNA模板2.0 µL, ddH2O 7 µL), 以3种菌群标准菌株基因组DNA行常规PCR反应(反应体系及条件同上)测定标准菌株基因组DNA浓度及A值作为实时荧光定量PCR反应的标准品, 10倍系列稀释纯化产物, 行SYBR GreenⅠ实时荧光定量PCR反应以获得标注曲线(反应条件95 ℃预变性3 min, 95 ℃变性10 s, 49.3 ℃退火30 s, 65 ℃延伸1 min, 共40个循环; 反应体系: 20 µL: 2×SYBR® Premix Ex TaqTM 10 µL, 上下游引物各0.5 µL, DNA模板2.0 µL, ddH2O 7 µL). 反应完成后以0.5 ℃为间隔, 从60 ℃加热至95 ℃, 每一间隔保持10 s, 获取融解曲线. 将粪便样品中提取的3中菌群DNA行实时荧光定量PCR反应(反应体系与条件同上), 所有样品均做2个平行复孔, 每次实验均设标准品校正和ddH2O代替DNA样本的阴性对照, 完毕后根据融解曲线分析PCR产物特异性, 系统软件分析结果, 结果以每克湿便的细菌拷贝数的对数(以10为底数)表示.
| 细菌 | 目的基因 | PCR扩增片段长度(bp) | 引物序列(5'→3') |
| 大肠埃希菌 | 16SrDNA | 340 | F: 5'-GTTAATACCTTTGCTCATTG-3' |
| R: 5'-ACCAGGGTATCTTAATCCTGTT-3' | |||
| 乳酸杆菌 | 16SrDNA | 341 | F: 5'-AGCAGTAGGGAATCTTCCA-3' |
| R: 5'-CACCGCTACACATGGA-3' | |||
| 双歧杆菌 | 16SrDNA | 243 | F: 5'-TCGCGTCCGGTGTGAAAG-3' |
| R: 5'-CCACATCCAGCATCCAC-3' |
统计学处理 免疫组织化学及电镜图像采用Image-Pro Plus 6.0软件进行分析, 用SPSS19.0统计软件分析所得数据, 计量资料用mean±SD表示, 采用多元线性回归分析大肠杆菌、乳酸杆菌、双歧杆菌与TLR4之间的关系, P<0.05为差异有统计学意义.
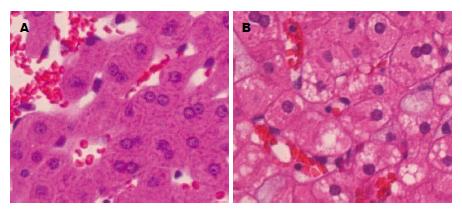
根据中华医学会肝脏病学分会脂肪肝和酒精性肝病学组非酒精性脂肪性肝病诊疗指南(2010年修订版)中的组织学诊断标准[4]评估肝脏病理改变, 正常对照组肝细胞形态正常(图1A). 而NAFLD模型组肝细胞可见广泛脂肪变性及大量气球样改变(图1B).
正常对照组与NASH组家兔肠道大肠杆菌、乳酸杆菌、双歧杆菌及肠黏膜TLR4分析结果如表2.
| 正常对照组 | NASH组 | t值 | P值 | |
| 双歧杆菌(拷贝数/克湿便) | 5933.030±4400.412 | 8982.414±6222.880 | -1.059 | 0.311 |
| 乳酸杆菌(拷贝数/克湿便) | 2.240±1.601 | 5.643±4.601 | 1.848 | 0.089 |
| 大肠杆菌(拷贝数/克湿便) | 14.299±11.400 | 54.767±28.467 | 3.492 | 0.008 |
| TLR4 | 0.015±0.010 | 0.042±0.014 | -4.089 | 0.002 |
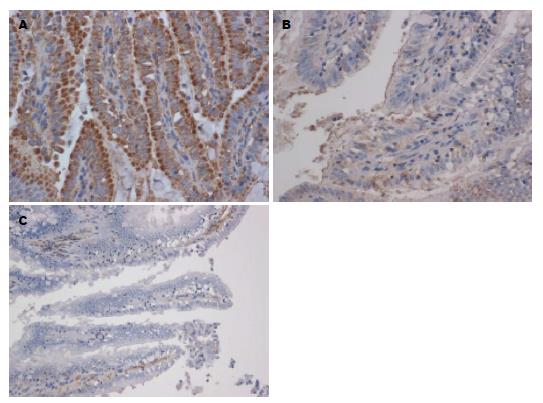
模型组阳性染色明显增强, 呈棕褐色信号, 在肠黏膜上皮细胞膜顶端及胞浆均有表达, 呈线性连续性分布(图2A). 而对照组TLR4表达量极低, 主要在肠黏膜上皮细胞膜的顶端间断分布, 呈淡黄色信号(图2B), 而PBS代替一抗的阴性对照组显示非特异性染色主要分布于肠绒毛的血管中(图2C).
以TLR4为应变量, 大肠杆菌(X1)、乳酸杆菌(X2)及双歧杆菌(X3)为自变量, 进入概率为α≤0.10, 移出概率为α≥0.15进行多元线性逐步回归分析, 最终大肠杆菌及双歧杆菌进入回归方程, 所构建的回归方程为Y = 0.029+3.443×10-4×X1-1.613×10-6×X3, 方程统计检验结果示: F = 8.167, P = 0.007; 回归方程有意义. R2 = 0.598, 提示TLR4的变化中有59.8%与大肠杆菌及双歧杆菌有关. 通过分析各自变量的回归系数显示: 大肠杆菌与TLR4呈正相关(标准化β = 0.554), 双歧杆菌与TLR4呈负相关(标准化β = -0.475)(表3).
| 自变量 | 回归系数β | 标准化β | t值 | P值 | 95.0%CI |
| 常量 | 0.029 | 3.761 | 0.03 | 0.12-0.45 | |
| 大肠杆菌 | 3.443×10-4 | 0.554 | 2.871 | 0.015 | 8.034×10-5-6.082×10-4 |
| 双歧杆菌 | -1.613×10-6 | -0.475 | -2.462 | 0.032 | -3.055×10-6--1.709×10-7 |
人体肠道中存在着数量庞大的菌群, 菌种多达500-1000余种[5], 大量肠道细菌主要位居于结肠和远端小肠, 在回肠中以厌氧菌如类杆菌属、双歧杆菌、梭杆菌属和消化链球菌属等占主导地位, 含量达到1×109/g; 而需氧菌和兼性厌氧菌包括肠杆菌、乳酸杆菌数量相对较少, 约有1×106-1×108/g[6]. 当结肠内菌群因各种原因移位至小肠引起小肠内厌氧菌过度滋生就会造成小肠污染综合征, Shanab等[7]的研究发现NASH组小肠污染综合征的患病率(77.78%)显著高于对照组(31.25%), 给NASH大鼠口服乳果糖或庆大霉素, 其血清转氨酶和肝组织炎症坏死程度可显著减轻[8,9], 杨林辉等研究发现NAFLD患者存在肠道菌群失调、革兰阴性杆菌过度生长的现象[10], 这些均提示肠道菌群数量及结构改变与NAFLD发病有密切关系. 我们的研究发现NAFLD家兔肠道内大肠杆菌较正常家兔明显增多, 而双歧杆菌及乳酸杆菌数量无明显改变, 与既往研究结果类似, 说明NAFLD家兔肠道内存在菌群失调及革兰阴性杆菌过度生长.
TLR4是内毒素识别受体, 主要表达于肠黏膜上皮细胞、树突状细胞、巨噬细胞等细胞膜上, 介导固有免疫, 他与内毒素结合后, 通过激活白介素受体相关激酶(interleukin 1 receptor associated kinase, IRAK)、核因子-κB(nuclear factor kappa B, NF-κB)等通路上调肿瘤坏死因子(tumor necrosis factor-α, TNF-α)、白介素(interleukin, IL)-1、IL-6、IL-8、IL-12等细胞因子的表达而引起炎症的发生, 与肝脏脂质沉积、炎症损伤及纤维化修复等密切相关. 有研究报道TLR4/MyD88信号通道在高脂饮食相关脂肪性肝病发病早期起关键作用[11], Tadanobu等[12]的研究显示NAFLD患者肝脏库普弗细胞TLR4高表达, 且与病情进展程度一致. Rivera等[13]发现TLR4沉默小鼠比野生型小鼠肝脏损害程度减轻, 脂质沉积减少, 说明TLR4与NAFLD的发病有着密切的关系. 正常人体肠道黏膜TLR4表达水平很低[14], 从而监视着正常状态下的肠道菌群并使得肠道即使存在一定量的内毒素也不会引起疾病, 即人体对内毒素的免疫耐受. Nomura等[15]发现TLR4表达的下调导致LPS耐受性的产生, 且LPS耐受程度与TLR4表达下调量之间呈正相关, 证明TLR4低表达是产生LPS耐受的关键环节. 我们研究也发现NAFLD组家兔小肠黏膜TLR4表达明显升高, 说明NAFLD家兔对内毒素的免疫耐受机制已被破坏.
我们看到NAFLD家兔同时存在着肠道菌群失调及TLR4表达上调, 而进一步分析这两者之间的关系, 我们发现大肠杆菌与TLR4表达呈正相关, 大肠杆菌增多时TLR4表达上调, 而双歧杆菌与TLR4表达的关系则相反, 我们推测这一现象与内毒素有关. 内毒素是革兰阴性菌细胞壁外膜上的一种脂多糖(lipopolysaccharide, LPS)与微量蛋白质的复合物, 许多研究证实肝病时会出现肠道菌群微生态失调, 革兰阴性菌大量增殖使肠道内毒素明显增加, 而大肠杆菌是肠道革兰阴性菌中的优势菌群, 其数量增多必然引起肠道中的内毒素增加, 而双歧杆菌及乳酸杆菌均为肠道益生菌的代表, 他们的存在可以抑制大肠杆菌等菌群的生长、促进肠道内有害物质排出, 从而抑制肠道中内毒素增加. TLR4是内毒素的受体, 有研究显示LPS能明显上调内皮细胞TLR4的表达, 并且其作用呈一定的时间和剂量依赖性[16], 故肠道大肠杆菌增多引起肠道中内毒素增加的同时也使得TLR4的表达表达上调, 相反, 由于双歧杆菌等益生菌增加则使得TLR4的表达表达下调, 这较为合理的解释了我们的研究结果.
但我们同时发现, 乳酸杆菌与双歧杆菌同为肠道益生菌, 有类似的作用, 同样应与TLR4成负相关, 而我们的研究中乳酸杆菌与TLR4并未表现出现这样的关系, 我们认为这一现象可能是由于实验样本量较少而未能完全反映出他们之间存在的关系, 需在以后的研究中增加样本量以进一步研究.
通过该研究, 我们发现NAFLD家兔肠道内大肠杆菌数量与TLR4表达呈正相关, 而双歧杆菌及乳酸杆菌等益生菌的作用则相反, 从统计学角度, 可以认为大肠杆菌增加会使TLR4表达上调, 而益生菌则抑制其表达上调, 这为应用抗生素及益生菌治疗NAFLD提供了一定的理论依据, 但这一结论需要建立肠道菌群失调的模型以进一步研究, 也为今后关于NAFLD发病机制的研究提供了一定的思路.
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是一种获得性代谢性应激相关的肝脏疾病,是目前世界上最为普遍的肝脏疾病之一, 国内外发病率呈明显上升趋势. NAFLD临床上包括单纯性脂肪肝、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis)和脂肪性肝硬化3种类型, 其发生机制尚不明确.
庹必光, 教授, 遵义医学院附属医院消化科
目前许多研究均证实内毒素在NAFLD的发生、进展过程中发挥了不可忽视的作用, 而肠道菌群是LPS最主要的来源, TLR4作为内毒素的受体在这一过程中亦有重要作用, 研究肠道菌群改变与TLR4的关系将对研究NAFLD发病及治疗有一定的贡献.
Abu-Shanab等研究发现NASH 组小肠污染综合征的患病率(77.78%)显著高于对照组(31.25%). 有研究显示LPS能明显上调内皮细胞TLR4的表达, 并且其作用呈一定的时间和剂量依赖性. Nomura等发现TLR4表达的下调导致LPS耐受性的产生, 且LPS耐受程度与TLR4表达下调量之间呈正相关.
本研究在于探讨NAFLD家兔肠道各菌群的改变对肠黏膜TLR4的影响, 既往尚无相同的报道.
本研究NAFLD家兔肠道内大肠杆菌明显增多, 而双歧杆菌及乳酸杆菌等无明显改变. 大肠杆菌数与肠黏膜TLR4呈正相关, 双歧杆菌与肠黏膜TLR4呈负相关, 提示NAFLD家兔存在肠道菌群失调且与TLR4改变关系密切, 大肠杆菌等格兰阴性菌增多可能引起肠道内毒素负荷增加, 使TLR4表达上调并激活一系列炎症因子促进NAFLD的发生及发展.
本文通过建立家兔高脂肪饮食导致的脂肪肝模型, 研究肠黏膜的Toll4受体和肠道一些细菌的变化. 设计合理, 图片翔实, 具有一定学术意义.
编辑: 郭鹏 电编:鲁亚静
| 1. | Farrell GC, Larter CZ. Nonalcoholic fatty liver disease: from steatosis to cirrhosis. Hepatology. 2006;43:S99-S112. [PubMed] [DOI] |
| 2. | Farrell GC, Chitturi S, Lau GK, Sollano JD. Guidelines for the assessment and management of non-alcoholic fatty liver disease in the Asia-Pacific region: executive summary. J Gastroenterol Hepatol. 2007;22:775-777. [PubMed] [DOI] |
| 3. | Holland WL, Bikman BT, Wang LP, Yuguang G, Sargent KM, Bulchand S, Knotts TA, Shui G, Clegg DJ, Wenk MR. Lipid-induced insulin resistance mediated by the proinflammatory receptor TLR4 requires saturated fatty acid-induced ceramide biosynthesis in mice. J Clin Invest. 2011;121:1858-1870. [PubMed] [DOI] |
| 4. | 范 建高. 非酒精性脂肪性肝病诊疗指南(2010年修订版). 胃肠病学和肝病学杂志. 2010;19:483-487. |
| 5. | Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, Nielsen T, Pons N, Levenez F, Yamada T. A human gut microbial gene catalogue established by metagenomic sequencing. Nature. 2010;464:59-65. [PubMed] [DOI] |
| 6. | Macpherson AJ, Harris NL. Interactions between commensal intestinal bacteria and the immune system. Nat Rev Immunol. 2004;4:478-485. [PubMed] [DOI] |
| 7. | Shanab AA, Scully P, Crosbie O, Buckley M, O'Mahony L, Shanahan F, Gazareen S, Murphy E, Quigley EM. Small intestinal bacterial overgrowth in nonalcoholic steatohepatitis: association with toll-like receptor 4 expression and plasma levels of interleukin 8. Dig Dis Sci. 2011;56:1524-1534. [PubMed] [DOI] |
| 8. | Fan JG, Xu ZJ, Wang GL. Effect of lactulose on establishment of a rat non-alcoholic steatohepatitis model. World J Gastroenterol. 2005;11:5053-5056. [PubMed] |
| 9. | Wu WC, Zhao W, Li S. Small intestinal bacteria overgrowth decreases small intestinal motility in the NASH rats. World J Gastroenterol. 2008;14:313-317. [PubMed] [DOI] |
| 11. | Li L, Chen L, Hu L, Liu Y, Sun HY, Tang J, Hou YJ, Chang YX, Tu QQ, Feng GS. Nuclear factor high-mobility group box1 mediating the activation of Toll-like receptor 4 signaling in hepatocytes in the early stage of nonalcoholic fatty liver disease in mice. Hepatology. 2011;54:1620-1630. [PubMed] [DOI] |
| 12. | Tadanobu N, Naoki T, Takefumi K, Michiharu K, Eiji T. Enhanced expression of toll-like receptor 4 and myd88 is associated with disease progression in human nonalcoholic fatty liver disease. Gastroenterology. 2011;140:s978. [DOI] |
| 13. | Rivera CA, Adegboyega P, van Rooijen N, Tagalicud A, Allman M, Wallace M. Toll-like receptor-4 signaling and Kupffer cells play pivotal roles in the pathogenesis of non-alcoholic steatohepatitis. J Hepatol. 2007;47:571-579. [PubMed] [DOI] |
| 14. | Abreu MT, Vora P, Faure E, Thomas LS, Arnold ET, Arditi M. Decreased expression of Toll-like receptor-4 and MD-2 correlates with intestinal epithelial cell protection against dysregulated proinflammatory gene expression in response to bacterial lipopolysaccharide. J Immunol. 2001;167:1609-1616. [PubMed] |
| 15. | Nomura F, Akashi S, Sakao Y, Sato S, Kawai T, Matsumoto M, Nakanishi K, Kimoto M, Miyake K, Takeda K. Cutting edge: endotoxin tolerance in mouse peritoneal macrophages correlates with down-regulation of surface toll-like receptor 4 expression. J Immunol. 2000;164:3476-3479. [PubMed] |
| 16. | 杨 清武, 朱 佩芳, 王 正国, 蒋 建新. Toll样受体4介导内毒素对内皮细胞NF-κB的激活. 生物化学与生物物理进展. 2002;29:407-410. |