修回日期: 2013-11-28
接受日期: 2013-11-30
在线出版日期: 2013-12-18
目的: 了解辛伐他汀对急性肝衰竭肝损伤的保护作用及其机制.
方法: D-氨基半乳糖(D galactosamine, D-GaIN)和细菌脂多糖(Lipopolysaccharide, LPS)腹腔注射建立小鼠急性肝衰竭模型. ♂6-8周龄Balb/c随机分为正常组、肝衰竭对照组和辛伐他汀组, 每组18只. Kaplan-Meier法分析小鼠生存率, 生化检测6、12、24和48 h血清丙氨酸转氨酶(alanine aminotransferase, ALT)和24 h肝脏超氧化物水平. HE染色分析24 h肝脏形态学变化, 免疫组织化学分析12 h肝脏高迁移率族蛋白1(high mobility group box-1 protein, HMGB1)表达. ELISA检测血清HMGB1、白介素-1β(interleukin-1β, IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、IL-6和IL-10水平, 免疫印迹分析内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)、磷酸化内皮型一氧化氮合酶(P-eNOS)和LC3Ⅱ表达.
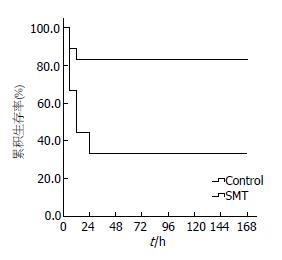
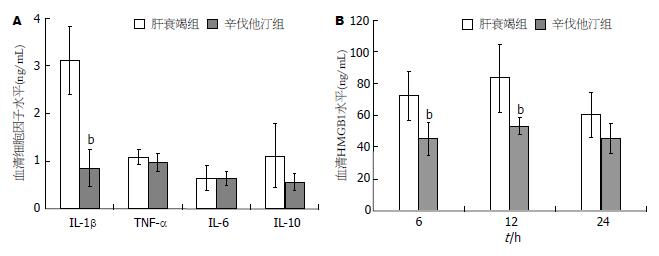
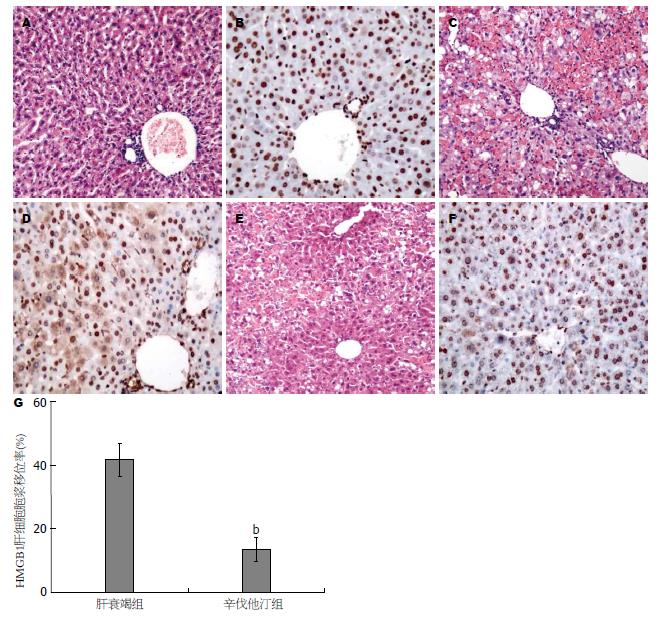
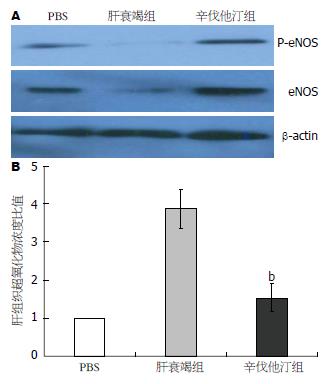
结果: 辛伐他汀组1 wk生存率为83.3%显著高于肝衰竭对照组的33.3%(P<0.01); 6、12、24和48 h血清ALT水平显著低于急性肝衰竭组(P<0.01). 辛伐他汀组6和12 h的HMGB1水平以及24 h的IL-1β水平显著低于肝衰竭对照组(P<0.01), 肝脏炎症坏死和HMGB1胞浆移位较对照明显减轻. 辛伐他汀增加急性肝衰竭动物肝脏eNOS、P-eNOS和LC3Ⅱ表达水平, 降低肝组织超氧化物水平.
结论: 辛伐他汀对急性肝衰竭具有保护作用, 其机制与改善内皮细胞功能障碍、氧化应激和促进肝细胞自噬有关.
核心提示: 辛伐他汀改善肝脏内皮细胞功能障碍、氧化应激和促进肝细胞自噬保护急性肝衰竭肝损伤.
引文著录: 雷延昌, 罗盼, 李雯. 辛伐他汀保护小鼠急性肝衰竭肝损伤. 世界华人消化杂志 2013; 21(35): 3940-3946
Revised: November 28, 2013
Accepted: November 30, 2013
Published online: December 18, 2013
AIM: To explore the effects of simvastatin on acute live failure in mice and the underlying mechanism.
METHODS: D-galactosamine (D-GaIN) and lipopolysaccharide (LPS) were used to induce acute liver failure in BALB/c mice. Male mice (6-8 wk) were randomly assigned to three groups (n = 18), a normal group, an acute liver failure group and a simvastatin treatment group. Kaplan-meier method was used for survival analysis. Serum ALT levels at different time point (6, 12, 24, 48 h) and hepatic superoxide level at 24 h were measured by biochemical methods. Hepatic morphological changes at 24 h were assessed by HE staining and hepatocyte HMGB1 cytoplasmic translocation was detected by immunohistochemistry. Serum levels of HMGB1, IL-1β, TNF-α, IL-6 and IL-10 were detected by ELISA. Expression of eNOS, P-eNOS and LC3Ⅱ in liver tissues was analyzed by Western blot.
RESULTS: The survival rate at one week was significantly higher in the simvastatin treatment group than in the acute liver failure group (83.3% vs 33.3%, P < 0.01). Simvastatin treatment significantly decreased ALT levels at 6, 12, 24, and 48 h compared with the acute liver failure group (all P < 0.01). Serum levels of HMGB1 at 6 and 12 h and IL-1β at 12 h were also decreased significantly in the simvastatin group (all P < 0.01), and the inflammation or necrosis and hepatocyte HMGB1 cytoplasmic translocation in liver tissues were decreased in the simvastatin group. In simvastatin-treated mice, eNOS, P-eNOS and LC3Ⅱ expression in liver tissue was increased compared to the acute liver failure group. However, hepatic superoxide level at 24 h was decreased in the simvastatin group.
CONCLUSION: Simvastatin protects against acute live failure possibly by improving endothelial dysfunction, oxide stress and hepatocyte autophagy in mice.
- Citation: Lei YC, Luo P, Li W. Administration of simvastatin protects against acute live failure in mice. Shijie Huaren Xiaohua Zazhi 2013; 21(35): 3940-3946
- URL: https://www.wjgnet.com/1009-3079/full/v21/i35/3940.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i35.3940
革兰氏阴性菌脂多糖(lipopolysaccharide, LPS)抑制肝窦内皮细胞NO产生, 增加肝脏血管阻力和降低乙酰胆碱的舒血管效应导致内皮细胞功能障碍[1-3]. 最近研究发现, 辛伐他汀抑制LPS诱导的肝脏内皮细胞功能障碍, 保护内毒素血症引起的肝损伤[4]. 慢性肝病和肝硬化内毒素血症导致肝窦内皮细胞功能障碍, 尤其在肝硬化肠道细菌移位时加重[5-9], 辛伐他汀改善肝硬化门脉高压患者肝窦内皮细胞功能障碍[10-12]. 此外, 他汀类药物改善败血症血管炎症反应和微循环障碍[13,14]. 最近研究发现, 辛伐他汀保护肝移植后缺血再灌注损伤, 在供体肝脏冷藏液中加入辛伐他汀可以维持肝脏血管内皮细胞KLF2表达发挥血管保护作用, 抑制肝损伤、炎症反应和氧化应激, 从而改善内皮细胞功能障碍[15].
目前认为, 内毒素血症和微循环障碍导致的继发性肝损伤在肝衰竭的发生发展过程中发挥重要作用[16]. 病毒、药物、酒精等直接或免疫损伤致肝细胞坏死和局部炎症反应, 炎症反应导致微循环障碍造成缺血缺氧进一步加重肝细胞死亡, 促进内毒素血症的发生, 最终加速肝细胞死亡和肝衰竭的发生和进展. 基于辛伐他汀保护内毒素血症和缺血再灌注引起的肝损伤, 改善微循环障碍和肝硬化肝窦内皮细胞功能障碍, 推测辛伐他汀具有改善微循环障碍对急性肝衰竭具有保护作用. 为验证上述假说进行本研究.
♂6-8周龄Balb/c小鼠, 体质量20 g±0.5 g, 由南昌大学医学院动物实验中心提供(动物质量合格证编号2013091206), 动物饲养和处理严格按照美国国立卫生研究院实验动物饲养和使用指南. 主要试剂: 细菌脂多糖(Sigma公司, 美国), D-氨基半乳糖(Sigma公司, 美国); 辛伐他汀标准品购自中国药品生物制品检定所. 高迁移率族蛋白1(high mobility group box-1 protein, HMGB1)和白介素-1β(interleukin-1β, IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α), TNF-α、IL-6和IL-10试剂盒(NEB公司, 美国), 超氧化物检测试剂盒(碧云天, 中国). 兔抗鼠HMGB1(ABGENT公司, 美国); 兔抗鼠LC3Ⅱ(Cell signaling公司, 美国); 兔抗鼠eNOS 和P-eNOS(Abcam公司, 英国).
1.2.1 动物模型及分组: Balb/c小鼠♂实验前12 h禁食, 不禁水. 动物随机分为3组: 正常组、急性肝衰竭组和辛伐他汀组, 每组18只. 急性肝衰竭组给予D-GaIN(600 mg/kg)和LPS(10 μg/kg)腹腔注射, 辛伐他汀治疗组在腹腔注射D-GaIN/LPS前3 d每日给予辛伐他汀(25 mg/kg)灌胃, 正常组和急性肝衰竭对照组在相应时间点等量PBS灌胃.
1.2.2 标本收集: 腹腔注射D-GaIN/LPS后6、12、24、48 h对存活动物眼眶采血分离血清置于-80 ℃保存. 分别于12和24 h处死部分动物, 肝组织用40 g/L中性甲醛固定, 进行免疫组织化学检测HMGB1表达和肝脏病理分析.
1.2.3 血清生化和细胞因子检测: 全自动生化分析仪检测ALT, 血清HMGB1和IL-1β、TNF-α、IL-6和IL-10和超氧化物检测按照生产厂家说明书进行, 根据标准品获得标准曲线计算结果.
1.2.4 免疫印迹及其分析: 免疫印迹及其分析: 取 0.5 g肝组织研磨后加入1 mL含蛋白酶抑制剂混合物的双蒸水混匀-80 ℃保存, 取10 µL样品加入90 µL RIPA高效裂解液(碧云天, 中国)充分裂解, 6000 g离心30 s, 加入50 µL上样缓冲液, 聚丙烯酰胺凝胶电泳后转移至硝酸纤维素膜上, 10%的BSA在4 ℃封闭过夜, 一抗37 ℃孵育2 h, 1:10000辣根过氧化物酶标记的羊抗兔IgG抗体37 ℃孵育0.5 h, 化学发光法检测结果, Quntity one分析软件进行灰度分析.
统计学处理 所有数据用SPSS18.0软件作统计学分析, 数据资料以mean±SD表示, 生存率比较采用Log-rank检验, 重复测量设计资料分析采用方差分析, 两组间比较应用独立样本t检验, 两个样本率的比较用χ2检验, P<0.05为差异有统计学意义.
Kaplan-Meier生存分析显示, D-GalN/LPS腹腔注射小鼠1 wk生存率为33.3%, 显著低于MSC-CM治疗组的83.3%(P<0.01, 图1). 生化检测小鼠血清ALT水平可了解肝细胞损伤的程度, 急性肝衰竭小鼠血清ALT在6 h开始升高, 12 h达峰值, 24 h维持在较高水平, 48 h逐渐恢复. 辛伐他汀治疗组6、12和24 h血清ALT水平显著低于急性肝衰竭组(P<0.01, 表1).
在本研究中, D-GalN/LPS诱导急性肝衰竭小鼠血清12 h的ALT水平达峰值. 前期研究显示, 小鼠血清TNF-α、IL-1β、IL-6和抗炎因子IL-10的峰值水平也出现在12 h. 为了解辛伐他汀对急性肝衰竭炎症因子和抗炎因子水平的影响, ELISA检测结果显示, 辛伐他汀治疗组TNF-a、IL-6和抗炎因子IL-10与对照组无显著差异, 而IL-1β显著低于对照组(P<0.01, 图2A). 近年来发现HMGB1在急性肝衰竭炎症反应中发挥重要作用, 研究者前期发现D-GalN/LPS诱导急性肝衰竭小鼠血清HMGB1在6 h已开始升高, 12 h达高峰, 24 h开始下降, 48 h接近正常水平. 为了解MSC-CM治疗对肝衰竭HMGB1的影响, 比较6、12和24 h血清HMGB1水平, 结果显示辛伐他汀治疗组在6和12 h的HMGB1水平显著低于肝衰竭对照组(P<0.01, 图2B).
急性肝衰竭对照组肝细胞大片状坏死, 坏死区大量炎症细胞浸润(图3C), 肝脏 HMGB1不仅在胞核表达, 大量肝细胞胞浆有明显表达(图3D). 辛伐他汀治疗组肝小叶结构基本完整, 局灶肝细胞嗜酸性变, 无炎症细胞浸, HMGB1胞浆表达肝细胞较少(图3E, 3F). 图像分析对照组HMGB1肝细胞移位率显著高于辛伐他汀治疗组(P<0.01, 图3G).
为了解辛伐他汀对急性肝衰竭肝脏微循环障碍和氧化应激的影响, 免疫印迹检测肝脏eNOS和P-eNOS水平显示, 急性肝衰竭小鼠肝脏eNOS和P-eNOS较PBS对照组明显降低, 辛伐他汀治疗增加其表达水平(图4A). 测定各处理组肝组织过氧化物水平显示, 辛伐他汀治疗组肝脏超氧化物浓度比值显著低于肝衰竭对照组(P<0.01, 图4B).
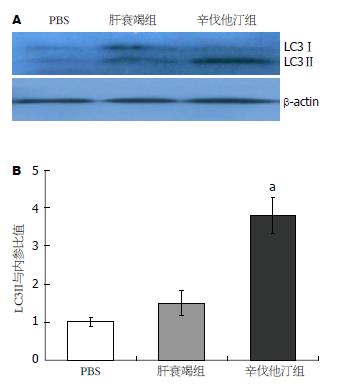
近年来的研究显示, 诱导自噬保护多种诱因的急性肝细胞损伤. 为了解辛伐他汀的肝脏保护作用与肝细胞自噬有关, 免疫印迹检测不同治疗组肝脏LC3Ⅱ表达显示, 辛伐他汀组肝脏LC3Ⅱ表达较急性肝衰竭组高(图5). 表明辛伐他汀促进急性肝衰竭肝细胞自噬.
D-GalN/LPS腹腔注射是目前比较成熟的小鼠急性肝衰竭模型, 较好的模拟肝衰竭发病机制. ♂Balb/c小鼠腹腔注射D-GalN/LPS 1 wk生存率为33.3%, 动物死亡发生在给药后12-24 h , 与作者之前的研究一致[17,18]. 辛伐他汀治疗组小鼠1 wk生存率为83.3%显著高于肝衰竭对照组的33.3%. 急性肝衰竭小鼠血清ALT水平在6 h开始升高, 12 h达高峰, 24 h开始下降并逐渐恢复正常, 与国外的研究和作者近来的研究结果一致[17,19,20]. 辛伐他汀治疗组显著降低血清ALT水平和肝脏炎症减轻, 显示其保护急性肝衰竭肝损伤保护作用.
内毒素血症和肝脏微循环障碍所继发的肝损伤在肝衰竭的发生发展过程中具有重要作用目前已得到共识[16]. 肝衰竭内毒素血症发生率可高达90%-100%, 内毒素血症产生的LPS刺激巨噬细胞或枯否细胞释放大量炎症因子加重肝损伤. 氯化钆部分清除肝脏枯否细胞, 显著降低D-GalN/LPS诱导小鼠急性肝损伤, 提高生存率[21]. 近年来发现, 后期炎症因子HMGBl在急性肝衰竭发生和疾病的严重程度密切相关[12], 急性肝衰竭发生肝细胞HMGB1胞浆移位[22]. HMGB1可通过LPS刺激巨噬细胞和血管内皮细胞等主动释放, 亦可由坏死肝细胞被动释放[23-26], HMGB1促进TNF-α、IL-1β、IL-6和IL-8释放和外周单核细胞趋化因子释放, 募集更多炎症细胞加剧炎症反应和组织损伤. 本研究显示, 与急性肝衰竭对照组比较, 辛伐他汀组血清12 h的HMGB1和IL-1β水平显著降低, 而TNF-α、IL-1β、IL-6以及抗炎因子IL-10的水平无差异. 然而, 辛伐他汀治疗组肝脏炎症坏死和肝细胞HMGB1胞浆移位显著减轻. 由于HMGB1既可通过巨噬细胞LPS刺激产生, 又可通过坏死肝细胞被动释放, 提示辛伐他汀对LPS刺激巨噬细胞或枯否细胞炎症因子释放的影响较小, 不是其保护肝衰竭肝细胞损伤的主要机制.
肝衰竭继发性肝损伤的另外一个重要因素是肝脏微循环障碍, 肝脏炎症反应导致微循环障碍, 造成了缺血缺氧性损伤, 缺血缺氧直接导致肝细胞死亡, 肝细胞大量死亡, 肝脏解毒能力降低、肠道屏障功能障碍、免疫抑制等, 促进内毒素血症的发生, 内毒素血症加速了肝细胞的死亡[16].
败血症和肝硬化内毒素血症导致肝窦内皮细胞功能障碍, LPS抑制肝窦内皮细胞NO产生, 增加肝脏血管阻力[1-4]. 近年来的研究发现, 辛伐他汀改善败血症和肝硬化门脉高压患者肝窦内皮细胞功能障碍, 减轻肝损伤[4,10-12]. 最近发现, 辛伐他汀保护肝移植缺血再灌注损伤, 其作用是通过改善内皮细胞功能障碍, 抑制炎症反应和氧化应激减少肝损伤[15]. 本研究发现辛伐他汀增加急性肝衰竭动物肝脏eNOS和P-eNOS, 降低肝组织超氧化物水平. 肝脏eNOS和P-eNOS主要由肝脏血管内皮细胞产生, 因此, 辛伐他汀增加血管内皮细胞eNOS和P-eNOS表达, NO水平增加改善急性肝衰竭微循环障碍, 同时降低氧化应激反应, 保护微循环障碍继发性肝细胞损伤.
最近研究显示, 细胞自噬可以选择性清除损伤的线粒体, 保护线粒体损伤诱导的细胞死亡. 促进肝细胞自噬可以保护对乙酰氨基酚、D-GalN/LPS以及酒精对小鼠的肝细胞毒性, 抑制肝细胞自噬增加TNF-α和D-GalN诱导的肝细胞凋亡及损伤[27-29]. 虽然LPS可以促进肝细胞自噬, 但D-GalN抑制LPS诱导的肝细胞自噬[29]. 本研究发现辛伐他汀增加急性肝衰竭小鼠肝脏LC3BⅡ表达水平, 促进肝细胞自噬, 是保护肝损伤的机制之一.
本研究显示辛伐他汀提高急性肝衰竭小鼠生存率, 降低血清ALT水平, 改善肝脏炎症坏死和HMGB1肝细胞胞浆移位, 增加急性肝衰竭动物肝脏eNOS、P-eNOS和LC3BⅡ表达水平, 降低肝组织超氧化物水平, 但对LPS刺激巨噬细胞或枯否细胞炎症因子释放的影响较小. 因此, 辛伐他汀对急性肝衰竭具有保护作用与改善内皮细胞功能障碍、氧化应激和促进肝细胞自噬有关. 该结果为辛伐他汀保护肝衰竭肝细胞损伤提供了新的理论基础, 具有重要的理论和应用价值. 此外, 辛伐他汀与核苷类抗乙型肝炎病毒药物联合增加其病毒抑制作用[30]. 因我国肝衰竭大部分是慢性乙型肝炎引起效应, 应用辛伐他汀治疗慢性乙型肝炎肝衰竭值得进一步研究.
内毒素血症和微循环障碍所继发的肝损伤在肝衰竭发病中十分重要. 辛伐他汀改善败血症血管炎症反应和微循环障碍, 对肝移植后缺血再灌注损伤具有保护作用. 然而, 辛伐他汀对肝衰竭的保护作用尚不清楚.
朴云峰, 教授, 吉林大学第一临床医院消化科; 宣世英, 教授, 青岛市市立医院肝病内科
改善内毒素血症和微循环障碍减轻肝衰竭肝细胞炎症坏死, 糖皮质激素和目前的保肝抗炎药物可减轻炎症反应, 但糖皮质激素的不良反应和护肝药物治疗肝衰竭的效果有限, 探索改善内毒素血症和微循环障碍的方法十分必要.
辛伐他汀保护内毒素血症和缺血再灌注引起的肝损伤, 改善微循环障碍和肝硬化肝窦内皮细胞功能障碍, 其机制是通过抑制炎症反应、氧化应激、改善微循环障碍和促进肝细胞自噬等.
辛伐他汀提高急性肝衰竭生存率, 降低血清ALT、IL-1β和后期炎症因子HMGB1水平减轻肝脏炎症坏死和HMGB1胞浆移位, 增加肝脏P-eNOS和LC3Ⅱ表达水平, 降低肝组织超氧化物水平.
本研究显示辛伐他汀保护急性肝衰竭肝损伤. 近年来发现, 辛伐他汀与核苷类抗病毒药物联合增加抗病毒效应, 辛伐他汀治疗慢乙型肝炎肝衰竭值得进一步研究.
本文为辛伐他汀保护肝衰竭肝细胞损伤提供了新的理论基础, 具有重要的理论和应用价值.
编辑: 田滢 电编:鲁亚静
| 1. | Bauer M, Bauer I, Sonin NV, Kresge N, Baveja R, Yokoyama Y, Harding D, Zhang JX, Clemens MG. Functional significance of endothelin B receptors in mediating sinusoidal and extrasinusoidal effects of endothelins in the intact rat liver. Hepatology. 2000;31:937-947. [PubMed] |
| 2. | Yokoyama Y, Baveja R, Kresge N, Sonin N, Nakanishi K, Zhang JX, Gitzelmann CA, Clemens MG. Endothelin receptor remodeling induces the portal venous hyper-response to endothelin-1 following endotoxin pretreatment. Shock. 2002;17:36-40. [PubMed] |
| 3. | Kamoun WS, Karaa A, Kresge N, Merkel SM, Korneszczuk K, Clemens MG. LPS inhibits endothelin-1-induced endothelial NOS activation in hepatic sinusoidal cells through a negative feedback involving caveolin-1. Hepatology. 2006;43:182-190. [PubMed] |
| 4. | La Mura V, Pasarín M, Meireles CZ, Miquel R, Rodríguez-Vilarrupla A, Hide D, Gracia-Sancho J, García-Pagán JC, Bosch J, Abraldes JG. Effects of simvastatin administration on rodents with lipopolysaccharide-induced liver microvascular dysfunction. Hepatology. 2013;57:1172-1181. [PubMed] [DOI] |
| 5. | Shah V, Toruner M, Haddad F, Cadelina G, Papapetropoulos A, Choo K, Sessa WC, Groszmann RJ. Impaired endothelial nitric oxide synthase activity associated with enhanced caveolin binding in experimental cirrhosis in the rat. Gastroenterology. 1999;117:1222-1228. [PubMed] |
| 6. | Bosch J, Abraldes JG, Fernández M, García-Pagán JC. Hepatic endothelial dysfunction and abnormal angiogenesis: new targets in the treatment of portal hypertension. J Hepatol. 2010;53:558-567. [PubMed] [DOI] |
| 7. | La Mura V, Reverter JC, Flores-Arroyo A, Raffa S, Reverter E, Seijo S, Abraldes JG, Bosch J, García-Pagán JC. Von Willebrand factor levels predict clinical outcome in patients with cirrhosis and portal hypertension. Gut. 2011;60:1133-1138. [PubMed] [DOI] |
| 8. | Iwakiri Y, Groszmann RJ. Vascular endothelial dysfunction in cirrhosis. J Hepatol. 2007;46:927-934. [PubMed] |
| 9. | Bellot P, García-Pagán JC, Francés R, Abraldes JG, Navasa M, Pérez-Mateo M, Such J, Bosch J. Bacterial DNA translocation is associated with systemic circulatory abnormalities and intrahepatic endothelial dysfunction in patients with cirrhosis. Hepatology. 2010;52:2044-2052. [PubMed] [DOI] |
| 10. | Zafra C, Abraldes JG, Turnes J, Berzigotti A, Fernández M, Garca-Pagán JC, Rodés J, Bosch J. Simvastatin enhances hepatic nitric oxide production and decreases the hepatic vascular tone in patients with cirrhosis. Gastroenterology. 2004;126:749-755. [PubMed] |
| 11. | Abraldes JG, Rodríguez-Vilarrupla A, Graupera M, Zafra C, García-Calderó H, García-Pagán JC, Bosch J. Simvastatin treatment improves liver sinusoidal endothelial dysfunction in CCl4 cirrhotic rats. J Hepatol. 2007;46:1040-1046. [PubMed] |
| 12. | Abraldes JG, Albillos A, Bañares R, Turnes J, González R, García-Pagán JC, Bosch J. Simvastatin lowers portal pressure in patients with cirrhosis and portal hypertension: a randomized controlled trial. Gastroenterology. 2009;136:1651-1658. [PubMed] [DOI] |
| 13. | Terblanche M, Almog Y, Rosenson RS, Smith TS, Hackam DG. Statins and sepsis: multiple modifications at multiple levels. Lancet Infect Dis. 2007;7:358-368. [PubMed] |
| 14. | Janda S, Young A, Fitzgerald JM, Etminan M, Swiston J. The effect of statins on mortality from severe infections and sepsis: a systematic review and meta-analysis. J Crit Care. 2010;25:656.e7-656.e22. [PubMed] [DOI] |
| 15. | Marrone G, Russo L, Rosado E, Hide D, García-Cardeña G, García-Pagán JC, Bosch J, Gracia-Sancho J. The transcription factor KLF2 mediates hepatic endothelial protection and paracrine endothelial-stellate cell deactivation induced by statins. J Hepatol. 2013;58:98-103. [PubMed] [DOI] |
| 19. | van Poll D, Parekkadan B, Cho CH, Berthiaume F, Nahmias Y, Tilles AW, Yarmush ML. Mesenchymal stem cell-derived molecules directly modulate hepatocellular death and regeneration in vitro and in vivo. Hepatology. 2008;47:1634-1643. [PubMed] [DOI] |
| 20. | Parekkadan B, van Poll D, Suganuma K, Carter EA, Berthiaume F, Tilles AW, Yarmush ML. Mesenchymal stem cell-derived molecules reverse fulminant hepatic failure. PLoS One. 2007;2:e941. [PubMed] |
| 21. | Zhang M, Xu S, Han Y, Cao X. Apoptotic cells attenuate fulminant hepatitis by priming Kupffer cells to produce interleukin-10 through membrane-bound TGF-β. Hepatology. 2011;53:306-316. [PubMed] [DOI] |
| 22. | Zhou RR, Zhao SS, Zou MX, Zhang P, Zhang BX, Dai XH, Li N, Liu HB, Wang H, Fan XG. HMGB1 cytoplasmic translocation in patients with acute liver failure. BMC Gastroenterol. 2011;11:21. [PubMed] [DOI] |
| 23. | Tsung A, Sahai R, Tanaka H, Nakao A, Fink MP, Lotze MT, Yang H, Li J, Tracey KJ, Geller DA. The nuclear factor HMGB1 mediates hepatic injury after murine liver ischemia-reperfusion. J Exp Med. 2005;201:1135-1143. [PubMed] |
| 24. | Wang H, Bloom O, Zhang M, Vishnubhakat JM, Ombrellino M, Che J, Frazier A, Yang H, Ivanova S, Borovikova L. HMG-1 as a late mediator of endotoxin lethality in mice. Science. 1999;285:248-251. [PubMed] |
| 25. | Scaffidi P, Misteli T, Bianchi ME. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation. Nature. 2002;418:191-195. [PubMed] |
| 26. | Bonaldi T, Talamo F, Scaffidi P, Ferrera D, Porto A, Bachi A, Rubartelli A, Agresti A, Bianchi ME. Monocytic cells hyperacetylate chromatin protein HMGB1 to redirect it towards secretion. EMBO J. 2003;22:5551-5560. [PubMed] |
| 27. | Lin CW, Zhang H, Li M, Xiong X, Chen X, Chen X, Dong XC, Yin XM. Pharmacological promotion of autophagy alleviates steatosis and injury in alcoholic and non-alcoholic fatty liver conditions in mice. J Hepatol. 2013;58:993-999. [PubMed] [DOI] |
| 28. | Ni HM, Bockus A, Boggess N, Jaeschke H, Ding WX. Activation of autophagy protects against acetaminophen-induced hepatotoxicity. Hepatology. 2012;55:222-232. [PubMed] [DOI] |
| 29. | Amir M, Zhao E, Fontana L, Rosenberg H, Tanaka K, Gao G, Czaja MJ. Inhibition of hepatocyte autophagy increases tumor necrosis factor-dependent liver injury by promoting caspase-8 activation. Cell Death Differ. 2013;20:878-887. [PubMed] [DOI] |
| 30. | Bader T, Korba B. Simvastatin potentiates the anti-hepatitis B virus activity of FDA-approved nucleoside analogue inhibitors in vitro. Antiviral Res. 2010;86:241-245. [PubMed] [DOI] |