修回日期: 2013-10-21
接受日期: 2013-10-30
在线出版日期: 2013-12-18
目的: 通过克隆、表达一种有前景的肝癌肿瘤标志物人去羟基凝血素(Des-γ-carboxy prothrombin, DCP), 制备抗DCP单克隆抗体并初步鉴定其特性.
方法: 依据DCP基因序列, 合成DCP全长基因, 构建原核表达载体pColdⅡ-DCP, 转化至Escherichia coli BL21(DE3), IPTG诱导表达, 以Ni2+亲和层析柱纯化带有His标签的DCP蛋白. 纯化的蛋白免疫Balb/c小鼠, 制备抗DCP单克隆抗体. 以ELISA法检测抗体效价与亚型; Western blot和免疫组织化学染色鉴定抗体特异性.
结果: 成功表达并获得DCP蛋白, 其相对分子量约为23000; 获得1株稳定分泌抗人DCP单克隆抗体杂交瘤细胞株3B5; Western blot和免疫组织化学结果显示抗人DCP单克隆抗体能与DCP发生特异性结合, 且ELISA检测抗体的效价为1:2.43×105, 其亚类为IgG2a.
结论: 成功制备了抗人DCP单克隆抗体, 为进一步将该抗体应用于肝癌的早期诊断提供了重要工具.
核心提示: 本文以pCold Ⅱ原核表达载体诱导表达纯化6×His标签的人去羟基凝血素(Des-γ-carboxy prothrombin, DCP)重组蛋白, 为今后规模化生产提供基础; 并最终获得1株持续稳定分泌抗DCP mAb杂交瘤细胞株, 成功制备了效价高、特异性好的鼠抗人DCP单克隆抗体, 并检测了肝细胞肝癌中的DCP的表达.
引文著录: 沈鹏, 司进, 李琦雯, 渠利利, 李璐蓉, 严晓璐, 季国忠. 异常凝血酶DCP基因克隆表达、纯化及单克隆抗体制备与鉴定. 世界华人消化杂志 2013; 21(35): 3932-3939
Revised: October 21, 2013
Accepted: October 30, 2013
Published online: December 18, 2013
AIM: To clone and express human des-γ-carboxy prothrombin (DCP), a valuable serum marker for hepatocellular carcinoma (HCC), and to prepare the monoclonal antibody (mAb) against DCP.
METHODS: The DCP gene was cloned into the prokaryotic expression vector pCold II. The recombinant construct was expressed in BL21 Escherichia coli strain, and the recombinant protein with an N-terminal 6-His tag was purified by nickel chelate-nitrilotriacetic-acid (Ni-NTA) affinity chromatography. The purified protein was used to immunize the Balb/c mice for mAb preparation. The sensitivity and specificity of the mAb were assessed by indirect enzyme-linked immunosorbent assay (ELISA), Western blot and immunohistochemistry.
RESULTS: The recombinant DCP protein was successfully expressed and purified, and its molecular weight was approximately 23 kDa. One hybridoma cell line stably secreting anti-DCP monoclonal antibody named 3B5 was obtained. Western blot analysis and immunohistochemistry indicated that the DCP mAb showed specific combination with DCP. ELISA detection indicated that the titer of the mAb was 1:2.43 × 105. The immunoglobulin isotype of the mAb was identified as IgG2a.
CONCLUSION: The successful preparation of DCP mAb may lay a solid foundation for the research of the use of DCP in early diagnosis of HCC.
- Citation: Shen P, Si J, Li QW, Qu LL, Li LR, Yan XL, Ji GZ. Human des-γ-carboxy prothrombin: Cloning, expression and monoclonal antibody preparation. Shijie Huaren Xiaohua Zazhi 2013; 21(35): 3932-3939
- URL: https://www.wjgnet.com/1009-3079/full/v21/i35/3932.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i35.3932
肝细胞性肝癌(hepatocellular carcinoma, HCC)是一种常见的恶性肿瘤, 其死亡率很高. 在我国, 肝癌的死亡率占恶性肿瘤的第2位, 占全球肝癌死亡人数的53%[1], 肝癌的发生发展是一个涉及多阶段、多因素的复杂过程, 除了依赖于肿瘤细胞自身以外, 肿瘤周围的局部微环境也起着重要的作用[2]. 在我国, HCC主要和乙型肝炎病毒感染、肝硬化相关. 有典型临床症状的就诊患者, 往往已届晚期, 肝癌的早期诊断是治疗能否取得成功的关键, 而每年一次的血清甲胎蛋白(α-fetoprotein, AFP)测定和B型超声检查是肝癌普查的基本措施[3,4]. 目前, AFP是临床上诊断HCC最常用的血清肿瘤标志物, 但是AFP在一些良性肝病、部分生殖系统和胃肠道的恶性肿瘤中也会升高, 诊断肝癌仍存在一定的缺陷[5,6], 所以寻找新的有助早期诊断HCC血清标志物一直是备受关注的研究热点.
Liebman等[7]在1984年首次报道了人去羟基凝血素(Des-γ-carboxy prothrombin, DCP)水平升高存在于91%的肝癌患者血清中. DCP即异常凝血酶原, 与正常凝血酶原区别在于其氨基酸特定位置上的谷氨酸残基未经羧基化. 当肝细胞发生癌变时, 内质网不能将DCP羧化成有活性的凝血酶原, 从而使DCP含量升高. DCP在临床上是一个具有很好应用前景的肝癌血清标志物, 如果作为AFP诊断HCC的补充指标, 将能改善HCC的早期诊断.
关于DCP蛋白的生物学功能研究已经全面开展, 亟需高质量的抗体. 虽然DCP被发现时间较久, 国外已有抗体, 但是价格昂贵, 而且目前国内对于抗DCP抗体制备的报道较少. 因为DCP单克隆抗体的生产会受到如抗原的免疫原性低、复性困难的限制等原因, 难以规模化扩大生产, 不适合其推广使用. 为此, 本研究拟通过构建DCP原核表达载体, 表达、纯化DCP重组蛋白, 免疫小鼠, 获得一株能稳定分泌抗人DCP单抗的杂交瘤细胞. 经ELISA及Western blot等多种手段对所得的单克隆抗体进行生物学特性分析, 制备出具有良好特异性和效价的抗DCP mAb, 为进一步研究DCP在肝癌发生发展中的作用机制以及为后期肝癌早期诊断试剂条的开发奠定了良好的实验基础.
质粒pCold Ⅱ、菌株大肠杆菌(Escherichia coli, E. coli)宿主菌DH5α和BL21(DE3)、小鼠骨髓瘤细胞株(Sp2/0)由本实验室保存; 实验动物Balb/c小鼠(6-8周龄, ♀, SPF清洁级)购自南京医科大学实验动物中心; 胎牛血清购自美国Invitrogen公司; 辣根过氧化物酶标记的山羊抗小鼠IgG抗体购自北京中杉金桥生物技术有限公司; 标准蛋白Marker、Taq DNA聚合酶、T4 DNA连接酶购自美国Fermentas公司、限制性内切酶NdeⅠ和Hind Ⅲ购自TaKaRa公司; ECL试剂盒、Protein A琼脂糖亲和层析柱、Ni-NTA琼脂糖柱购自GE Healthcare公司; 弗氏完全佐剂和不完全佐剂、免疫球蛋白标准亚类鉴定试剂盒、细胞培养基均为美国Sigma产品; BCA蛋白定量试剂盒购自凯基公司; 引物由南京钟鼎生物有限责任公司合成.
1.2.1 pCold Ⅱ-DCP表达载体的构建: 依据DCP基因序列, 合成DCP基因后, 经1.5%琼脂糖凝胶电泳检测, 并对其用限制性内切酶NdeⅠ和HindⅢ双酶切的原核表达载体pCold Ⅱ连接, 转化至大肠杆菌E. coli. DH5α中扩增, 再转入E. coli. BL21(DE3)感受态细胞, 接种于LB固体培养基中, 含氨苄青霉素(Amp)100 mg/L, 抽取质粒, 进行NdeⅠ和HindⅢ酶切鉴定和测序(测序由南京钟鼎生物有限责任公司完成).
1.2.2 DCP融合蛋白的表达及纯化: 挑取含重组质粒pCold Ⅱ-DCP-BL21的菌落接种于10 mL LB培养基(Amp, 100 mg/L)中, 220 r/min 37 ℃摇菌过夜, 按1:100比例接种于1000 mL的LB培养基(Amp, 100 mg/L)中, 相同条件下培养3 h, 待菌液达到A600时加入IPTG至终浓度为0.5 mmol/L, 15 ℃、25 ℃、37 ℃分别振摇培养16 h, 诱导培养结束后, 收集菌体到50 mL无菌离心管, 并分别对不同诱导时间样品行SDS-PAGE电泳, 未诱导的工程菌做对照, 分析不同诱导温度条件下目的蛋白表达情况, 摸索最佳诱导温度. 5000 r/min 4 ℃离心10 min, 弃上清, 重悬于20 mL lysis buffer(20 mmol/L Tris-HCl包含1 mmol/L蛋白酶抑制剂混合物, pH 8.0)中, 经细胞超声破碎仪破碎(超声2 s、冷却4 s、功率100 W), 12000 r/min、4 ℃离心15 min后分别收集沉淀和上清, SDS-PAGE分析目的蛋白的可溶情况. 沉淀重悬于lysis buffer (含8 mol/L尿素), 并经0.22 μm滤膜过滤, 过Ni-NTA层析柱进行纯化; 10倍的柱体积lysis buffer(含8 mol/L尿素+20 mmol/L咪唑)洗涤; 用buffer C(20 mmol/L Tris-HCl buffer, pH 8.0, 含150 mmol/L NaCl, 8 mol/L尿素, 250 mmol/L咪唑)洗脱目的蛋白. 将洗脱的蛋白, 用含有一定浓度梯度的尿素(6、5、4、2、1 mol/L)进行复性, 最终用PBS透析. 透析完成后冻干浓缩蛋白, 测定浓度为1.5 mg/mL, 后进行SDS-PAGE分析.
1.2.3 动物免疫: 取6只6-8周龄体质量为18-20 g的Balb/c小鼠, 首次免疫时将纯化的DCP蛋白与等体积弗氏完全佐剂完全混合乳化, 经左下腹注射, 剂量为100 μg/只, 以后每隔2 wk取同等剂量的抗原和等体积的弗氏不完全佐剂加强免疫, 共计4次. 第4次加强免疫1 wk后眼眶采血, 间接ELISA法检测小鼠外周血抗DCP抗体的效价. 效价高者于融合前3 d用纯化的蛋白尾静脉冲击免疫一次, 注射剂量同前.
1.2.4 mAb的制备、纯化与效价测定: (1)杂交瘤细胞的制备: 将生长状态良好的Sp2/0骨髓瘤细胞与免疫小鼠脾细胞以1:10的比例混合, 加入50%聚乙二醇(polyethylene glycol, PEG)进行融合, 融合过程按常规方法进行[8,9]. 用DCP表达蛋白作为检测抗原, 对有融合细胞孔的上清液进行间接ELISA检测, 一抗为细胞培养上清, 二抗为辣根过氧化物酶标记的山羊抗小鼠IgG(1:2000稀释), TMB显色检测筛选阳性细胞克隆株. 将筛选的阳性细胞克隆株用有限稀释法进行单克隆筛选, 间接ELISA法检测, 直至阳性率达100%, 筛选出稳定分泌抗DCP抗体的杂交瘤细胞株进行扩大培养, 并冻存于液氮中; (2)抗体的纯化及效价测定: 选择Balb/c经产母鼠, 每只腹腔注射灭菌液体石蜡0.5 mL, 1 wk后, 经腹腔接种杂交瘤细胞0.5 mL(1×106细胞/只). 10-14 d后小鼠腹部明显肿胀收集腹水, 12000 r/min离心10 min, 去除上层的脂肪、液体石蜡和沉淀, 吸取淡黄色腹水, 将腹水经Protein A琼脂糖亲和层析柱获得纯化抗体, 之后在PBS中进行4 ℃透析过夜, 隔日BCA法测定抗体浓度, ELISA法测定抗体效价, 然后加入50%甘油混合, 小量分装后-80 ℃保存备用.
1.2.5 mAb的生物学特性分析和鉴定: (1)mAb的Ig亚类鉴定: 取杂交瘤培养上清, 采用ELISA方法进行亚型测定(参照Sigma公司小鼠单克隆抗体亚型检测试剂盒说明书进行); (2)mAb特异性鉴定: 将上述表达的DCP蛋白用12%SDS-PAGE凝胶电泳, 转移至硝酸纤维素膜, 5%脱脂奶粉封闭2 h, 应用上述制备的抗DCP mAb为一抗, 1:1000稀释, 4 ℃孵育过夜, TBST洗涤4次, 加入辣根过氧化物酶标记的山羊抗小鼠IgG(1:8000稀释), 37 ℃孵育1 h, 洗涤, 最后凝胶成像仪进行显色, 观察结果; (3)mAb效价的检测: 将杂交瘤细胞的培养上清, 按梯度稀释, 经间接ELISA法测定mAb的效价(效价即样品A/空白A≥2.1的最高稀释度).
1.2.6 免疫组织化学法检测及结果判断: 取人正常肝组织及肝癌石蜡组织, 制作4 μm厚的组织切片进行二甲苯脱蜡, 用0.03%H2O2室温处理切片20 min, 消除内源性过氧化酶的活性, 用血清封闭, DCP一抗(1:400)孵育1 h后, 加生物素标记的第二抗体, 孵育45 min, 加ABC复合物45 min, DAB显色, 观察、记录.
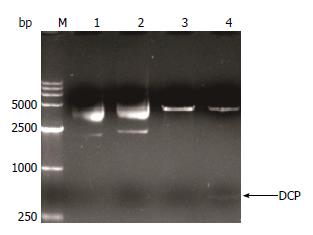
重组质粒pCold Ⅱ-DCP经5' NdeⅠ和3' Hind Ⅲ进行双酶切, 出现两条特异性条带, 位置与pCold Ⅱ和目的片段的大小一致(图1). 测序结果显示目标序列与NCBI(Accession number. NC_000011.9)相应序列相符, 证实表达载体pCold II-DCP构建成功.
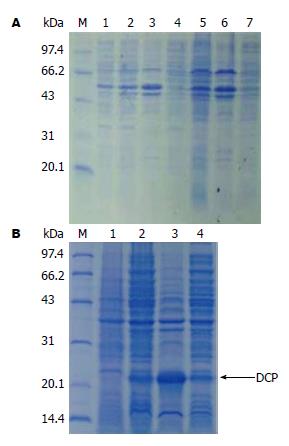
2.2.1 摸索最佳诱导温度选择及DCP蛋白的可溶性分析: 温度对于目的蛋白的表达量以及表达形式有非常重要的影响. 0.5 mmol/L IPTG浓度、诱导16 h相同的条件下, 选取3个不同的温度梯度15 ℃、25 ℃和37 ℃对pCold Ⅱ-DCP-BL21大肠杆菌进行诱导表达. 诱导后SDS-PAGE(图2)电泳显示: 在15 ℃、23 kDa处有DCP的表达, 且表达在沉淀中.
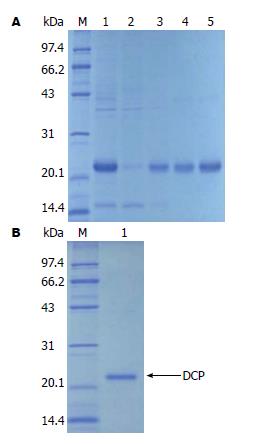
2.2.2 DCP蛋白的纯化及复性: 大量诱导经超声破碎, 取其沉淀, 经Ni2+亲和层析柱纯化及复性(图3), 并BCA法测定蛋白浓度为1.5 mg/mL, 用BID-RAD quantity one软件分析显示DCP蛋白纯度>80%.
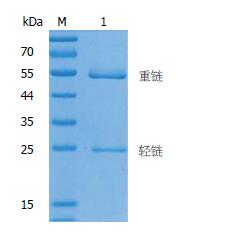
取血清抗体效价最高的免疫小鼠的脾细胞与Sp2/0骨髓瘤细胞融合, 采用ELISA法检测细胞培养上清中抗体的分泌情况, 结果初筛10株阳性克隆; 又进行3次单克隆筛选, 直至所有克隆孔的阳性率达100%. 阳性克隆按有限稀释法进行克隆化培养, 筛选出1株稳定分泌特异性抗DCP mAb的杂交瘤细胞株, 命名为3B5, 通过Protein A亲和层析获得纯化的抗体, 电泳结果显示呈清晰的两条带, 分别为免疫球蛋白重链约55 kDa, 轻链约25 kDa(图4), 用BCA法测定纯化的抗体浓度为0.7 mg/mL; 经过3 mo以上传代能良好生长, 并稳定分泌抗体.
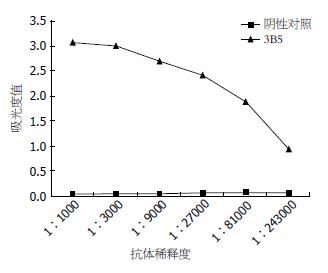
(1)mAb的Ig亚类鉴定: 应用Sigma单克隆抗体亚类检测试剂盒进行抗体亚类鉴定, 按照说明书酶联免疫捕获法表明其免疫球蛋白亚类为IgG2a; (2)mAb特异性鉴定: 单克隆抗体的特异性通过免疫印迹实验进行验证. 用已获得的抗DCP mAb为一抗, 结果显示, 经诱导后与纯化后的DCP蛋白在23 kDa处各有一条特异的反应条带(图5), 而未经诱导的菌体蛋白没有条带, 证明此单抗特异性针对DCP重组蛋白; (3)mAb效价的检测: 经间接ELISA测定, 小鼠腹水DCP单克隆抗体的效价达1:243000以上(图6).
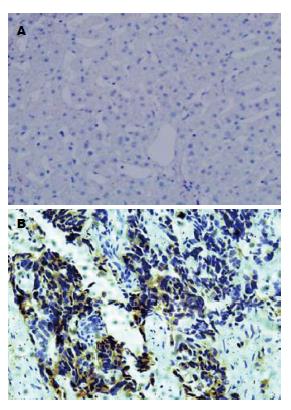
以抗DCP mAb为一抗, 对正常肝组织及肝癌组织的石蜡切片进行免疫组织化学染色显示(图7), 正常肝组织呈阴性, 而肝癌组织呈阳性反应.
正常凝血酶原是在一种依赖维生素K的γ谷氨酰羧化酶的参与下, 将结构中的10个谷氨酸(Glu)残基羧化成γ-羧基谷氨酸(Gla), 使之成为有活性的凝血酶原. 如果上述任何位点的一个或多个Glu残基羧化不全, 都将可能形成异常的凝血酶原(DCP). 当VitK减少时, 无法使肝细胞内质网上的肽链N端的谷氨酸残基羧化成γ-羧基谷氨酸(Gla), 形成有活性的凝血酶原即以去羧基凝血酶原形式释放入血[10], 这种去羧基凝血酶原又常被称为VitK缺乏诱导蛋白或异常凝血酶原. 当肝细胞发生癌变时, 内质网不能将DCP羧化成有活性的凝血酶原, 从而使血清中DCP含量升高. 血清中的DCP水平明显升高除发生在HCC外, 还可见于阻塞性黄疸和肝内胆汁淤积引起的长期维生素K缺乏或服用维生素K拮抗剂患者. Bertino等[11]在对肝癌患者用维生素K治疗后, 发现DCP水平降低, 但是AFP水平并不受影响, 提示维生素K缺乏可能是导致DCP水平升高一个因素. 也有可能是γ谷氨酰羧化酶活性降低, 不能使谷氨酸残基羧化成γ-羧基谷氨酸(Gla), 或者是凝血酶原前体产生过多, 但这些异常的情况可能并不是单独起作用, 而是共同引起DCP水平的升高[12].
目前, 临床上筛选早期HCC的肿瘤标志物仍以AFP为主, 但是对于AFP低浓度或阴性的患者容易造成漏诊. 故目前急需寻找一种敏感性更高、特异性更强的肿瘤标志物, 建立高效、便捷的检测方法, 来提高HCC的早期诊断率. 而DCP对于HCC的诊断是一个有用的肿瘤标志物. 近来, 已经进行的几项大规模的病例研究中发现在截断点为40 mAU/mL时, DCP诊断HCC的敏感性、特异性和诊断的精确性分别波动于55.9%-87.0%、85.0%-99.8%和59.0%-84.0%[13]. 在1031例样本丙型肝炎抗肝硬化治疗临床试验(hepatitis C antiviral long-term treatment against cirrhosis, HALT-C)队列研究中, 有学者比较了AFP与DCP在早期诊断肝癌的准确性, 在早期诊断的所有检测时间, 发现DCP有更高的敏感性与特异性, 联合检测可以达到更高的敏感性[14]. 这个结果也与Ertle等[15]研究结果相符. 最近的系统评价表明, DCP作为诊断HCC的血清标志物, 其灵敏度为67%(95%CI: 58%-74%), 特异性为92%(95%CI: 88%-94%)[16]. DCP与肝癌细胞血管侵袭[17]、肝脏肿瘤组织的大小有密切关系, 而与血清AFP水平无明显关联[18]. Suzuki等[19]研究发现, 当HCC细胞经历轻微的表型变化时, 会产生DCP. 但是, 当肝癌细胞向间质转化时, 他们合成蛋白的能力会减弱, DCP产生会减少. DCP可能是一个独一无二的反映HCC细胞表型变化的肿瘤标志物. Yue等[20]研究发现DCP结合细胞表面受体Met, 导致Met磷酸化, 进而激活EGFR. 而且DCP可以增加基质金属蛋白酶-2(matrix metalloproteinases-2, MMP-2)和MMP-9的表达与分泌, 通过激活细胞外调节蛋白激酶1/2-丝裂原活化蛋白激酶(extracellular regulated protein kinases-mitogen-activated protein kinase, ERK1/2-MAPK)信号通路来刺激肝癌的生长并促进其转移. DCP在预测HCC肿瘤行为起到关键作用. 但是目前的基础机制并不是很明确, 所以需要更多的研究.
DCP不仅可作为HCC的诊断指标, 而且也可应用于监测治疗效果、预后的判断和随访及复发的治疗预后[21], HCC患者AFP和DCP都增高的情况下其生存率是最低的, 无1人存活时间超过3年, 相反AFP和DCP均低的患者却有较好的预后[22]. 在有乙型肝炎背景的HCC患者中, 血清DCP水平较高的患者, 肿瘤更具有侵袭的特征, 并且这些患者的平均生存时间缩短[23]. 对于小肝癌, 术前DCP水平高会有肿瘤复发的可能性[24]. Yamashita等[25]研究发现在HCC>2 cm时, DCP水平高时(>100 mAU/mL)更容易发生微侵袭. 因此, 在这种患者, 肝切除手术被推荐. 而且DCP可以作为评估肿瘤对索拉非尼反应性的预测分子[26], 或者作为肝移植受体的参考标准[12].
近年有关肝癌标志物的研究较多, 一些新技术如基因芯片和蛋白质组学的应用已经筛选出了很多基因和蛋白, 众多新的标志物被发现. 但很多研究尚缺乏多中心和大样本资料的验证, 使研究结果的说服力有限. 而且由于实验的方法、筛选的临界值和研究的群体不同, 导致研究结果很难比较. 目前临床上标志物众多, 但在血清检查中尚没有单一的高特异性和敏感性的肿瘤标志物可以检测出所有的肝癌患者. 每一种肿瘤标志物在诊断上都有其独特的优势, 但是也有他的局限性. 因此, 对肿瘤标志物的联合检测至关重要, 可以增加诊断肝癌的敏感性[27]. 如AFP、AFP-L3和DCP的应用[28,29], AFP特异性不足, 但是被广泛应用于治疗评估与预后预测. DCP是一个独一无二的标志物, 与AFP值无关, 可以预测微血管侵袭, AFP-L3有很高特异性而且是很强的预后预测分子, 3个标志物在HCC临床各个方面必不可少. 而且AFP、AFP-L3、DCP的联合检测在小肝癌的诊断方面比早期传统的组后更优胜、更准确[30]. 联合检测可以更好的早期诊断肝癌, 提高诊断的效率, 这也是近几年来肿瘤早期血清学诊断发展的方向. 联合检测项目越多, 其诊断特异性越强, 但是其敏感性并非越高, 同时也会给患者在经济上带来不必要的负担. 因此科学合理运用已知的肿瘤标志物来联合诊断HCC至关重要.
目前DCP蛋白的生物学功能研究已经全面开展, 亟需高质量的抗体. 但是关于DCP的单克隆抗体制备报道较少, 免疫的抗原难以制备可能是其中的主要原因. 本研究以大肠杆菌E. coli BL21(DE3)原核表达系统, 其具有营养要求低、操作方便、周期短、蛋白表达量高、试验成本低等优点, 是目前一种广泛应用的基因表达系统. 本实验原核表达DCP产量较高, 有一定的优势. 本研究选择带有6×His标签的pCold Ⅱ为原核表达载体, 此载体可以在较低的温度及诱导剂浓度下诱导目的蛋白表达, 有利于蛋白结构的稳定, 并提高蛋白产量. His标签与其他标签相比有很多明显优势, 是目前用于纯化的融合标签中使用最为广泛的一种. His因其分子量较小, 免疫原性少, 对目的蛋白的大小、构象和特性影响不大, 纯化之后的重组蛋白不必除去标签; 再者His不带电(pH 8.0), 不会对蛋白质的表达、分泌、折叠、构象形成等产生显著影响, 以前常用的GST标签, 因其分子量较大, 在纯化后需要切除标签后才能进行下一步的检测分析; 而且与之前有研究用DEAE-Sephacel分离DCP蛋白相比[31], 更容易得到和天然蛋白相似的产物, 更好的作为抗原免疫制备抗体. 因为重组蛋白免疫原性较好, 而且可大量诱导纯化, 这也避免了基因免疫后抗体效价低, 很难制备单克隆抗体的缺点. 本研究研制的抗体识别DCP的条带仅有一条, 且免疫组织化学结果阳性, 表明抗体特异性较好, 原核表达诱导小鼠产生的主要是针对非糖基化和线性化表位的抗体, 所以本抗体可能与DCP非糖基化位点上出现特异性的结合, 有待进一步研究确认.
总之, 本研究的重要意义: (1)以pCold Ⅱ原核表达载体诱导表达纯化6×His标签的DCP重组蛋白, 为今后规模化生产提供基础; (2)最终获得1株持续稳定分泌抗DCP mAb杂交瘤细胞株, 成功制备了效价高、特异性好的鼠抗人DCP单克隆抗体, 并检测了肝细胞肝癌中的DCP的表达, 为以后的DCP在肝癌发生发展中的功能研究及后期肝癌早期诊断试剂条的开发奠定了良好的检测工具.
肝细胞性肝癌(hepatocellular carcinoma, HCC)是一种常见的恶性肿瘤, 其死亡率很高. 肝癌的早期诊断是治疗能否取得成功的关键, 而临床上甲胎蛋白(α-fetoprotein, AFP)诊断肝癌仍存在一定的不足, 所以寻找新的有助早期诊断HCC血清标志物一直是备受关注的研究热点.
高润平, 教授, 吉林大学第一医院肝胆胰内科
人去羟基凝血素(Des-γ-carboxy prothrombin, DCP)在临床上是一个具有很好应用前景的肝癌血清标志物. 虽然DCP被发现时间较久, 国外已有抗体, 但是价格昂贵, 而且DCP抗体的生产会受到如抗原的免疫原性低、复性困难的限制等原因, 难以规模化扩大生产, 不适合其推广使用. 关于DCP蛋白的生物学功能研究已经全面开展, 亟需高质量的抗体.
Gao等关于DCP的Meta分析中, 可以看出DCP是一个可以与AFP相媲美的肝癌肿瘤标志物.
本实验选择带有His标签的pCold Ⅱ低温表达DCP, 蛋白结构稳定, 产量较高, 与天然蛋白相似, 可更好的作为抗原免疫制备较高质量抗体.
为进一步研究DCP在肝癌发生发展中的作用机制以及为后期肝癌早期诊断试剂条的开发、ELISA方法或磁酶免疫方法的建立奠定了良好的实验基础.
本文作者通过基因克隆技术成功制备了DCP融合蛋白, 进而将其免疫小鼠, 制备了抗DCP mAb的杂交瘤细胞株, 成功制备了抗人DCP单克隆抗体, 经免疫印迹和免疫组织化学初步验证其具有良好的特异结合活性. 本研究为提高肝细胞癌的早期确诊率提供了理论基础和实验依据.
编辑: 郭鹏 电编:鲁亚静
| 1. | Poon D, Anderson BO, Chen LT, Tanaka K, Lau WY, Van Cutsem E, Singh H, Chow WC, Ooi LL, Chow P. Management of hepatocellular carcinoma in Asia: consensus statement from the Asian Oncology Summit 2009. Lancet Oncol. 2009;10:1111-1118. [PubMed] [DOI] |
| 2. | Wu SD, Ma YS, Fang Y, Liu LL, Fu D, Shen XZ. Role of the microenvironment in hepatocellular carcinoma development and progression. Cancer Treat Rev. 2012;38:218-225. [PubMed] [DOI] |
| 3. | Altekruse SF, McGlynn KA, Dickie LA, Kleiner DE. Hepatocellular carcinoma confirmation, treatment, and survival in surveillance, epidemiology, and end results registries, 1992-2008. Hepatology. 2012;55:476-482. [PubMed] [DOI] |
| 4. | Trinchet JC, Chaffaut C, Bourcier V, Degos F, Henrion J, Fontaine H, Roulot D, Mallat A, Hillaire S, Cales P. Ultrasonographic surveillance of hepatocellular carcinoma in cirrhosis: a randomized trial comparing 3- and 6-month periodicities. Hepatology. 2011;54:1987-1997. [PubMed] [DOI] |
| 5. | Gupta S, Bent S, Kohlwes J. Test characteristics of alpha-fetoprotein for detecting hepatocellular carcinoma in patients with hepatitis C. A systematic review and critical analysis. Ann Intern Med. 2003;139:46-50. [PubMed] |
| 6. | Spangenberg HC, Thimme R, Blum HE. Serum markers of hepatocellular carcinoma. Semin Liver Dis. 2006;26:385-390. [PubMed] [DOI] |
| 7. | Liebman HA, Furie BC, Tong MJ, Blanchard RA, Lo KJ, Lee SD, Coleman MS, Furie B. Des-gamma-carboxy (abnormal) prothrombin as a serum marker of primary hepatocellular carcinoma. N Engl J Med. 1984;310:1427-1431. [PubMed] [DOI] |
| 8. | Köhler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature. 1975;256:495-497. [PubMed] [DOI] |
| 9. | Kearney JF, Radbruch A, Liesegang B, Rajewsky K. A new mouse myeloma cell line that has lost immunoglobulin expression but permits the construction of antibody-secreting hybrid cell lines. J Immunol. 1979;123:1548-1550. [PubMed] |
| 10. | Furie B, Furie BC. Molecular basis of vitamin K-dependent gamma-carboxylation. Blood. 1990;75:1753-1762. [PubMed] |
| 11. | Bertino G, Ardiri AM, Boemi PM, Ierna D, Interlandi D, Caruso L, Minona E, Trovato MA, Vicari S, Li Destri G. A study about mechanisms of des-gamma-carboxy prothrombin's production in hepatocellular carcinoma. Panminerva Med. 2008;50:221-226. [PubMed] |
| 12. | Inagaki Y, Tang W, Makuuchi M, Hasegawa K, Sugawara Y, Kokudo N. Clinical and molecular insights into the hepatocellular carcinoma tumour marker des-γ-carboxyprothrombin. Liver Int. 2011;31:22-35. [PubMed] [DOI] |
| 13. | Omata M, Lesmana LA, Tateishi R, Chen PJ, Lin SM, Yoshida H, Kudo M, Lee JM, Choi BI, Poon RT. Asian Pacific Association for the Study of the Liver consensus recommendations on hepatocellular carcinoma. Hepatol Int. 2010;4:439-474. [PubMed] [DOI] |
| 14. | Lok AS, Sterling RK, Everhart JE, Wright EC, Hoefs JC, Di Bisceglie AM, Morgan TR, Kim HY, Lee WM, Bonkovsky HL. Des-gamma-carboxy prothrombin and alpha-fetoprotein as biomarkers for the early detection of hepatocellular carcinoma. Gastroenterology. 2010;138:493-502. [PubMed] [DOI] |
| 15. | Ertle JM, Heider D, Wichert M, Keller B, Kueper R, Hilgard P, Gerken G, Schlaak JF. A combination of α-fetoprotein and des-γ-carboxy prothrombin is superior in detection of hepatocellular carcinoma. Digestion. 2013;87:121-131. [PubMed] [DOI] |
| 16. | Gao P, Li M, Tian QB, Liu DW. Diagnostic performance of des-γ-carboxy prothrombin (DCP) for hepatocellular carcinoma: a bivariate meta-analysis. Neoplasma. 2012;59:150-159. [PubMed] [DOI] |
| 17. | Matsubara M, Shiraha H, Kataoka J, Iwamuro M, Horiguchi S, Nishina S, Takaoka N, Uemura M, Takaki A, Nakamura S. Des-γ-carboxyl prothrombin is associated with tumor angiogenesis in hepatocellular carcinoma. J Gastroenterol Hepatol. 2012;27:1602-1608. [PubMed] [DOI] |
| 18. | Takayasu K, Arii S, Sakamoto M, Matsuyama Y, Kudo M, Ichida T, Nakashima O, Matsui O, Izumi N, Ku Y. Clinical implication of hypovascular hepatocellular carcinoma studied in 4,474 patients with solitary tumour equal or less than 3 cm. Liver Int. 2013;33:762-770. [PubMed] [DOI] |
| 19. | Suzuki H, Murata K, Gotoh T, Kusano M, Okano H, Oyamada T, Yasuda Y, Imamura M, Kudo M, Mizokami M. Phenotype-dependent production of des-γ-carboxy prothrombin in hepatocellular carcinoma. J Gastroenterol. 2011;46:1219-1229. [PubMed] [DOI] |
| 20. | Yue P, Gao ZH, Xue X, Cui SX, Zhao CR, Yuan Y, Yin Z, Inagaki Y, Kokudo N, Tang W. Des-γ-carboxyl prothrombin induces matrix metalloproteinase activity in hepatocellular carcinoma cells by involving the ERK1/2 MAPK signalling pathway. Eur J Cancer. 2011;47:1115-1124. [PubMed] [DOI] |
| 21. | Bertino G, Ardiri AM, Calvagno GS, Bertino N, Boemi PM. Prognostic and diagnostic value of des-γ-carboxy prothrombin in liver cancer. Drug News Perspect. 2010;23:498-508. [PubMed] [DOI] |
| 22. | Chon YE, Choi GH, Lee MH, Kim SU, Kim do Y, Ahn SH, Kim KS, Choi JS, Han KH, Chon CY. Combined measurement of preoperative α-fetoprotein and des-γ-carboxy prothrombin predicts recurrence after curative resection in patients with hepatitis-B-related hepatocellular carcinoma. Int J Cancer. 2012;131:2332-2341. [PubMed] [DOI] |
| 23. | Kim HS, Park JW, Jang JS, Kim HJ, Shin WG, Kim KH, Lee JH, Kim HY, Jang MK. Prognostic values of alpha-fetoprotein and protein induced by vitamin K absence or antagonist-II in hepatitis B virus-related hepatocellular carcinoma: a prospective study. J Clin Gastroenterol. 2009;43:482-488. [PubMed] [DOI] |
| 24. | Bae HM, Lee JH, Yoon JH, Kim YJ, Heo DS, Lee HS. Protein induced by vitamin K absence or antagonist-II production is a strong predictive marker for extrahepatic metastases in early hepatocellular carcinoma: a prospective evaluation. BMC Cancer. 2011;11:435. [PubMed] [DOI] |
| 25. | Yamashita Y, Tsuijita E, Takeishi K, Fujiwara M, Kira S, Mori M, Aishima S, Taketomi A, Shirabe K, Ishida T. Predictors for microinvasion of small hepatocellular carcinoma ≤ 2 cm. Ann Surg Oncol. 2012;19:2027-2034. [PubMed] [DOI] |
| 26. | Ueshima K, Kudo M, Takita M, Nagai T, Tatsumi C, Ueda T, Kitai S, Ishikawa E, Yada N, Inoue T. Des-γ-carboxyprothrombin may be a promising biomarker to determine the therapeutic efficacy of sorafenib for hepatocellular carcinoma. Dig Dis. 2011;29:321-325. [PubMed] [DOI] |
| 27. | Bertino G, Ardiri A, Malaguarnera M, Malaguarnera G, Bertino N, Calvagno GS. Hepatocellualar carcinoma serum markers. Semin Oncol. 2012;39:410-433. [PubMed] [DOI] |
| 28. | Marrero JA, Feng Z, Wang Y, Nguyen MH, Befeler AS, Roberts LR, Reddy KR, Harnois D, Llovet JM, Normolle D. Alpha-fetoprotein, des-gamma carboxyprothrombin, and lectin-bound alpha-fetoprotein in early hepatocellular carcinoma. Gastroenterology. 2009;137:110-118. [PubMed] [DOI] |
| 29. | Sterling RK, Jeffers L, Gordon F, Venook AP, Reddy KR, Satomura S, Kanke F, Schwartz ME, Sherman M. Utility of Lens culinaris agglutinin-reactive fraction of alpha-fetoprotein and des-gamma-carboxy prothrombin, alone or in combination, as biomarkers for hepatocellular carcinoma. Clin Gastroenterol Hepatol. 2009;7:104-113. [PubMed] [DOI] |
| 30. | Clinical Practice Guidelines for Hepatocellular Carcinoma - The Japan Society of Hepatology 2009 update. Hepatol Res. 2010;40 Suppl 1:2-144. [PubMed] [DOI] |
| 31. | Belle M, Brebant R, Guinet R, Leclercq M. Production of a new monoclonal antibody specific to human des-gamma-carboxyprothrombin in the presence of calcium ions. Application to the development of a sensitive ELISA-test. J Immunoassay. 1995;16:213-229. [PubMed] [DOI] |