修回日期: 2013-09-06
接受日期: 2013-11-06
在线出版日期: 2013-12-08
目的: 探索糖尿病与胃癌的发生的病因学联系.
方法: 检索美国一项索引(MedLine)、荷兰医学文摘(EMBASE)、Cochrane图书馆和中国生物医学文献数据库(1990-01/2013-07)国内外公开发表的关于糖尿病患者的胃癌发病率的前瞻性队列研究, 共有15项研究符合纳入标准. 我们以NOS评定量表(Newcastle-Ottawa Quality Assessment Scale)为依据进行质量评价, 使用STATA12.0软件, 选用DerSimonian-Laird的随机效应模型.
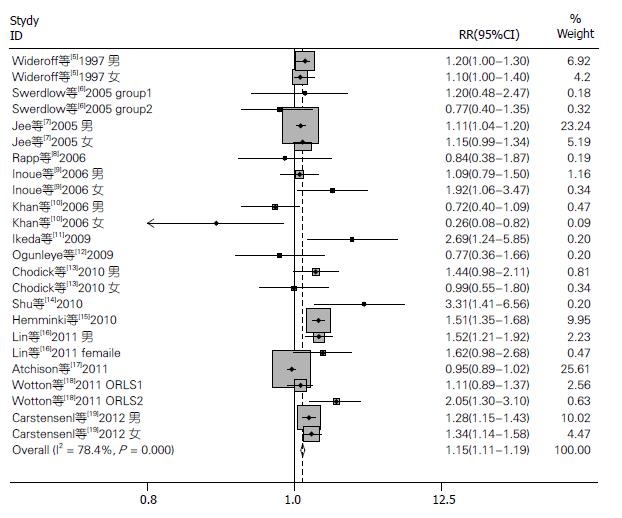
结果: 与对照组相比, 糖尿病患者经Meta分析后的发生胃癌的相对危险度(relative risk, RR)值为1.15, 95%CI: 1.11-1.19, 提示糖尿病患者胃癌发病风险增加.
结论: 糖尿病患者的胃癌发病风险增加.
核心提示: 经荟萃分析, 与对照组相比, 糖尿病患者发生胃癌的相对危险度值为1.15, 95%CI: 1.11-1.19, 提示糖尿病患者胃癌发病风险增加.
引文著录: 陆丽华, 董跃滨. 糖尿病患者胃癌发病风险增加的荟萃分析. 世界华人消化杂志 2013; 21(34): 3870-3875
Revised: September 6, 2013
Accepted: November 6, 2013
Published online: December 8, 2013
AIM: To systematically assess the association between diabetes mellitus and the risk of gastric cancer.
METHODS: We searched Medline (PubMed), EMBASE, the Cochrane Library and CBN databases from January 1990 to July 2013. We also searched the references of qualifying articles. Cohort studies comparing the risk of gastric cancer between diabetic patients and control subjects were included. Fifteen studies met our criteria, and the quality of these studies was assessed using the Newcastle-Ottawa Quality Assessment Scale. Meta-analysis was performed using the random-effects model (DerSimonian-Laird method).
RESULTS: The meta-analysis showed an increased gastric cancer risk in diabetic patients [relative risk (RR) = 1.15, 95%CI: 1.11-1.19].
CONCLUSION: Diabetes mellitus may increase the risk of gastric cancer.
- Citation: Lu LH, Dong YB. Diabetes mellitus increases the risk of gastric cancer: A meta-analysis. Shijie Huaren Xiaohua Zazhi 2013; 21(34): 3870-3875
- URL: https://www.wjgnet.com/1009-3079/full/v21/i34/3870.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i34.3870
糖尿病是临床常见病、多发病, 杨文英教授于2010年发表在《新英格兰杂志》关于中国人糖尿病发病率的最新数据: 年龄标化的总糖尿病患病率和糖尿病前期患病率分别为9.7%和15.5%, 据此推算, 中国9240万例有糖尿病, 1.482亿成年人处于糖尿病前期[1]. 国内外大量研究表明, 在糖尿病人群中恶性肿瘤患病率明显上升, 如大肠癌、子宫内膜癌、乳腺癌、肝癌、胰腺癌[2,3].
胃癌是极其常见的恶性肿瘤, 在世界范围内最常见的恶性肿瘤中排名第4位[4], 其治疗难度大, 预后差. 在治疗上, 手术切除是目前唯一可能根治胃癌的手段, 但仅限于病变较早的Ⅰ期胃癌. 而中晚期胃癌手术及放化疗效果差, 医疗花费巨大, 术后5年生存率一般仅30%-50%. 因此在预防医学中, 提倡胃癌的早预防、早发现、早治疗.
本文以荟萃分析的方法, 整合此前已有的糖尿病与胃癌之间病因学联系的多项研究数据, 而得出可靠的结论. 此结论可为糖尿病患者胃癌的早发现、早治疗提供可靠的理论依据.
通过下列途径收集文献资料: (1)电子数据库检索包括MedLine(PubMed)、EMBASE、Cochrane图书馆和中国生物医学文献数据库; (2)检索词包括diabetes(glucose, diabetes, or hyperglycemia), gastric cancer (stomach cancer, gastric cancer, stomach malignant neoplasm, or gastric malignant neoplasm), and risk (incidence, prevalence, or risk), 检索文献未限制语言; (3)手工检索: 查阅所获资料的参考文献索引, 手工检索相应文献.
1.2.1 资料选择: 纳入与排除标准: 纳入标准: (1)1990-01/2013-07公开发表的有关糖尿病患者中胃癌发病率的前瞻性队列研究; (2)糖尿病患者诊断1年后明确诊断为胃癌; (3)能够提供确切的RR值及其95%可信区间; (4)随访时间为8年以上的研究. 排除标准: (1)综述、教科书内容、读者来信、社论、述评、病例对照研究等; (2)剔除重复报告、质量差、报道信息太少及无法利用的队列研究; (3)如果是同一队列的重复报告, 则仅保留资料最新、最完整的研究报道; (4)随访时间短于8年的研究.
1.2.2 入选文献的质量评价: 分别由2位研究者独立阅读所搜集文献的标题、摘要和全文以选定符合纳入标准的文献, 并对每一篇符合纳入标准的文献进行评价, 不同意见通过讨论解决. 质量评分标准采用NOS质量评定量表(Newcastle-Ottawa Quality Assessment Scale). 纳入的队列研究均考虑了混杂因素(如年龄、性别、吸烟史、饮酒史、体质量等)对RR的影响, 并进行了调整.
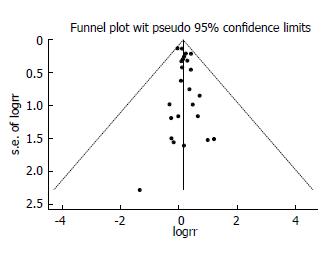
统计学处理 使用STATA12.0软件, 选用DerSimonian-Laird的随机效应模型. 因各文献用糖尿病患者的胃癌发病率为计数资料进行比较, 故在分析时用相对危险度(relative risk, RR)和95%CI为统计指标. P<0.05为差异有统计学意义. 我们还报道了I2的异质性评估值. 使用漏斗图来评价发表偏倚.
共检索到2380篇相关文献, 复习后排除了2362篇相关研究, 最终只有15项研究符合选择标准[5-19](表1). 亚洲有5项研究被纳入, 另7项研究在欧洲进行, 澳大利亚1项研究、美国2项研究符合纳入标准. 入选的研究人群多诊断糖尿病1年以后明确诊断为胃癌, 仅两项研究另外[13,18]. 各文献中研究人群的年龄和随访时间(8-43年)差异较大.
| 纳入的研究 | 国家 | n | 年龄(岁) | 随访年限 | RR (95%CI) |
| Wideroff等[5]1997 | 丹麦 | 109581 | 不限 | 17 | 男1.2(1.0-1.3) |
| 女1.1(1.0-1.4) | |||||
| Swerdlow等[6]2005 | 英国 | 29701 | <49 | 35 | <30岁组1.2(0.48-2.47) |
| 30-49岁组0.77(0.40-1.35) | |||||
| Jee等[7]2005 | 韩国 | 1298385 | 30-95 | 10 | 男1.11 (1.04-1.2) |
| 女1.15 (0.99-1.34) | |||||
| Rapp等[8]2006 | 澳大利亚 | 140813 | >19 | 14 | 0.84 (0.38-1.87) |
| Inoue等[9]2006 | 日本 | 133084 | 40-69 | 14 | 男1.09 (0.79-1.5) |
| 女1.92 (1.06-3.47) | |||||
| Khan等[10]2006 | 日本 | 56881 | 40-79 | 10 | 男0.72 (0.40-1.09) |
| 女0.26 (0.08-0.82) | |||||
| Ikeda等[11]2009 | 日本 | 2603 | ≤40 | 14 | 2.69 (1.24-5.85) |
| Ogunleye等[12]2009 | 英国 | 9577 | 不限 | 11 | 0.77 (0.36-1.66) |
| Chodick等[13]2010 | 以色列 | 16721 | ≥21 | 8 | 男1.44 (0.98-2.11) |
| 女0.99 (0.55-1.80) | |||||
| Shu等[14]2010 | 瑞典 | 24052 | < 21 | 42 | 3.31(1.41-6.56) |
| Hemminki等[15]2010 | 瑞典 | 125126 | >39 | 43 | 1.51(1.35-1.68) |
| Lin等[16]2011 | 美国 | 469448 | 50-71 | 10 | 男1.52(1.21-1.92) |
| 女1.62(0.98-2.68) | |||||
| Atchison等[17]2011 | 美国 | 594815 | >18 | 27 | 0.95(0.89-1.02) |
| Wotton等[18]2011 | 英国 | 15898 | ≥ 30 | 35 | ORLS1 1.11 (0.89-1.37) |
| 7771 | ORLS2 2.05 (1.30-3.10) | ||||
| Carstensenl等[19]2012 | 丹麦 | 未提供数据 | 不限 | 15 | 男1.28 (1.15-1.43) |
| 女1.34 (1.14-1.58) |
使用NOS质量评定量表对文献进行评分. 评价项目主要包括对象选择、可比性、结局(队列研究)共3个项目, 每个项目下设评价条目. 本次荟萃分析纳入的均是高质量的文献(NOS评分≥8).
结果显示15项研究存在较高的异质性, I2 = 78.4%, 故选用随机效应模型进行合并分析. 将15项研究绘制成漏斗图(图2), 该图近似漏斗状, 呈对称图形, 可认为入选文献没有显著的发表偏倚.
以地理位置区分亚组, 共分为亚洲(5篇文献)、欧洲(7篇文献)、美洲(仅美国2篇文献)、大洋洲(仅澳大利亚1篇文献), 未发现明显的地区差别. 同样, 研究显示性别与此无明显关系.
本荟萃分析证实糖尿病患者胃癌发病风险增加, 与以前的研究[20,21]一致(RR = 1.11[20], 95%CI: 1.00-1.24[21]; RR = 1.19, 95% CI: 1.08-1.31). 一项2011年[22]的荟萃分析因其纳入标准、排除标准不同, 得到不同的结论.
关于糖尿病患者胃癌发病风险增加的潜在机制, 有以下几点: (1)有众多证据表明糖尿病可导致多种癌症的高发: 糖尿病早期胰岛素浓度增加刺激细胞增殖, 激活胰岛素受体或胰岛素样生长因子-I受体(insulin-like growth factor I receptor, IGF-IR)和抑制胰岛素样生长因子结合蛋白, 增加胰岛素样生长因子(insulin-like growth factor-I, IGF-I)浓度. 高胰岛素血症已被证明可导致胃肠道癌的发病风险增加[23]; 糖尿病患者的血管内皮生长因子(vascular endothelial growth factor, VEGF)增高. 血管内皮生长因子与肿瘤血行转移、淋巴转移、肝转移等相关[24]. 更重要的是IGF/IGF-IR轴与VEGF/VEGFR系统相互作用, 促进胃肠道恶性肿瘤的发生和进展[25]; 实验证实高血糖直接导致DNA损伤; (2)幽门螺杆菌(Helicobacter pylori, H. pylori)的作用. H. pylori是一种革兰阴性杆菌, 专一性定居于人胃, 大量研究表明H. pylori感染与胃癌的存在或发展相关[26]. 然而, 并非所有H. pylori感染者均进展为胃癌, 提示H. pylori介导的致癌过程需要其他的辅助因子. Khan等[10]的研究提示空腹血糖>5.8 mmol/L且H. pylori阴性者其胃癌的RR为1.5(0.5-5.2), 空腹血糖>5.8 mmol/L且H. pylori阳性者其RR为4.2(1.6-11.1), 这项研究表明高血糖在H. pylori相关的致癌过程中发挥重要的调节作用. 一些研究报道糖尿病患者H. pylori感染率高而根除率低, 提示H. pylori和高血糖之间存在互动[27]. H. pylori可通过增加胃泌素, 促进胰岛素释放, 从而导致高胰岛素血症[28]. 他也可促进胰岛素抵抗和相关的氧化应激[29], 从而导致胃黏膜相关的致癌过程.
瑞典的队列研究[30]共纳入30000例1型糖尿病患者, 证实1型糖尿病患者胃癌的发病率增高(RR = 2.3, 95%CI: 1.1-4.1). 另一项欧洲的研究[6], <30岁的糖尿病患者(主要为1型糖尿病)胃癌的RR为1.2(0.48-2.47), 相对比30-49岁组RR = 0.77(0.40-1.35)高. 恶性贫血和H. pylori可协同导致1型糖尿病患者的胃癌风险增加. 1型糖尿病患者中H. pylori感染更普遍[31].
本荟萃分析纳入的是NOS评分≥8的高质量文献, 均为大规模的队列研究, 糖尿病患者诊断1年后经胃镜或手术、病理等明确诊断为胃癌(时间上符合因果关系), 糖尿病及胃癌均按照当时的诊疗指南进行诊断, 以上均为保证结论真实客观的有利条件.
本荟萃分析纳入的15项研究存在较高的异质性, I2 = 78.4%, 对结果的解释应谨慎. 其中一篇文献[11]按照当时的诊断标准选择糖尿病患者, 分析资料时却用糖化血红蛋白>7.0%来代表糖尿病组, 提醒我们需设置更严格的纳入标准.
本荟萃分析提示糖尿病患者胃癌的发病率上升. 本研究提示糖代谢异常可促进肿瘤的发生与发展、H. pylori感染与胃癌的存在或发展相关, 且两者有协同致癌作用. 1型糖尿病患者发病早, 血糖控制差, H. pylori感染率高, 其胃癌的发病风险更高. 进一步的研究可着重于糖尿病患者发生胃癌的具体机制及相应的治疗措施.
研究表明在糖尿病人群中多种恶性肿瘤患病率明显上升, 糖尿病与胃癌发病之间的相关研究结果不一致, 荟萃分析可通过整合数据而得出可靠结论.
郝丽萍,副教授, 华中科技大学同济医学院公共卫生学院营养与食品卫生学系
世界范围内有多项关于糖尿病与胃癌之间的病因学联系的队列研究和病例的对照研究.
Tian等和Yoon等的两项研究均与本文得到的结论一致. Marimuthu的荟萃分析因其纳入标准、排除标准不同, 得到不同结论.
目前国内尚未有糖尿病与胃癌之间的病因学联系的荟萃分析.
本文提示糖尿病患者胃癌发病风险增加, 有助于糖尿病患者胃癌的早期发现、早期治疗.
糖尿病与很多癌症的发病风险增加已经达成共识, 但与胃癌发病风险关系的研究还未有定论, 本研究选题有一定意义.
编辑: 田滢 电编:闫晋利
| 1. | Yang W, Lu J, Weng J, Jia W, Ji L, Xiao J, Shan Z, Liu J, Tian H, Ji Q. Prevalence of diabetes among men and women in China. N Engl J Med. 2010;362:1090-1101. [PubMed] [DOI] |
| 2. | Giovannucci E, Harlan DM, Archer MC, Bergenstal RM, Gapstur SM, Habel LA, Pollak M, Regensteiner JG, Yee D. Diabetes and cancer: a consensus report. Diabetes Care. 2010;33:1674-1685. [PubMed] [DOI] |
| 3. | Friberg E, Orsini N, Mantzoros CS, Wolk A. Diabetes mellitus and risk of endometrial cancer: a meta-analysis. Diabetologia. 2007;50:1365-1374. [PubMed] [DOI] |
| 4. | Herszényi L, Tulassay Z. Epidemiology of gastrointestinal and liver tumors. Eur Rev Med Pharmacol Sci. 2010;14:249-258. [PubMed] |
| 5. | Wideroff L, Gridley G, Mellemkjaer L, Chow WH, Linet M, Keehn S, Borch-Johnsen K, Olsen JH. Cancer incidence in a population-based cohort of patients hospitalized with diabetes mellitus in Denmark. J Natl Cancer Inst. 1997;89:1360-1365. [PubMed] [DOI] |
| 6. | Swerdlow AJ, Laing SP, Qiao Z, Slater SD, Burden AC, Botha JL, Waugh NR, Morris AD, Gatling W, Gale EA. Cancer incidence and mortality in patients with insulin-treated diabetes: a UK cohort study. Br J Cancer. 2005;92:2070-2075. [PubMed] [DOI] |
| 7. | Jee SH, Ohrr H, Sull JW, Yun JE, Ji M, Samet JM. Fasting serum glucose level and cancer risk in Korean men and women. JAMA. 2005;293:194-202. [PubMed] [DOI] |
| 8. | Rapp K, Schroeder J, Klenk J, Ulmer H, Concin H, Diem G, Oberaigner W, Weiland SK. Fasting blood glucose and cancer risk in a cohort of more than 140,000 adults in Austria. Diabetologia. 2006;49:945-952. [PubMed] [DOI] |
| 9. | Inoue M, Iwasaki M, Otani T, Sasazuki S, Noda M, Tsugane S. Diabetes mellitus and the risk of cancer: results from a large-scale population-based cohort study in Japan. Arch Intern Med. 2006;166:1871-1877. [PubMed] [DOI] |
| 10. | Khan M, Mori M, Fujino Y, Shibata A, Sakauchi F, Washio M, Tamakoshi A. Site-specific cancer risk due to diabetes mellitus history: evidence from the Japan Collaborative Cohort (JACC) Study. Asian Pac J Cancer Prev. 2006;7:253-259. [PubMed] |
| 11. | Ikeda F, Doi Y, Yonemoto K, Ninomiya T, Kubo M, Shikata K, Hata J, Tanizaki Y, Matsumoto T, Iida M. Hyperglycemia increases risk of gastric cancer posed by Helicobacter pylori infection: a population-based cohort study. Gastroenterology. 2009;136:1234-1241. [PubMed] [DOI] |
| 12. | Ogunleye AA, Ogston SA, Morris AD, Evans JM. A cohort study of the risk of cancer associated with type 2 diabetes. Br J Cancer. 2009;101:1199-1201. [PubMed] [DOI] |
| 13. | Chodick G, Heymann AD, Rosenmann L, Green MS, Flash S, Porath A, Kokia E, Shalev V. Diabetes and risk of incident cancer: a large population-based cohort study in Israel. Cancer Causes Control. 2010;21:879-887. [PubMed] [DOI] |
| 14. | Shu X, Ji J, Li X, Sundquist J, Sundquist K, Hemminki K. Cancer risk among patients hospitalized for Type 1 diabetes mellitus: a population-based cohort study in Sweden. Diabet Med. 2010;27:791-797. [PubMed] [DOI] |
| 15. | Hemminki K, Li X, Sundquist J, Sundquist K. Risk of cancer following hospitalization for type 2 diabetes. Oncologist. 2010;15:548-555. [PubMed] [DOI] |
| 16. | Lin SW, Freedman ND, Hollenbeck AR, Schatzkin A, Abnet CC. Prospective study of self-reported diabetes and risk of upper gastrointestinal cancers. Cancer Epidemiol Biomarkers Prev. 2011;20:954-961. [PubMed] [DOI] |
| 17. | Atchison EA, Gridley G, Carreon JD, Leitzmann MF, McGlynn KA. Risk of cancer in a large cohort of U.S. veterans with diabetes. Int J Cancer. 2011;128:635-643. [PubMed] [DOI] |
| 18. | Wotton CJ, Yeates DG, Goldacre MJ. Cancer in patients admitted to hospital with diabetes mellitus aged 30 years and over: record linkage studies. Diabetologia. 2011;54:527-534. [PubMed] [DOI] |
| 19. | Carstensen B, Witte DR, Friis S. Cancer occurrence in Danish diabetic patients: duration and insulin effects. Diabetologia. 2012;55:948-958. [PubMed] [DOI] |
| 20. | Tian T, Zhang LQ, Ma XH, Zhou JN, Shen J. Diabetes mellitus and incidence and mortality of gastric cancer: a meta-analysis. Exp Clin Endocrinol Diabetes. 2012;120:217-223. [PubMed] [DOI] |
| 21. | Yoon JM, Son KY, Eom CS, Durrance D, Park SM. Pre-existing diabetes mellitus increases the risk of gastric cancer: a meta-analysis. World J Gastroenterol. 2013;19:936-945. [PubMed] [DOI] |
| 22. | Marimuthu SP, Vijayaragavan P, Moysich KB, Jayaprakash V. Diabetes mellitus and gastric carcinoma: Is there an association? J Carcinog. 2011;10:30. [PubMed] [DOI] |
| 23. | Giovannucci E. Insulin, insulin-like growth factors and colon cancer: a review of the evidence. J Nutr. 2001;131:3109S-3120S. [PubMed] |
| 24. | Pavelić K, Kolak T, Kapitanović S, Radosević S, Spaventi S, Kruslin B, Pavelić J. Gastric cancer: the role of insulin-like growth factor 2 (IGF 2) and its receptors (IGF 1R and M6-P/IGF 2R). J Pathol. 2003;201:430-438. [PubMed] [DOI] |
| 25. | Akagi Y, Liu W, Zebrowski B, Xie K, Ellis LM. Regulation of vascular endothelial growth factor expression in human colon cancer by insulin-like growth factor-I. Cancer Res. 1998;58:4008-4014. [PubMed] |
| 26. | Tseng CH. Diabetes conveys a higher risk of gastric cancer mortality despite an age-standardised decreasing trend in the general population in Taiwan. Gut. 2011;60:774-779. [PubMed] [DOI] |
| 27. | Coughlin SS, Calle EE, Teras LR, Petrelli J, Thun MJ. Diabetes mellitus as a predictor of cancer mortality in a large cohort of US adults. Am J Epidemiol. 2004;159:1160-1167. [PubMed] [DOI] |
| 28. | Batty GD, Shipley MJ, Marmot M, Smith GD. Diabetes status and post-load plasma glucose concentration in relation to site-specific cancer mortality: findings from the original Whitehall study. Cancer Causes Control. 2004;15:873-881. [PubMed] [DOI] |
| 29. | Smith GD, Egger M, Shipley MJ, Marmot MG. Post-challenge glucose concentration, impaired glucose tolerance, diabetes, and cancer mortality in men. Am J Epidemiol. 1992;136:1110-1114. [PubMed] |
| 30. | Zendehdel K, Nyrén O, Ostenson CG, Adami HO, Ekbom A, Ye W. Cancer incidence in patients with type 1 diabetes mellitus: a population-based cohort study in Sweden. J Natl Cancer Inst. 2003;95:1797-1800. [PubMed] [DOI] |
| 31. | De Block CE, De Leeuw IH, Van Gaal LF. High prevalence of manifestations of gastric autoimmunity in parietal cell antibody-positive type 1 (insulin-dependent) diabetic patients. The Belgian Diabetes Registry. J Clin Endocrinol Metab. 1999;84:4062-4067. [PubMed] [DOI] |