修回日期: 2013-10-30
接受日期: 2013-11-06
在线出版日期: 2013-12-08
目的: 检测Raf激酶抑制蛋白(Raf kinase inhibitory protein, RKIP)在胃癌(gastric cancer, GC)中的表达, 分析其与GC生物学行为的关系, 并探讨RKIP对GC侵袭能力的影响.
方法: 应用RT-PCR方法检测74例GC组织及其相应癌旁正常组织中RKIP mRNA的表达, 并分析胃癌组织中RKIP mRNA的表达与各临床病理学特点之间的关系; Western blot检测GC组织及其癌旁正常组织中RKIP蛋白的表达变化. 采用脂质体转染方法将正义、反义RKIP表达质粒及其相应空白载体分别转染SGC-7901细胞, 建立相应的稳定转染细胞系, 并用Western blot检测转染效果. 应用Transwell细胞迁移实验研究分析RKIP表达水平改变对GC细胞体外侵袭能力的影响.
结果: RT-PCR结果显示, RKIP mRNA在 GC组织中的表达量相对值明显低于在癌旁组织中的表达相对值(0.12±0.02 vs 0.48±0.04, t = 6.562, P<0.01). 在GC组织中, RKIP mRNA的表达与肿瘤的分化程度、TNM分期、淋巴结转移有关(均P<0.05). RKIP蛋白在GC组织中表达明显低于癌旁正常组织(0.08±0.02 vs 0.41±0.04, t = 7.068, P<0.01). Transwell细胞迁移实验显示, 上调RKIP表达能抑制SGC-7901细胞的侵袭能力, 而下调RKIP表达能增强SGC-7901细胞的侵袭能力.
结论: RKIP的低表达与胃癌的恶性程度及侵袭性关系密切, 揭示RKIP可能是一个潜在预防胃癌转移的治疗靶点.
核心提示: Raf-1激酶抑制蛋白(Raf-1 kinase inhibitor protein, RKIP)在胃癌组织中表达降低或缺失, 且与胃癌细胞的恶性程度和侵袭能力密切相关, 其表达下调/缺失可能促进胃癌转移, RKIP有可能成为肿瘤转移干预治疗的新靶点.
引文著录: 卢昭辉, 张谢夫, 刘洪翔, 赵爽. RKIP在胃癌组织中的低表达及对其侵袭力的影响. 世界华人消化杂志 2013; 21(34): 3863-3869
Revised: October 30, 2013
Accepted: November 6, 2013
Published online: December 8, 2013
AIM: To detect the expression of Raf kinase inhibitory protein (RKIP) in gastric cancer (GC), to analyze the relationship between RKIP expression and clinicopathological characteristics of GC, and to explore the role of RKIP in invasion of GC cells.
METHODS: The expression levels of RKIP mRNA in 74 gastric cancer tissues and the corresponding tumor-adjacent gastric tissues were detected by reverse transcription-polymerase chain reaction (RT-PCR). The relationship between RKIP mRNA expression and clinicopathological characteristics of GC was analyzed. Western blot was used to detect the expression level of RKIP protein. In addition, SGC-7901 cells were stably transfected with plasmids that expressed either sense or antisense RKIP cDNA, with the cells transfected with the empty plasmid as a negative control. The effect of transfection was detected by Western blot. Cell adhesion and invasion assays were used to analyze the effect of RKIP expression on cell invasion in vitro.
RESULTS: The expression level of RKIP mRNA in GC tissues was significantly lower than that in adjacent gastric tissues (0.12 ± 0.02 vs 0.48 ± 0.04, t = 6.562, P < 0.01). The expression of RKIP mRNA was significantly associated with histologic differentiation, TNM stage, and lymph node metastasis (all P < 0.05). RKIP protein expression in cancer tissues was significantly lower than that in adjacent gastric tissues (0.08 ± 0.02 vs 0.41 ± 0.04, t = 7.068, P < 0.01). Up-regulated RKIP in SGC-7901 cells could decrease cell invasion, whereas down-regulated RKIP increased cell invasion.
CONCLUSION: Low expression of RKIP in gastric carcinoma is closely related to tumor malignancy and invasiveness, suggesting that RKIP may be a potential therapeutic target for the prevention of metastasis in GC patients.
- Citation: Lu ZH, Zhang XF, Liu HX, Zhao S. Low expression of RKIP in gastric cancer and its role in gastric cancer cell migration. Shijie Huaren Xiaohua Zazhi 2013; 21(34): 3863-3869
- URL: https://www.wjgnet.com/1009-3079/full/v21/i34/3863.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i34.3863
脂酰乙醇胺结合蛋白(phosphatidylethanolamine binding protein, PEBP)是Bernier等[1,2]从牛脑中纯化出一种可以与磷脂酰乙醇胺结合的蛋白. 1999年, Yeung等[3]发现人PEBP能与Raf-1结合, 从而抑制Raf-1/活化蛋白激酶的激酶(mitogen-activated protein kinase kinase, MEK)/胞外信号调节激酶(extracellular signal-regulated kinase, ERK)信号通路信号通路, 因此, 其被重新命名为Raf-1激酶抑制蛋白(Raf-1 kinase inhibitor protein, RKIP). 2003年Fu等[4]研究发现PKIP可以抑制肿瘤细胞转移的作用后, PKIP成为肿瘤领域的一个新的热点. RKIP能抑制前列腺癌, 乳腺癌和黑色素瘤细胞的转移, 而且RKIP下调或缺失与前列腺癌, 乳腺癌和黑色素瘤等多种人类恶性肿瘤的转移和不良预后有关[4-6]. 然而, RKIP在胃癌(gastric cancer, GC)转移中的作用尚未见报道. 为探讨RKIP在GC转移中的作用和机制, 本研究采用RT-PCT及Western blot检测RKIP在GC组织与相应癌旁组织中的表达差异, 并采用脂质体转染方法将正义、反义RKIP表达质粒及其相应空白载体分别转染SGC-7901细胞, 建立相应的稳定转染细胞系, 分析RKIP表达水平改变对GC细胞体外侵袭能力影响.
收集2011-12/2013-02郑州大学第一附属医院胃肠外科手术切除的胃癌标本74例, 每例标本均采集癌组织和距肿瘤5 cm的癌旁组织. 手术切除标本离体后用4 ℃的生理盐水冲洗掉血污, 迅速置入无菌冻存管于-80 ℃冰箱保存备用. 所有检测标本均经病理学诊断证实, 患者知情同意且术前均未行放化疗. 74例患者中男39例、女35例; 年龄23-85岁, 中位年龄61岁. 肿瘤癌灶<5 cm 41例, ≥5 cm 33例. 胃癌组织按分化程度分为: 低分化组30例、中分化26例和高分化组18例. 按美国癌症联合委员会(American Joint Committee on Cancer, AJCC)胃癌TNM分期(2010年第7版)标准[7,8]: Ⅰ期9例, Ⅱ期14例, Ⅲ期31例, Ⅳ期20例. 淋巴结转移阳性47例, 阴性27例. 有远处转移19例, 无远处转移55例. 人胃癌细胞SGC-7901由郑州大学基础医学院提供, 为中分化胃腺癌细胞[9], 来源于56岁女性转移性腺癌的淋巴结中的癌组织; 细胞在37 ℃、5%CO2饱和湿度条件下, 用含10%FBS的DMEM培养基培养. pcDNA3.1(+)-ssRKIP为带有正义RKIP cDNA的表达载体, pcDNA3.1(-)-asRKIP为带有反义RKIP cDNA的表达载体, pcDNA3.1(+)、pcDNA3.1(-)为空白质粒, 上述质粒均购自美国Invitrogen公司. FBS、DMEM购自Gibico公司, TRIzol及RT-PCR试剂盒购自Gibico公司. RKIP上游引物: 5'-GAATAGACCCACCAGCAT-3',下游引物: 5'-CGTAAACCAGCCAGACAT-3', 预计扩增片段长度为236 bp; GAPDH上游引物: 5'-ATCTGGCACCACACCTTCTACAATGAGCTGCG-3',下游引物: 5'-CGTCATACTCCTGCTTGCTGATCCACATCTGC-3', 预计扩增长度342 bp, 所有引物序列均由上海生工生物工程有限责任公司提供. 一抗为兔抗人RKIP多克隆抗体, 二抗为HRP标记山羊抗兔IgG, 购自美国Santa Cruz公司; 内参为鼠抗人β-actin单克隆抗体, 二抗为HRP标记的山羊抗鼠IgG, 均购自美国Sigma公司; ECL发光液及BCA蛋白定量试剂盒购自美国Pierce公司; Lipofectamine2000购自美国Invitrogen公司; Transwell小室购自美国Corning公司.
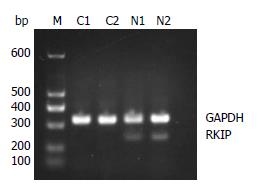
1.2.1 采用逆转录聚合酶链反应检测RKIP mRNA的表达变化: 按照试剂盒的操作说明分别提取癌组织和癌旁组织总RNA, 在20 μL的反应体积中加入2.0 μL总RNA, 37 ℃孵育1.5 h, 95 ℃灭活5 min, 再立即冰浴, -20 ℃保存备用. 然后设计引物, 进行PCR扩增, 在25 μL PCR反应体系中加入cDNA 2 μL, 扩增条件为: 95 ℃预变性3 min, 94 ℃变性45 s, 57 ℃退火45 s, 72 ℃延伸45 s; 循环30次. 最后72 ℃延伸8 min, 经1.5%琼脂糖凝胶电泳鉴定PCR产物. 通过凝胶扫描仪进行DNA电泳条带密度值分析, 以GAPDH作为阳性对照, 将RKIP与GAPDH比值作为RKIP表达水平的参数, 对RKIP产物相对定量.
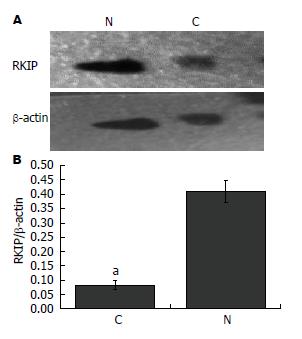
1.2.2 Western blot检测RKIP蛋白的表达: 将标本从-80 ℃冰箱取出研磨, 在冰浴条件下加入裂解液, 置匀浆器中反复研磨, 使组织充分匀浆化, 冰浴30 min后, 4 ℃、12000 r/min离心15 min, 取上清, 74例胃癌及对应的癌旁组织成功提取总蛋白. 用BCA法测上清蛋白浓度, 制备12%SDS-PAGE, 每泳道加总蛋白量30 μg, 进行电泳, 经半干转印至PVDF膜, 在含有5%脱脂奶粉的TBST溶液中封闭室温下封闭非特异性抗原2 h, 加入RKIP兔抗人多克隆抗体及鼠抗人β-actin抗体4 ℃孵育过夜, 漂洗后加入HRP标记的山羊抗兔IgG和HRP标记的山羊抗小鼠IgG常温孵育1 h, TBST洗涤, ECL化学发光试剂自显影. RKIP相对含量用RKIP/β-actin(43 kDa)灰度比值表示, 采用Quantity One软件分析.
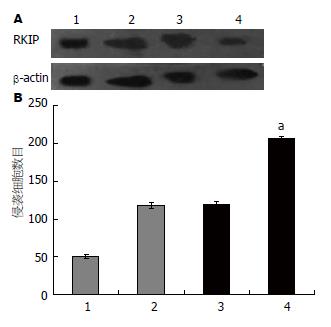
1.2.3 细胞转染: 复苏SGC-7901细胞, 待细胞至对数生长期时, 接种SGC-7901细胞于6孔板培养板中, 当细胞长至80%融合率时, 用于转染, 按Lipofectamine2000转染试剂盒说明将pcDNA3.1(+)-ssRKIP、pcDNA3.1(-)-asRKIP和空白质粒pcDNA3.1(+)、pcDNA3.1(-)分别转染SGC-7901细胞, 转染48 h后, 细胞按1:10传代, 用500 mg/LG418的DMEM培养基进行筛选, 4 wk后挑取G418抗性克隆, 扩大培养, Western blot检测RKIP表达.
1.2.4 细胞侵袭能力检测: 采用6孔Transwell小室检测细胞的侵袭能力. 选用8 μm孔径聚碳酯膜, 用Matrigel包被聚碳酯膜. 具体步骤如下: (1)用含0.2%FBS的DMEM培养基重悬细胞, 调整细胞数为2×105/mL; (2)下室中加入500 μL含10% FBS的DMEM培养基, 上室中加入200 μL细胞悬液; (3)置于5%CO2细胞培养箱中常温孵育24 h; (4)用棉签擦去膜上面未穿膜的细胞, 无水乙醇固定20 min, 结晶紫染色20 min, 清水冲洗3遍以上; (5)显微镜下观察穿膜细胞, 随机取高倍镜下5个视野计数取平均值. 实验重复3次.
统计学处理 应用SPSS17.0统计软件包进行统计学分析, 对胃癌组织和癌旁组织中的RKIP mRNA灰度值进行配对t检验, 对临床病理因素间的关系进行χ2检验及Fisher确切概率法检验, P<0.05为差异有统计学意义.
采用RT-PCR检测RKIP mRNA在74例胃癌及癌旁组织中的表达, RT-PCR产物经检测可见一特异扩增条带, 其分子量大小与预期结果相符(图1). RKIP mRNA在胃癌组织中的表达量相对值为(0.12±0.02), 癌旁组织中的表达量为(0.48±0.04), 两组比较差异有统计学意义(t = 6.562, P<0.01). RKIP的表达与患者性别、年龄、肿瘤大小无关, 而与患者肿瘤分化程度、淋巴结转移与否、肿瘤TNM分期及是否远传转移有关(P<0.05)(表1). 提示RKIP表达下调可能与临床胃癌转移有关. 采用Western blot方法检测RKIP在胃癌组织及癌旁组织中的表达, 结果显示RKIP在癌组织中的表达量(0.08±0.02)明显低于癌旁正常组织(0.41±0.04), 两组比较差异有统计学意义(t = 7.068, P<0.01)(图2).
| 临床资料 | n | RKIP mRNA表达数 | 表达阳性率(%) | χ2值 | P值 | |
| 表达 | 缺失 | |||||
| 性别 | 1.140 | 0.286 | ||||
| 男 | 39 | 9 | 30 | 23.1 | ||
| 女 | 35 | 12 | 23 | 34.3 | ||
| 年龄(岁) | 0.874 | 0.350 | ||||
| <55 | 29 | 10 | 19 | 34.5 | ||
| ≥55 | 45 | 11 | 34 | 24.4 | ||
| 肿瘤大小(cm) | 0.501 | 0.479 | ||||
| <5 | 41 | 13 | 28 | 31.7 | ||
| ≥5 | 33 | 8 | 25 | 24.2 | ||
| TNM分期 | 0.0041 | |||||
| Ⅰ期 | 9 | 7 | 2 | 77.8 | ||
| Ⅱ期 | 14 | 5 | 9 | 35.7 | ||
| Ⅲ期 | 31 | 6 | 25 | 19.4 | ||
| Ⅳ期 | 20 | 3 | 17 | 15.0 | ||
| 病理分级 | 9.909 | 0.007 | ||||
| 高分化 | 18 | 10 | 8 | 55.6 | ||
| 中分化 | 26 | 7 | 19 | 26.9 | ||
| 低分化 | 30 | 4 | 26 | 13.3 | ||
| 淋巴结移 | 6.236 | 0.013 | ||||
| 阴性 | 47 | 18 | 29 | 51.4 | ||
| 阳性 | 27 | 3 | 24 | 23.1 | ||
| 远处转移 | 10.958 | 0.001 | ||||
| 有 | 19 | 11 | 8 | 57.9 | ||
| 无 | 55 | 10 | 45 | 18.2 | ||
为检测RKIP在胃癌细胞转移中的作用, 建立了RKIP表达上调的SGC-7901系(SGC-7901-ssRKIP, 图3A), 以及RKIP表达下调的SGC-7901细胞系(SGC-7901-asRKIP, 图3A), 分析RKIP表达水平改变对胃癌侵袭能力的影响. 结果如图3B所示; RKIP表达上调能抑制SGC-7901细胞的侵袭能力, 而RKIP表达下调能增加SGC-7901细胞的侵袭能力, RKIP的表达与胃癌细胞体外侵袭能力负相关.
GC是目前世界上发病率第4位的肿瘤, 居消化系恶性肿瘤发病率及病死率的第2位[10,11]. 根据GLOBOCAN2008的统计, 2008年全球胃癌新发病例98.9万例, 中国为46.3万例, 占46.8%; 同期全球死于胃癌的病例共73.7万例, 中国为35.2万例, 占47.8%. 在中国胃癌是最常见的癌症死亡原因之一, 绝大多数胃癌患者就诊时已处于中晚期, 有的甚至已有远处转移, 缺乏胃癌早期诊断的敏感、特异性指标, 是导致胃癌死亡率高、预后差的主要原因之一.
RKIP是一种高度保守的多功能蛋白, 广泛存在于人体的各个组织中[12]. 人的RKIP定位于12号染色体q24.22, 含4个外显子, 其转录的mRNA长达1434 bp, 编码187个氨基酸组成的蛋白[13]. 调节许多重要的生理过程如心脏和神经功能, 精子发生和生殖行为[14]. 信号传导通路的异常可促进肿瘤的发生与发展, 近年来研究发现, RKIP能抑制Raf-1介导的MEK的磷酸化和活化, 抑制MAPK信号传导通路, 并参与对G蛋白耦联受体信号通路和核因子κB(nuclear factor κB, NF-κB)信号通路的调控[15]. 丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路在信号转导中发挥重要作用, 他参与调节细胞增殖、分化及凋亡等细胞活动[16]. RKIP可以通过结合Raf抑制MEK的磷酸化和活化而抑制该通路, 也可以通过不依赖Raf, 直接与MEK作用, 从而抑制Raf-1-MEK1/2-ERK1/2信号通路, Adlard等[15]与Yeung等[17]指出RKIP还参与了NF-κB信号通路的调控, 抑制RKIP的表达, 可以增加NF-κB介导的转录.
Fu等[4]用免疫组织化学方法检测发现前列腺癌患者原发病灶的病理标本中有RKIP的表达, 但在转移前列腺的病理标本无RKIP的表达, 在转移的肿瘤细胞中增加RKIP的表达, 能减弱体外浸润能力, 而在非转移的癌细胞中减少RKIP表达能增强他们的体外浸润. RKIP抑制恶性黑色素瘤[18]、乳腺癌[5]、结直肠癌[19]、肝癌[20]等多种恶性肿瘤转移的作用也有报道, 被认为是一种新的肿瘤转移抑制基因.
本研究应用实时定量RT-PCR技术对74例胃癌组织及相对应的癌旁组织进行检测后发现, RKIP mRNA在GC组织中的表达量相对值明显低于在癌旁组织中的表达相对值(0.12±0.02 vs 0.48±0.04, t = 6.562, P<0.01). 为进一步明确RKIP在胃癌发生、发展中的作用, 我们采用Western blot对74例胃癌组织及相对应的癌旁组织进行检测后发现, RKIP蛋白在GC组织中表达明显低于癌旁正常组织(0.08±0.02 vs 0.41±0.04, t = 7.068, P<0.01), 且Westren blot检测的RKIP与胃癌的临床病理因素之间的关系同RT-PCT检测的结果基本一致, RKIP的表达与胃癌组织的分化程度、TNM分期和淋巴结转移有关(P<0.05). 胃癌的分化程度越低, RKIP阳性的表达水平越低; 随着TNM分期的增加, 胃癌组织中的RKIP表达阳性率呈下降趋势, 分期越晚, 表达越低; 有淋巴结转移者中的表达阳性率明显低于无淋巴结转移者(P<0.05); 在有远处转移者中的表达阳性率明显低于无远处转移者(P<0.05), 提示RKIP表达下调可能与临床胃癌转移有关. 为了研究RKIP与胃癌转移的关系, 我们采用Transwell细胞侵袭实验结合Western blot来检测RKIP表达水平与体外侵袭能力的关系, 结果提示: 上调RKIP表达水平能抑制SGC-7901的侵袭能力, 而下调RKIP表达水平则能增强SGC-7901的侵袭能力, 从而可以得出结论: RKIP的低表达增强了胃癌细胞的侵袭能力, RKIP很有可能成为胃癌侵袭行为评价的有效指标之一, 用于检测胃癌患者的侵袭潜能.
总之, RKIP在胃癌组织中表达降低或缺失, 且与胃癌细胞的恶性程度和侵袭能力密切相关, 其表达下调/缺失可能促进胃癌转移, RKIP有可能成为肿瘤转移干预治疗的新靶点. 最新研究[21-27]表明RKIP表达降低或缺失可以诱导肿瘤细胞放化疗抵抗, 其作用机制现在还不是特别清楚, 因此对RKIP的研究还有待深入, 为肿瘤的治疗提供新的切入点.
胃癌(gastric cancer, GC)是目前世界上发病率第4位的肿瘤, 居消化系恶性肿瘤发病率及病死率的第2位, 在中国胃癌是最常见的癌症死亡原因之一, 绝大多数胃癌患者就诊时已处于中晚期, 有的甚至已有远处转移, 缺乏胃癌早期诊断的敏感、特异性指标, 是导致胃癌死亡率高、预后差的主要原因之一. 因此探讨胃癌发生发展的分子机制, 为临床胃癌的诊治提供分子依据就尤为重要.
肖恩华, 教授, 中南大学湘雅二医院放射教研室
目前针对Raf激酶抑制蛋白(Raf kinase inhibitory protein, RKIP)与胃癌的浸润和转移能力的研究在国内鲜有报道.
最新研究证实RKIP能抑制前列腺癌、恶性黑色素瘤、乳腺癌、结直肠癌、肝癌等多种恶性肿瘤转移, 被认为是一种新的肿瘤转移抑制基因. 然而, RKIP在GC转移中的作用尚未见报道.
本研究采用RT-PCR及Western blot检测RKIP在胃癌组织及相应癌旁组织中的表达情况, 并采用Transwell细胞迁移实验研究分析RKIP表达水平改变对胃癌细胞体外侵袭能力的影响.
从RKIP的基因水平和蛋白水平检测其在胃癌组织及相应癌旁组织中的表达情况, 并尝试证明RKIP表达水平改变对胃癌细胞体外侵袭能力的影响, 为胃癌的早期诊断及预后提供新的参考指标.
本文对进一步的临床研究有较好的借鉴作用.
编辑: 田滢 电编:闫晋利
| 1. | Bernier I, Jollès P. Purification and characterization of a basic 23 kDa cytosolic protein from bovine brain. Biochim Biophys Acta. 1984;790:174-181. [PubMed] [DOI] |
| 2. | Bernier I, Tresca JP, Jollès P. Ligand-binding studies with a 23 kDa protein purified from bovine brain cytosol. Biochim Biophys Acta. 1986;871:19-23. [PubMed] [DOI] |
| 3. | Yeung K, Seitz T, Li S, Janosch P, McFerran B, Kaiser C, Fee F, Katsanakis KD, Rose DW, Mischak H. Suppression of Raf-1 kinase activity and MAP kinase signalling by RKIP. Nature. 1999;401:173-177. [PubMed] [DOI] |
| 4. | Fu Z, Smith PC, Zhang L, Rubin MA, Dunn RL, Yao Z, Keller ET. Effects of raf kinase inhibitor protein expression on suppression of prostate cancer metastasis. J Natl Cancer Inst. 2003;95:878-889. [PubMed] |
| 5. | Hagan S, Al-Mulla F, Mallon E, Oien K, Ferrier R, Gusterson B, García JJ, Kolch W. Reduction of Raf-1 kinase inhibitor protein expression correlates with breast cancer metastasis. Clin Cancer Res. 2005;11:7392-7397. [PubMed] [DOI] |
| 6. | Schuierer MM, Bataille F, Hagan S, Kolch W, Bosserhoff AK. Reduction in Raf kinase inhibitor protein expression is associated with increased Ras-extracellular signal-regulated kinase signaling in melanoma cell lines. Cancer Res. 2004;64:5186-5192. [PubMed] [DOI] |
| 7. | Washington K. 7th edition of the AJCC cancer staging manual: stomach. Ann Surg Oncol. 2010;17:3077-3079. [PubMed] [DOI] |
| 8. | Santiago JM, Sasako M, Osorio J. [TNM-7th edition 2009 (UICC/AJCC) and Japanese Classification 2010 in Gastric Cancer. Towards simplicity and standardisation in the management of gastric cancer]. Cir Esp. 2011;89:275-281. [PubMed] [DOI] |
| 9. | Yoo BC, Ku JL, Hong SH, Shin YK, Park SY, Kim HK, Park JG. Decreased pyruvate kinase M2 activity linked to cisplatin resistance in human gastric carcinoma cell lines. Int J Cancer. 2004;108:532-539. [PubMed] [DOI] |
| 10. | Crew KD, Neugut AI. Epidemiology of gastric cancer. World J Gastroenterol. 2006;12:354-362. [PubMed] |
| 11. | Fox JG, Wang TC. Inflammation, atrophy, and gastric cancer. J Clin Invest. 2007;117:60-69. [PubMed] [DOI] |
| 12. | Yamazaki T, Nakano H, Hayakari M, Tanaka M, Mayama J, Tsuchida S. Differentiation induction of human keratinocytes by phosphatidylethanolamine-binding protein. J Biol Chem. 2004;279:32191-32195. [PubMed] [DOI] |
| 13. | Simister PC, Banfield MJ, Brady RL. The crystal structure of PEBP-2, a homologue of the PEBP/RKIP family. Acta Crystallogr D Biol Crystallogr. 2002;58:1077-1080. [PubMed] |
| 14. | Keller ET, Fu Z, Brennan M. The role of Raf kinase inhibitor protein (RKIP) in health and disease. Biochem Pharmacol. 2004;68:1049-1053. [PubMed] [DOI] |
| 15. | Adlard PA, Bush AI. Metals and Alzheimer's disease. J Alzheimers Dis. 2006;10:145-163. [PubMed] |
| 16. | Marais R, Marshall CJ. Control of the ERK MAP kinase cascade by Ras and Raf. Cancer Surv. 1996;27:101-125. [PubMed] |
| 17. | Yeung KC, Rose DW, Dhillon AS, Yaros D, Gustafsson M, Chatterjee D, McFerran B, Wyche J, Kolch W, Sedivy JM. Raf kinase inhibitor protein interacts with NF-kappaB-inducing kinase and TAK1 and inhibits NF-kappaB activation. Mol Cell Biol. 2001;21:7207-7217. [PubMed] [DOI] |
| 18. | Park S, Yeung ML, Beach S, Shields JM, Yeung KC. RKIP downregulates B-Raf kinase activity in melanoma cancer cells. Oncogene. 2005;24:3535-3540. [PubMed] [DOI] |
| 19. | Minoo P, Zlobec I, Baker K, Tornillo L, Terracciano L, Jass JR, Lugli A. Loss of raf-1 kinase inhibitor protein expression is associated with tumor progression and metastasis in colorectal cancer. Am J Clin Pathol. 2007;127:820-827. [PubMed] [DOI] |
| 20. | Lee HC, Tian B, Sedivy JM, Wands JR, Kim M. Loss of Raf kinase inhibitor protein promotes cell proliferation and migration of human hepatoma cells. Gastroenterology. 2006;131:1208-1217. [PubMed] [DOI] |
| 21. | Baritaki S, Bonavida B. Viral infection and cancer: the NF-kappaB/Snail/RKIP loop regulates target cell sensitivity to apoptosis by cytotoxic lymphocytes. Crit Rev Immunol. 2010;30:31-46. [PubMed] |
| 22. | Baritaki S, Katsman A, Chatterjee D, Yeung KC, Spandidos DA, Bonavida B. Regulation of tumor cell sensitivity to TRAIL-induced apoptosis by the metastatic suppressor Raf kinase inhibitor protein via Yin Yang 1 inhibition and death receptor 5 up-regulation. J Immunol. 2007;179:5441-5453. [PubMed] |
| 23. | Baritaki S, Yeung K, Palladino M, Berenson J, Bonavida B. Pivotal roles of snail inhibition and RKIP induction by the proteasome inhibitor NPI-0052 in tumor cell chemoimmunosensitization. Cancer Res. 2009;69:8376-8385. [PubMed] [DOI] |
| 24. | Chatterjee D, Bai Y, Wang Z, Beach S, Mott S, Roy R, Braastad C, Sun Y, Mukhopadhyay A, Aggarwal BB. RKIP sensitizes prostate and breast cancer cells to drug-induced apoptosis. J Biol Chem. 2004;279:17515-17523. [PubMed] [DOI] |
| 25. | Ruan L, Wang GL, Yi H, Chen Y, Tang CE, Zhang PF, Li MY, Li C, Peng F, Li JL. Raf kinase inhibitor protein correlates with sensitivity of nasopharyngeal carcinoma to radiotherapy. J Cell Biochem. 2010;110:975-981. [PubMed] [DOI] |
| 26. | Woods Ignatoski KM, Grewal NK, Markwart SM, Vellaichamy A, Chinnaiyan AM, Yeung K, Ray ME, Keller ET. Loss of Raf kinase inhibitory protein induces radioresistance in prostate cancer. Int J Radiat Oncol Biol Phys. 2008;72:153-160. [PubMed] [DOI] |
| 27. | Wu K, Bonavida B. The activated NF-kappaB-Snail-RKIP circuitry in cancer regulates both the metastatic cascade and resistance to apoptosis by cytotoxic drugs. Crit Rev Immunol. 2009;29:241-254. [PubMed] |