修回日期: 2013-09-25
接受日期: 2013-10-31
在线出版日期: 2013-12-08
目的: 了解组织型转谷氨酰胺酶2(tissue transglutaminase 2, TG2)在胃中的表达情况及其临床意义, 为寻找早期诊断胃癌相关的分子标志物提供实验依据.
方法: 采用RT-PCR和Western blot检测TG2在胃癌组织中的表达; 应用免疫组织化学染色检测TG2在胃癌组织中的表达, 并分析其在胃癌组织中表达的临床病理学意义.
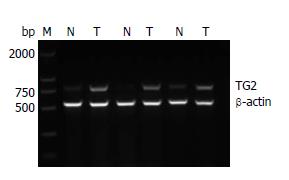
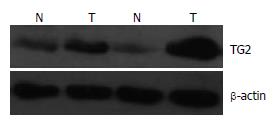
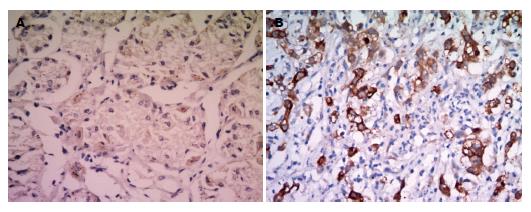
结果: (1)RT-PCR和Western blot结果均显示, TG2在正常胃黏膜和胃癌组织中的表达强度分别为0.274±0.051 vs 0.671±0.105和0.317±0.032 vs 0.918±0.117, 与正常胃黏膜组织比较, TG2在胃癌组织中的表达明显增加(P<0.05); (2)免疫组织化学染色结果显示, TG2蛋白在正常胃黏膜和胃癌组织中的阳性表达率分别为33.33%(8/24)和71.74%(33/46), 胃癌组织中的阳性表达率明显高于正常胃黏膜组织(P<0.05).
结论: TG2蛋白高表达与胃癌的发生密切相关.
核心提示: 早期诊断对提高胃癌患者5年生存率具有十分重要的影响, 获得早期诊断的特异性分子标记则是早期确诊的关键因素. 组织型转谷氨酰胺酶2(tissue transglutaminase 2)作为正常胃黏膜与胃癌组织中差异表达蛋白质, 有望成为早期诊断胃癌的预警分子指标.
引文著录: 李臻, 张志伟, 赵强, 刘重元, 杨科, 邓彦君, 伍石华, 杨林. TG2在胃癌组织中表达的临床意义. 世界华人消化杂志 2013; 21(34): 3858-3862
Revised: September 25, 2013
Accepted: October 31, 2013
Published online: December 8, 2013
AIM: To assess the clinical significance of expression of tissue transglutaminase 2 (TG2) in gastric carcinoma, so as to provide a new clue for finding new specific markers of gastric cancer.
METHODS: The expression of TG2 in gastric cancer tissues was detected by RT-PCR, Western blot and immunohistochemistry. The clinical significance of TG2 expression in gastric cancer was analyzed.
RESULTS: The result of RT-PCR and Western blot analyses showed that the mRNA and protein expression levels of TG2 were significantly lower in normal gastric mucosa than in gastric cancer tissues (0.274 ± 0.051 vs 0.671 ± 0.105, 0.317 ± 0.032 vs 0.918 ± 0.117, both P < 0.05). The immunohistochemical results demonstrated that the positive expression rate of TG2 protein in normal gastric mucosa was significantly lower than that in gastric cancer tissues [33.33% (8/24) vs 71.74% (33/46), P < 0.05].
CONCLUSION: Overexpression of TG2 protein may be closely related to the occurrence of gastric cancer.
- Citation: Li Z, Zhang ZW, Zhao Q, Liu ZY, Yang K, Deng YJ, Wu SH, Yang L. Clinical significance of expression of tissue transglutaminase 2 in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(34): 3858-3862
- URL: https://www.wjgnet.com/1009-3079/full/v21/i34/3858.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i34.3858
近年来, 尽管全球的胃癌发病率呈逐渐下降趋势, 但中国却高出世界平均水平两倍多, 且已逐年呈现年轻化趋势. 临床上绝大多数患者确诊时已属胃癌进展期, 甚至发生远处转移, 临床治疗及预后极差[1,2]. 因此, 胃癌的早期诊断及治疗变得尤为重要. 目前, 寻找高效、敏感的胃癌诊断标志物, 对提高胃癌早期诊断, 改善整体疗效, 延长患者生命具有十分重要的意义. 我们选取前期通过蛋白质组学方法筛选的胃癌相关蛋白质组织型转谷氨酰胺酶2(tissue transglutaminase 2, TG2)[3], 检测其在正常胃黏膜及胃癌组织中的表达情况, 以期为胃癌早期诊断标志物的发现提供实验依据.
17例新鲜胃癌及匹配的远端胃黏膜组织均选自2011-10/2012-05南华大学附属第一医院肿瘤外科手术切除标本, 所有胃癌患者术前均未经化、放疗, 所有标本均已病理确诊. 分别切取癌组织及距癌灶边缘约5.0 cm以上的远端胃黏膜组织, 于液氮罐内保存. 另收集南华大学附一医院存档石蜡标本共70例, 正常胃黏膜24例, 胃癌46例, 其中男26例, 女20例, 年龄42-75岁, 高分化腺癌19例, 中分化腺癌10例, 低未分化腺癌17例. 采用Primer5.0软件设计引物(表1), 由上海生工生物工程有限公司合成.
| 基因 | 引物序列 | 产物大小(bp) |
| TG2 | 上游: TATGGCCAGTGCTGGGTCTTCGCC | 786 |
| 下游: GGCTCCAGGGTTAGGTTGAGCAGG | ||
| β-actin | 上游: GGACCTGACTGACTACCTC | 553 |
| 下游: CATACTCCTGCTTGCTGAT |
1.2.1 RT-PCR检测TG2 mRNA表达: 将20 mg组织在液氮中碾磨后, 加入1 mL TRIzol充分混匀, 按TRIzol试剂操作程序抽提组织总RNA, 分别用紫外分光光度计和凝胶电泳检测RNA的浓度、纯度和质量, -80 ℃保存备用. RT-PCR按照AMV逆转录试剂盒说明书, 按照操作步骤进行逆转录, 然后取RT产物2 µL, 加入引物和内对照引物分别各1 µL(10 µmol/L)设30 µL PCR反应体系, 在PCR仪中扩增, 用1%琼脂糖凝胶电泳检测扩增产物.
1.2.2 Western blot检测TG2蛋白的表达: 将收集的组织加入组织裂解液后, 分别在匀浆器中研磨, 制备蛋白, 测定浓度后, 以各泳道50 µg的总蛋白进行10%SDS不连续聚丙烯酰胺凝胶电泳, 转膜、封闭, 一抗(1:1000)及抗β-actin单体(1:2000)4 ℃孵育过夜, 洗膜后, HRP标记的羊抗兔二抗(1:1000)孵育、洗膜、发光、曝光、显影、定影以及分析结果.
1.2.3 免疫组织化学染色: 将制备好的石蜡切片二甲苯脱蜡2次后水化; PBS洗片3次, 每次3 min, 抗原修复; 加3%过氧化物酶阻断液, 37 ℃ 15 min; PBS洗片3次, 每次3 min; 加足量非免疫性动物血清, 37 ℃ 10 min; 分别滴加Ⅰ抗(兔抗人TG2单克隆抗体为epitomic公司产品), 4 ℃过夜; 滴加生物素标记的Ⅱ抗, 37 ℃ 15 min; 滴加链霉菌抗生物素蛋白-过氧化物酶溶液, 37 ℃ 15 min; DAB显色、苏木素复染、返蓝、脱水、透明, 封片, 显微镜观察、照相. 阳性表达的判断标准: 浅黄色为弱阳性, 黄色或棕黄色为中等阳性, 棕色或深棕色为强阳性, 无棕黄色或与背景着色一致为阴性.
统计学处理 应用SPSS17.0统计学软件进行结果分析, Western blot及RT-PCR数据均采用配对t检验, 免疫组织化学染色采用χ2检验, 以P<0.05为差异有统计学意义.
TG2基因在正常胃黏膜组织的表达强度[相对强度(relative value, Rv)]为0.274±0.051, 胃癌组织TG2基因表达强度Rv为0.671±0.105(表2). 与正常胃黏膜组对比, 胃癌组TG2基因的表达均明显增强(P<0.05)(图1, 表2).
| 分组 | TG2基因表达 | P值 |
| 正常胃黏膜 | 0.274±0.051 | <0.05 |
| 胃癌组织 | 0.671±0.105 |
TG2蛋白在正常胃黏膜和胃癌组织的表达强度Rv分别为0.317±0.032和0.918±0.117. 与正常胃黏膜组织组比较, TG2蛋白在胃癌组织中高表达, 较正常胃黏膜组表达明显增强(P<0.01, 图2, 表3).
| 分组 | TG2蛋白 | P值 |
| 正常胃黏膜 | 0.317±0.032 | <0.01 |
| 胃癌组织 | 0.918±0.117 |
近年来, 虽然胃癌的早期筛查、诊断及治疗水平均有了一定程度的提高, 但临床效果及患者预后仍不容乐观. 胃镜结合活检是目前最常用的早期确诊手段, 然而检查很难进行大规模普及. 现已临床应用的CEA、CA19-9、CA50等[4-6]胃癌分子标志物因缺乏特异性对胃癌的早期诊断尚无定论. 因此, 寻找胃癌早期诊断的相关分子标志物, 对提高患者的5年生存率和改善预后仍具有非常重要的意义.
蛋白质组学技术可以从整体水平分析组织与细胞中的全部蛋白质表达改变, 如包括蛋白的表达、组成、翻译及修饰, 了解蛋白间的相互作用, 能够更全面客观地反应癌变的动态过程, 是目前筛选肿瘤诊断标志物的高通量的方法. 我选取本课题组前期通蛋白质组学技术筛选的胃癌相关蛋白质-TG2蛋白, 分析其在胃癌中的表达情况.
TG2是TG家族中的重要成员, 为一类结构功能复杂的蛋白质, 由4个结构域组成, 行使功能的主要为α/β催化核心区[7]. TG2蛋白在人体分布较为广泛(如血管内皮细胞、平滑肌细胞以及成纤维细胞等), 在不同的细胞环境中发挥截然不同的生理功能, 与组织纤维化、神经退行性疾病、动脉粥样硬化和癌症等疾病的发生发展密切相关. 近年来, 大量研究表明TG2在多数肿瘤细胞中上调表达, 包括乳腺癌、卵巢癌、胰腺癌、结肠癌等[8-13]. Jiang等[14]运用蛋白质组学对转移相关蛋白进行分析, 发现在转移性肺癌细胞中, 有11个选择性高表达蛋白, 而TG2就是其中之一. 有学者发现通过表皮生长因子诱导TG2的高表达, 能够阻碍化疗药物引发的肿瘤细胞凋亡现象[15]. 有研究报道[16], TG2可能通过激活黏附斑激酶, 最终诱导如磷脂酰激醇3-激酶/蛋白激酶B等抗凋亡信号通路, 使细胞生长增殖失控. 另外, TG2的上调表达还可能增强肿瘤基质中转化生长因子-β的大量分泌, 进一步诱导上皮间叶转化, 增强胃癌的侵袭转移能力[17].
前期蛋白质组学研究显示, TG2蛋白在胃癌组织中呈高表达, 本实验通过RT-PCR、Western blot和免疫组织化学染色对胃癌及正常胃黏膜组织中TG2的表达进行了验证, 结果与蛋白质组学检测基本一致, 即胃癌组织中TG2蛋白表达明显高于正常胃黏膜. TG2在胃癌组织中表达上调, 可能与瘤细胞的过度增殖, 抗凋亡增强等有关.
总之, 本实验通过对蛋白质组学初筛的胃癌差异表达蛋白TG2从基因、蛋白及不同组织中的表达情况进行了分析, 结果仅提示TG2蛋白与胃癌的发生密切相关, 有望成为胃癌早期诊断, 判断疗效及预后的一个有价值的指标, 但是其具体的分子机制还有待于进一步深入研究.
胃癌的发生涉及众多基因的异常表达, 组织中不同基因的表达与组织学类型、分化程度、转移和预后等密切相关.
郑鹏远, 教授, 主任医师, 博士生导师, 副院长,郑州大学第二附属医院消化科
了解胃癌发生中组织型转谷氨酰胺酶2(tissue transglutaminase2, TG2)蛋白的表达情况,可为胃癌的早期诊断、组织学分型及预后提供实验依据.
早期诊断是胃癌研究的热点之一. 至今, 许多研究从不同角度进行了系统深入的探讨与分析, 尤其是蛋白质组学技术的迅猛发展, 为胃癌早期诊断分子标志物的筛选提供了大量的素材, 深入了解相关胃癌差异表达蛋白质在胃癌组织中表达的意义, 对临床早期诊断、治疗机预后评估等均有十分重要的意义.
本文通过选取前期课题组通过激光捕获显微切割技术(laser cap ture m icrodissection, LCM)结合定量蛋白质组学技术筛选的胃癌组织差异表达蛋白质TG2, 在正常胃黏膜和胃癌组织中从基因、蛋白水平及组织中的表达情况进行观察, 全面证实与分析TG2蛋白表达的意义, 为胃癌早期诊断分子标志物的筛选提供了非常有价值的实验资料.
分析TG2蛋白在胃癌组织中的表达及意义, 为正常胃黏膜癌变的临床病理诊断及鉴别提供了分子参考, 对该蛋白的深入研究, 有望成为早期发现、预防与诊断胃癌的预警分子指标.
本文研究TG2在胃中的表达情况及其临床意义, 为寻找早期诊断胃癌相关的分子标志物提供实验依据, 结果显示TG2蛋白高表达与胃癌的发生密切相关. 研究内容较新颖, 设计合理, 具有较好的临床指导意义.
编辑: 郭鹏 电编:闫晋利
| 2. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin. 2009;59:225-249. [PubMed] [DOI] |
| 4. | Hoskovec D, Varga J, Konečná E, Antos F. Levels of CEA and Ca 19 - 9 in the sera and peritoneal cavity in patients with gastric and pancreatic cancers. Acta Cir Bras. 2012;27:410-416. [PubMed] [DOI] |
| 5. | Kim DH, Oh SJ, Oh CA, Choi MG, Noh JH, Sohn TS, Bae JM, Kim S. The relationships between perioperative CEA, CA 19-9, and CA 72-4 and recurrence in gastric cancer patients after curative radical gastrectomy. J Surg Oncol. 2011;104:585-591. [PubMed] [DOI] |
| 6. | Li GC, Zhang Z, Ma XJ, Gu WL, Wang YN, Li J. Are biomarkers correlated with recurrence patterns in patients with resectable gastric adenocarcinoma. Mol Biol Rep. 2012;39:399-405. [PubMed] [DOI] |
| 7. | Wang Y, Ande SR, Mishra S. Phosphorylation of transglutaminase 2 (TG2) at serine-216 has a role in TG2 mediated activation of nuclear factor-kappa B and in the downregulation of PTEN. BMC Cancer. 2012;12:277. [PubMed] [DOI] |
| 8. | Wang Y, Ande SR, Mishra S. Overexpression of phospho mutant forms of transglutaminase 2 downregulates epidermal growth factor receptor. Biochem Biophys Res Commun. 2012;417:251-255. [PubMed] [DOI] |
| 9. | Mangala LS, Fok JY, Zorrilla-Calancha IR, Verma A, Mehta K. Tissue transglutaminase expression promotes cell attachment, invasion and survival in breast cancer cells. Oncogene. 2007;26:2459-2470. [PubMed] [DOI] |
| 10. | Khanna M, Chelladurai B, Gavini A, Li L, Shao M, Courtney D, Turchi JJ, Matei D, Meroueh S. Targeting ovarian tumor cell adhesion mediated by tissue transglutaminase. Mol Cancer Ther. 2011;10:626-636. [PubMed] [DOI] |
| 11. | Verma A, Guha S, Diagaradjane P, Kunnumakkara AB, Sanguino AM, Lopez-Berestein G, Sood AK, Aggarwal BB, Krishnan S, Gelovani JG. Therapeutic significance of elevated tissue transglutaminase expression in pancreatic cancer. Clin Cancer Res. 2008;14:2476-2483. [PubMed] [DOI] |
| 12. | Kotsakis P, Wang Z, Collighan RJ, Griffin M. The role of tissue transglutaminase (TG2) in regulating the tumour progression of the mouse colon carcinoma CT26. Amino Acids. 2011;41:909-921. [PubMed] [DOI] |
| 13. | Assi J, Srivastava G, Matta A, Chang MC, Walfish PG, Ralhan R. Transglutaminase 2 overexpression in tumor stroma identifies invasive ductal carcinomas of breast at high risk of recurrence. PLoS One. 2013;8:e74437. [PubMed] [DOI] |
| 14. | Jiang D, Ying W, Lu Y, Wan J, Zhai Y, Liu W, Zhu Y, Qiu Z, Qian X, He F. Identification of metastasis-associated proteins by proteomic analysis and functional exploration of interleukin-18 in metastasis. Proteomics. 2003;3:724-737. [PubMed] [DOI] |
| 15. | Antonyak MA, Miller AM, Jansen JM, Boehm JE, Balkman CE, Wakshlag JJ, Page RL, Cerione RA. Augmentation of tissue transglutaminase expression and activation by epidermal growth factor inhibit doxorubicin-induced apoptosis in human breast cancer cells. J Biol Chem. 2004;279:41461-41467. [PubMed] [DOI] |
| 16. | Nadalutti C, Viiri KM, Kaukinen K, Mäki M, Lindfors K. Extracellular transglutaminase 2 has a role in cell adhesion, whereas intracellular transglutaminase 2 is involved in regulation of endothelial cell proliferation and apoptosis. Cell Prolif. 2011;44:49-58. [PubMed] [DOI] |