修回日期: 2013-09-17
接受日期: 2013-11-06
在线出版日期: 2013-12-08
目的: 研究雷帕霉素调节肝纤维化模型大鼠转化生长因子β1(transformation growth factor β1, TGF-β1)的表达, 改善肝纤维变的相关作用.
方法: 应用大鼠以四氯化碳油(CCl4花生油)诱导建立肝纤维化模型, 具体分成正常对照组、肝纤维化模型组、RAPA组, 饲养8 wk后观察动物肝脏组织形态学改变及TGF-β1在肝组织的表达. 在动物饲养过程中动态地测定肝纤维化进程中血清TGF-β1水平的变化.
结果: 3组大鼠肝组织切片经HE及免疫组织化等染色后, 图片经Image-pro plus 6.0图像分析软件整理. A(IA值9891.4±1725.7)、B(IA值为104239.9±20890.6)、C(IA值为27853.6±2031). 3组大鼠肝组织切片中TGF-β1表达呈显著性差异, 具有统计学意义(P<0.01).
结论: 雷帕霉素具有显著的下调肝脏组织中TGF-β1表达及下调血清TGF-β1水平, TGF-β1表达下调与改善肝纤维化变有平行关系.
核心提示: 随着肝纤维化模型的建立, 证实模型组中肝组织及血清中的转化生长因子β1(transformation growth factor β1, TGF-β1)随着模型的建立进展时间延长而逐渐升高. 应用雷帕霉素(rapamycin, RAPA)治疗后, TGF-β1表达明显降低, 从组织形态学印证了雷帕霉素组的肝脏组织纤维化明显较模型组要轻. 研究显示RAPA确能通过调节TGF-β1因子的表达改善肝脏纤维化病变.
引文著录: 颜文贞, 钟志宏, 戴璟, 戴东, 陈土明, 胡祖超. 调节肝纤维化模型大鼠TGF-β1表达探讨雷帕霉素改善肝纤维化的相关性. 世界华人消化杂志 2013; 21(34): 3848-3852
Revised: September 17, 2013
Accepted: November 6, 2013
Published online: December 8, 2013
AIM: To investigate the role of transformation growth factor-β1 (TGF-β1) in the therapeutic effect of rapamycin on liver fibrosis in rats.
METHODS: Rats were divided into three groups: a normal control group, a liver fibrosis model group and a rapamycin treatment group. Rats were treated with carbon tetrachloride to induce liver fibrosis. Eight weeks after treatment, liver histological changes and the expression of TGF-β1 in the liver were detected. In addition, serum TGF-β1 levels were dynamically monitored.
RESULTS: After immunohistochemical and HE staining, image-pro plus 6 image analysis software was used to analyze the integrated absorbance (IA). The IA values were 9891.4 ± 1725.7, 104239.9 ± 20890.6, and 27853.6 ± 2031 in the normal control group, liver fibrosis model group and rapamycin treatment group, respectively. The expression of TGF-β1 in liver tissue was significantly different among the three groups (P < 0.01).
CONCLUSION: Rapamycin can significantly reduce the levels of TGF-β1 in liver tissue and serum, which may be involved in the therapeutic effect of rapamycin on liver fibrosis.
- Citation: Yan WZ, Zhong ZH, Dai J, Dai D, Chen TM, Hu ZC. Correlation between TGF-β1 expression and rapamycin-induced liver fibrosis improvement in rats. Shijie Huaren Xiaohua Zazhi 2013; 21(34): 3848-3852
- URL: https://www.wjgnet.com/1009-3079/full/v21/i34/3848.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i34.3848
肝纤维化是由于各种致病因子所致肝内结体组织异常增生, 主要涉及细胞外基质(extracellular matrix, ECM)度沉淀、肝星状细胞(hepatic stellate cell, HSC)活化及增殖及转移生长因子β1(transformation growth factor β1, TGF-β1)过度表达等诸多因素影响而成. 雷帕霉素(rapamycin, RAPA)大环内酯类免疫抑制剂[1,2], 他能阻断磷脂酰肌醇3激酶(phosphatidylinositol 3-kinase, PI3K)/蛋白激酶B(protein kinase B, AKT)/雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)细胞通路, 具有抑制细胞分化和增殖功能[3,4]. 本实验拟研究应用雷帕霉素治疗肝纤维化的作用. 具体观察肝脾组织病理改变、TGF-β1在肝脏组织的表达以及肝纤维化进展中血清TGF-β1的水平, 探讨RAPA在肝纤维化进展中的作用及其相关意义.
成年健康♂SD大鼠30只, 体质量200-250 g, 由广东医学院动物实验中心提供, 清洁级动物. 大鼠合格证编码: 44006400000013. 应用四氯化碳油(CCl4花生油)诱导建立肝纤维化模型, 以3 mL/kg剂量皮下注射体积浓度为40%的CCl4油溶液, 2次/wk, 连续8 wk[5].
1.2.1 实验: 30只SD大鼠随机分为3组: 正常对照组(A组)、肝纤维化模型组(B组)、雷帕霉素组(C组), 每组10只. B、C组于6 wk前都按前述方法建立肝纤维化模型, 其中的C组于第6周予雷帕霉素2 mg/kg体质量灌胃治疗, 1次/d, 持续2 wk. A、B组按同剂量予生理盐水灌胃, 1次/d, 持续2 wk. 各组大鼠分别于第3、6、8周从眼眶内眦静脉取血1 mL, 室温凝固30 min后, 2 ℃-8 ℃放置24 h; 1500 r/min离心15 min, 取血清-80 ℃冰冻保存待检.
1.2.2 指标观察: 组织形态学观察; HE染色后显微镜下观察; ELISA试剂盒检测血清TGF-β1浓度(大鼠TGF-β1双抗试剂盒, 由上海基尔顿生物技术有限公司提供); 组织中TGF-β1应用免疫组织化学法, 每张切片取5个视野测定TGF-β1阳性反应产物的积分光密度(integral optical density, IA)表示组织TGF-β1的表达水平, IA值越大表示阳性表达越强. 利用Image-pro plus 6.0图像分析软件处理相片.
统计学处理 使用SPSS17.0统计软件处理数据. 计量资料用mean±SD表示. 组间差异采用单因素方差分析(ANOVA)进行统计分析, 组间两两比较用最小显著性差异(LSD-t)进行统计学检验, P<0.05为差异有统计意义.
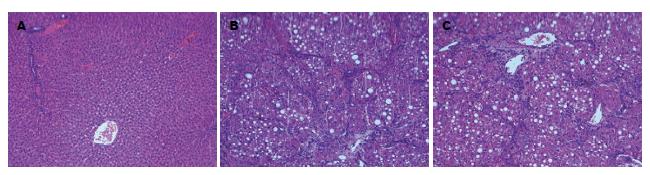
肝脏组织病理切片HE染色, 显微镜下观察: 正常对照组肝细胞沿中央小静脉放射状整齐排列, 肝细胞正常. 肝纤维化模型组肝脏组织呈混合滴性脂肪变, 肝细胞体积增大, 排列紊乱, 小叶间静脉扩张, 部分小叶中央静脉缺如, 或纤维间隔明显增生, 蜿蜒曲折行向中央静脉方向, 可见碎片状坏死区出现在门管区周围或隔周围, 内含成纤维细胞, 炎症细胞浸润, 小胆管增生, 部分纤维间隔穿插包绕肝细胞. 肝纤维化大鼠应用雷帕霉素组亦呈现肝纤维化大鼠为模型组形态学改变, 肝脏组织内纤维框架明显减少, 肝组织形态较肝纤维化大鼠为模型组有明显改善(图1).
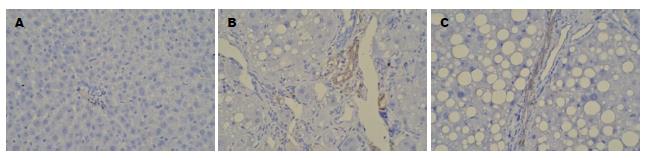
经免疫组织化学染色后, 在胞浆内出现棕褐色颗粒表达为阳性. 正常对照组(图2A)显示肝脏组织极少表达TGF-β1, 模型组(图2B)汇管区附近可见大量TGF-β1表达, 可见明显纤维间隔. 雷帕霉素组(图2C)有不同程度的TGF-β1阳性表达. 雷帕霉素组的TGF-β1表达(27853.6±2031)与模型组(104239.9±20890.6)比较, 有明显差异(P<0.01), 雷帕霉素组的TGF-β1表达(27853.6±2031)与正常对照组(9891.4±1725.7)比较, 有明显差异(P<0.01).
在肝纤维化模型建立中, 各组血清TGF-β1水平, 第3、6周时, B、C组血清TGF-β1浓度, 组间无明显差异(P>0.05). 第8周时, 雷帕霉素组有非常明显降低(P<0.01)(表1).
| 分组 | 3 wk | 6 wk | 8 wk |
| 正常对照组 | 259.97±34.93 | 269.25±16.78 | 265.65±13.83 |
| 肝纤维化模型组 | 311.61±19.20 | 330.74±44.23 | 487.55±46.52 |
| 肝纤维化应用雷帕霉素组 | 306.29±67.15 | 323.28±38.47 | 434.53±24.65 |
肝硬化是临床常见的慢性进行性肝病, 由一种或多种病因持续或者反复作用形成弥漫性肝损害. 据世界卫生组织提供的数据, 近年来每年全世界死于肝硬化的人数已增加到50万. 在发达国家, 肝硬化居死亡原因第5位, 仅次于恶性肿瘤、心血管疾病、脑血管病和意外事故. 研究者[6-9]认为, 晚期肝硬化是不可逆转的, 而肝纤维化、甚至早期肝硬化是可逆转的, 尤其在当潜在的疾病被根除. 实验研究显示: 雷帕霉素(rapamycin, RAPA)是1999年美国FAD认定的一种新型大环内酯类免疫抑制剂, 他能阻断PI3K/AKT/mTOR细胞通路, 具有抑制细胞分化和增殖功能. 通过大量的动物实验已经证实雷帕霉素是一种安全有效的新型免疫抑制剂, 2010年雷帕霉素已经进入第Ⅲ期临床试验, 更多的研究集中在他的器官移植抗排斥反应的作用. 近年来在肝纤维化形成机制中, TGF-β1的作用逐渐被发现, 提出TGF-β家族中尤以TGF-β1在肝纤维化的发生发展中有着重要的作用, TGF-β1与肝纤维化变呈正相关性[10-17]. 本文实验通过建立CCL4诱导的肝纤维化模型发现, 随着肝纤维化的建立, 证实模型组中肝组织及血清中的TGF-β1随着模型的建立进展时间延长而逐渐升高, 明显高于正常对照组(P<0.01). 应用雷帕霉素治疗后, TGF-β1较模型组均有明显降低(P<0.01), 从组织形态学也印证了雷帕霉素组的肝脏组织纤维化明显较模型组要轻. 实验证明雷帕霉素确能明显抑制肝脏纤维化, 但是其也具有一定不良反应, 如胃肠道反应、感染等. TGF-β1是最强的促纤维化细胞因子之一, 在肝纤维化的研究中越来越多. Guyot等[18]认为肝星状细胞(hepatic stellate cell, HSC)是成纤维细胞前体, 在慢性肝损伤时HSC活化转变为成纤维细胞, 分泌ECM、细胞因子和蛋白酶抑制剂等成分参与肝纤维化进展. 近年来越多的研究指出TGF-β1能活化HSC, 促进肝纤维化进展[19-22]. Shek等[23]报道称细胞因子中只有TGF-β1能活化HSC合成胶原纤维, 而其他细胞因子仅刺激HSC增殖, 通过TGF/Smad信号通路进行调控ECM的沉积. 在肝纤维化进展期中, 库否细胞(kupffer cell, KC)通过自分泌或旁分泌途径分泌大量TGF-β1, 同时增加HSC上血小板衍生因子(platelet derived growth factor, PDGF)受体表达, 通过自分泌循环分泌TGF-β1和PDGF, 使HSC持续活化, 抑制其凋亡. 雷帕霉素是PI3K/AKT/mTOR信号通路抑制剂, 抑制其激酶活性, 阻断其细胞通路, 抑制细胞分化和增殖[24-26]. KC是固定在肝脏的巨噬细胞,雷帕霉素阻断KC的PI3K/AKT/mTOR信号通路, 减少细胞因子肿瘤坏死因子-α、TGF-β1等释放, 抑制HSC增殖活化. 雷帕霉素亦可直接作用于HSC的Fas/Fasl系统, 启动Fas/Fasl凋亡通路, 上调P53、下调Bcl-2的表达实现HSC凋亡, 抑制增殖[27,28]. 雷帕霉素治疗肝纤维化的作用机制是复杂的, 通过多途径、多靶点共同作用, 减轻炎症和纤维化. 因此, 关于肝脏纤维化的详细机制还有待于进一步研究.
肝纤维化主要涉及细胞外基质(extracellular matrix, ECM)、肝星状细胞(hepatic stellate cell, HSC)及转移生长因子β1(transformation growth factor β1, TGF-β1)等诸多因素影响而成. 如何有效的预防及治疗肝纤维化导致的慢性肝损伤, 是肝病研究者们亟待解决的问题. 本研究显示肝纤维化病变是可以控制及可治疗的.
党双锁, 教授, 西安交通大学医学院第二附属医院感染科
雷帕霉素(rapamycin, RAPA)他通过阻断PI3K/AKT/mTOR细胞通路, 具有抑制TGF-β1在肝脏组织内的表达, 改善肝纤维化病变的进程. 应用RAPA治疗肝纤维化在相关研究中尚未有类似报道.
王博等转化生长因子1在不同疾病脾功能亢进患者脾组织中的表达及意义. Shek等报道称细胞因子中只有TGF-β1能活化HSC合成胶原纤维, 而其他细胞因子仅刺激HSC增殖, 通过TGF/Smad信号通路进行调控ECM的沉积. Gao等报道显示雷帕霉素是PI3K/AKT/mTOR信号通路抑制剂, 抑制其激酶活性, 阻断其细胞通路, 抑制细胞分化和增殖.
肝纤维化模型应用RAPA, 通过RAPA阻断PI3K/AKT/mTOR细胞通路, 具有抑制TGF-β1在肝脏组织内的表达, 改善肝纤维化病变的进程.
本文研究目的明确, 掌握国内外相关研究进展, 具有相应的创新性, 为肝纤维化等慢性肝损伤的治疗拓宽视野.
编辑: 田滢 电编:闫晋利
| 1. | Sanchez Antolín G, Garcia Pajares F, Lorenzo Pelayo S, Herranz Bachiller MT, Almohalla C, Velicia R, Caro Paton A. Indications and effectiveness of the mammalian target of rapamycin in liver transplantation. Transplant Proc. 2011;43:714-717. [PubMed] [DOI] |
| 2. | Kahan BD. Two-year results of multicenter phase III trials on the effect of the addition of sirolimus to cyclosporine-based immunosuppressive regimens in renal transplantation. Transplant Proc. 2003;35:37S-51S. [PubMed] |
| 3. | Kurdián M, Herrero-Fresneda I, Lloberas N, Gimenez-Bonafe P, Coria V, Grande MT, Boggia J, Malacrida L, Torras J, Arévalo MA. Delayed mTOR inhibition with low dose of everolimus reduces TGFβ expression, attenuates proteinuria and renal damage in the renal mass reduction model. PLoS One. 2012;7:e32516. [PubMed] [DOI] |
| 4. | Wu MJ, Wen MC, Chiu YT, Chiou YY, Shu KH, Tang MJ. Rapamycin attenuates unilateral ureteral obstruction-induced renal fibrosis. Kidney Int. 2006;69:2029-2036. [PubMed] |
| 5. | Constandinou C, Henderson N, Iredale JP. Modeling liver fibrosis in rodents. Methods Mol Med. 2005;117:237-250. [PubMed] |
| 6. | Li GM, Li DG, Fan JG, Xie Q. [Effect of silencing connective tissue growth factor on the liver fibrosis in rats]. Zhonghua Ganzangbing Zazhi. 2010;18:822-825. [PubMed] |
| 7. | Tangkijvanich P, Yee HF. Cirrhosis--can we reverse hepatic fibrosis? Eur J Surg Suppl. 2002;100-112. [PubMed] |
| 8. | Henderson NC, Forbes SJ. Hepatic fibrogenesis: from within and outwith. Toxicology. 2008;254:130-135. [PubMed] [DOI] |
| 9. | Rockey DC. Antifibrotic therapy in chronic liver disease. Clin Gastroenterol Hepatol. 2005;3:95-107. [PubMed] |
| 10. | Milani S, Herbst H, Schuppan D, Stein H, Surrenti C. Transforming growth factors beta 1 and beta 2 are differentially expressed in fibrotic liver disease. Am J Pathol. 1991;139:1221-1229. [PubMed] |
| 11. | Presser LD, McRae S, Waris G. Activation of TGF-β1 promoter by hepatitis C virus-induced AP-1 and Sp1: role of TGF-β1 in hepatic stellate cell activation and invasion. PLoS One. 2013;8:e56367. [PubMed] [DOI] |
| 12. | Li H, Dong C, Cao T, Chang S. [Expression of ADAMTS-2 and TGF-β1 in cirrhotic liver]. Zhongnan Daxue Xuebao (Yixueban). 2012;37:1026-1030. [PubMed] [DOI] |
| 13. | Bao JF, Shi JP, Xu S. [Dynamic expression of TGF-beta1/Smad protein in CCl4-induced liver fibrosis and its significance in rats]. Zhonghua Shiyan He Linchuangbing Duxue Zazhi. 2011;25:334-337. [PubMed] |
| 15. | Kim J, Kim CJ, Ko IG, Joo SH, Ahn HJ. Splenectomy affects the balance between hepatic growth factor and transforming growth factor-β and its effect on liver regeneration is dependent on the amount of liver resection in rats. J Korean Surg Soc. 2012;82:238-245. [PubMed] [DOI] |
| 16. | Morinaga A, Ogata T, Kage M, Kinoshita H, Aoyagi S. Comparison of liver regeneration after a splenectomy and splenic artery ligation in a dimethylnitrosamine-induced cirrhotic rat model. HPB (Oxford). 2010;12:22-30. [PubMed] [DOI] |
| 17. | Ueda S, Yamanoi A, Hishikawa Y, Dhar DK, Tachibana M, Nagasue N. Transforming growth factor-beta1 released from the spleen exerts a growth inhibitory effect on liver regeneration in rats. Lab Invest. 2003;83:1595-1603. [PubMed] |
| 18. | Guyot C, Lepreux S, Combe C, Doudnikoff E, Bioulac-Sage P, Balabaud C, Desmoulière A. Hepatic fibrosis and cirrhosis: the (myo)fibroblastic cell subpopulations involved. Int J Biochem Cell Biol. 2006;38:135-151. [PubMed] |
| 19. | Guimarães EL, Best J, Dollé L, Najimi M, Sokal E, van Grunsven LA. Mitochondrial uncouplers inhibit hepatic stellate cell activation. BMC Gastroenterol. 2012;12:68. [PubMed] |
| 20. | Xiao X, Gang Y, Gu Y, Zhao L, Chu J, Zhou J, Cai X, Zhang H, Xu L, Nie Y. Osteopontin contributes to TGF-β1 mediated hepatic stellate cell activation. Dig Dis Sci. 2012;57:2883-2891. [PubMed] [DOI] |
| 21. | Woodhoo A, Iruarrizaga-Lejarreta M, Beraza N, García-Rodríguez JL, Embade N, Fernández-Ramos D, Martínez-López N, Gutiérrez-De Juan V, Arteta B, Caballeria J. Human antigen R contributes to hepatic stellate cell activation and liver fibrosis. Hepatology. 2012;56:1870-1882. [PubMed] [DOI] |
| 22. | Lang Q, Liu Q, Xu N, Qian KL, Qi JH, Sun YC, Xiao L, Shi XF. The antifibrotic effects of TGF-β1 siRNA on hepatic fibrosis in rats. Biochem Biophys Res Commun. 2011;409:448-453. [PubMed] [DOI] |
| 23. | Shek FW, Benyon RC. How can transforming growth factor beta be targeted usefully to combat liver fibrosis? Eur J Gastroenterol Hepatol. 2004;16:123-126. [PubMed] |
| 24. | Gao N, Flynn DC, Zhang Z, Zhong XS, Walker V, Liu KJ, Shi X, Jiang BH. G1 cell cycle progression and the expression of G1 cyclins are regulated by PI3K/AKT/mTOR/p70S6K1 signaling in human ovarian cancer cells. Am J Physiol Cell Physiol. 2004;287:C281-C291. [PubMed] |
| 25. | Gao N, Zhang Z, Jiang BH, Shi X. Role of PI3K/AKT/mTOR signaling in the cell cycle progression of human prostate cancer. Biochem Biophys Res Commun. 2003;310:1124-1132. [PubMed] |
| 26. | Xu Z, Zhang Y, Jiang J, Yang Y, Shi R, Hao B, Zhang Z, Huang Z, Kim JW, Zhang G. Epidermal growth factor induces HCCR expression via PI3K/Akt/mTOR signaling in PANC-1 pancreatic cancer cells. BMC Cancer. 2010;10:161. [PubMed] [DOI] |
| 28. | Shafer A, Zhou C, Gehrig PA, Boggess JF, Bae-Jump VL. Rapamycin potentiates the effects of paclitaxel in endometrial cancer cells through inhibition of cell proliferation and induction of apoptosis. Int J Cancer. 2010;126:1144-1154. [PubMed] [DOI] |