修回日期: 2013-09-21
接受日期: 2013-11-06
在线出版日期: 2013-12-08
目的: 分析MicroRNA-96(miR-96)在胃癌组织中的表达情况; 体外研究miR-96反义寡核酸技术(antisense oligonucleotide, ASO)对胃癌细胞侵袭和迁移的影响.
方法: 运用荧光定量PCR检测122例胃癌组织及对应正常组织中miR-96的表达; 通过miR-96 ASO降低胃癌细胞中miR-96的表达, 采用Transwell实验和划痕实验观察miR-96 ASO对胃癌细胞侵袭和迁移能力的影响, 同时运用Western blot的方法检测侵袭相关蛋白的表达变化.
结果: 在122例胃癌病例中, 62.30%(76/122)的胃癌组织miR-96表达明显高于对应正常组织(P<0.05); 与空白对照组和转染无义ASO组相比, miR-96 ASO可以显著降低miR-96的表达(P<0.05); Transwell实验和划痕实验结果显示转染miR-96 ASO后, 胃癌细胞的侵袭迁移能力明显下降, 同时相关侵袭蛋白基质金属蛋白酶2(matrix metalloproteinase 2, MMP2)和MMP9表达下降(P<0.05).
结论: miR-96在胃癌组织中表达上调, 降低miR-96的表达可有效抑制胃癌细胞的侵袭和迁移. miR-96有可能成为胃癌侵袭转移调控的新靶点.
核心提示: MicroRNA-96(miR-96)通过调控基质金属蛋白酶2(matrix metalloproteinase 2, MMP2)和MMP9的表达而对肿瘤细胞侵袭迁移产生影响.
引文著录: 毛盛勋, 周智勇, 何楠, 尹成龙, 曹家庆. miR-96对胃癌细胞侵袭迁移的影响. 世界华人消化杂志 2013; 21(34): 3775-3782
Revised: September 21, 2013
Accepted: November 6, 2013
Published online: December 8, 2013
AIM: To detect the expression of miR-96 in gastric cancer tissues and investigate the regulatory effect of miR-96 ASO on the invasion and migration of gastric cancer cells in vitro.
METHODS: The expression of miR-96 in 122 gastric cancer tissues and their adjacent tissues was detected by real-time quantitative PCR. After transfection of gastric cancer cells with miR-96ASO, an miR-96 antisense oligonucleotide, the biological effects of miR-96 was measured by transwell assay and wound healing assay, and invasion-related protein expression was analyzed by Western blot.
RESULTS: MiR-96 was found to be overexpressed in 62.30% (76/122) of the gastric cancer cases (P < 0.05). MiR-96 expression in gastric cancer cells transfected with miR-96 ASO was significantly lower than that in control cells (P < 0.05). Transwell and wound healing assay results showed that cell invasion and migration were decreased greatly after transfection with miR-96 ASO. Furthermore, down-regulation of miR-96 resulted in obvious inactivation of MMP2 and MMP9 (P < 0.05).
CONCLUSION: MiR-96 is overexpressed in human gastric cancer. Reducing the expression of miR-96 can effectively inhibit the invasion and migration of gastric cancer cells. MiR-96 may become a new target for the regulation of invasion and migration of gastric cancer.
- Citation: Mao SX, Zhou ZY, He N, Yin CL, Cao JQ. Role of miR-96 in invasion and migration of gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2013; 21(34): 3775-3782
- URL: https://www.wjgnet.com/1009-3079/full/v21/i34/3775.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i34.3775
MicroRNAs(miRNA)是一种内源性的非编码小分子RNA, 可以在转录后水平调节蛋白质的合成, 广泛分布于生物细胞体内. 大量研究已经证实miRNA在恶性肿瘤细胞的发生、发展中发挥重要作用, 其中包括调控细胞的增殖、分化、凋亡以及侵袭和转移[1-10]. 研究报道miR-96在乳腺癌及结肠癌等恶性肿瘤中表达上调[11-23]. 过表达miR-96的表达可以促进在乳腺癌细胞的增殖[23]. 然而miR-96对胃癌细胞侵袭迁移能力的影响尚未见报道. 本实验采用荧光定量PCR检测miR-96在胃癌组织中的表达情况, 同时利用反义寡核酸技术(antisense oligonucleotide, ASO)抑制miR-96在胃癌细胞中的表达, 分析miR-96对胃癌细胞侵袭迁移能力的影响, 同时检查侵袭相关蛋白基质金属蛋白酶2(matrix metalloproteinase 2, MMP2)和MMP9蛋白的表达变化.
收集2008-09/2012-05南昌大学第二附属医院胃肠外科122例胃癌及对应癌旁组织手术标本, 所有标本均经病理学检查确诊, 其中男76例, 女46例, 年龄39-72岁. 所有患者术前均未接受放化疗. 胃癌SGC7901和MGC-803细胞由本实验室保存; TaqMan miRNA分析试剂盒(美国ABI公司); DMEM高糖培养基(美国Gibco公司)、胎牛血清(美国Hyclone公司)、脂质体Lipfectamine 2000(美国Invitrogen公司); 反义miR-96寡核苷酸(miR-96 ASO)(大连宝生物公司); 总蛋白提取试剂盒(北京普利莱)、兔抗人MMP2和MMP9单克隆抗体(美国Santa Cruz公司)、β-actin二抗(北京中杉金桥公司); TranswellChamber(美国Chemicon公司); Matrigel胶(美国BD公司); 荧光定量PCR分析仪7500(美国ABI公司).
1.2.1 实时荧光定量PCR检测miR-96的表达: 采用RNA提取试剂提取瘤组织及对应正常组织中总RNA, 测定浓度, -80 ℃保存. 运用miRNA分析试剂盒检测miR-96的表达. 首先取2 μg总RNA为反应模板与3 μL逆转录酶相互混合, 反应体系为20 μL, 反应条件为: 16 ℃ 30 min, 45 ℃ 30 min, 85 ℃ 5min. 反应结束后, 收集cDNA. 采用SYBR Green法定量检测, 将质粒稀释品分别梯度稀释为1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、1×10-7和1×10-8, 用于建立标准曲线. 反应条件: 95 ℃ 15min; 95 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 30 s, 共45个循环, 最后72 ℃延伸7 min. 在每个循环的最后增加溶解曲线. 阈值定义为基础荧光信号的10个标准差, 即时循环数为Ct, 依据标准曲线计算目的基因的mRNA量. 实验重复3次.
1.2.2 反义miR-96单核苷酸序列设计: 获取人miR-96的序列(http://www.sanger.ac.uk/software/Rfam/mirna), 设计其反义寡核苷酸序列, 运用NCBI BLAST检索程序以排除其他的同源序列. 另外, 同时设计一条无义阴性对照序列, 如下所示: miR-96 sense: 5'-AGUCACUAGUGGUUCCGUUUA-3', 反义miR-96 antisense: 5'-TAAACGGAACCACTAGTGACT-3', 无义序列sense: 5'-UCUUCCGAACGUGUCACGUTT-3', antisense: 5'-AAGUGACACGUUCGGAGAATT-3', 由上海英骏生物技术公司合成.
1.2.3 细胞培养和反义寡核苷酸转染: 将SGC7901和MGC-803胃癌细胞接种于10%胎牛血清DMEM培养基, 37 ℃、5%CO2条件下培养. 运用LipfectamineTM 2000转染试剂盒进行转染, 反义miR-96寡核苷酸终浓度分别为: 50、100、150、200和250 nmol/L. 本实验组筛选出最佳终干扰浓度为150 nmol/L. 转染后培养时间分别为24、48、72 h, 初步筛出最佳作用时间为48 h. 上述操作重复3次.
1.2.4 转染miR-96 ASO后对miR-96表达的影响: 实验分为空白对照组、无义ASO和miR-96. 转染终浓度为150 nmol/L的miR-96 ASO 48 h后, 提取总RNA, 测定浓度, 逆转录为cDNA(反应条件同1.2.1), 测定cDNA浓度. 运用microRNA检测试剂盒检测miR-96的表达(具体条件同1.2.1). 上述操作重复3次.
1.2.5 Transwell侵袭实验: Transwell小室的上下室之间以孔径为8 μm的聚碳酸酯微膜孔分隔开, 滤膜上层铺盖人工基底胶(Matrigel). 实验开始前将Transwell小室复温至37 ℃, 在内室中加入300 μL的DMEM培养液, 置于培养箱中孵育2 h, 使Matrigel水化. 用胰酶消化细胞成单细胞悬液, 800 r/min离心5 min, 收集细胞, 用PBS洗涤细胞两次, 最后用无血清的DMEM培养基重悬细胞, 调整细胞数为1.0×106个/mL. 吸出内室中培养液, 吸取500 μL含10%血清的DMEM于外室中作为趋化因子, 加300 μL细胞悬液于内室中, 37 ℃、5%CO2培养箱中培养24 h. 取出Transwell小室吸除培养基, 利用棉签擦净Transwell小室滤膜上层的Matrigel及未穿过滤膜的细胞. 将小室浸入细胞染色液中染色20 min, 采用蒸馏水冲洗, 风干. 实验分组同1.2.4, 每次同时做3个重复小室, 显微镜观察计数, 取平均值.
1.2.6 Transwell迁移实验: 实验分组同1.2.4. 具体过程与Transwell侵袭实验基本一致, 不同的是Transwell迁移实验不需要铺Matrigel.
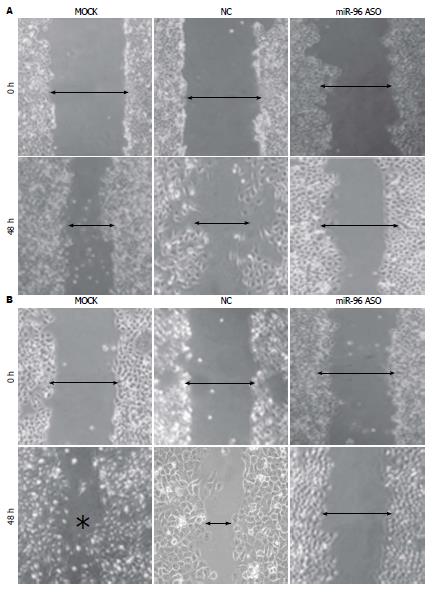
1.2.7 划痕实验: 实验分组同1.2.4. 采用Marker笔在6孔板背面均匀划横线, 约0.5-1.0 cm宽, 横穿过孔, 每孔至少穿过5条线. 在孔中加入约5×105个细胞, 掌握为过夜细胞能铺满整孔. 第2天利用10 μL枪头依横线划痕, 注意枪头垂直. PBS洗细胞3次, 去除划下的细胞, 加入培养基. 置于37 ℃、5%CO2培养箱培养. 0、48 h取样, 在显微镜拍照. 每个样本至少重复3次.
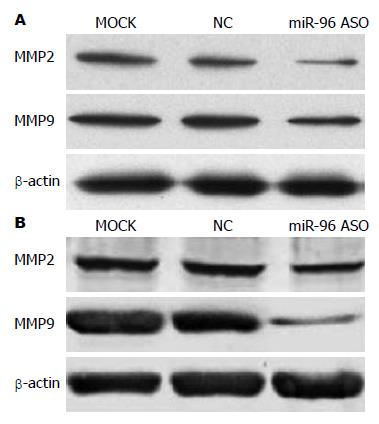
1.2.8 检测各组细胞中MMP2和MMP9蛋白表达: 实验分组同1.2.4. 收集各组SGC7901和MGC-803细胞, 运用总蛋白提取试剂盒提取各组细胞中的总蛋白, 经10%SDS-PAGE电泳后转膜, 将膜放在含5%脱脂奶粉的TBST缓冲液中37 ℃封闭2 h, 加一抗稀释液1:400稀释兔抗人MMP2和MMP9单克隆抗体在4 ℃孵育过夜, 1×TBST缓冲液3次(每次10 min), 加辣根过氧化物酶标记的山羊抗兔IgG(1:5000稀释), 置于37 ℃孵育2 h, 1×TBST缓冲液3次(每次10 min), 运用ECL化学发光法检测目的蛋白条带. 以β-actin作为内参.
统计学处理 采用SPSS17.0统计软件包进行分析. 计量资料以mean±SD表示, 癌及癌旁组织比较采用配对样本t检验, 多组均数之间比较采用单因素方差分析, 两两比较采用LSD-t检验, P<0.05为差异有统计学意义.
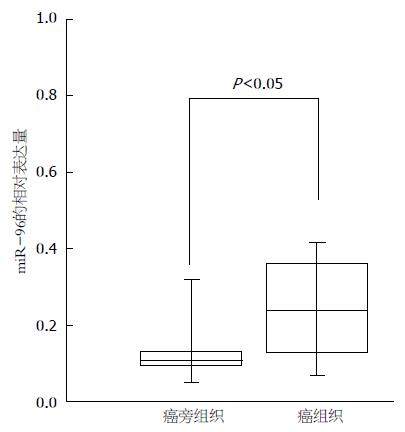
运用实时荧光定量PCR检测122例胃癌患者癌及癌旁组织中miR-96的表达情况, 结果发现: 62.30%(76/122)病例胃癌组织miR-96的表达明显高于相对应的正常癌旁组织, 结果有统计学意义(t = 29.21, P<0.05)(图1). 其他37.70%(46/122)病例胃癌组织miR-96的表达未见明显增高(t = 0.23, P>0.05).
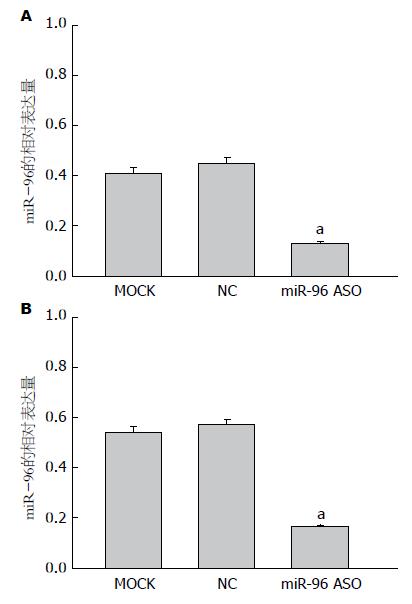
荧光定量PCR方法检测结果发现: SGC7901细胞转染miR-96 ASO组miR-96的相对表达量较空白对照组和转染无义ASO组明显降低(组间F = 391.66, P<0.05); MGC-803细胞同样发现miR-96 ASO组miR-96的相对表达量较空白对照组和转染无义ASO组明显下调(组间F = 488.42, P<0.05)(图2).
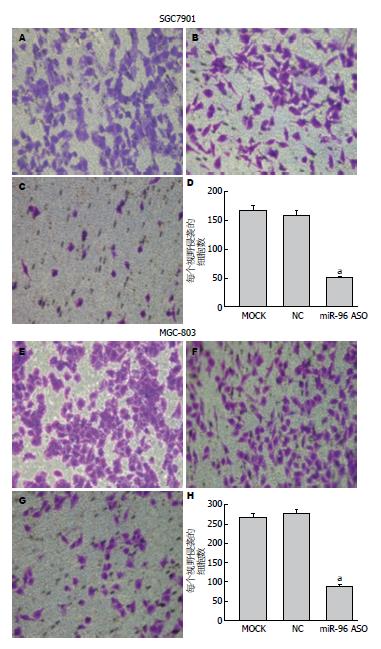
转染miR-96 ASO组的SGC7901细胞侵袭能力与空白对照组及转染无义ASO组相比明显降低(组间F = 596.33, P<0.05), 而空白对照组与转染无义ASO组无明显差别(P>0.05). MGC-803细胞实验结果与SGC7901细胞一致. 结果显示: 转染miR-96 ASO组的MGC-803细胞侵袭能力较空白对照组、转染无义ASO组相比明显降低(组间F = 631.24, P<0.05), 而空白对照组与转染无义ASO组无明显差别(P>0.05)(图3).
通过各组细胞穿过人工基质胶的细胞数量的多少, 来评估各组细胞的侵袭能力, 每组取5个高倍镜视野. 结果显示: 转染miR-96 ASO组的SGC7901细胞侵袭能力与空白对照组及转染无义ASO组相比明显降低(组间F = 472.57, P<0.05), 而空白对照组与转染无义ASO组无明显差别(P>0.05). MGC-803细胞实验结果与SGC7901细胞一致. 结果显示: 转染miR-96 ASO组的MGC-803细胞侵袭能力较空白对照组、转染无义ASO组相比明显降低(组间F = 289.34, P<0.05), 而空白对照组与转染无义ASO组无明显差别(P>0.05)(图4).
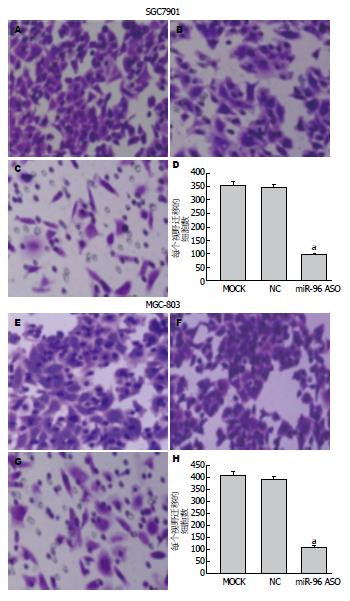
miR-96 ASO组细胞划痕的愈合率比空白对照组组和转染无义ASO组细胞划痕愈率明显下降, 差异具有统计学意义(SGC7901细胞组间F = 743.24, P<0.05; MGC-803细胞组间F = 564.18, P<0.05)(图5).
miR-96 ASO转染SGC7901和MGC-803细胞后, Western blot检查各组细胞中MMP2和MMP9蛋白表达水平, 结果发现miR-96 ASO组MMP2和MMP9的相对表达水平明显低于空白对照组和转染无义ASO组(P<0.05)(图6).
胃癌是全球发病率最高的恶性肿瘤之一, 侵袭转移是患者死亡和治疗效果不理想的主要原因. 侵袭转移是一个多步骤、多阶段、多途径、多个因素共同调控的复杂生物学过程[24-27], 基本过程包括: 首先癌细胞脱离原发灶、其次癌细胞进入循环系统(淋巴循环和血液循环)、侵袭靶器官、远处定植和新生血管形成, 最终导致转移灶的形成. 胃癌的侵袭转移牵涉到多个因素、蛋白和基因多方面的调节. miRNAs是在真核生物中发现的一类内源性的具有调控功能的非编码RNA, 其大小20-25 nt, 通过与靶mRNA互补配对从而导致mRNA降解或抑制转录后蛋白翻译最终导致诱导基因沉默. 研究证实miRNA参与一系列的重要的生物学进程, 包括生长发育、细胞分化、组织器官形成、细胞凋亡和癌症的发生及侵袭转移等. 近年来研究发现[28,29], miRNAs与恶性肿瘤关系密切, 与多种恶性肿瘤的发生及侵袭转移相关. 因此miRNAs可能成为诊断肿瘤的新的分子标志和判断肿瘤治疗及预后的分子靶点, 而且miRNAs在转录后水平调节靶基因的表达, 这更有助于肿瘤的早发现、早诊断和早治疗[30].
研究已经证实miR-96在多种恶性肿瘤中表达失调[13-19], 但miR-96在胃癌中的表达及作用目前尚不清楚. 本实验首先利用实时荧光定量PCR检测临床胃癌标本及相对应的癌旁胃组织, 结果发现miR-96在胃癌组织中呈明显高表达. 这表明miR-96在胃癌发生发展中发挥重要作用. 为了研究miR-96对胃癌细胞侵袭迁移能力的影响, 本实验首先通过转染miR-96 ASO降低胃癌细胞中miR-96的表达, 同时利用Transwell方法检测降低miR-96的表达后胃癌细胞侵袭迁移能力的变化, 结果显示转染miR-96 ASO的胃癌细胞侵袭迁移能力明显降低. 此外我们进一步利用划痕实验观察到抑制miR-96的表达后, 胃癌细胞的划痕愈合能力明显下调. 这些结果都表明miR-96在胃癌细胞的侵袭迁移过程中起着非常重要的作用, 这与Chen等[19]研究发现降低miR-96的表达可以明显抑制肝癌细胞的侵袭迁移能力结果基本一致, 说明miR-96在恶性肿瘤的侵袭转移中发挥重要作用.
为了进一步分析降低miR-96表达后引起胃癌细胞侵袭迁移能力下降的可能机制, 我们发现, 抑制miR-96的表达可以明显降低侵袭相关蛋白MMP2和MMP9蛋白的表达, 说明miR-96可能是通过调控MMP2和MMP9的表达而对肿瘤细胞侵袭迁移产生影响.
总之, miR-96在调控胃癌细胞的侵袭和迁移方面发挥重要作用, 其很可能成为一个胃癌侵袭转移新的调节基因, 为胃癌临床基因治疗提供新的靶点.
MicroRNAs(miRNA)是一种内源性的非编码小分子RNA, 可以在转录后水平调节蛋白质的合成, 广泛分布于生物细胞体内. 大量研究已经证实miRNA在恶性肿瘤细胞的发生、发展中发挥重要作用, 其中包括调控细胞的增殖、分化、凋亡以及侵袭和转移.
刘炳亚, 研究员, 上海交通大学医学院附属瑞金医院上海消化外科研究所
近年来研究发现miRNAs与恶性肿瘤关系密切, 与多种恶性肿瘤的发生及侵袭转移相关. 因此miRNAs可能成为诊断肿瘤的新的分子标志和判断肿瘤治疗及预后的分子靶点, 而且miRNAs在转录后水平调节靶基因的表达, 这更有助于肿瘤的早发现、早诊断和早治疗.
研究报道miR-96在乳腺癌及结肠癌等恶性肿瘤中表达上调. 过表达miR-96的表达可以促进在乳腺癌细胞的增殖. 然而miR-96对胃癌细胞侵袭迁移能力的影响尚未见报道.
本实验首次检测miR-96在胃癌组织中的表达情况; 首次分析miR-96对胃癌细胞侵袭迁移能力的影响; 首次分析miR-96与MMP2和MMP9蛋白的关联.
miR-96在调控胃癌细胞的侵袭和迁移方面发挥重要作用, 其很可能成为一个胃癌侵袭转移新的调节基因, 为胃癌临床基因治疗提供新的靶点.
本文具有一定指导意义.
编辑: 田滢 电编:闫晋利
| 2. | Schwarzenbacher D, Balic M, Pichler M. The role of microRNAs in breast cancer stem cells. Int J Mol Sci. 2013;14:14712-14723. [PubMed] |
| 3. | Park EC, Kim G, Jung J, Wang K, Lee S, Jeon SS, Lee ZW, Kim SI, Kim S, Oh YT. Differential expression of MicroRNAs in patients with glioblastoma after concomitant chemoradiotherapy. OMICS. 2013;17:259-268. [PubMed] [DOI] |
| 4. | Katsuda T, Ochiya T. [microRNAs act as a fine-tuner of liver development, regeneration, and carcinogenesis]. Seikagaku. 2012;84:666-674. [PubMed] |
| 5. | Xia H, Hui KM. MicroRNAs involved in regulating epithelial-mesenchymal transition and cancer stem cells as molecular targets for cancer therapeutics. Cancer Gene Ther. 2012;19:723-730. [PubMed] [DOI] |
| 6. | O'Connell RM, Baltimore D. MicroRNAs and hematopoietic cell development. Curr Top Dev Biol. 2012;99:145-174. [PubMed] [DOI] |
| 7. | Onder TT, Daley GQ. microRNAs become macro players in somatic cell reprogramming. Genome Med. 2011;3:40. [PubMed] [DOI] |
| 8. | Zimmerman AL, Wu S. MicroRNAs, cancer and cancer stem cells. Cancer Lett. 2011;300:10-19. [PubMed] [DOI] |
| 9. | Agami R. microRNAs, RNA binding proteins and cancer. Eur J Clin Invest. 2010;40:370-374. [PubMed] [DOI] |
| 10. | Chen CZ, Li L, Lodish HF, Bartel DP. MicroRNAs modulate hematopoietic lineage differentiation. Science. 2004;303:83-86. [PubMed] |
| 11. | Wang Y, Luo H, Li Y, Chen T, Wu S, Yang L. hsa-miR-96 up-regulates MAP4K1 and IRS1 and may function as a promising diagnostic marker in human bladder urothelial carcinomas. Mol Med Rep. 2012;5:260-265. [PubMed] [DOI] |
| 12. | Lin H, Dai T, Xiong H, Zhao X, Chen X, Yu C, Li J, Wang X, Song L. Unregulated miR-96 induces cell proliferation in human breast cancer by downregulating transcriptional factor FOXO3a. PLoS One. 2010;5:e15797. [PubMed] [DOI] |
| 13. | Sarver AL, French AJ, Borralho PM, Thayanithy V, Oberg AL, Silverstein KA, Morlan BW, Riska SM, Boardman LA, Cunningham JM. Human colon cancer profiles show differential microRNA expression depending on mismatch repair status and are characteristic of undifferentiated proliferative states. BMC Cancer. 2009;9:401. |
| 14. | Guo Y, Liu H, Zhang H, Shang C, Song Y. miR-96 regulates FOXO1-mediated cell apoptosis in bladder cancer. Oncol Lett. 2012;4:561-565. [PubMed] |
| 15. | Xu D, He X, Chang Y, Xu C, Jiang X, Sun S, Lin J. Inhibition of miR-96 expression reduces cell proliferation and clonogenicity of HepG2 hepatoma cells. Oncol Rep. 2013;29:653-661. [PubMed] [DOI] |
| 16. | Xu XM, Qian JC, Deng ZL, Cai Z, Tang T, Wang P, Zhang KH, Cai JP. Expression of miR-21, miR-31, miR-96 and miR-135b is correlated with the clinical parameters of colorectal cancer. Oncol Lett. 2012;4:339-345. [PubMed] |
| 17. | Wang Y, Huang JW, Calses P, Kemp CJ, Taniguchi T. MiR-96 downregulates REV1 and RAD51 to promote cellular sensitivity to cisplatin and PARP inhibition. Cancer Res. 2012;72:4037-4046. [PubMed] [DOI] |
| 18. | Vishwamitra D, Li Y, Wilson D, Manshouri R, Curry CV, Shi B, Tang XM, Sheehan AM, Wistuba II, Shi P. MicroRNA 96 is a post-transcriptional suppressor of anaplastic lymphoma kinase expression. Am J Pathol. 2012;180:1772-1780. [PubMed] [DOI] |
| 19. | Chen RX, Xia YH, Xue TC, Ye SL. Suppression of microRNA-96 expression inhibits the invasion of hepatocellular carcinoma cells. Mol Med Rep. 2012;5:800-804. [PubMed] [DOI] |
| 20. | Yu S, Lu Z, Liu C, Meng Y, Ma Y, Zhao W, Liu J, Yu J, Chen J. miRNA-96 suppresses KRAS and functions as a tumor suppressor gene in pancreatic cancer. Cancer Res. 2010;70:6015-6025. [PubMed] [DOI] |
| 21. | Guttilla IK, White BA. Coordinate regulation of FOXO1 by miR-27a, miR-96, and miR-182 in breast cancer cells. J Biol Chem. 2009;284:23204-23216. [PubMed] [DOI] |
| 22. | Myatt SS, Wang J, Monteiro LJ, Christian M, Ho KK, Fusi L, Dina RE, Brosens JJ, Ghaem-Maghami S, Lam EW. Definition of microRNAs that repress expression of the tumor suppressor gene FOXO1 in endometrial cancer. Cancer Res. 2010;70:367-377. [PubMed] [DOI] |
| 23. | Pineau P, Volinia S, McJunkin K, Marchio A, Battiston C, Terris B, Mazzaferro V, Lowe SW, Croce CM, Dejean A. miR-221 overexpression contributes to liver tumorigenesis. Proc Natl Acad Sci U S A. 2010;107:264-269. [PubMed] [DOI] |
| 24. | Fidler IJ. The pathogenesis of cancer metastasis: the 'seed and soil' hypothesis revisited. Nat Rev Cancer. 2003;3:453-458. [PubMed] |
| 25. | Steeg PS. Tumor metastasis: mechanistic insights and clinical challenges. Nat Med. 2006;12:895-904. [PubMed] |
| 26. | Yang Z, Garcia A, Xu S, Powell DR, Vertino PM, Singh S, Marcus AI. Withania somnifera Root Extract Inhibits Mammary Cancer Metastasis and Epithelial to Mesenchymal Transition. PLoS One. 2013;8:e75069. [PubMed] [DOI] |
| 27. | Abdul Hafid SR, Chakravarthi S, Nesaretnam K, Radhakrishnan AK. Tocotrienol-adjuvanted dendritic cells inhibit tumor growth and metastasis: a murine model of breast cancer. PLoS One. 2013;8:e74753. [PubMed] [DOI] |
| 28. | Brennecke J, Hipfner DR, Stark A, Russell RB, Cohen SM. bantam encodes a developmentally regulated microRNA that controls cell proliferation and regulates the proapoptotic gene hid in Drosophila. Cell. 2003;113:25-36. [PubMed] |
| 30. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Murray T, Thun MJ. Cancer statistics, 2008. CA Cancer J Clin. 2008;58:71-96. [PubMed] [DOI] |