修回日期: 2013-09-28
接受日期: 2013-10-20
在线出版日期: 2013-12-08
肝再生实际上是肝脏在组织发生缺损后进行损伤修复的代偿性增生过程, 其机制非常复杂, 多种细胞因子、核受体和信号通路参与其中. 法尼醇X受体(farnesoid X receptor, FXR)是需配体激活的转录因子, 属于代谢性核受体, 在肝脏胆汁酸、脂质、糖代谢过程中起着重要的调节作用. 近来研究发现, 核受体FXR对肝脏再生至关重要. FXR的激活通过促进部分肝切除后肝细胞的增殖, 直接促进肝脏再生; 通过调节胆汁酸的合成与转运, 避免切除后胆汁酸过多引起的肝组织损伤; 其代谢调节作用有益于肝再生进程. 本文着重对FXR调控肝再生的机制及促肝再生药物靶向治疗做一综述.
核心提示: 本文着重介绍了核受体法尼醇X受体(farnesoid X receptor, FXR)在肝再生中的重要作用, 包括促进肝细胞增殖、降低胆汁酸压力及其代谢调节作用, 并探讨了部分肝切除或活体肝移植术后, 针对FXR的促肝再生药物靶向治疗的可能性.
引文著录: 孟强, 刘克辛. 核受体FXR在肝再生中的作用. 世界华人消化杂志 2013; 21(34): 3767-3774
Revised: September 28, 2013
Accepted: October 20, 2013
Published online: December 8, 2013
Liver regeneration is a practical compensatory re-growth in response to the loss of hepatic tissue. The mechanism of liver regeneration is very complex and many cytokines, transcription factors and signaling pathways are involved in this process. The farnesoid X receptor (FXR) is a member of metabolic nuclear receptors of intracellular ligand-activated transcription factors and plays an important role in metabolism of bile acids, lipid and glucose. In addition, it has been recently reported that FXR is crucial for liver regeneration. FXR activation directly promotes liver regeneration by regulating hepatocyte proliferation and regulates synthesis and transport of bile acids to prevent the liver from injury by increased bile acids after hepatectomy. The metabolic regulation of FXR is beneficial to liver regeneration. This review focuses on the mechanism of FXR regulation of liver regeneration and targeted drugs.
- Citation: Meng Q, Liu KX. Role of nuclear receptor FXR in liver regeneration. Shijie Huaren Xiaohua Zazhi 2013; 21(34): 3767-3774
- URL: https://www.wjgnet.com/1009-3079/full/v21/i34/3767.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i34.3767
近年来, 各种原因引起的肝癌或肝硬化等终末期肝病的发病率正逐年升高, 肝切除术是其目前最常用也是最有效的治疗方法[1,2]. 然而部分肝切除手术的安全性及其预后在很大程度上取决于患者残余肝脏的再生能力. 研究发现, 大部分行部分肝切除术的终末期肝病患者, 预后不佳. 究其原因, 主要在于患者残余肝脏的再生能力低下或迟缓[3]. 如何有效地提高残余肝组织的再生代偿能力, 进而提高部分肝切除术的治疗效果已成为当今急需解决的课题之一. 法尼醇X受体(farnesoid X receptor, FXR)作为一个需配体激活具有转录因子功能的核受体, 调节着不同代谢途径中相关基因的表达, 现已成为胆汁淤积、糖尿病、动脉硬化及胆固醇结石等代谢性疾病治疗中的研究热点之一[4-8]. 最近, 有报道表明核受体FXR还调节着肝再生相关基因的表达, 成为肝再生必不可少的调节因子[9-11]. 本文简要概述了肝再生过程、FXR的基本性质包括其结构、分布、分型及配体, 着重对FXR调控肝再生的机制及促肝再生药物靶向治疗做一综述.
肝脏是人体重要的代谢与解毒器官, 也是体内再生能力非常强的器官之一. 正常肝脏仅有0.0012%-0.01%的肝细胞进行有丝分裂, 但肝脏被部分切除或受到化学毒物损伤后, 肝脏中残余肝细胞表现出强大的再生能力. 在正常情况下, 人体肝脏在部分切除后, 3 d内开始再生, 6 mo后可恢复原肝质量. 然而肝癌患者因其往往伴有肝硬化症状, 硬变的肝脏行部分切除术后, 其再生能力较正常肝脏明显减慢或延迟, 对患者预后产生极为不利的影响[12]. 严重者甚至由于残余肝脏再生能力不足、肝脏正常生理功能无法恢复而死亡. 再者, 随着近年来器官移植技术的发展, 活体肝移植术已被公认为治疗终末期肝脏疾病的有效方法, 而该手术进行的前提是必须同时保证供体和受体的生命安全, 因此肝脏部分切除后, 残余肝组织能否迅速有效地生长直接影响患者的预后[13]. 此外研究还发现, 随着年龄的增长, 人体肝脏再生能力呈现明显下降趋势[14]. 因此, 如何有效地提高残余肝脏的再生能力已成为当下研究热点. 肝再生实际上是肝脏对于自身部分切除或受到外界毒物损伤后的一种适应性代偿反应, 体内多种物质如细胞因子、转录因子、信号通路等参与其中, 对肝再生过程起着重要的调控作用[15].
FXR于1995年被首次发现, 因其可被甲羟戊酸代谢途径的中间代谢产物法尼醇激活而得名[16]. FXR是核受体超家族成员之一, 属于代谢性核受体, 与其同类的还有肝脏X受体(liver X receptors, LXRs)、过氧化物酶体增殖物激活受体(peroxisome proliferators activated receptors, PPARs)、孕烷X受体(pregnane X receptor, PXR)及组成性雄甾烷受体(constitutive androstane receptor, CAR)[17]. 核受体FXR在胆汁酸、脂质和糖代谢过程中发挥着重要的调节作用, 近来还发现FXR通过调节肝再生过程中重要基因的表达, 对肝再生过程也发挥着重要的调节作用.
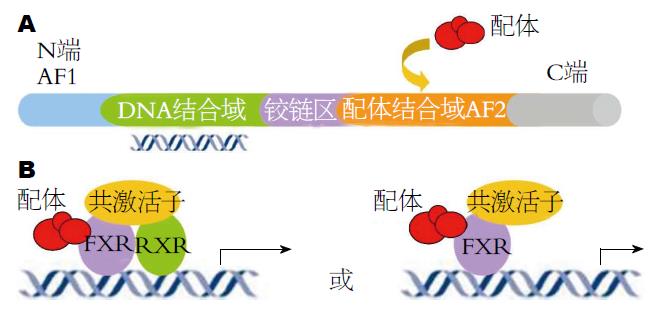
FXR的结构有如下特点: (1)具典型的核受体结构, 主要由氨基端(N端)的非配体依赖激活域(ligand-independent activation function 1 domain, AF1)、DNA结合域(DNA-binding domain, DBD)、铰链区(hinge region)及羧基端(C端)的配体结合域(ligand-binding domain, LBD)构成, 其中配体结合域LBD含有配体依赖激活域(ligand-dependent activation function 2 domain, AF2)[18](图1A); (2)配体与FXR-LBD结合后, 引起FXR空间构象的改变, 使得FXR-DBD与FXR下游靶基因的调控区域中的FXR反应元件(FXR response element, FXRE)结合, 从而调节靶基因的转录过程; (3)FXR反应元件FXRE为间隔一个或零个核苷酸的反向重复序列(inverted repeat elements separated by one or zero nucleotide, IR-1或IR-0), IR-1为主要的FXR结合序列[19-22]. 此外, FXR还可与正向重复序列(direct repeat, DR)和外翻重复序列(everted repeat, ER)结合[23,24]; (4)FXR以与视黄醇X受体(retinoicd X receptor, RXR)形成异源二聚体或单体形式, 与靶基因上的FXRE结合, 从而调控下游靶基因的转录过程[25-27]. 多数情况下, FXR以FXR-RXR异源二聚体形式与下游靶基因上的FXRE结合, 少数情况下以FXR单体与靶基因的反应元件结合, 进而调控靶基因的转录过程(图1B).
核受体FXR高表达于肝脏、肠道、肾脏及肾上腺, 而在心脏和脂肪组织表达很少. 目前, FXR基因已在人、大鼠和小鼠等多个物种成功克隆. 人FXR基因位于12号染色体(12q23.1), 有两种基因编码: FXRα(NR1H4)和FXRβ(NR1H5), 人FXRβ是假基因[28]. 人FXR基因通过选择性启动子和选择性剪接形成4种亚型: FXRα1、FXRα2、FXRβ1和FXRβ2.
1999年, 研究者发现生理水平的胆汁酸是FXR的内源性配体, 因此核受体FXR又称为胆汁酸受体, 在维持胆汁酸体内平衡中发挥重要作用. 鹅去氧胆酸(chenodeoxycholic acid, CDCA)是FXR最为有效的激动剂. 石胆酸(lithocholic acid, LCA)、去氧胆酸(desoxycholic acid, DCA)和胆酸(cholic acid, CA)都可以激活FXR, 但其激活效应弱于CDCA, 熊去氧胆酸(ursodesoxycholic acid, UDCA)不能激活FXR. 胆汁酸激活FXR的作用由强到弱顺序是: CDCA>DCA>LCA>CA[29]. 一些多不饱和脂肪酸如花生四烯酸和二十二碳六烯酸, 以及胆汁酸代谢产物包括26-,25-羟基胆汁酸也被认为是FXR的配体. 目前已发现的 FXR人工合成的激动剂包括GW4064、6-乙基-鹅脱氧胆酸(6-ECDCA)、fexaramine、MFA-1、AGN29和AGN31等, 拮抗剂有guggulsterone、lithocholate、AGN34等[30].
近年来, FXR在肝再生中的重要作用逐渐被阐明, 总结起来, 主要表现在3个方面: (1)FXR的激活可促进部分肝切除后肝细胞的增殖; (2)FXR在胆汁酸合成与转运过程中发挥重要的调节作用, 可减轻部分肝切除引起的肝组织损伤, 起到一定的肝保护作用; (3)FXR的代谢调节作用, 有益于肝再生进程.
肝脏在受到部分切除或损伤后, 正常的肝组织发生再生对于恢复肝脏的体积和功能非常重要. 研究表明, 正常的肝脏再生是依赖并由FXR调节的. 2006年, Huang等[31]研究者将FXR基因敲除小鼠(FXR-/-)与野生小鼠比较, 发现FXR-/-小鼠的肝再生率明显降低, 且5-溴脱氧尿嘧啶核苷(5-bromo-2-deoxyuridine, BrdU)标记阳性肝细胞数明显减少, 表明FXR-/-小鼠处于DNA合成期的肝细胞数减少, 肝细胞增殖减慢. 此外还发现, 野生小鼠在被喂食FXR的配体0.2%胆酸后, 其肝再生率明显增加, 调控细胞周期进程的转录因子Forkhead box M1b(FoxM1b)表达增多. FoxM1b是一种上调细胞增殖的转录因子, 高表达于细胞周期G1/S相, 通过抑制细胞周期蛋白依赖激酶抑制剂p21和p27的表达, 进而上调细胞周期蛋白Cyclin D1、Cyclin E和Cyclin B1的表达, 使肝再生加速[32-34]. 上述结果表明, FXR在小鼠肝再生过程中发挥重要作用, 且此作用与其诱导FoxM1b表达有关, 但FoxM1b是FXR的直接或间接作用靶点尚不清楚. 直至2010年, 核受体FXR的激活促进肝再生的机制终于被阐明. 肝部分切除后, FXR的激活可直接与FoxM1b基因转录调控区域中的FXRE, 即IR-0结合, 诱导转录因子FoxM1b的表达, 从而对肝再生起到促进作用[35,36].
肝脏被部分切除后, 胆汁酸压力相对于残余肝脏来说明显增加, 过多的胆汁酸可引起肝细胞的损伤. 研究表明, FXR是胆汁酸的最初的感受器. 部分肝切除后, 残余肝脏感受到比正常生理水平较多的胆汁酸刺激, 随后激活胆汁酸受体FXR, 激活的FXR可调节胆汁酸的合成、转运、代谢, 使肝细胞免受胆汁酸过多引发的肝损伤, 此肝保护功能将有助于肝再生的进行[37].
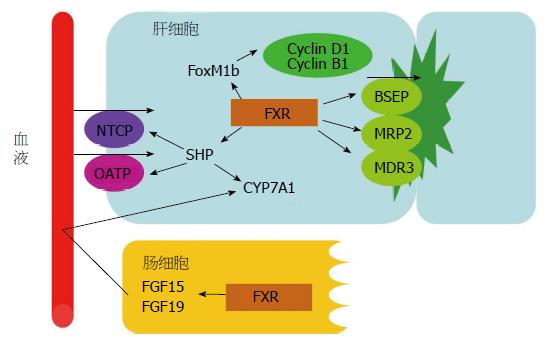
3.2.1 FXR的激活可抑制胆汁酸的合成: 胆汁酸是以胆固醇为原料在肝脏被合成的, 有两种合成途径: 经典途径和替代途径. 经典途径是胆汁酸合成的主要途径, 胆固醇7α羟化酶(cholesterol 7α-hydroxylase, CYP7A1)为此途径胆汁酸合成的限速酶, CYP8B1也参与了胆汁酸的合成. 核受体FXR的激活通过抑制CYP7A1和CYP8B1表达, 负反馈调节肝内胆汁酸的合成. 此作用机制主要表现在两方面: (1)肝脏FXR的激活, 可诱导小分子异源二聚体伴侣(short heterodimer partner, SHP)的表达, 随后SHP与肝脏受体同系物1(liver receptor homolog 1, LRH-1)结合并使之灭活, 进而LRH-1下游基因CYP7A1的表达受到抑制[38]. SHP还可与肝细胞核因子4α(hepatocyte nuclear factor 4α, HNF4α)作用, 下调CYP7A1和CYP8B1表达[39]. 有报道, 0.2%胆酸使野生小鼠肝脏Shp表达增加, Cyp7A1表达减少; 而给予小鼠胆汁酸结合树脂可降低Shp表达, 升高Cyp7A1表达. 此外, 野生小鼠部分肝切除后3 d内, Cyp7A1明显减少, 一直持续到肝切除后第7天; 而FXR-/-小鼠部分肝切除后的第3天Cyp7A1表达就出现了. 这些结果证实了核受体FXR的激活可间接地抑制Cyp7A1的表达, 减少肝内胆汁酸的合成[31]; (2)肠道FXR的激活, 可诱导人肠道成纤维细胞生长因子19(fibrolast growth factor 19, FGF19)的表达或在小鼠诱导FGF15的产生, 随后FGF19/15结合于成纤维细胞生长因子受体4(fibrolast growth factor receptor 4, FGFR4), 激活JNK依赖的信号通路, 抑制CYP7A1的表达. FXR的激活通过上述两方面抑制CYP7A1的表达, 从而减少肝细胞内胆汁酸的合成[40-42]. 此外, FXR通过诱导肝胰岛素诱导基因2(insulin-induced gene-2, insig-2), 抑制胆固醇合成限速酶HMG-CoA还原酶的表达, 从而抑制胆固醇的合成[43]. 可见, FXR的激活不仅能够直接抑制胆汁酸的合成, 还能抑制胆汁酸合成原料胆固醇的合成, 协同降低肝细胞内胆汁酸的合成.
3.2.2 FXR的激活可调节胆汁酸的转运: 胆汁酸在肝脏合成后被肝细胞胆管侧膜上的外排性转运体胆酸盐外排泵(bile salt export pump, BSEP)、多药耐药相关蛋白2(multidrug resistance-associated protein 2, MRP2)及多药耐药蛋白3(multidrug resistance protein 3, MDR3, 啮齿类动物Mdr2)泵入胆小管, 随胆汁进入小肠并被重新吸收入血, 随门脉血进入肝脏, 被肝细胞基底膜上的摄取性转运体钠离子依赖性牛磺胆酸共转运多肽(Na+-dependent taurocholate cotransporting polypeptide, NTCP)和有机阴离子转运多肽(organic anion transporting polypeptide, OATP)摄取进入肝细胞[44]. 核受体FXR的激活, 通过调节肝细胞外排性或摄取性转运体的表达, 进而影响肝细胞内胆汁酸水平和肝损伤情况. 研究发现, BSEP基因的启动子上有一个14 bp的反向重复序列IR-1: 5'-GGGACATTGATCCT-3', 核受体FXR激活后, 可与BSEP启动子上的FXR反应元件IR-1直接结合, 从而调控BSEP的基因转录[22]. Yu等[45]用人原代肝细胞考察了各种FXR配体对BSEP表达的影响, 发现CDCA和GW4064作用肝细胞3 h后, BSEP的基因表达明显升高, 且CDCA与BSEP基因表达呈时间及剂量依赖性. 另有报道, 部分肝切除后, 与野生小鼠相比, FXR-/-小鼠血中及肝中的胆汁酸含量明显增高, 肝损伤更为严重. 原因在于野生小鼠肝部分切除后, 残肝内胆汁酸压力明显增高, 激活胆汁酸受体FXR, 诱导胆汁酸外排转运体BSEP表达, 从而降低了肝细胞内胆汁酸水平, 减轻了肝损伤. 而FXR-/-小鼠肝切除后, BSEP表达并无明显变化, 因此肝内胆汁酸水平居高不下, 肝损伤更为严重[31]. 核受体FXR的激活还可上调MRP2, MDR3/Mdr2的表达, 使肝内胆汁酸外排增多, 从而降低肝细胞内胆汁酸水平, 起到很好的保肝作用[24,46]. 此外, Zollner等[47]证实, 核受体FXR激活通过诱导SHP的表达, 负反馈抑制NTCP的表达, 使进入肝细胞内的胆汁酸减少, 降低肝内胆汁酸水平. FXR还可抑制OATP的表达[48]. FXR对NTCP和OATP的下调可减少肝细胞对胆汁酸的再摄取, 是避免部分肝切除后残肝细胞内胆汁酸超负荷的一种重要机制(图2).
近年来, 许多研究者认为, 部分肝切除后残余肝脏增多的代谢需求是激活肝细胞增殖的重要信号. FXR作为代谢性核受体, 在胆汁酸、脂质、糖代谢过程中发挥着重要的调控作用, 此作用将有助于肝再生的进行[49]. 通过内源性或外源性物质对FXR的激活将有效地提高肝脏再生能力.
目前国内外研究者正在积极地对肝再生机制做更为深入的研究, 以期发现更加安全有效的促肝再生的药物. 已发现具有促进肝再生作用的药物有: 促肝细胞生长素、双环醇、西地那非、促红细胞生成素及地胆草提取物等, 这些药物促肝再生作用的靶点主要集中在3个方面: (1)细胞因子, 如白介素(interleukin, IL)、转化生长因子-β家族(transforming growth factor-β, TGF-β)、肝细胞生长因子(hepatocyte growth factor, HGF)及表皮生长因子(epidermal growth factor, EGF)等; (2)转录因子, 包括核受体PXR、CAR等; (3)信号通路: HGF/c-met信号通路等. 药物通过影响这些因子的功能而对肝再生过程发挥调节作用, 然而这些药物促肝再生的疗效一般, 或有较严重的不良反应.
核受体FXR可被内源性和外源性配体激活, 因此成为理想的药物作用靶点[50-52]. 实际上, 美国FDA批准上市的药物中有13%作用靶点在核受体, 被广泛用于治疗代谢综合征、炎症和癌症[53-55]. 近年来, 针对FXR作用靶点的药物研究日趋受到国内外研究者的关注[56,57]. 目前, FXR激动剂6ECDCA(INT-747)已进行Ⅱ期临床试验, 用于治疗原发性胆汁性肝硬化、非酒精性脂肪肝和2型糖尿病[58-60]. WAY362450(FXR 450)用于降血脂的治疗[60]. 为了研发安全有效的促肝再生药物, 为了有的放矢地从理论上、实践上阐明药物的作用机制, 同时为了提高新药开发的成功率, 越来越多的药物研究者跻身于药物促肝再生作用与核受体FXR相关性的研究中. 相信不久的将来, FXR激动剂很可能用于活体肝脏移植或肝癌切除术后肝脏再生的治疗中. 应用FXR激动剂促进肝脏再生有以下诸多优点: (1)FXR的激活可直接促进肝脏再生; (2)可降低胆汁酸的肝细胞毒性, 预防细胞凋亡; (3)FXR的激活将改善肝脏代谢功能. 因此在不远的将来, 开发有效的、安全的FXR配体进入临床试验, 将加快肝脏部分切除术后患者肝脏再生的速度.
核受体FXR的功能已从最初的调控多种物质的代谢途径扩展到调节肝细胞增殖过程. FXR的促进肝脏再生的新作用, 主要表现在: (1)部分肝切除后, 肝脏FXR被比生理水平高的胆汁酸所激活, 通过诱导FoxM1b的表达, 调控细胞周期进程, 进而促进肝细胞增殖; (2)肝脏和肠道FXR的激活, 通过下调胆汁酸合成限速酶CYP7A1表达, 使胆汁酸合成减少; 通过上调胆汁酸外排转运体BSEP、MRP2和MDR3/Mdr2的表达, 增加胆汁酸的外排, 并且下调肝细胞摄取性转运体NTCP和OATP的表达, 使进入肝细胞的胆汁酸减少, 从而降低了部分肝切除后增多的胆汁酸对肝细胞的损伤, 此作用将有助于肝脏再生过程. 核受体FXR激活所表现出的多方面调节胆汁酸的合成、转运与代谢作用, 与以往报道的FXR调节胆汁酸代谢和防止胆汁酸毒性的功能相一致; (3)FXR的代谢调节作用, 将满足部分肝切除后残余肝脏增多的代谢需求, 有益于肝再生的进行.
总之, 核受体FXR在肝脏再生过程中发挥着必不可少的调控作用, 同时也是重要的细胞保护者. 不久的将来, FXR激动剂很可能用于肝脏部分移植或肝癌切除术后肝脏再生的治疗中. 我们期待研究者们继续致力于FXR多方面功能的深入研究, 这将有助于我们更好地理解肝脏再生的复杂机制及开发更加安全有效的促肝再生靶向药物.
肝切除已成为目前治疗肝癌或肝硬化等终末期肝病最常用的方法. 然而研究发现, 大部分行肝切除术的终末期肝病患者, 由于残余肝脏的再生能力低下或迟缓, 部分肝切除术的治疗效果不理想. 法尼醇X受体(farnesoid X receptor, FXR)是需配体激活的具有转录因子功能的核受体超家族成员之一, 属于代谢性核受体, 调节着不同代谢途径中相关基因的表达, 现已成为胆汁淤积、糖尿病、动脉硬化及胆固醇结石等代谢性疾病治疗中的研究热点之一. 近来研究发现, 核受体FXR还可通过调节肝再生过程中重要基因的表达, 成为肝再生必不可少的调节因子.
石毓君, 副研究员, 四川大学华西医院移植工程与移植免疫实验室
进一步深入研究核受体FXR调节肝再生的机制及相关信号通路, 为研发安全有效的促肝再生靶向药物, 提高肝脏部分移植或肝癌切除术后肝脏再生能力提供重要指导. 而且为了有的放矢地从理论上、实践上阐明药物的作用机制, 同时为了提高新药开发的成功率, 越来越多的药物研究者将跻身于药物促肝再生作用与核受体FXR相关性的研究中.
Huang等研究发现, 肝切除后超生理水平的胆汁酸可激活核受体FXR, FXR被激活后, 可负反馈抑制胆汁酸合成限速酶CYP7A1的表达, 进而减少肝内胆汁酸合成; 上调胆汁酸外排转运体BSEP表达, 增加胆汁酸的排泄, 从而降低部分切除后肝内胆汁酸负荷.
本文简要概述了肝再生过程、FXR的基本性质包括其结构、分布、分型及配体, 着重阐述了核受体FXR与肝再生的关系, 并在此基础上进一步阐述了FXR激活促进肝脏再生的机制, 对研发肝再生治疗的靶向药物有重要的指导意义.
FXR可能作为促肝再生药物的治疗靶点, FXR激动剂配体的应用很可能成为肝脏部分移植或肝癌切除术后肝脏再生的潜在方法, 有望加快肝部分切除患者的肝脏再生速度.
本文为肝癌切除或肝移植术后的肝再生治疗提供了新的思路, 具有较好的创新性和应用价值.
编辑: 田滢 电编:闫晋利
| 1. | Brouquet A, Andreou A, Shindoh J, Vauthey JN. Methods to improve resectability of hepatocellular carcinoma. Recent Results Cancer Res. 2013;190:57-67. [PubMed] [DOI] |
| 2. | Mavros MN, Mayo SC, Hyder O, Pawlik TM. A systematic review: treatment and prognosis of patients with fibrolamellar hepatocellular carcinoma. J Am Coll Surg. 2012;215:820-830. [PubMed] [DOI] |
| 3. | Helling TS. Liver failure following partial hepatectomy. HPB (Oxford). 2006;8:165-174. [PubMed] [DOI] |
| 4. | Jonker JW, Liddle C, Downes M. FXR and PXR: potential therapeutic targets in cholestasis. J Steroid Biochem Mol Biol. 2012;130:147-158. [PubMed] [DOI] |
| 5. | Cipriani S, Mencarelli A, Palladino G, Fiorucci S. FXR activation reverses insulin resistance and lipid abnormalities and protects against liver steatosis in Zucker (fa/fa) obese rats. J Lipid Res. 2010;51:771-784. [PubMed] [DOI] |
| 6. | Bays HE, Goldberg RB, Truitt KE, Jones MR. Colesevelam hydrochloride therapy in patients with type 2 diabetes mellitus treated with metformin: glucose and lipid effects. Arch Intern Med. 2008;168:1975-1983. [PubMed] [DOI] |
| 7. | Vignozzi L, Morelli A, Filippi S, Comeglio P, Chavalmane AK, Marchetta M, Toce M, Yehiely-Cohen R, Vannelli GB, Adorini L. Farnesoid X receptor activation improves erectile function in animal models of metabolic syndrome and diabetes. J Sex Med. 2011;8:57-77. [PubMed] [DOI] |
| 8. | Morelli A, Vignozzi L, Maggi M, Adorini L. Farnesoid X receptor activation improves erectile dysfunction in models of metabolic syndrome and diabetes. Biochim Biophys Acta. 2011;1812:859-866. [PubMed] [DOI] |
| 9. | Zhang L, Wang YD, Chen WD, Wang X, Lou G, Liu N, Lin M, Forman BM, Huang W. Promotion of liver regeneration/repair by farnesoid X receptor in both liver and intestine in mice. Hepatology. 2012;56:2336-2343. [PubMed] [DOI] |
| 10. | Borude P, Edwards G, Walesky C, Li F, Ma X, Kong B, Guo GL, Apte U. Hepatocyte-specific deletion of farnesoid X receptor delays but does not inhibit liver regeneration after partial hepatectomy in mice. Hepatology. 2012;56:2344-2352. [PubMed] [DOI] |
| 11. | Chen WD, Wang YD, Meng Z, Zhang L, Huang W. Nuclear bile acid receptor FXR in the hepatic regeneration. Biochim Biophys Acta. 2011;1812:888-892. [PubMed] [DOI] |
| 12. | Takami T, Terai S, Sakaida I. Stem cell therapy in chronic liver disease. Curr Opin Gastroenterol. 2012;28:203-208. [PubMed] [DOI] |
| 13. | Gehrau RC, Mas VR, Maluf DG. Hepatic disease biomarkers and liver transplantation: what is the potential utility of microRNAs? Expert Rev Gastroenterol Hepatol. 2013;7:157-170. [PubMed] [DOI] |
| 14. | de la Fuente SG, Bennett KM, Scarborough JE. Functional status determines postoperative outcomes in elderly patients undergoing hepatic resections. J Surg Oncol. 2013;107:865-870. [PubMed] [DOI] |
| 15. | Fausto N, Campbell JS, Riehle KJ. Liver regeneration. Hepatology. 2006;43:S45-S53. [PubMed] [DOI] |
| 16. | Forman BM, Goode E, Chen J, Oro AE, Bradley DJ, Perlmann T, Noonan DJ, Burka LT, McMorris T, Lamph WW. Identification of a nuclear receptor that is activated by farnesol metabolites. Cell. 1995;81:687-693. [PubMed] [DOI] |
| 17. | Pawlak M, Lefebvre P, Staels B. General molecular biology and architecture of nuclear receptors. Curr Top Med Chem. 2012;12:486-504. [PubMed] [DOI] |
| 18. | Chawla A, Repa JJ, Evans RM, Mangelsdorf DJ. Nuclear receptors and lipid physiology: opening the X-files. Science. 2001;294:1866-1870. [PubMed] [DOI] |
| 19. | Chong HK, Infante AM, Seo YK, Jeon TI, Zhang Y, Edwards PA, Xie X, Osborne TF. Genome-wide interrogation of hepatic FXR reveals an asymmetric IR-1 motif and synergy with LRH-1. Nucleic Acids Res. 2010;38:6007-6017. [PubMed] [DOI] |
| 20. | Song CS, Echchgadda I, Baek BS, Ahn SC, Oh T, Roy AK, Chatterjee B. Dehydroepiandrosterone sulfotransferase gene induction by bile acid activated farnesoid X receptor. J Biol Chem. 2001;276:42549-42556. [PubMed] [DOI] |
| 21. | Li J, Pircher PC, Schulman IG, Westin SK. Regulation of complement C3 expression by the bile acid receptor FXR. J Biol Chem. 2005;280:7427-7434. [PubMed] [DOI] |
| 22. | Ananthanarayanan M, Balasubramanian N, Makishima M, Mangelsdorf DJ, Suchy FJ. Human bile salt export pump promoter is transactivated by the farnesoid X receptor/bile acid receptor. J Biol Chem. 2001;276:28857-28865. [PubMed] [DOI] |
| 23. | Mak PA, Kast-Woelbern HR, Anisfeld AM, Edwards PA. Identification of PLTP as an LXR target gene and apoE as an FXR target gene reveals overlapping targets for the two nuclear receptors. J Lipid Res. 2002;43:2037-2041. [PubMed] [DOI] |
| 24. | Kast HR, Goodwin B, Tarr PT, Jones SA, Anisfeld AM, Stoltz CM, Tontonoz P, Kliewer S, Willson TM, Edwards PA. Regulation of multidrug resistance-associated protein 2 (ABCC2) by the nuclear receptors pregnane X receptor, farnesoid X-activated receptor, and constitutive androstane receptor. J Biol Chem. 2002;277:2908-2915. [PubMed] [DOI] |
| 25. | Vaquero J, Briz O, Herraez E, Muntané J, Marin JJ. Activation of the nuclear receptor FXR enhances hepatocyte chemoprotection and liver tumor chemoresistance against genotoxic compounds. Biochim Biophys Acta. 2013;1833:2212-2219. [PubMed] [DOI] |
| 26. | Ohno T, Shirakami Y, Shimizu M, Kubota M, Sakai H, Yasuda Y, Kochi T, Tsurumi H, Moriwaki H. Synergistic growth inhibition of human hepatocellular carcinoma cells by acyclic retinoid and GW4064, a farnesoid X receptor ligand. Cancer Lett. 2012;323:215-222. [PubMed] [DOI] |
| 27. | de Lera AR, Bourguet W, Altucci L, Gronemeyer H. Design of selective nuclear receptor modulators: RAR and RXR as a case study. Nat Rev Drug Discov. 2007;6:811-820. [PubMed] [DOI] |
| 28. | Cai SY, Xiong L, Wray CG, Ballatori N, Boyer JL. The farnesoid X receptor FXRalpha/NR1H4 acquired ligand specificity for bile salts late in vertebrate evolution. Am J Physiol Regul Integr Comp Physiol. 2007;293:R1400-R1409. [PubMed] [DOI] |
| 29. | Parks DJ, Blanchard SG, Bledsoe RK, Chandra G, Consler TG, Kliewer SA, Stimmel JB, Willson TM, Zavacki AM, Moore DD. Bile acids: natural ligands for an orphan nuclear receptor. Science. 1999;284:1365-1368. [PubMed] [DOI] |
| 30. | Wang YD, Chen WD, Moore DD, Huang W. FXR: a metabolic regulator and cell protector. Cell Res. 2008;18:1087-1095. [PubMed] [DOI] |
| 31. | Huang W, Ma K, Zhang J, Qatanani M, Cuvillier J, Liu J, Dong B, Huang X, Moore DD. Nuclear receptor-dependent bile acid signaling is required for normal liver regeneration. Science. 2006;312:233-236. [PubMed] [DOI] |
| 32. | Wang X, Kiyokawa H, Dennewitz MB, Costa RH. The Forkhead Box m1b transcription factor is essential for hepatocyte DNA replication and mitosis during mouse liver regeneration. Proc Natl Acad Sci U S A. 2002;99:16881-16886. [PubMed] [DOI] |
| 33. | Wang X, Krupczak-Hollis K, Tan Y, Dennewitz MB, Adami GR, Costa RH. Increased hepatic Forkhead Box M1B (FoxM1B) levels in old-aged mice stimulated liver regeneration through diminished p27Kip1 protein levels and increased Cdc25B expression. J Biol Chem. 2002;277:44310-44316. [PubMed] [DOI] |
| 34. | Wang X, Quail E, Hung NJ, Tan Y, Ye H, Costa RH. Increased levels of forkhead box M1B transcription factor in transgenic mouse hepatocytes prevent age-related proliferation defects in regenerating liver. Proc Natl Acad Sci U S A. 2001;98:11468-11473. [PubMed] [DOI] |
| 35. | Chen WD, Wang YD, Zhang L, Shiah S, Wang M, Yang F, Yu D, Forman BM, Huang W. Farnesoid X receptor alleviates age-related proliferation defects in regenerating mouse livers by activating forkhead box m1b transcription. Hepatology. 2010;51:953-962. [PubMed] [DOI] |
| 38. | Goodwin B, Jones SA, Price RR, Watson MA, McKee DD, Moore LB, Galardi C, Wilson JG, Lewis MC, Roth ME. A regulatory cascade of the nuclear receptors FXR, SHP-1, and LRH-1 represses bile acid biosynthesis. Mol Cell. 2000;6:517-526. [PubMed] [DOI] |
| 39. | Fiorucci S, Mencarelli A, Distrutti E, Palladino G, Cipriani S. Targetting farnesoid-X-receptor: from medicinal chemistry to disease treatment. Curr Med Chem. 2010;17:139-159. [PubMed] [DOI] |
| 40. | Inagaki T, Choi M, Moschetta A, Peng L, Cummins CL, McDonald JG, Luo G, Jones SA, Goodwin B, Richardson JA. Fibroblast growth factor 15 functions as an enterohepatic signal to regulate bile acid homeostasis. Cell Metab. 2005;2:217-225. [PubMed] [DOI] |
| 41. | Holt JA, Luo G, Billin AN, Bisi J, McNeill YY, Kozarsky KF, Donahee M, Wang DY, Mansfield TA, Kliewer SA. Definition of a novel growth factor-dependent signal cascade for the suppression of bile acid biosynthesis. Genes Dev. 2003;17:1581-1591. [PubMed] [DOI] |
| 42. | Li T, Matozel M, Boehme S, Kong B, Nilsson LM, Guo G, Ellis E, Chiang JY. Overexpression of cholesterol 7α-hydroxylase promotes hepatic bile acid synthesis and secretion and maintains cholesterol homeostasis. Hepatology. 2011;53:996-1006. [PubMed] [DOI] |
| 43. | Hubbert ML, Zhang Y, Lee FY, Edwards PA. Regulation of hepatic Insig-2 by the farnesoid X receptor. Mol Endocrinol. 2007;21:1359-1369. [PubMed] [DOI] |
| 45. | Yu J, Lo JL, Huang L, Zhao A, Metzger E, Adams A, Meinke PT, Wright SD, Cui J. Lithocholic acid decreases expression of bile salt export pump through farnesoid X receptor antagonist activity. J Biol Chem. 2002;277:31441-31447. [PubMed] [DOI] |
| 46. | Huang L, Zhao A, Lew JL, Zhang T, Hrywna Y, Thompson JR, de Pedro N, Royo I, Blevins RA, Peláez F. Farnesoid X receptor activates transcription of the phospholipid pump MDR3. J Biol Chem. 2003;278:51085-51090. [PubMed] |
| 47. | Zollner G, Wagner M, Fickert P, Geier A, Fuchsbichler A, Silbert D, Gumhold J, Zatloukal K, Kaser A, Tilg H. Role of nuclear receptors and hepatocyte-enriched transcription factors for Ntcp repression in biliary obstruction in mouse liver. Am J Physiol Gastrointest Liver Physiol. 2005;289:G798-G805. [PubMed] [DOI] |
| 48. | Cui YJ, Aleksunes LM, Tanaka Y, Goedken MJ, Klaassen CD. Compensatory induction of liver efflux transporters in response to ANIT-induced liver injury is impaired in FXR-null mice. Toxicol Sci. 2009;110:47-60. [PubMed] [DOI] |
| 49. | Liu Y, Binz J, Numerick MJ, Dennis S, Luo G, Desai B, MacKenzie KI, Mansfield TA, Kliewer SA, Goodwin B. Hepatoprotection by the farnesoid X receptor agonist GW4064 in rat models of intra- and extrahepatic cholestasis. J Clin Invest. 2003;112:1678-1687. [PubMed] |
| 50. | Lonard DM, O'malley BW. Nuclear receptor coregulators: judges, juries, and executioners of cellular regulation. Mol Cell. 2007;27:691-700. [PubMed] [DOI] |
| 51. | Mangelsdorf DJ, Thummel C, Beato M, Herrlich P, Schütz G, Umesono K, Blumberg B, Kastner P, Mark M, Chambon P. The nuclear receptor superfamily: the second decade. Cell. 1995;83:835-839. [PubMed] [DOI] |
| 52. | Nagy L, Schwabe JW. Mechanism of the nuclear receptor molecular switch. Trends Biochem Sci. 2004;29:317-324. [PubMed] [DOI] |
| 53. | Overington JP, Al-Lazikani B, Hopkins AL. How many drug targets are there? Nat Rev Drug Discov. 2006;5:993-996. [PubMed] [DOI] |
| 54. | Altucci L, Leibowitz MD, Ogilvie KM, de Lera AR, Gronemeyer H. RAR and RXR modulation in cancer and metabolic disease. Nat Rev Drug Discov. 2007;6:793-810. [PubMed] [DOI] |
| 55. | Jordan VC, Brodie AM. Development and evolution of therapies targeted to the estrogen receptor for the treatment and prevention of breast cancer. Steroids. 2007;72:7-25. [PubMed] [DOI] |
| 56. | Zimber A, Gespach C. Bile acids and derivatives, their nuclear receptors FXR, PXR and ligands: role in health and disease and their therapeutic potential. Anticancer Agents Med Chem. 2008;8:540-563. [PubMed] [DOI] |
| 57. | Fiorucci S, Baldelli F. Farnesoid X receptor agonists in biliary tract disease. Curr Opin Gastroenterol. 2009;25:252-259. [PubMed] [DOI] |
| 58. | Fiorucci S, Mencarelli A, Distrutti E, Zampella A. Farnesoid X receptor: from medicinal chemistry to clinical applications. Future Med Chem. 2012;4:877-891. [PubMed] [DOI] |
| 59. | Lindor KD. Farnesoid X receptor agonists for primary biliary cirrhosis. Curr Opin Gastroenterol. 2011;27:285-288. [PubMed] [DOI] |
| 60. | Evans MJ, Mahaney PE, Borges-Marcucci L, Lai K, Wang S, Krueger JA, Gardell SJ, Huard C, Martinez R, Vlasuk GP. A synthetic farnesoid X receptor (FXR) agonist promotes cholesterol lowering in models of dyslipidemia. Am J Physiol Gastrointest Liver Physiol. 2009;296:G543-G552. [PubMed] [DOI] |