修回日期: 2013-09-10
接受日期: 2013-09-30
在线出版日期: 2013-11-28
目的: 研究血清组织蛋白酶S(Cathepsin S, Cat S)在肝癌中的临床意义.
方法: 应用逆转录聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)和蛋白印迹法(Western blot)观察肝癌患者癌组织和癌旁组织中Cat S的表达情况, 同时应用酶联免疫吸附技术(enzyme linked immunosorbent assay, ELISA)检测62例肝癌、40例肝硬化和30例健康对照组中血清Cat S含量, 分析血清Cat S的表达水平与肝癌患者临床病理参数之间的关系.
结果: 肝癌患者癌组织中Cat S mRNA及蛋白表达水平均显著高于癌旁组织(mRNA: 0.67±0.15 vs 0.28±0.12, P<0.05; 蛋白: 0.81±0.16 vs 0.35±0.13, P<0.05); 肝癌组血清Cat S蛋白水平明显高于肝硬化组和正常对照组(131.46 µg/L±42.16 µg/L vs 64.28 µg/L±12.71 µg/L、50.2 µg/L±17.41 µg/L, 均P<0.05); 肝癌患者血清Cat S含量与肝细胞癌(hepatocellular carcinoma, HCC)门静脉癌栓的形成、肿瘤大小、肝外转移、TNM分期均显著相关(P<0.05).
结论: 血清Cat S有可能成为一种新的具有临床应用价值的肿瘤标志物, 有助于肝癌的诊断、预后预测及术后复发的监测.
核心提示: 我们的研究发现组织蛋白酶S(Cathepsin S, Cat S)mRNA及蛋白在肝癌组织中表达显著高于癌旁组织, 肝癌组患者血清Cat S含量明显高于肝硬化组和正常对照组, 肿瘤复发组血清Cat S含量明显高于术后1 mo组、术后6 mo组, 肝癌患者血清Cat S含量与肝细胞癌(hepatocellular carcinoma, HCC)门静脉癌栓的形成、肿瘤大小、肝外转移、TNM分期均显著相关. 提示检测血清Cat S含量有助于了解HCC的发生发展、判断HCC患者的病情及预后, 血清Cat S含量可作为HCC的疗效评价和动态随访指标.
引文著录: 杨雅阁, 张炳勇, 刘龙, 白阳秋, 曹名波. 肝癌患者血清Cathepsin S含量检测的临床意义. 世界华人消化杂志 2013; 21(33): 3742-3746
Revised: September 10, 2013
Accepted: September 30, 2013
Published online: November 28, 2013
AIM: To assess the clinical significance of serum Cathepsin S (Cat S) in patients with hepatocellular carcinoma (HCC).
METHODS: Reverse transcription-polymerase chain reaction (RT-PCR) and Western blot were used to detect the expression of Cat S mRNA and protein in 62 HCC surgical specimens and matched tumor-adjacent non-cancerous specimens. Enzyme linked immunosorbent assay (ELISA) was used to determine serum levels of Cat S in 62 patients with HCC, 40 patients with cirrhosis and 30 healthy controls. The relationship between serum levels of Cat S and clinical and pathological parameters of hepatocellular carcinoma was analyzed.
RESULTS: The relative expression level of Cat S mRNA was significantly higher in HCC than in tumor-adjacent non-cancerous tissue (0.67 ± 0.15 vs 0.28 ± 0.12, P < 0.05). The protein expression of Cat S in HCC was also significantly higher than that in tumor-adjacent non-cancerous tissues (0.81 ± 0.16 vs 0.35 ± 0.13, P < 0.05). Serum Cat S levels in HCC patients were significantly higher than those in cirrhotic patients and healthy controls (131.46 ± 42.16 µg/L vs 64.28 ± 12.71 µg/L, 50.2 ± 17.41 µg/L, both P < 0.05). Serum levels of Cat S in HCC were correlated with the formation of portal vein tumor thrombus, tumor size, extrahepatic metastasis and TNM stage (all P < 0.05).
CONCLUSION: Serum Cat S might serve as a novel tumor marker for hepatocellular carcinoma, and it may be helpful in diagnosing, evaluating prognosis and monitoring postoperative recurrence of HCC.
- Citation: Yang YG, Zhang BY, Liu L, Bai YQ, Cao MB. Clinical significance of serum Cathepsin S in patients with hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2013; 21(33): 3742-3746
- URL: https://www.wjgnet.com/1009-3079/full/v21/i33/3742.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i33.3742
肝细胞癌(hepatocellular carcinoma, HCC)是全世界肿瘤疾病死亡中第3大最常见原因, 发病率和死亡率仍在逐年攀升[1], 其5年生存率低下[2]. HCC是一种血供丰富的恶性肿瘤, 血管再生与肿瘤细胞的浸润、复发、转移密切相关. 如何尽早判断肝癌的病情并预测其转移和复发是肝癌防治研究工作的重点. 组织蛋白酶S(Cathepsin S, Cat S)是一种半胱氨酸蛋白水解酶, 能介导细胞外基质(extracellular matrix, ECM)的降解, 近年来研究发现Cat S参与肿瘤血管的生成和血管内外肿瘤细胞的转移[3-5]. 近期一些研究发现在前列腺癌、星型细胞瘤、肺癌、肝癌[6-9]等组织中Cat S的表达上调, 且其高表达与预后不良及复发相关. Jobs等[10]研究发现血清Cat S含量与心血管疾病的死亡率和癌症死亡率呈显著正相关. 然而, 有关血清Cat S含量在肝癌的研究尚未见报道. 我们通过对Cat S在肝癌患者癌组织和癌旁组织中mRNA及蛋白表达情况进行研究,同时对肝癌患者血清Cat S表达水平进行检测和分析, 探讨其在HCC发生发展中的临床意义.
选择2012-03/2013-03河南省人民医院肝胆外科住院的肝癌患者62例, 其中男41例, 女21例, 年龄32-75岁, 平均年龄50.2岁±10.5岁. 收集患者肿瘤切除后新鲜肝脏标本, 按照自身配对法留取患者的癌组织和癌旁组织(距癌灶边缘5.0 cm)各62例, 置于-80 ℃冰箱保存. 所有肝癌患者诊断均经过病理证实, 术前均未进行放疗及化疗. 其中HBsAg阳性者47例, HBsAg阴性者15例; 有门静脉癌栓者27例, 无门静脉癌栓者35例; 肿瘤直径(多发病灶时取直径总和均值)≥5.0 cm 38例, 直径<5.0 cm 24例; 有肝外转移11例, 无肝外转移51例; 临床分期根据国际抗癌联盟的TNM系统分期法划分, Ⅰ期5例、Ⅱ期22例、Ⅲ期24例、Ⅳ期11例; 按HCC的Edmondson病理分级, 高分化21例、中分化31例、低分化10例. 根据术后随访时间分为术后1 mo组57例, 术后6 mo组41例. 术后1年内随访中经病理证实肿瘤复发者, 设为肿瘤复发组13例. 选择本院消化内科肝硬化患者40例, 男25例, 女15例, 年龄35-70岁, 平均年龄45岁; 正常对照组30例为本院同期同年龄段健康体检者, 其中男性25例, 女性10例, 平均年龄42岁.
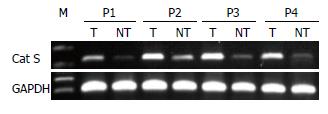
1.2.1 逆转录聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR)检测Cathepsin S mRNA表达: TRIzol试剂分别提取肝癌患者癌组织和癌旁组织总RNA后, 取5 μg总RNA合成第一链cDNA, 设计Cat S引物: 上游5'-TCTGTTGGTGTAGATGCG-3', 下游5'-AGATAAGGGTCTCGCGAT-3', 产物216 bp. 取1 μL cDNA按PCR试剂盒说明书进行扩增, 同时以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)为内参基因, 水为阴性对照, 行PCR扩增: 95 ℃ 5 min, 95 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 40 s, 30个循环, 终末延伸72 ℃ 5 min. 取5 μL的PCR扩增产物行1.5%琼脂糖凝胶电泳. 用凝胶成像分析系统进行电泳条带分析, 用目的条带灰度值与GAPDH条带灰度值的比值表示每个标本的相对mRNA水平.
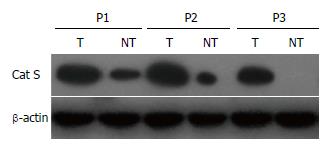
1.2.2 Western blot检测Cat S蛋白表达: 采用RIPA(radio-immunoprecipitation assay)裂解液(碧云天, 中国)分别提取肝癌患者癌组织和癌旁组织总蛋白, 并采用BCA检测试剂盒(普利莱基因技术有限公司, 中国)测定蛋白浓度水平. 每个样本取30 μg蛋白经10%SDS-PAGE电泳, 转膜, 进行Cat S一抗(BioVision生物有限公司)、辣根过氧化酶标记的二抗孵育和显色, 并照相. 以目的蛋白与β-肌动蛋白(β-actin)的灰度比进行半定量分析.
1.2.3 ELISA检测血清Cat S蛋白表达: 抽取清晨空腹静脉血3 mL, 置于EDTA抗凝的无菌试管中, 室温3500 r/min离心15 min, 收集上层血清, 置于-80 ℃低温冰箱中保存待测定. Cat S ELISA试剂盒购自美国R&D公司, 严格按照试剂盒说明书进行操作. 主要检测仪器为BIO-RAD680型酶联免疫检测仪, 于450 nm处测吸光度(A)值, 读取A值, 然后根据标准品应用Excel2007(微软公司)软件绘制标准曲线, 通过已知标准品浓度值计算样品浓度值. 每一血浆样品测两次求平均值.
统计学处理 实验数据采用SPSS17.0统计软件进行统计分析, 计量资料采用mean±SD表示, 组间定量资料比较采用t检验和方差分析, P<0.05为差异有统计学意义.
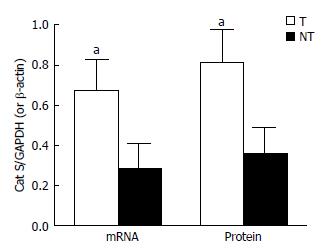
Cat S mRNA及蛋白在肝癌组织中均呈高表达, 而在对应的癌旁组织中低表达, 其表达量的相对值分别为0.28±0.12、0.35±0.13, 显著低于肝癌组织中0.67±0.15、0.81±0.16, 差异均具有统计学意义(P<0.05)(表1, 图1-3).
肝癌组患者血清Cat S含量明显高于肝硬化组和正常对照组(131.46 µg/L±42.16 µg/L vs 64.28 µg/L±12.71 µg/L、50.2 µg/L±17.41 µg/L, P<0.05); 术后1 mo组, 术后6 mo组血清Cat S含量均明显低于术前(肝癌组)(P<0.05); 肿瘤复发组血清Cat S含量明显高于术后1 mo组、术后6 mo组、肝硬化组和健康对照组(P<0.05)(表2).
HCC患者血清Cat S含量与HCC门静脉癌栓的形成、肿瘤大小、肝外转移、TNM分期均显著相关(P<0.05), 与HBsAg和肿瘤分化程度无关(P>0.05)(表3).
| 分类 | n | Cat S | P值 |
| HBsAg | 0.676 | ||
| 阴性 | 15 | 136.43±32.24 | |
| 阳性 | 47 | 130.73±49.15 | |
| 门静脉癌栓 | 0.018 | ||
| 无 | 35 | 120.23±45.58 | |
| 有 | 27 | 147.50±41.16 | |
| 肝外转移 | 0.035 | ||
| 无 | 51 | 126.49±46.37 | |
| 有 | 11 | 158.15±30.74 | |
| TNM分期 | 0.001 | ||
| I-II | 27 | 106.59±33.21 | |
| III-IV | 35 | 150.65±38.42 | |
| 分化程度 | 0.987 | ||
| 高分化 | 21 | 130.25±49.36 | |
| 中分化 | 31 | 132.03±33.05 | |
| 低分化 | 10 | 130.35±51.66 | |
| 肿瘤直径(cm) | 0.004 | ||
| <5 | 24 | 111.77±39.04 | |
| ≥5 | 38 | 144.95±44.96 |
HCC以其高发病率, 高复发率及高死亡率, "三高"著称, 其5年生存率低下[2]. 目前对于HCC的治疗, 肝移植及手术切除是有效的治疗方法[11]. 经皮微波或射频等消融治疗及经导管肝动脉化疗栓塞治疗为失去手术机会的患者提供有效的治疗方法, 在一定程度上达到了与外科手术切除相媲美的治疗效果[12,13]. 但大部分HCC患者在明确诊断时已经是中晚期肝癌, 失去了手术切除及其他根治性手术的机会; 如何尽早判断肝癌的病情并预测其转移和复发是肝癌防治研究工作的重点. 肿瘤的发生、发展、侵袭、转移都离不开新生血管的生成, 新近发现的Cat S在肿瘤血管的生成和血管内外肿瘤细胞的转移过程中发挥着重要作用.
Cat S属半胱氨酸蛋白水解酶, 主要分布在脾脏、淋巴结、心脏、抗原递呈细胞. Cat S在免疫应答中可能扮演重要角色, 还能够参与血管基质重塑和动脉粥样硬化内膜的形成[14]. Cat S能够降解细胞外基质分子, 参与肿瘤血管生成和血管内外肿瘤细胞的转移. 近年来发现, 多种肿瘤如前列腺癌、星形细胞瘤、胰腺癌、肺癌[15]、胃癌[16]、尤其是肝癌组织中均有Cat S的高表达, 且其高表达促进肿瘤细胞的侵袭、转移. Wang等[17]对鼠胰岛细胞瘤模型的研究中发现人为敲除Cat S将减少血管生成和肿瘤细胞增殖, 从而抑制实体瘤的进展. Ryschich等[3]发现Cat S可能参与肝细胞癌新生血管的形成. Fan等[9]研究发现Cat S在MHCC97-H肝癌细胞系呈高表达, 利用RNA干扰技术敲除Cat S, 可显著抑制MHCC97-H细胞的增殖, 侵袭和血管生成. Cat S的过度表达一方面通过增加ECM内的生长因子的生物利用度促进肿瘤增长, 另一方面直接提高ECM组分的降解, 结果促进肿瘤细胞侵袭、转移形成继发性肿瘤[18].
我们采用RT-PCR及Western blot法检测了62例HCC及其对应的癌旁非癌组织中Cat S基因的表达, 发现在HCC组织中Cat S基因的表达明显高于对应的癌旁非癌组织(P<0.05). 本研究结果还发现肝癌组患者血清Cat S含量明显高于肝硬化组和正常对照组(P<0.05), 肿瘤复发组血清Cat S含量明显高于术后1 mo组、术后6 mo组(P<0.05), 提示检测血清Cat S含量有助于HCC的早期筛选及复查. HCC患者血清Cat S含量与HCC门静脉癌栓的形成、肿瘤大小、肝外转移、TNM分期均呈显著相关(P<0.05), 提示检测血清Cat S含量的高低有助于了解HCC的发生发展、判断HCC患者的病情及预后. 血清Cat S含量越高说明病情越重, 其预后不良. 因此推测肝癌的发生发展与血清Cat S水平有关, Cat S可能参与肝癌的发病过程, 并可能通过降解细胞外基质作用, 促进肝细胞癌血管生成和血管内外癌细胞的转移.
本研究结果显示血清Cat S有可能成为一种新的具有临床应用价值的肿瘤标志物, 有助于肝癌的诊断、预后预测及术后复发的监测. 血清Cat S含量检测方法简单, 易于推广普及. 本研究尚需进一步扩大研究病例数, 延长术后随访时间, 以探讨其临床诊断与评价的科学量化范围. 随着对Cathepsin S研究的深入, 将会对其在肿瘤发生发展过程中的分子作用机制有更全面、更透彻的认识, 并为肿瘤的治疗提供新的策略.
肝细胞癌(hepatocellular carcinoma)是世界上最常见的恶性肿瘤之一, 大部分HCC患者在明确诊断时已经是中晚期肝癌, 失去了手术切除及其他根治性手术的机会; 寻找肝细胞癌分子靶点, 尽早判断肝癌的病情并预测其转移和复发, 并为临床有效治疗提供分子基础是肝癌防治研究工作的重点. 组织蛋白酶(Cathepsin S, Cat S)是一种半胱氨酸蛋白水解酶, 能介导细胞外基质(extracellular matrix, ECM)的降解, 参与肿瘤血管生成和血管内外肿瘤细胞的转移, 在人类的多种肿瘤中表达. 近年来研究发现血清Cat S含量与癌症死亡率呈显著正相关. 然而, 有关血清Cat S含量在肝癌中的研究, 国内外尚未见文献报道.
王德盛, 副主任医师, 中国人民解放军第四军医大学西京医院肝胆外科
关于Cat S在恶性肿瘤转移与复发中的作用是目前研究热点.
近年来的研究表明, Cat S基因的高表达在恶性肿瘤的浸润转移过程中起重要作用. 先后有文献报道, Cat S高表达或活性升高与前列腺癌、星型细胞瘤、肺癌和胃癌等多种肿瘤的侵袭转移密切相关.
本研究采用RT-PCR及Western blot方法检测Cat S在HCC中的表达, 同时检测肝癌患者血清Cat S表达水平, 分析血清Cat S水平与肝癌临床病理的关系及对预后的临床意义, 为肝细胞癌的诊断、治疗及预后预测提供新的策略.
本文较为新颖, 具有一定指导意义.
编辑: 郭鹏 电编:鲁亚静
| 1. | Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin. 2011;61:69-90. [PubMed] [DOI] |
| 2. | Siegel R, Ward E, Brawley O, Jemal A. Cancer statistics, 2011: the impact of eliminating socioeconomic and racial disparities on premature cancer deaths. CA Cancer J Clin. 2011;61:212-236. [PubMed] [DOI] |
| 3. | Ryschich E, Lizdenis P, Ittrich C, Benner A, Stahl S, Hamann A, Schmidt J, Knolle P, Arnold B, Hämmerling GJ. Molecular fingerprinting and autocrine growth regulation of endothelial cells in a murine model of hepatocellular carcinoma. Cancer Res. 2006;66:198-211. [PubMed] [DOI] |
| 4. | Katunuma N. Structure-based development of specific inhibitors for individual cathepsins and their medical applications. Proc Jpn Acad Ser B Phys Biol Sci. 2011;87:29-39. [PubMed] [DOI] |
| 5. | Shi GP, Sukhova GK, Kuzuya M, Ye Q, Du J, Zhang Y, Pan JH, Lu ML, Cheng XW, Iguchi A. Deficiency of the cysteine protease cathepsin S impairs microvessel growth. Circ Res. 2003;92:493-500. [PubMed] |
| 6. | Lindahl C, Simonsson M, Bergh A, Thysell E, Antti H, Sund M, Wikström P. Increased levels of macrophage-secreted cathepsin S during prostate cancer progression in TRAMP mice and patients. Cancer. Genomics Proteomics. 2009;6:149-159. [PubMed] |
| 7. | Flannery T, Gibson D, Mirakhur M, McQuaid S, Greenan C, Trimble A, Walker B, McCormick D, Johnston PG. The clinical significance of cathepsin S expression in human astrocytomas. Am J Pathol. 2003;163:175-182. [PubMed] [DOI] |
| 8. | Söderström M, Ekfors T, Böhling T, Aho A, Aro HT, Vuorio E. Cysteine proteinases in chondrosarcomas. Matrix Biol. 2001;19:717-725. [PubMed] [DOI] |
| 9. | Fan Q, Wang X, Zhang H, Li C, Fan J, Xu J. Silencing cathepsin S gene expression inhibits growth, invasion and angiogenesis of human hepatocellular carcinoma in vitro. Biochem Biophys Res Commun. 2012;425:703-710. [PubMed] [DOI] |
| 10. | Jobs E, Ingelsson E, Risérus U, Nerpin E, Jobs M, Sundström J, Basu S, Larsson A, Lind L, Ärnlöv J. Association between serum cathepsin S and mortality in older adults. JAMA. 2011;306:1113-1121. [PubMed] [DOI] |
| 11. | Llovet JM, Bruix J. Molecular targeted therapies in hepatocellular carcinoma. Hepatology. 2008;48:1312-1327. [PubMed] [DOI] |
| 12. | Liang P, Yu J, Yu XL, Wang XH, Wei Q, Yu SY, Li HX, Sun HT, Zhang ZX, Liu HC. Percutaneous cooled-tip microwave ablation under ultrasound guidance for primary liver cancer: a multicentre analysis of 1363 treatment-naive lesions in 1007 patients in China. Gut. 2012;61:1100-1101. [PubMed] [DOI] |
| 13. | Wang ZJ, Wang MQ, Duan F, Song P, Liu FY, Chang ZF, Wang Y, Yan JY, Li K. Transcatheter arterial chemoembolization followed by immediate radiofrequency ablation for large solitary hepatocellular carcinomas. World J Gastroenterol. 2013;19:4192-4199. [PubMed] [DOI] |
| 15. | Kos J, Sekirnik A, Kopitar G, Cimerman N, Kayser K, Stremmer A, Fiehn W, Werle B. Cathepsin S in tumours, regional lymph nodes and sera of patients with lung cancer: relation to prognosis. Br J Cancer. 2001;85:1193-1200. [PubMed] |
| 16. | Yang Y, Lim SK, Choong LY, Lee H, Chen Y, Chong PK, Ashktorab H, Wang TT, Salto-Tellez M, Yeoh KG. Cathepsin S mediates gastric cancer cell migration and invasion via a putative network of metastasis-associated proteins. J Proteome Res. 2010;9:4767-4778. [PubMed] [DOI] |
| 17. | Wang B, Sun J, Kitamoto S, Yang M, Grubb A, Chapman HA, Kalluri R, Shi GP. Cathepsin S controls angiogenesis and tumor growth via matrix-derived angiogenic factors. J Biol Chem. 2006;281:6020-6029. [PubMed] [DOI] |
| 18. | Flannery T, McQuaid S, McGoohan C, McConnell RS, McGregor G, Mirakhur M, Hamilton P, Diamond J, Cran G, Walker B. Cathepsin S expression: An independent prognostic factor in glioblastoma tumours--A pilot study. Int J Cancer. 2006;119:854-860. [PubMed] [DOI] |