修回日期: 2013-09-18
接受日期: 2013-09-30
在线出版日期: 2013-11-28
目的: 应用诊断试验Meta分析方法评价瞬时弹性成像技术(fibroscan, FS)诊断慢性病毒性肝炎肝纤维化的准确性以及研究其准确性是否受病因影响.
方法: 检索万方数据-学术期刊全文库、中国期刊全文数据库(Chinese Journal Full-Text Database, CJFD)、中国生物医学文献数据库(Chinese Biomedical Literature Database, CBM)、PubMed(Medline)、Cochrane library、EMBASE数据库中有关FS评价慢性病毒性肝炎肝纤维化的中英文文献, 进行严格筛选和评价, 应用Meta-disc1.4和Stata12.0软件进行统计学分析.
结果: 共纳入28篇中英文文献. FS诊断慢性病毒性肝炎明显肝纤维化(≥F2)和肝硬化(F = 4)的合并敏感度、合并特异度、合并诊断比值比、综合受试者工作特征(summary receiver operating characteristic, SROC)曲线下面积分别为0.72(0.70-0.73)、0.85(0.83-0.87)、18.51(13.28-25.80)、0.88和 0.86(0.84-0.88)、0.86(0.85-0.87)、49.14(30.53-79.09)、0.94. Meta分析对所有慢性病毒性肝炎所得的结果, 与按慢性丙型肝炎(chronic hepatitis C, CHC)或慢性乙型肝炎(chronic hepatitis B, CHB)病因分类后Meta分析所得的结果相比, 未见明显差异.
结论: FS诊断肝纤维化分级的准确性良好, 尤其对诊断肝硬化. 不论是CHC或CHB, FS诊断肝纤维化分级的准确性无明显差别.
核心提示: Fibroscan诊断肝纤维化分级的准确性良好, 尤其对诊断肝硬化. 不论是慢性丙型肝炎或慢性乙型肝炎, Fibroscan诊断肝纤维化分级的准确性无明显差别.
引文著录: 罗子华, 邹健, 宓林, 刘燕, 童依丽, 于晓峰. Fibroscan评价慢性病毒性肝炎肝纤维化(≥F2)的Meta分析. 世界华人消化杂志 2013; 21(33): 3724-3735
Revised: September 18, 2013
Accepted: September 30, 2013
Published online: November 28, 2013
AIM: To evaluate the value of fibroscan (FS) in hepatic fibrosis stage assessment in patients with chronic viral hepatitis, and to examine whether its accuracy is affected by etiology.
METHODS: English and Chinese articles related to assessment of hepatic fibrosis stage by fibroscan in Wanfang, Chinese Journal Full-Text Database (CJFD), Chinese Biomedical Literature Database (CBM), PubMed, Cochrane library and EMBASE database were strictly screened and evaluated. Data of enrolled articles were analyzed using Meta-disc1.4 and Stata12.0 software.
RESULTS: A total of 28 English and Chinese articles were included. The pooled sensitivity, specificity, diagnostic odds ratio and the area under curve (AUC) of summary receiver operating characteristic (SROC) curve for significant fibrosis (F ≥ 2) and cirrhosis (F = 4) in patients with chronic viral hepatitis were 0.72 (0.70-0.73), 0.85 (0.83-0.87), 18.51 (13.28-25.80), 0.88 and 0.86 (0.84-0.88), 0.86 (0.85-0.87), 49.14 (30.53-79.09) and 0.94, respectively. There was no significant difference among the results of meta-analysis according to etiology.
CONCLUSION: Fibroscan has a high diagnostic accuracy for evaluating hepatic fibrosis stage, especially in patients with cirrhosis. The diagnostic accuracy of fibroscan is not affected by etiology.
- Citation: Luo ZH, Zou J, Mi L, Liu Y, Tong YL, Yu XF. Evaluation of hepatic fibrosis stage (≥ F2) by fibroscan in patients with chronic viral hepatitis: A Meta-analysis. Shijie Huaren Xiaohua Zazhi 2013; 21(33): 3724-3735
- URL: https://www.wjgnet.com/1009-3079/full/v21/i33/3724.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i33.3724
迄今为止, 肝穿刺活检(liver biopsy, LB)仍被视为诊断肝纤维化分级的"金标准", 尽管其属于创伤性检查和存在发生并发症的风险. 肝活检常见的并发症有迷走神经反射、肝区疼痛、肝包膜下出血等, 甚至可以导致死亡, 据报道死亡率在1/(1-1.2)万左右[1]. 另外, 不同病理医师的诊断主观上存在误差, 穿刺部位的局限也可引起抽样误差, Colloredo等[2]研究还发现肝穿刺活检的样本量越小对肝纤维化程度低估的可能性越大, 这些都是影响病理诊断结果的重要因素. 因此临床上迫切需要能够替代肝穿刺活检的无创性检查.
瞬时弹性成像技术(fibroscan, FS)是2003年左右出现的应用超声波技术测定肝组织硬度的无创性检查[3], 根据肝脏组织对低频超声震动波反射回来的弹性数值, 来评估肝脏的硬度, 单位以千帕(kPa)表示; 弹性数值越大, 表示肝组织质地越硬, 纤维化程度越严重. 众多研究证实FS值与肝纤维化病理分级密切相关, 同时亦有研究发现FS值受病因、肝脏炎症程度、肝酶水平、肝脏脂肪变程度等因素的影响, 但各研究的纳入病例数、患者纳入标准、患者基本特征不完全一致, 得出的诊断界值也参差不齐, 因此, 迫切需要检验FS诊断肝纤维化分级的准确性.
在我国, 罹患肝病者多为慢性病毒性肝炎, 尤以乙型肝炎为主. 随着时间推移, 慢性乙型肝炎(chronic hepatitis B, CHB)和慢性丙型肝炎(chronic hepatitis C, CHC)肝纤维化程度逐渐加重, 伴随肝脏结构和血流动力学改变, 最终导致肝硬化和相关并发症的发生. 而肝纤维化分级的评估是临床评价病情和决定治疗策略的重要依据, 因此需要无创性检查实时监测和评价病情[4,5].
本文的主要目的是应用诊断性Meta分析方法研究FS诊断肝纤维化分级的准确性以及研究FS的准确性是否受病因的影响: (1)Meta分析FS诊断CHC肝纤维化分级的准确性; (2)Meta分析FS诊断CHB肝纤维化分级的准确性; (3)对所有慢性病毒性肝炎者, 研究FS诊断肝纤维化分级的准确性; (4)比较各中心得出的肝纤维化诊断界值, 供临床工作者参考使用.
文献检索: 通过计算机检索2002-01/2013-05期间发表的相关文献, 中文数据库包括万方数据-学术期刊全文库、中国期刊全文数据库(Chinese Journal Full-Text Database, CJFD)、中国生物医学文献数据库(Chinese Biomedical Literature Database, CBM), 外文数据库包括PubMed(Medline)、Cochrane library、EMBASE, 主要检索词为fibroscan、transient elastography、瞬时弹性成像、瞬时弹性扫描, 再通过chronic hepatitis B、chronic hepatitis C、cirrhosis、fibrosis等检索词进一步筛检. 纳入的文献需符合以下标准: (1)中文或英文原始文献; (2)研究对象为CHB和/或CHC者, 或为研究对象亚组中的这类患者; (3)以LB为金标准, 研究FS诊断肝纤维化分级的准确性; (4)有肝组织病理学诊断结果, 并采用METAVIR分级法[6]将肝纤维化分为F0-F4期, F0: 无纤维化; F1: 汇管区纤维化但无纤维间隔; F2: 汇管区纤维化伴少量间隔; F3: 间隔纤维化; F4: 早期肝硬化, 其中F≥2定义为明显肝纤维化. 若文献采用其他肝纤维化分级法, 其分级标准必须与METAVIR分级类似; (5)研究需采用受试者工作特征(receiver operating characteristic, ROC)曲线和受试者工作特征曲线下面积(area under the ROC, AUROC)评价FS诊断肝纤维化分级的准确性, 最佳诊断界值为敏感度与特异度之和最大的点. 排除标准: (1)重复发表的文献; (2)若纳入文献均符合以上标准, 但纳入的患者无法除外存在重复, 取纳入的患者总数较大者; (3)无法提取文献数据获得四格表资料或无法获取全文者; (4)文献中的病例数太少而对结果产生严重偏倚; (5)研究对象中合并HIV感染、HDV感染、自身免疫性肝炎或酒精性肝炎等肝脏疾病.
1.2.1 资料提取: 根据上述纳入和排除标准, 提取相关的临床和统计学资料, 包括作者、发表年份、国家、病因、纳入分析数、男性人数、FS与LB间隔、平均年龄、平均体质量指数(body mass index, BMI)、LB样本描述、F2和F4界值、F2-4/F4例数, 以及统计分析需要的各项参数, 包括真阳性数、真阴性数、假阳性数、假阴性数、敏感度、特异度、阳性预测值、阴性预测值等.
1.2.2 文献质量评价: 根据诊断性试验质量评价量表(quality assessment of diagnostic accuracy studies, QUADAS)[7,8], 对纳入文献严格按各条目要求以"是"、"否"、"不清楚"进行严格的评价, 并规定"是"为1分, "否"和"不清楚"为0分, 总分低于10分的文献排除.
统计学处理 提取纳入文献的数据, 整理成四格表形式. 诊断性试验中异质性是由阈值效应和非阈值效应引起的, 通过计算灵敏度对数与"1-特异度"对数的Spearman相关系数检验其阈值效应, 若存在阈值效应, 则不合并灵敏度、特异度和诊断比值比(diagnostic odds ratio, DOR); 通过计算DOR的I2值检验非阈值效应, I2值在0%-100%之间, 当I2 = 0%时研究间无异质性, 数值越大, 异质性就越大. I2 = 25%时, 表明存在轻度异质性; I2 = 50%时, 表明存在中度异质性; I2 = 75%时, 表明存在高度异质性. 根据Cochrane手册, I2>50%时则认为研究间存在异质性. 如果存在异质性, 选用随机效应模型, 否则采用固定效应模型. 此外, 采用漏斗图法直观评估偏倚情况. FS诊断肝纤维化分级的准确性通过以下指标评估: (1)运用综合受试者工作特性(summary receiver operating characteristic, SROC)曲线分析法, 绘制出SROC曲线, 并计算曲线下面积(area under curve, AUC); (2)计算合并DOR、合并敏感度、合并特异度及其95%可信区间(95% confidence interval, 95%CI). 以上指标均采用Meta-disc1.4和Stata12.0软件分析.
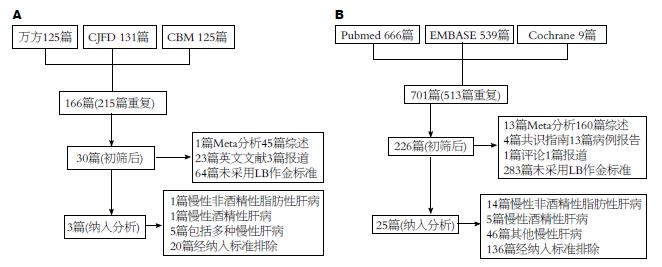
检索中文数据库和外文数据库, 采用上述检索策略, 严格按照纳入标准和排除标准筛检, 最后共28篇文献纳入Meta分析(图1).
纳入的28篇文献中, 来自法国的研究3篇, 韩国的研究6篇, 罗马尼亚的研究4篇, 日本的研究3篇, 中国的研究5篇, 意大利的研究4篇, 来自西班牙、印度尼西亚和全球多中心的研究各1篇. 其中15篇文献研究对象包含CHC, 病例数为2796例; 12篇文献研究对象包含CHB, 病例数为1713例; 4篇文献研究对象为CHC和CHB, 病例数为645例.
筛选出的文献均满足纳入标准并经过严格的QUADAS评分, 总体而言, 来自欧美国家的研究多以CHC为研究对象, 来自亚洲国家的研究多以CHB为研究对象, 早期的研究对患者的纳入条件较宽泛, 随后的研究纳入标准逐渐细化, 对患者的丙氨酸氨基转移酶(alanine aminotransferase, ALT)水平、总胆红素(total bilirubin, TB)水平、BMI水平等指标再进行分层比较, 但限于各中心的研究对指标的分层无统一标准, 难以设定更严格的条件进行Meta分析, 因此本文的患者纳入标准未对ALT、TB等指标的水平进一步限制, 但排除文献中研究对象有急性病毒性肝炎者或急性肝功能衰竭者. 经初筛后的文献, 多因未能提取完整的四格表数据、研究对象中合并慢性非病毒性肝炎、FS与LB的间隔时间过长、来自同一中心的研究不能除外研究对象重复等原因而在进一步筛检中排除. 表1列出了纳入文献的基本特征, 男女比例无明显差异, 各研究ALT水平波动范围较大, 但均未达到急性肝功能衰竭的程度, FS与LB多在同一天内完成, 但部分研究未提及时间间隔. 此外, 大部分文献对肝穿刺活检的样本有简要的描述, 但多数研究未提及病理诊断上存在争议的样本情况.
| 病因 | 作者 | 发表时间(国家) | 纳入时间 | 纳入分析数(男性) | 病理评分标准 | FS与LB间隔 | 年龄(岁) | BMI水平(kg/m2) | ALT 水平(IU/L) | 肝穿刺活检样本描述 | QUAD-AS评分 |
| CHC | Ziol等[9] | 2005(法国) | 2002-11/2003-09 | 251(155) | METAVIR | 6 mo | 47.5±13.0 | 23.9±3.4 | 2.0±2.0×ULN | 长度18.0 mm(中位数) | 11 |
| CHC | Castéra等[10] | 2005(法国) | 2003-06/2004-06 | 183(104) | METAVIR | 1 d | 51.0±12.0 | 25.0±4.0 | 2.2±1.9×ULN | 长度17.0 mm(中位数) | 12 |
| CHC | 1Colletta等[11] | 2005(意大利) | 1995-11/1998-03 | 40(22) | METAVIR | 6 mo(中位数) | 44(27-66) | 21(18-26) | 38(23-42) | 长度20±3 mm; 汇管区7 个(中位数) | 12 |
| CHC | Lupsor等[12] | 2008(罗马尼亚) | 2007-05/2008-03 | 324(115) | METAVIR | 1 d | 48.4±10.9 | 26.5±4.7 | 89.0±58.0 | 长度平均11.4 mm; 汇管区平均11.6 个 | 12 |
| CHC | Masuzaki等[13] | 2008(日本) | 2004-11/2007-04 | 386(227) | N(与META- VIR类同) | 14 d | 68.2±9.5 | 23(14-34) | 47(6-506) | 长度16(15-17)mm; 96.2%样本≥5 个汇管区 | 12 |
| CHC | Sporea等[14] | 2008(罗马尼亚) | 2007-06/2008-06 | 191(61) | METAVIR | N | 49.8±11.0 | N | N | 样本要求长度至少20 mm和包括8 个汇管区 | 10 |
| CHC | Arena等[15] | 2008(西班牙) | 2006-09/2007-07 | 150(93) | METAVIR | 1 d | 原文中分亚组描述 | 原文中分亚组描述 | 原文中分亚组描述 | 样本要求长度至少25 mm和包括11.0 个汇管区 | 12 |
| CHC | Lupsor等[16] | 2009(罗马尼亚) | 2008-10/2008-12 | 112(44) | METAVIR | 6 mo | 49.0±12.3 | 26.1±4.0 | 80.2±51.4 | 长度平均11.0 mm; 汇管区平均11.0 个 | 11 |
| CHC | Ichino等[17] | 2010(日本) | 2004-07/2009-02 | 165(92) | METAVIR | 7 d | 53.2±12.6 | N | 72.4±54.9 | N | 11 |
| CHC | Rizzo等[18] | 2011(意大利) | 2008-11/2009-10 | 139(83) | METAVIR | 3 mo(中位数) | 55.0±12.0 | 26.0±3.0 | 77.2±33.0 | 样本要求长度至少15 mm和包括10 个汇管区 | 13 |
| CHC | Patel等[19] | 2011(全球多中心) | 2006-11/2008-10 | 214(105) | METAVIR | N | 45.7±11.7 | 25.1±4.2 | 45.8%患者>1.5×ULN | 长度15.8 mm±8.2 mm; 汇管区要求至少6 个 | 11 |
| CHC | Cho等[20] | 2011(韩国) | 2006-09/2009-08 | 86(40) | Batts and Ludwig | 1 d | 51.7±10.9 | 24.5±4.2 | 73.6±72.8 | 长度34.7 mm±11.2 mm | 12 |
| CHC | Kim等[21] | 2011(韩国) | 2005-06/2009-07 | 91(44) | Batts and Ludwig | 1 d | 47.9±11.6 | 22.9±2.9 | 40.2±20.9 | 样本要求长度至少15 mm和包括6 个汇管区 | 13 |
| CHC | Ferraioli等[22] | 2013(意大利) | 2009-06/2012-02 | 195(139) | METAVIR | 1 d | 45.3(中位数) | 25.3(中位数) | 70.0(中位数) | 长度27.0 mm±8.0 mm | 12 |
| CHC | Bosselut等[23] | 2013(法国) | 2007-11/2008-07 | 269(165) | METAVIR | 2 mo | 50.2±11.2 | 24.4±3.7 | N | 长度26.3 mm±8.3 mm; 汇管区21.4 个±8.2 个 | 12 |
| CHB | Chan等[24] | 2009(中国) | 2006-07/2008-03 | 161(122) | METAVIR | 28 d | 45±11 | 24±4 | 93±78 | 长度19 mm±3 mm; 汇管区10 个±5 个 | 12 |
| CHB | Kim等[25] | 2009(韩国) | 2005-03/2006-11 | 91(73) | METAVIR | 1 d | 40±13 | 23.8±4.6 | 46±24 | 样本要求长度至少10 mm和包括10 个汇管区 | 13 |
| CHB | Lesmana等[26] | 2011(印度尼西亚) | 2008-10/2010-04 | 117(63) | METAVIR | N | 40.6±11.0 | 23.3±3.5 | 47.7±37.0 | 样本要求长度至少15 mm和包括5 个汇管区 | 11 |
| CHB | Viganò等[27] | 2011(意大利) | 2007-01/2008-07 | 125(97) | METAVIR | N | 47(21-67) | 36%患者>25 | 68(19-855) | 长度27 mm(中位数); 汇管区12 个(中位数) | 12 |
| CHB | Ogawa等[28] | 2011(日本) | N | 44(29) | METAVIR | 1 d | 47.0±13.9 | N | 50.4±29.0 | 长度18 mm(中位数) | 12 |
| CHB | Zhu等[29] | 2011(中国) | 2009-03/2010-04 | 175(137) | METAVIR | 1 d | 36.5±9.4 | N | 40.1±18.6 | 样本要求长度至少15 mm和包括6 个汇管区 | 13 |
| CHB | Cho等[20] | 2011(韩国) | 2006-09/2009-08 | 121(81) | Batts and Ludwig | 1 d | 39.1±12.8 | 23.9±3.0 | 167.0±197.9 | 长度34.5 mm±11.5 mm | 12 |
| CHB | 纪冬等[30] | 2011(中国) | 2010-01/2010-12 | 313(215) | 中国指南 | 1 d | 35.6±11.2 | N | 原文中分亚组描述 | 长度平均20 mm | 10 |
| CHB | 张旭等[31] | 2011(中国) | 2010-01/2010-06 | 88(60) | 中国指南 | 1 d | 34.9±11.6 | 24.2±5.0 | N | 样本要求长度至少15 mm和包括6 个汇管区 | 11 |
| CHB | Kim等[32] | 2012(韩国) | 2010-06/2011-11 | 170(102) | Batts and Ludwig | 1 d | 45.3±15.1 | 23.4±2.8 | 62.9±26.1 | 长度21.3 mm±0.7 mm | 13 |
| CHB | Kim等[33] | 2012(韩国) | 2008-07/2010-06 | 194(117) | Batts and Ludwig | 1 d | 46.7±14.7 | 23.4±2.8 | 58.4±27.1 | 长度21.3 mm±0.7 mm | 13 |
| CHB | 李建志等[34] | 2012(中国) | 2010-02/2011-06 | 114(79) | 中国指南 | N | 37.4±10.2 | 24.3±3.3 | 60.9±64.6 | N | 10 |
| CHC CHB | Sporea等[35] | 2010(罗马尼亚) | N | 71(41) | METAVIR | N | 50.7±12.9 | N | N | 样本要求长度至少20 mm | 10 |
| CHC CHB | Lee等[36] | 2010(韩国) | 2005-10/2007-07 | 121(89) | METAVIR | 1 d | 43.1±11.9 | 23.6±2.9 | 156.9±211.2 | 样本要求长度至少10 mm和包括7 个汇管区 | 11 |
| CHC CHB | Cho等[20] | 2011(韩国) | 2006-09/2009-08 | 207(121) | Batts and Ludwig | 1 d | 44.3±13.5 | 24.1±3.5 | 128.2±164.7 | 长度34.7 mm±11.3 mm | 12 |
| CHC CHB | Kim等[22] | 2013(意大利) | 2009-06/2012-02 | 246(171) | METAVIR | 1 d | 44.7±11.8 | 25.2±3.9 | 65(中位数) | 长度27 mm±8 mm | 12 |
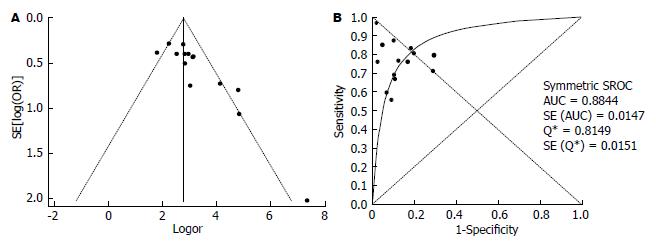
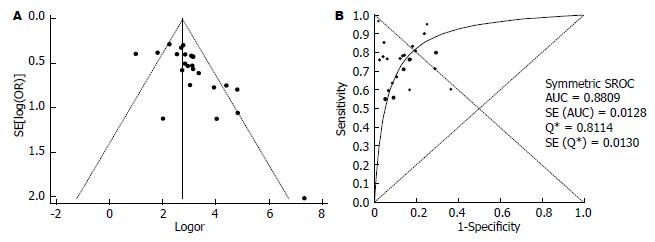
2.3.1 FS诊断CHC肝纤维化分级的Meta分析: 15篇文献研究对象包含CHC, 其中14篇文献评价了FS诊断CHC明显肝纤维化(F≥2)的准确性(表2), 诊断界值在6.2-10.1 kPa之间; 灵敏度对数与"1-特异度"对数的Spearman相关系数为-0.037, P = 0.899, 表明尚不能认为存在阈值效应. DOR的I2值为57.4, 表明存在较大的异质性, 同时漏斗图见个别研究在95%CI外, 故采用随机效应模型计算合并DOR和拟合SROC曲线(图2), 其值分别为19.38(13.10-28.67)、0.88, 合并敏感度和合并特异度分别为0.72(0.70-0.75)、0.85(0.83-0.87).
| 作者 | 发表时间 | F2-4/n | 界值(kPa) | SE(%) | SP(%) | PPV(%) | NPV(%) | AUC(95%CI) |
| Ziol等[9] | 2005 | 163/251 | 8.8 | 56 | 91 | 88 | 56 | N |
| Castera等[10] | 2005 | 136/183 | 7.1 | 67 | 89 | 95 | 48 | 0.83 (0.76-0.88) |
| Castéra等[11] | 2005 | 14/40 | 8.7 | 100 | 100 | 100 | 100 | N |
| Lupsor等[12] | 2008 | 210/324 | 7.4 | 76 | 84 | 90 | 65 | 0.86(0.82-0.90) |
| Sporea等[14] | 2008 | 161/191 | 6.8 | 60 | 93 | 98 | 30 | 0.77 |
| Arena等[15] | 2008 | 84/150 | 7.8 | 83 | 82 | 83 | 79 | 0.91(0.87-0.95) |
| Lupsor等[16] | 2009 | 68/112 | 8.1 | 85 | 95 | 97 | 80 | 0.96(0.91-0.99) |
| Ichino等[17] | 2010 | 99/165 | 7.1 | 81 | 80 | 86 | 74 | 0.88(0.83-0.93) |
| Rizzo等[18] | 2011 | 87/139 | 6.5 | 71 | 71 | 82 | 56 | 0.78(0.70-0.85) |
| Patel等[19] | 2011 | 43/214 | 10.1 | 77 | 88 | 62 | 94 | 0.88(0.82-0.93) |
| Cho等[20] | 2011 | 56/86 | 7.4 | 88 | 90 | 94 | 79 | 0.94(0.86-0.98) |
| Kim等[21] | 2011 | 50/91 | 6.2 | 76 | 98 | 97 | 80 | 0.91(0.84-0.97) |
| Ferraioli等[22] | 2013 | 97/195 | 6.9 | 69 | 90 | 87 | 75 | 0.86(0.80-0.90) |
| Bosselut等[23] | 2013 | 129/269 | 7.1 | 80 | 71 | 72 | 79 | 0.83(0.78-0.87) |
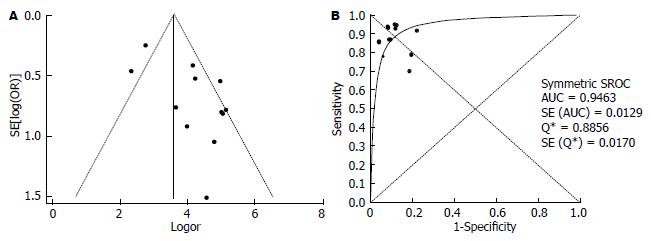
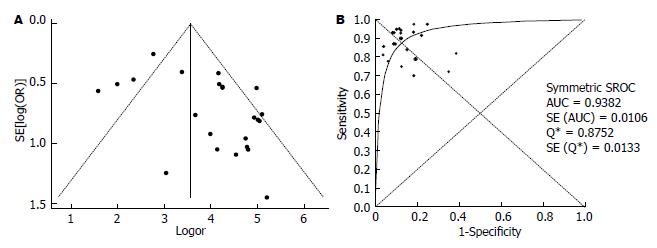
12篇文献评价了FS诊断CHC肝硬化(F = 4)的准确性(表3), 诊断界值在9.3-15.9 kPa之间; 灵敏度对数与"1-特异度"对数的Spearman相关系数为0.011, P = 0.974, 表明尚不能认为存在阈值效应. DOR的I2值为72.1, 表明存在较大的异质性, 同时漏斗图见个别研究在95%CI外, 故采用随机效应模型计算合并DOR和拟合SROC曲线(图3), 其值分别为59.95(31.05-115.76)、0.95, 合并敏感度和合并特异度分别为0.85(0.81-0.87)、0.89(0.87-0.90).
| 作者 | 发表时间 | F4/n | 界值kPa | SE(%) | SP(%) | PPV(%) | NPV(%) | AUC(95%CI) |
| Ziol等[9] | 2005 | 49/251 | 14.6 | 86 | 96 | 78 | 97 | N |
| Castéra等[10] | 2005 | 46/183 | 12.5 | 87 | 91 | 77 | 95 | 0.95(0.91-0.98) |
| Lupsor等[12] | 2008 | 69/324 | 11.9 | 87 | 91 | 72 | 96 | 0.94(0.91-0.96) |
| Masuzaki等[13] | 2008 | 219/386 | 15.9 | 79 | 81 | 87 | 69 | 0.87(0.83-0.90) |
| Arena等[15] | 2008 | 29/150 | 14.8 | 94 | 92 | 73 | 98 | 0.98(0.95-0.99) |
| Lupsor等[16] | 2009 | 42/112 | 13.1 | 95 | 89 | 84 | 97 | 0.97(0.92-1.00) |
| Ichino等[17] | 2010 | 24/165 | 11.6 | 92 | 78 | 42 | 98 | 0.90(0.84-0.96) |
| Rizzo等[18] | 2011 | 30/139 | 11.0 | 70 | 82 | 53 | 90 | 0.80(0.72-0.86) |
| Patel等[19] | 2011 | 18/214 | 11.7 | 94 | 88 | 42 | 99 | 0.93(0.88-0.98) |
| Cho等[20] | 2011 | 6/86 | 14.7 | 100 | 89 | 40 | 100 | 0.96(0.90-0.99) |
| Kim等[21] | 2011 | 9/91 | 11.0 | 78 | 94 | 58 | 98 | 0.97(0.93-1.00) |
| Ferraioli等[22] | 2013 | 32/195 | 9.3 | 94 | 92 | 69 | 99 | 0.97(0.93-0.99) |
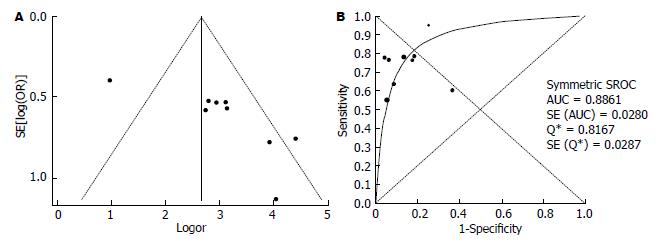
2.3.2 FS诊断CHB肝纤维化分级的Meta分析: 12篇文献研究对象包含CHB, 其中9篇文献评价了FS诊断CHB明显肝纤维化(F≥2)的准确性(表4), 诊断界值在5.9-9.3 kPa之间. 灵敏度对数与"1-特异度"对数的Spearman相关系数为0.250, P = 0.516, 表明尚不能认为存在阈值效应. DOR的I2值为73.2, 表明存在较大的异质性, 同时漏斗图见个别研究在95%CI外, 故采用随机效应模型计算合并DOR和拟合SROC曲线(图4), 其值分别为19.84(9.35-42.09)、0.89, 合并敏感度和合并特异度分别为0.70(0.67-0.73)、0.87(0.83-0.90).
| 作者 | 发表时间 | F2-4/n | 界值(kPa) | SE(%) | SP(%) | PPV(%) | NPV(%) | AUC(95%CI) |
| Cho等[20] | 2011 | 88/121 | 7.8 | 78 | 82 | 92 | 58 | 0.85(0.77-0.91) |
| Lesmana等[26] | 2011 | 73/117 | 5.9 | 60 | 64 | 73 | 49 | 0.61(0.51-0.72) |
| Viganò等[27] | 2011 | 66/125 | 8.7 | 64 | 92 | 90 | 70 | N |
| Ogawa等[28] | 2011 | 20/44 | 6.3 | 95 | 74 | 74 | 95 | 0.86 |
| 纪冬等[30] | 2011 | 236/313 | 9.3 | 55 | 95 | 97 | 41 | 0.79(0.74-0.84) |
| 张旭等[31] | 2011 | 59/88 | 7.3 | 76 | 83 | 90 | 63 | 0.86 |
| Kim等[32] | 2012 | 121/170 | 8.0 | 78 | 96 | 98 | 64 | 0.94(0.90-0.97) |
| Kim等[33] | 2012 | 164/194 | 8.8 | 78 | 87 | 97 | 42 | 0.87(0.80-0.94) |
| 李建志等[34] | 2012 | 81/112 | 7.3 | 77 | 93 | 96 | 62 | 0.89(0.83-0.95) |
10篇文献评价了FS诊断CHB肝硬化(F = 4)的准确性(表5), 诊断界值在9-15.4 kPa之间; 灵敏度对数与"1-特异度"对数的Spearman相关系数为-0.091, P = 0.803, 表明尚不能认为存在阈值效应. DOR的I2值为53.8, 表明存在较大的异质性, 同时漏斗图见个别研究在95%CI外, 故采用随机效应模型计算合并DOR和拟合SROC曲线(图5), 其值分别为45.10(23.02-88.36)、0.93, 合并敏感度和合并特异度分别为0.89(0.85-0.92)、0.84(0.82-0.86).
| 作者 | 发表时间 | F4/n | 界值(kPa) | SE(%) | SP(%) | PPV(%) | NPV(%) | AUC(95%CI) |
| Cho等[20] | 2011 | 9/121 | 14.0 | 88 | 79 | 25 | 99 | 0.87(0.79-0.92) |
| Chan等[24] | 2009 | 40/161 | 9.0 | 98 | 75 | 57 | 98 | 0.93(0.89-0.97) |
| Kim等[25] | 2009 | 39/91 | 9.7 | 82 | 62 | 63 | 76 | 0.80(0.69-0.92) |
| Vigano等[27] | 2011 | 20/125 | 9.4 | 100 | 82 | 51 | 100 | N |
| Ogawa等[28] | 2011 | 4/44 | 12.0 | 75 | 89 | 38 | 98 | 0.89 |
| Zhu等[29] | 2011 | 29/175 | 13.8 | 93 | 91 | 68 | 99 | 0.98(0.96-0.99) |
| 纪冬等[30] | 2011 | 50/313 | 15.4 | 90 | 88 | 58 | 98 | 0.95(0.92-0.97) |
| 张旭等[31] | 2011 | 14/88 | 12.4 | 93 | 88 | 50 | 98 | 0.95 |
| Kim等[32] | 2012 | 47/170 | 14.0 | 87 | 91 | 79 | 95 | 0.96(0.94-0.99) |
| Kim等[33] | 2012 | 75/194 | 14.1 | 84 | 85 | 78 | 89 | 0.91(0.87-0.95) |
2.3.3 FS诊断CHC和CHB肝纤维化分级的Meta分析: 4篇文献评价FS诊断CHC和CHB明显肝纤维化和肝硬化的准确性(表6, 7). 对所有慢性病毒性肝炎者, 综合所有纳入的文献, 剔除其中重复的数据, 24篇文献评价了FS诊断明显肝纤维化(F≥2)的准确性, 灵敏度对数与"1-特异度"对数的Spearman相关系数为0.142, P = 0.507, 表明尚不能认为存在阈值效应. DOR的I2值为60.8, 表明存在较大的异质性, 同时漏斗图见个别研究在95%CI外, 故采用随机效应模型计算合并DOR和拟合SROC曲线(图6), 其值分别为18.51(13.28-25.80)、0.88, 合并敏感度和合并特异度分别为0.72(0.70-0.73)、0.85(0.83-0.87).
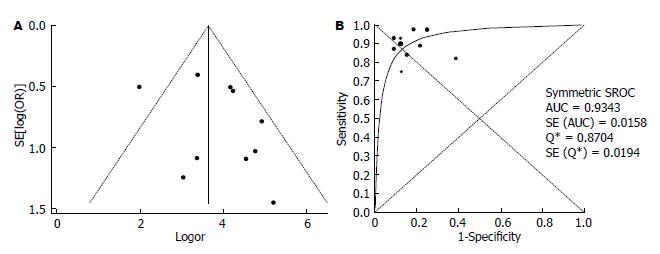
23篇文献评价了FS诊断肝硬化(F = 4)的准确性, 灵敏度对数与"1-特异度"对数的Spearman相关系数为-0.009, P = 0.966, 表明尚不能认为存在阈值效应. DOR的I2值为69.8, 表明存在较大的异质性, 同时漏斗图见个别研究在95%CI外, 故采用随机效应模型计算合并DOR和拟合SROC曲线(图7), 其值分别为49.14(30.53-79.09)、0.94, 合并敏感度和合并特异度分别为0.86(0.84-0.88)、0.86(0.85-0.87).
诊断性Meta分析通过AUC评估该诊断试验的准确性: AUC≤0.5表明该诊断试验无意义; 0.5<AUC≤0.7表明准确性较低; 0.7<AUC≤0.9表明准确性中等; AUC>0.9表明准确性较高, 即越接近于1(曲线越接近左上角)表明准确性越高.
FS自问世十年来, 在全球范围内不断推广使用, 其简易的操作性、稳定的重复性、可靠的准确性得到越来越多中心的认可, 虽然抗病毒治疗的进展使得乙型肝炎病毒(hepatitis B virus, HBV)和丙型肝炎病毒(hepatitis C virus, HCV)感染的发病率和肝硬化相关并发症的发生率得到有效的控制, 但庞大的患病人群基数迫切需要简便有效的工具监测疾病进展和评估治疗效果.
本文以发生明显肝纤维化(F≥2)和肝硬化(F = 4)为研究对象, 基于发生明显肝纤维化是决定是否行抗病毒治疗的重要参考[37], 发生肝硬化是密切监测胃-食管静脉曲张、肝细胞癌、腹水、肝性脑病等并发症的重要参考.
在欧美国家, 以HCV导致的病毒性肝炎为主, 各中心得出的FS诊断CHC明显肝纤维化(F≥2)的界值在6.2-10.1 kPa之间, 诊断肝硬化(F = 4)的界值在9.3-15.9 kPa之间, Meta分析其合并敏感度、合并特异度、合并DOR及AUC分别为0.72(0.70-0.75)、0.85(0.83-0.87)、19.38(13.10-28.67)、0.88和0.85(0.81-0.87)、0.89(0.87-0.90)、59.95(31.05-115.76)、0.95.
在亚洲国家, 以HBV导致的病毒性肝炎为主, 各中心得出的FS诊断CHB明显肝纤维化(F≥2)的界值在5.9-9.3 kPa之间, 诊断肝硬化(F = 4)的界值在9.0-15.4 kPa之间, Meta分析其合并敏感度、合并特异度、合并DOR及AUC分别为0.70(0.67-0.73)、0.87(0.83-0.90)、19.84(9.35-42.09)、0.89和0.89(0.85-0.92)、0.84(0.82-0.86)、45.10(23.02-88.36)、0.93.
根据上述结果, 表明FS诊断肝纤维化分级具有较高的准确性, 不论是CHC或CHB, FS诊断肝硬化(F = 4)的合并敏感度、合并特异度、合并DOR、AUC均优于诊断明显肝纤维化(F≥2), 提示FS诊断肝硬化(F = 4)的准确性更高; 对比CHC和CHB, FS诊断明显肝纤维化(F≥2)和肝硬化(F = 4)的准确性无明显差异; 但在CHC, FS诊断肝硬化(F = 4)的合并DOR明显高于CHB.
Meta分析对所有慢性病毒性肝炎所得的结果, 与按CHC或CHB病因分类后Meta分析所得的结果相比, 未见明显差异. 因此不论是CHC或CHB, FS诊断肝纤维化分级的准确性无明显差别. 尽管各中心得出的诊断界值参差不齐, 但对临床医师仍有指导意义. 对CHC患者, 在FS值为6.2 kPa时需警惕发生明显肝纤维化(F≥2)的可能, 在FS值为9.3 kPa时需警惕发生肝硬化(F = 4)的可能; 对CHB患者, 在FS值为5.9 kPa时需警惕发生明显肝纤维化(F≥2)的可能, 在FS值为9 kPa时需警惕发生肝硬化(F = 4)的可能.
值得注意的是, 即使各中心的最佳诊断界值均是在敏感度和特异度之和最大的条件下得出, 各中心的结论仍不完全一致, 有些甚至差别较大, 究其原因, 可能由各中心研究对象的BMI水平、ALT水平、操作者水平等因素不完全一致引起. 在临床实际应用时, 界值可以根据特定的需要而设定, 为减少误诊率可提高诊断界值以提高特异度, 为减少漏诊率可降低诊断界值以提高敏感度.
肝脏疾病的病因多种, 慢性肝炎长期发展均导致肝纤维化和肝硬化. 病因不同, 发生肝纤维化的时间、肝脏的病理学特征、肝脏的硬度不完全相同, 因此FS的诊断界值和诊断准确性不完全相同. FS在诊断慢性酒精性肝病[38]、慢性非酒精性脂肪性肝病[39]、原发性胆汁性肝硬化[40]等疾病的研究均有报道.
此外, 在分析FS值时, 其影响因素不可忽视, 已经有研究表明, BMI水平[41]、肝脏炎症程度和脂肪变程度[42]、ALT水平[43]等因素均可导致高估或低估FS值, 从而造成对肝纤维化分期的误判. 在临床上, 必须个体化评估病情, FS作为一种辅助检查工具对病情的判断具有重要参考价值, 但必须综合血清学指标和影像学检查才能准确评估病情, 给予恰当的治疗方案.
总之, FS诊断肝纤维化分级的准确性良好, 尤其对诊断肝硬化. 不论是CHC或CHB, FS诊断肝纤维化分级的准确性无明显差别.
在我国, 慢性病毒性肝炎是导致肝纤维化和肝硬化的最重要原因, 尤其以慢性乙型肝炎为主, 肝纤维化分级评估是决定是否行抗病毒治疗、是否需密切监测肝硬化相关并发症的重要参考. 因此临床上需要定期监测肝纤维化情况以评估病情和决定治疗方案.
吴君, 主任医师, 贵阳医学院附属医院感染科
目前肝穿刺活检仍被视为诊断肝纤维化分级的"金标准", 但其属于创伤性检查和存在发生并发症的风险, 不能为广大患者接受. Fibroscan可以无创性评估肝纤维化分级, 因其简易的操作性、稳定的重复性和可靠的准确性而得到不断推广使用.
肝脏疾病的病因多种, 慢性肝炎长期发展均导致肝纤维化和肝硬化. 病因不同, 发生肝纤维化的时间、肝脏的病理学特征、肝脏的硬度不完全相同, 因此, Fibroscan的诊断界值和诊断准确性不完全相同. Fibroscan在诊断慢性酒精性肝病、慢性非酒精性脂肪性肝病、原发性胆汁性肝硬化等疾病的研究均有报道.
通过诊断性Meta分析方法研究Fibroscan诊断肝纤维化分级的准确性, 并且进一步的研究发现Fibroscan的准确性在慢性丙型肝炎或慢性乙型肝炎无明显差别.
Fibroscan测量肝组织硬度, 具有无创性、简易的操作性、稳定的重复性和可靠的准确性, 简便且有效地监测肝纤维化情况以评估病情和决定治疗方案.
本文应用Meta分析方法对近年来国内外发表"Fibroscan诊断慢性病毒性肝炎肝纤维化(≥F2)的准确性"的相关文献进行评价, 选题热门, 分析结果有一定的学术价值和临床指导意义.
编辑: 郭鹏 电编:鲁亚静
| 1. | Bravo AA, Sheth SG, Chopra S. Liver biopsy. N Engl J Med. 2001;344:495-500. [PubMed] [DOI] |
| 2. | Colloredo G, Guido M, Sonzogni A, Leandro G. Impact of liver biopsy size on histological evaluation of chronic viral hepatitis: the smaller the sample, the milder the disease. J Hepatol. 2003;39:239-244. [PubMed] [DOI] |
| 3. | Sandrin L, Fourquet B, Hasquenoph JM, Yon S, Fournier C, Mal F, Christidis C, Ziol M, Poulet B, Kazemi F. Transient elastography: a new noninvasive method for assessment of hepatic fibrosis. Ultrasound Med Biol. 2003;29:1705-1713. [PubMed] [DOI] |
| 4. | Alberti A, Chemello L, Benvegnù L. Natural history of hepatitis C. J Hepatol. 1999;31 Suppl 1:17-24. [PubMed] [DOI] |
| 5. | McMahon BJ. The natural history of chronic hepatitis B virus infection. Hepatology. 2009;49:S45-S55. [PubMed] [DOI] |
| 6. | Bedossa P, Poynard T. An algorithm for the grading of activity in chronic hepatitis C. The METAVIR Cooperative Study Group. Hepatology. 1996;24:289-293. [PubMed] [DOI] |
| 7. | Whiting P, Rutjes AW, Reitsma JB, Bossuyt PM, Kleijnen J. The development of QUADAS: a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews. BMC Med Res Methodol. 2003;3:25. [PubMed] [DOI] |
| 8. | Whiting PF, Weswood ME, Rutjes AW, Reitsma JB, Bossuyt PN, Kleijnen J. Evaluation of QUADAS, a tool for the quality assessment of diagnostic accuracy studies. BMC Med Res Methodol. 2006;6:9. [PubMed] [DOI] |
| 9. | Ziol M, Handra-Luca A, Kettaneh A, Christidis C, Mal F, Kazemi F, de Lédinghen V, Marcellin P, Dhumeaux D, Trinchet JC. Noninvasive assessment of liver fibrosis by measurement of stiffness in patients with chronic hepatitis C. Hepatology. 2005;41:48-54. [PubMed] [DOI] |
| 10. | Castéra L, Vergniol J, Foucher J, Le Bail B, Chanteloup E, Haaser M, Darriet M, Couzigou P, De Lédinghen V. Prospective comparison of transient elastography, Fibrotest, APRI, and liver biopsy for the assessment of fibrosis in chronic hepatitis C. Gastroenterology. 2005;128:343-350. [PubMed] [DOI] |
| 11. | Colletta C, Smirne C, Fabris C, Toniutto P, Rapetti R, Minisini R, Pirisi M. Value of two noninvasive methods to detect progression of fibrosis among HCV carriers with normal aminotransferases. Hepatology. 2005;42:838-845. [PubMed] [DOI] |
| 12. | Lupşor M, Badea R, Stefănescu H, Grigorescu M, Sparchez Z, Serban A, Branda H, Iancu S, Maniu A. Analysis of histopathological changes that influence liver stiffness in chronic hepatitis C. Results from a cohort of 324 patients. J Gastrointestin Liver Dis. 2008;17:155-163. [PubMed] |
| 13. | Masuzaki R, Tateishi R, Yoshida H, Goto E, Sato T, Ohki T, Goto T, Yoshida H, Kanai F, Sugioka Y. Comparison of liver biopsy and transient elastography based on clinical relevance. Can J Gastroenterol. 2008;22:753-757. [PubMed] |
| 14. | Sporea I, Sirli R, Deleanu A, Tudora A, Curescu M, Cornianu M, Lazar D. Comparison of the liver stiffness measurement by transient elastography with the liver biopsy. World J Gastroenterol. 2008;14:6513-6517. [PubMed] [DOI] |
| 15. | Arena U, Vizzutti F, Abraldes JG, Corti G, Stasi C, Moscarella S, Milani S, Lorefice E, Petrarca A, Romanelli RG. Reliability of transient elastography for the diagnosis of advanced fibrosis in chronic hepatitis C. Gut. 2008;57:1288-1293. [PubMed] [DOI] |
| 16. | Lupsor M, Badea R, Stefanescu H, Sparchez Z, Branda H, Serban A, Maniu A. Performance of a new elastographic method (ARFI technology) compared to unidimensional transient elastography in the noninvasive assessment of chronic hepatitis C. Preliminary results. J Gastrointestin Liver Dis. 2009;18:303-310. [PubMed] |
| 17. | Ichino N, Osakabe K, Nishikawa T, Sugiyama H, Kato M, Kitahara S, Hashimoto S, Kawabe N, Harata M, Nitta Y. A new index for non-invasive assessment of liver fibrosis. World J Gastroenterol. 2010;16:4809-4816. [PubMed] [DOI] |
| 18. | Rizzo L, Calvaruso V, Cacopardo B, Alessi N, Attanasio M, Petta S, Fatuzzo F, Montineri A, Mazzola A, L'abbate L. Comparison of transient elastography and acoustic radiation force impulse for non-invasive staging of liver fibrosis in patients with chronic hepatitis C. Am J Gastroenterol. 2011;106:2112-2120. [PubMed] [DOI] |
| 19. | Patel K, Friedrich-Rust M, Lurie Y, Grigorescu M, Stanciu C, Lee CM, Schiff ER, Häussinger D, Manns MP, Gerken G. FibroSURE and FibroScan in relation to treatment response in chronic hepatitis C virus. World J Gastroenterol. 2011;17:4581-4589. [PubMed] [DOI] |
| 20. | Cho HJ, Seo YS, Lee KG, Hyun JJ, An H, Keum B, Kim JH, Yim HJ, Jeen YT, Lee HS. Serum aminotransferase levels instead of etiology affects the accuracy of transient elastography in chronic viral hepatitis patients. J Gastroenterol Hepatol. 2011;26:492-500. [PubMed] [DOI] |
| 21. | Kim SU, Jang HW, Cheong JY, Kim JK, Lee MH, Kim DJ, Yang JM, Cho SW, Lee KS, Choi EH. The usefulness of liver stiffness measurement using FibroScan in chronic hepatitis C in South Korea: a multicenter, prospective study. J Gastroenterol Hepatol. 2011;26:171-178. [PubMed] [DOI] |
| 22. | Ferraioli G, Tinelli C, Dal Bello B, Zicchetti M, Lissandrin R, Filice G, Filice C, Above E, Barbarini G, Brunetti E. Performance of liver stiffness measurements by transient elastography in chronic hepatitis. World J Gastroenterol. 2013;19:49-56. [PubMed] [DOI] |
| 23. | Bosselut N, Taibi L, Guéchot J, Zarski JP, Sturm N, Gelineau MC, Poggi B, Thoret S, Lasnier E, Baudin B. Including osteoprotegerin and collagen IV in a score-based blood test for liver fibrosis increases diagnostic accuracy. Clin Chim Acta. 2013;415:63-68. [PubMed] [DOI] |
| 24. | Chan HL, Wong GL, Choi PC, Chan AW, Chim AM, Yiu KK, Chan FK, Sung JJ, Wong VW. Alanine aminotransferase-based algorithms of liver stiffness measurement by transient elastography (Fibroscan) for liver fibrosis in chronic hepatitis B. J Viral Hepat. 2009;16:36-44. [PubMed] [DOI] |
| 25. | Kim do Y, Kim SU, Ahn SH, Park JY, Lee JM, Park YN, Yoon KT, Paik YH, Lee KS, Chon CY. Usefulness of FibroScan for detection of early compensated liver cirrhosis in chronic hepatitis B. Dig Dis Sci. 2009;54:1758-1763. [PubMed] [DOI] |
| 26. | Lesmana CR, Salim S, Hasan I, Sulaiman AS, Gani RA, Pakasi LS, Lesmana LA, Krisnuhoni E, Budihusodo U. Diagnostic accuracy of transient elastography (FibroScan) versus the aspartate transaminase to platelet ratio index in assessing liver fibrosis in chronic hepatitis B: the role in primary care setting. J Clin Pathol. 2011;64:916-920. [PubMed] [DOI] |
| 27. | Viganò M, Paggi S, Lampertico P, Fraquelli M, Massironi S, Ronchi G, Rigamonti C, Conte D, Colombo M. Dual cut-off transient elastography to assess liver fibrosis in chronic hepatitis B: a cohort study with internal validation. Aliment Pharmacol Ther. 2011;34:353-362. [PubMed] [DOI] |
| 28. | Ogawa E, Furusyo N, Murata M, Ohnishi H, Toyoda K, Taniai H, Ihara T, Ikezaki H, Hayashi T, Kainuma M. Longitudinal assessment of liver stiffness by transient elastography for chronic hepatitis B patients treated with nucleoside analog. Hepatol Res. 2011;41:1178-1188. [PubMed] [DOI] |
| 29. | Zhu X, Wang LC, Chen EQ, Chen XB, Chen LY, Liu L, Lei XZ, Liu C, Tang H. Prospective evaluation of FibroScan for the diagnosis of hepatic fibrosis compared with liver biopsy/AST platelet ratio index and FIB-4 in patients with chronic HBV infection. Dig Dis Sci. 2011;56:2742-2749. [PubMed] [DOI] |
| 30. | 纪 冬, 邵 清, 韩 萍, 张 健, 牛 小霞, 李 冰, 李 梵, 陈 国凤. 瞬时弹性成像联合血清学标志物检测对肝纤维化的诊断效能分析. 解放军医学杂志. 2011;36:1136-1138. |
| 32. | Kim BK, Kim HS, Park JY, Kim do Y, Ahn SH, Chon CY, Park YN, Han KH, Kim SU. Prospective validation of ELF test in comparison with Fibroscan and FibroTest to predict liver fibrosis in Asian subjects with chronic hepatitis B. PLoS One. 2012;7:e41964. [PubMed] [DOI] |
| 33. | Kim BK, Kim SU, Kim HS, Park JY, Ahn SH, Chon CY, Cho IR, Joh DH, Park YN, Han KH. Prospective validation of FibroTest in comparison with liver stiffness for predicting liver fibrosis in Asian subjects with chronic hepatitis B. PLoS One. 2012;7:e35825. [PubMed] [DOI] |
| 34. | 李 建志, 李 洁, 熊 春梅, 张 梅芳, 郑 雪, 张 灵云, 张 国全, 孙 爱华, 单 容. Fibroscan测定与超声影像学检查在诊断慢性乙肝相关肝纤维化中的价值. 山东大学学报(医学版). 2012;50:115-118. |
| 35. | Sporea I, Sirli R, Popescu A, Danilă M. Acoustic Radiation Force Impulse (ARFI)--a new modality for the evaluation of liver fibrosis. Med Ultrason. 2010;12:26-31. [PubMed] |
| 36. | Lee MH, Cheong JY, Um SH, Seo YS, Kim DJ, Hwang SG, Yang JM, Han KH, Cho SW. Comparison of surrogate serum markers and transient elastography (Fibroscan) for assessing cirrhosis in patients with chronic viral hepatitis. Dig Dis Sci. 2010;55:3552-3560. [PubMed] [DOI] |
| 37. | Strader DB, Wright T, Thomas DL, Seeff LB. Diagnosis, management, and treatment of hepatitis C. Hepatology. 2004;39:1147-1171. [PubMed] [DOI] |
| 38. | Nahon P, Kettaneh A, Tengher-Barna I, Ziol M, de Lédinghen V, Douvin C, Marcellin P, Ganne-Carrié N, Trinchet JC, Beaugrand M. Assessment of liver fibrosis using transient elastography in patients with alcoholic liver disease. J Hepatol. 2008;49:1062-1068. [PubMed] [DOI] |
| 39. | Yoneda M, Yoneda M, Mawatari H, Fujita K, Endo H, Iida H, Nozaki Y, Yonemitsu K, Higurashi T, Takahashi H. Noninvasive assessment of liver fibrosis by measurement of stiffness in patients with nonalcoholic fatty liver disease (NAFLD). Dig Liver Dis. 2008;40:371-378. [PubMed] [DOI] |
| 40. | Floreani A, Cazzagon N, Martines D, Cavalletto L, Baldo V, Chemello L. Performance and utility of transient elastography and noninvasive markers of liver fibrosis in primary biliary cirrhosis. Dig Liver Dis. 2011;43:887-892. [PubMed] [DOI] |
| 41. | Das K, Sarkar R, Ahmed SM, Mridha AR, Mukherjee PS, Das K, Dhali GK, Santra A, Chowdhury A. "Normal" liver stiffness measure (LSM) values are higher in both lean and obese individuals: a population-based study from a developing country. Hepatology. 2012;55:584-593. [PubMed] [DOI] |
| 42. | Fraquelli M, Rigamonti C, Casazza G, Donato MF, Ronchi G, Conte D, Rumi M, Lampertico P, Colombo M. Etiology-related determinants of liver stiffness values in chronic viral hepatitis B or C. J Hepatol. 2011;54:621-628. [PubMed] [DOI] |
| 43. | Chen XB, Zhu X, Chen LY, Chen EQ, Tang H. [Accuracy of FibroScan for the diagnosis of liver fibrosis influenced by serum alanine aminotransferase levels in patients with chronic hepatitis B]. Zhonghua Ganzangbing Zazhi. 2011;19:286-290. [PubMed] |