修回日期: 2013-09-12
接受日期: 2013-10-20
在线出版日期: 2013-11-28
目的: 观察锯齿状病变组织中CDX2基因甲基化状态和CDX2蛋白表达, 探讨临床病理意义和在癌变通路中的作用, 同时探讨CDX2基因在不同年龄层段甲基化状况.
方法: 应用Taqman探针qPCR(MethyLight)方法检测实验组225例锯齿状病变(包括96例增生性息肉(hyperplastic polyp, HP)、61例广基(无蒂)锯齿状腺瘤/息肉(sessile serrated adenoma/polyp, SSA/P)和68例传统型锯齿状腺瘤(traditional serrated adenoma, TSA)、对照组54例管状腺瘤(tubular adenoma, TA)、69例结直肠癌(colorectal cancer, CRC)和42例正常组织中CDX2基因CpG岛甲基化状态, 并通过测序法验证扩增序列, 同时应用免疫组织化学方法检测实验组116例锯齿状病变(包括52例HP、41例SSA/P、23例TSA)、对照组20例TA、24例CRC和24例正常组织中CDX2蛋白的表达情况.
结果: CDX2基因启动子甲基化率在对照组正常组织与实验组HP(P = 0.019)、SSA/P(P = 0.015)和TSA(P = 0.002), 对照组CRC与实验组HP(P = 0.000)、SSA/P(P = 0.000)和TSA(P = 0.000), 对照组TA与实验组TSA(P = 0.027)均有显著性差异; CDX2蛋白阳性率在对照组CRC与实验组HP(P = 0.001), 对照组TA与实验组HP(P = 0.005), 实验组HP和TSA(P = 0.038)均有显著性差异; CDX2基因启动子甲基化率和CDX2蛋白阳性率的相关性比较中, 实验组HP、SSA/P和TSA中P = 0.652, r = -0.064(极弱相关); P = 0.238, r = -0.182(极弱相关); P = 0.519, r = -0.142(极弱相关), 但两者有负相关趋势; CDX2基因启动子甲基化频率和不同年龄层段相关性比较实验组HP、SSA/P和TSA中P = 0.002, r = 0.312(弱相关); P = 0.000, r = 0.473(中等程度相关); P = 0.001, r = 0.392(弱相关), 对照组TA中P = 0.001, r = 0.440(中等程度相关).
结论: 组织中CDX2基因启动子中上游区域甲基化状态比较复杂, 极少部分甲基化状态可能有诱导CDX2蛋白表达下调, 在锯齿状通路的发生发展中影响作用也甚微; 大部分甲基化可能随着年龄增加而逐渐增加.
核心提示: Caudal type homeobox transcription factor 2(CDX2)基因启动子中上游区域甲基化状态比较复杂, 大部分甲基化可能随着年龄增加而逐渐增加.
引文著录: 许春伟, 王鲁平, 葛畅, 张玉萍, 方园. 锯齿状病变患者组织中CDX2基因启动子中上游区域的甲基化. 世界华人消化杂志 2013; 21(33): 3661-3669
Revised: September 12, 2013
Accepted: October 20, 2013
Published online: November 28, 2013
AIM: To detect CDX2 gene methylation status and CDX2 protein expression in serrated lesions to explore their clinical significance and role in carcinogenesis.
METHODS: Taqman probe qPCR (MethyLight) was used to detect CDX2 gene CpG island methylation status in 225 cases of serrated lesions (including 96 cases of hyperplastic polyps, 61 cases of sessile serrated adenomas/polyps, and 68 cases of traditional serrated adenomas), 54 cases of tubular adenomas, 69 cases of colorectal cancer, and 42 cases of normal colorectal mucosa tissue. The amplified sequences were verified by direct sequencing. Immunohistochemistry was used to detect CDX2 protein expression in 116 cases of serrated lesions (including 52 cases of hyperplastic polyps, 41 cases of sessile serrated adenomas/polyps, and 23 cases of traditional serrated adenomas), 20 cases of tubular adenomas, 24 cases of colorectal cancer, and 24 cases of normal colorectal mucosa tissue.
RESULTS: The rates of CDX2 promoter methylation differed significantly between normal colorectal mucosa tissue and hyperplastic polyps (P = 0.019), sessile serrated adenomas/polyps (P = 0.015), and traditional serrated adenomas (P = 0.002), between colorectal cancer and hyperplastic polyps (P = 0.000), sessile serrated adenomas/polyps (P = 0.000) and traditional serrated adenomas (P = 0.000), and between tubular adenomas and traditional serrated adenomas (P = 0.027). The positive rates of CDX2 protein differed significantly between colorectal cancer and hyperplastic polyps (P = 0.001), between tubular adenomas and hyperplastic polyps (P = 0.005), and between hyperplastic polyps and traditional serrated adenomas (P = 0.038). The rate of CDX2 promoter methylation and CDX2 protein expression had weak negative correlations among hyperplastic polyps (P = 0.652, r = -0.064), sessile serrated adenomas/polyps (P = 0.238, r = -0.182) and traditional serrated adenomas (P = 0.519, r = -0.142). The rate of CDX2 gene promoter methylation was positively correlated with age in hyperplastic polyps (P = 0.002, r = 0.312), sessile serrated adenomas/polyps (P = 0.000, r = 0.473), traditional serrated adenomas (P = 0.001, r = 0.392), and tubular adenoma (P = 0.001, r = 0.440).
CONCLUSION: CDX2 upstream promoter methylation status is complicated, and CDX2 protein expression is little affected by CDX2 upstream promoter methylation in serrated lesions. The rate of CDX2 upstream promoter methylation in serrated lesions gradually increases as the age increases.
- Citation: Xu CW, Wang LP, Ge C, Zhang YP, Fang Y. CDX2 upstream promoter methylation status in serrated lesions. Shijie Huaren Xiaohua Zazhi 2013; 21(33): 3661-3669
- URL: https://www.wjgnet.com/1009-3079/full/v21/i33/3661.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v21.i33.3661
目前结直肠癌(colorectal cancer, CRC)已成为严重威胁人民健康的常见病和多发病, CRC在全球处于恶性肿瘤发病率第3位, 在我国目前处于第5位, 且发病率呈逐年上升趋势[1]. 锯齿状病变是一组具有锯齿状结构的异质性上皮病变. 包括增生性息肉(hyperplastic polyp, HP)、广基(无蒂)锯齿状腺瘤/息肉(sessile serrated adenoma/polyp, SSA/P)、传统型锯齿状腺瘤(traditional serrated adenoma, TSA). 锯齿状病变通过"增生性息肉-锯齿状腺瘤-癌"这条锯齿状通路恶变成癌, 近年来越来越受国内外医学研究工作者的关注. 新近研究发现, CRC中60%的来自普通腺瘤, 35%来自"增生性息肉-锯齿状腺瘤-癌"这条锯齿状通路[2]. 特别是锯齿状病变的CpG岛甲基化表型(CpG island methylator phenotyp, CIMP). 锯齿状通路涉及一系列异常的表观遗传学改变[3]. 这些异常改变中以DNA甲基化最常见. DNA异常甲基化分为A型和C型, 前者与年龄因素有关, 年龄越大, 甲基化频率越高, 后者与肿瘤相关, 通过引起相关基因表达下调或沉默, 促进肿瘤的发生发展[4].
CDX2(caudal type homeobox transcription factor 2)是胃肠胚胎遗传通路中一种新发现的特异性的核转录因子, 是尾型同源框基因家族中的一员, 其基因及相关蛋白最早由Mlodzik等[5]于1987年从果蝇中分离成功. 他与Parahox家族呈高度的同源性, 基因定位于人类染色体13号长臂1区2和3带(13q12-13). CDX2蛋白在胃肠胚胎遗传通路中发挥重要作用[6]. 目前关于CDX2基因的研究主要是在胃癌及胃肠化生方面, 关于CDX2基因在锯齿状病变的研究甚少, 尤其是甲基化方面的研究. 本研究通过MethyLight方法一方面分析锯齿状病变中CDX2基因启动子区CpG岛甲基化和免疫组织化学中CDX2蛋白的表达情况, 在基因层面和蛋白层面对CDX2进行初步探究; 另一方面分析锯齿状病变中CDX2基因启动子区CpG岛甲基化和年龄相关因素情况, 在甲基化和年龄上对CDX2进行初步探究.
收集北京军区总医院2007-2013年病理诊断为各类结直肠息肉和腺瘤切片4810例, 从中筛选出腺体具有锯齿状特征的息肉及腺瘤, 进行组织学诊断及分类. 由3名病理医师按WHO(2010)消化系肿瘤分类及文献标准[7-11]4-5轮回顾性阅片. 从中筛选出225例锯齿状病变(96例HP、61例SSA/P和68例TSA)作为实验组, 同时收集54例管状腺瘤(tubular adenoma, TA)、42例正常组织和69例CRC作为对照组, 并收集相关临床及内窥镜资料. DNA提取试剂盒购自德国QIAGEN公司; 甲基化修饰试剂盒为美国ZYMO公司产品; 核酸蛋白质浓度测量仪B-500购自上海创萌生物科技有限公司; 甲基化阳性/阴性对照为美国ZYMO公司产品; qPCR反应试剂ROX购自TaKaRa公司; Mix购自上海辉睿生物科技有限公司; CDX2抗体购自中杉金桥公司(1:500稀释); 内参基因β-肌动蛋白(β-actin)引物和探针参照文献[12]设计, 其引物序列上游引物: 5'-TGGTCATCCAGGTTTAGTAACT-3', 下游引物: 5'-AACCAATAAACCTACTCCTCCCTTAA-3', 探针: FAM 5'-ACCACCACCCAACACACAATAACAAACACA-3' BHQ1. 甲基化引物和探针由上海辉睿生物科技有限公司合成. Mx3000P定量PCR扩增仪为美国Stratagene公司产品.
1.2.1 甲基化引物和探针设计:CDX2基因序列参照GenBank(http: //http://www.ncbi.nlm.nih.gov), GenBank Accession: NC_000013. 甲基化引物和探针由Beacon Designer7.9软件设计, 其引物序列上游引物: 5'-AAACTACGCACTACTCTAAACGAAA-3'; 下游引物: 5'-GTAGTTATAGTTTGGCGGGGTTTG-3'; 探针: FAM 5'-CGACAACCTACGCCTAACCGACCTC-3' BHQ1. 设计标准: 引物扩增片段在80-150 bp, 引物长度17-25 bp, GC含量在40%-70%, 两条引物的Tm值尽量接近. 避免引物内部或之间形成3 bp以上的互补序列. 探针长度20-30 bp, 探针的Tm值比引物高5 ℃-10 ℃, 探针内标或探针与引物之间避免形成3 bp以上的互补序列, 对其进行BLAST检查, 引物和探针符合要求, 并由上海辉睿生物科技有限公司合成.
1.2.2 DNA提取: 采用QIAamp DNA FFPE Tissue Kit试剂盒提取组织DNA, 将含有DNA组织的蜡块连切5张10 μm的厚蜡膜, 严格按照试剂盒说明步骤进行操作. 并测定其纯度和浓度备用.
1.2.3 甲基化修饰: 采用EZ DNA Methylation-GoldTM Kit(D5005)试剂盒, 严格按照试剂盒说明步骤进行操作. 经此步后, DNA序列中未甲基化的胞嘧啶(C)转变为尿嘧啶(U).
1.2.4 MethyLight: PCR反应体系(20 μL): 2×Taq PCR Master Mix 10 μL; 修饰后的DNA模板2 μL; 上、下游引物各1 μL(10 pmol); 探针FAM 0.4 μL(10 pmol); ROX 0.3 μL. 反应条件: 94 ℃预变性5 min; 94 ℃ 30 s, 56 ℃ 45 s, 72 ℃ 45 s, 共50个循环; 72 ℃延伸5 min, 4 ℃冷却5 min. 每例标本设两个复孔, 经亚硫酸氢盐修饰的Human Methylated & Non-methylated DNA Set作为阳性、阴性对照, 水为空白对照.
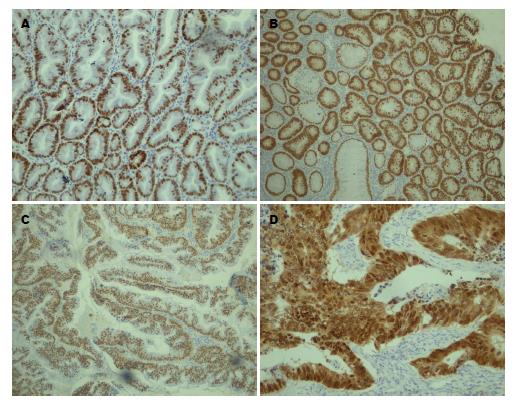
1.2.5 免疫组织化学染色: 所有标本常规石蜡包埋, 4 μm厚连续切片, 60 ℃温箱烘烤90 min. 采用EnVision二步法, 实验过程严格按照试剂盒说明书进行, 高温高压抗原修复, DAB显色, PBS代替一抗为阴性对照, 已知阳性的结肠腺体组织为阳性对照.
1.2.6 结果判断标准: MethyLight结果判断标准[13]: 同时扩增目的基因(CDX2)和内参基因(β-actin), 根据标准曲线得到两者的原始拷贝数, 计算标准甲基化指数(the normalized index of methylation, NIM)其定义为: NIM = [(CDX2 sample/CDX2 positive)/β-actin sample/β-actin positive)]×100, 其中CDX2 sample指样本中甲基化CDX2基因的拷贝数, CDX2 positive指阳性对照中甲基化CDX2基因的拷贝数, β-actin sample和β-actin positive与上述相同. NIM≥4为甲基化, NIM<4为非甲基化. 免疫组织化学判断标准: CDX2阳性定位于细胞核; 标记指数计算方法[14]: 每张切片低倍镜下选择组织结构良好、比较清晰的5个阳性细胞最为密集的区域, 每个区域在高倍镜下, 计数100个细胞中的阳性细胞指数(不包括间质细胞和其他非肿瘤细胞), 计算阳性细胞数平均值的百分率. 标记指数计分: Ⅰ级10%-25%为1分, Ⅱ级26%-50%为2分, Ⅲ级51%-75%为3分, Ⅳ级76%-100%为4分. 染色强度计分: Ⅰ级淡黄色为1分, Ⅱ级棕黄色为2分, Ⅲ级棕褐色为3分. 每张切片两种评分之乘积为该切片最后的表达强度: 1-3分为(+), 4-6分为(++), ≥8分为(+++).
统计学处理 所有数据采用SPSS19.0统计软件, 甲基化结果和免疫组织化学结果运用χ2及Fisher确切概率法, 两组间比较运用Bonferroni检验, 甲基化和蛋白表达相关性及甲基化和年龄相关性运用Pearson相关法进行统计学处理, 检验水准α = 0.05, 并设定P值为双侧分布, P<0.05为差异有统计学意义.
225例锯齿状病变中HP 96例、SSA/P 61例、TSA 68例, 分别占锯齿状病变的42.67%, 27.11%和30.22%. 96例HP中, 男性63例, 女性33例, 男性多见, 年龄31-88岁, 平均年龄56.052岁±12.448岁; 61例SSA/P中, 男性43例, 女性18例, 男性多见, 年龄23-84岁, 平均年龄56.665岁±14.976岁; 68例TSA中, 男性46例, 女性22例, 男性多见, 年龄30-85岁, 平均年龄59.470岁±12.506岁.
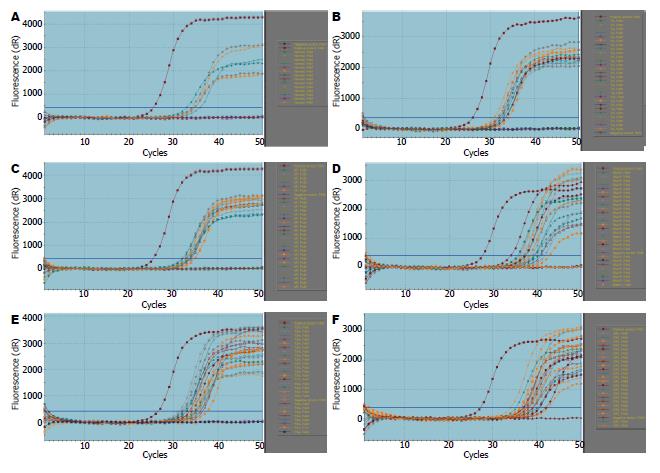
将阳性对照按10的倍数稀释成1-1×10-6 7个浓度梯度制作标准曲线(其拷贝数为103-109/mL), 各浓度梯度反应均做复孔. MethyLight的线性范围为104-108拷贝/mL, R2为0.942.
CDX2基因启动子CpG岛甲基化率在正常、TA、HP、SSA/P、TSA和CRC分别为53.38%(22/42)、62.96%(34/54)、72.97%(70/96)、80.88%(55/68)、75.41%(46/61)和100%(69/69). 实验组HP和对照组正常、CRC之间有显著性差异(P<0.05), 实验组HP和对照组TA之间差异不显著(P>0.05); 实验组HP和实验组SSA/P及TSA之间差异不显著(P>0.05); 实验组SSA/P和对照组正常、CRC之间有显著性差异(P<0.05), 实验组SSA/P和实验组HP、TSA及对照组TA之间差异不显著(P>0.05); 实验组TSA与对照组正常、TA、CRC之间有显著性差异(P<0.05), 与实验组HP、SSA/P之间差异不显著(P>0.05)(表1, 图1).
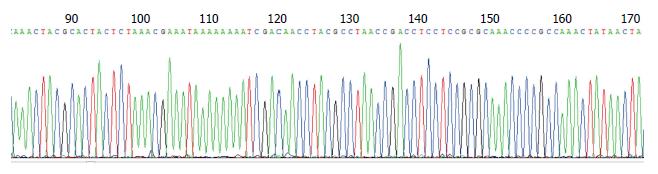
PCR扩增产物送北京金唯智生物科技有限公司测序, 由于扩增序列(91 bp)过小, 连接到质粒作为载体后, 用通用引物的方法测序, 比对测序目的片段和Beacon Designer 7.9软件设计序列吻合(图2).
CDX2蛋白阳性表达率在正常、TA、HP、SSA/P 、TSA 和CRC分别为100%(24/24)、75.00%(15/20)、98.07%(51/52)、87.80%(36/41)、82.61%(19/23)和70.83%(17/24). 实验组HP与对照组TA、CRC和实验组TSA之间有显著性差异(P<0.05), 与对照组正常和实验组SSA/P差异性不显著(P>0.05); 实验组SSA/P与对照组正常、TA、CRC和实验组HP、TSA差异性不显著(P>0.05); 实验组TSA与对照组正常、TA、CRC和实验组HP、TSA差异性不显著(P>0.05)(表2, 图3).
经统计学分析显示: HP、SSA/P、TSA四组中CDX2甲基化与CDX2蛋白表达结果差异不显著(P>0.05), 但有负相关趋势, 相关系数分别为r = -0.064、r = -0.182、r = -0.142(表3).
| 类型 | HP | SSA/P | TSA | |||||||
| CDX2 | 合计 | CDX2 | 合计 | CDX2 | 合计 | |||||
| (+)-(+++) | (-)-(-/+) | (+)-(+++) | (-)-(-/+) | (+)-(+++) | (-)-(-/+) | |||||
| CDX2 | 甲基化 | 42 | 1 | 43 | 30 | 5 | 35 | 17 | 4 | 21 |
| 非甲基化 | 9 | 0 | 9 | 6 | 0 | 6 | 2 | 0 | 2 | |
| 合计 | 51 | 1 | 52 | 36 | 5 | 41 | 19 | 4 | 23 | |
| P、r值 | P = 0.652, r = -0.064 | P = 0.238, r = -0.182 | P = 0.519, r = -0.142 | |||||||
经统计学分析显示: TA、HP、SSA/P、TSA 4组中CDX2基因甲基化与年龄差异均显著(P<0.01). 年龄20-40岁组甲基化率稳定在20%-40%之间, 年龄41-60岁组甲基化率稳定在70%-80%之间, 年龄超过60岁组甲基化率稳定在80%以上. CDX2基因甲基化与年龄相关性为正相关, 与TA、HP、SSA/P、TSA相关系数分别为r = 0.440、r = 0.312、r = 0.473、r = 0.392(表4-7).
| 分组 | n | 甲基化 | 非甲基化 | 甲基化率(%) |
| 年龄(岁) | ||||
| 20-40 | 8 | 2 | 6 | 25.00 |
| 41-60 | 54 | 39 | 15 | 72.22 |
| ≥61 | 34 | 29 | 5 | 85.29 |
| P、r值 | P = 0.002, r = 0.312 | |||
| 分组 | n | 甲基化 | 非甲基化 | 甲基化率(%) |
| 年龄(岁) | ||||
| 20-40 | 3 | 0 | 6 | 0.00 |
| 41-60 | 27 | 14 | 13 | 51.85 |
| ≥61 | 24 | 20 | 4 | 83.33 |
| P、r值 | P = 0.001, r = 0.440 | |||
| 分组 | n | 甲基化 | 非甲基化 | 甲基化率(%) |
| 年龄(岁) | ||||
| 20-40 | 9 | 2 | 7 | 22.22 |
| 41-60 | 23 | 18 | 5 | 78.26 |
| ≥61 | 29 | 26 | 3 | 89.66 |
| P、r值 | P = 0.000, r = 0.473 | |||
| 分组 | n | 甲基化 | 非甲基化 | 甲基化率(%) |
| 年龄(岁) | ||||
| 20-40 | 8 | 3 | 5 | 37.50 |
| 41-60 | 19 | 15 | 4 | 78.95 |
| ≥61 | 41 | 37 | 4 | 90.24 |
| P、r值 | P = 0.001, r = 0.392 | |||
CRC是最常见的消化系恶性肿瘤之一, 全球CRC每年新发病例数达123万例, 死亡约为发病率的1/2. 近年研究表明, CRC发病率目前仍呈持续增长态势, 其原因之一就是对结直肠锯齿状病变认识不足[3,15]. 2010年WHO消化系肿瘤病理学和遗传学分类中对锯齿状病变的分类比以往更为详细[7], HP在锯齿状病变中最常见, 占所有病变的75%以上, 根据组织学上黏液的不同分为微泡型增生性息肉(microvesicular hyperplastic polyp, MVHP)、富于杯状细胞型增生性息肉(goblet-cell rich hyperplastic polyp, GCHP)、黏液缺乏型增生性息肉(mucin-poor type, MPHP)[16]. SSA/P占锯齿状病变的15%-25%, 根据细胞异型性分为伴/不伴有细胞异型增生[16-18]. TSA不常见, 占锯齿状病变的1%左右, 特征为具有整体复杂结构与纤维状生长方式, 常显示细胞异型特点, 与TA及伴细胞异型的SSA不同[16,19]. TSA一般与高MSI癌无关, 可能与低MSI有关[10]. 近年来从分子遗传学角度对锯齿状病变进行研究发现, 结直肠锯齿状病变通路是一个多因素、多阶段、多基因连续累积发生的过程, 在此演变过程中有众多CRC相关基因参与, 具体的发病机制迄今未完全明了. 但这些基因发生的甲基化、基因杂合子丢失(loss of heterozygosity, LOH)等异常改变导致锯齿状病变的发生发展[20-22]. 锯齿状通路中有众多异常基因甲基化, 若能深入研究并加以利用, 不仅可以用于CRC的早期诊断、高危人群的监测、癌变风险评估等, 还可为CRC靶向治疗药物提供理论依据支持[2,23].
本实验研究中发现正常组织、TA、HP、SSA/P、TSA和CRC中均有CDX2基因启动子CpG岛中上游区域的甲基化, 实验组锯齿状病变HP、SSA/P和TSA甲基化率为72.97%(70/96)、75.41%(46/61)和80.88%(55/68), 对照组正常组织、TA和CRC的甲基化率为53.38(22/42)、62.96%(34/54)和100%(69/69), 经统计学处理有显著性差异. Dhir等[23]在18例TA中检测到甲基化率为52.9%, 29例不伴异型性的SSA/P中检测到甲基化率为66.67%, 19例伴有异型性的SSA/P中检测到甲基化率为73.68%, 但在9例HP中未检测到甲基化, 我们研究中对照组的TA和实验组的SSA/P的甲基化率与以上研究结果基本符合, 但实验组HP的甲基化率72.97%, 与以上研究结果出入较大, 可能与样本量、样本来源、引物在CpG岛的位置不同等因素有关. 本研究对照组与实验组组间比较过程中, 对照组正常组织与实验组HP(P = 0.019)、SSA/P(P = 0.015)和TSA(P = 0.002)有显著性差异, 对照组CRC与实验组HP(P = 0.000)、SSA/P(P = 0.000)和TSA(P = 0.000)有显著性差异, 对照组TA与实验组TSA(P = 0.027)有显著性差异, 与实验组HP(P = 0.204)和SSA/P(P = 0.148)差异性均不显著; 实验组与实验组组间比较过程中, HP和SSA/P(P = 0.729), HP和TSA(P = 0.238)及SSA/P和TSA(P = 0.452)组间差异性均不显著.
运用免疫组织化学方法研究中发现实验组HP、SSA/P和TSA蛋白表达阳性率为98.08%(51/52)、87.80%(36/41)和82.61%(19/23), 对照组正常组织、TA和CRC中蛋白表达阳性率为100%(24/24)、75.00%(15/20)和70.83%(17/24). 与Mochizuka等[24]对15例HP, 29例SSA/P, 12例TSA和16例TA结果不符, 在本实验中HP和SSA/P表达明显高于TSA和TA, 具体原因可能与样本量、样本来源等因素有关. 本研究对照组与实验组组间比较过程中, 对照组正常组织与实验组HP(P = 1.000)、SSA/P(P = 0.194)和TSA(P = 0.104)差异性不显著, 对照组CRC与实验组HP(P = 0.001)有显著性差异, 但SSA/P(P = 0.089)和TSA(P = 0.341)差异性不显著, 对照组TA与实验组HP(P = 0.005)有显著性差异, 但与实验组SSA/P(P = 0.205)和TSA(P = 0.813)差异性均不显著; 实验组与实验组组间比较过程中, HP和TSA(P = 0.038)有显著性差异, 但在HP和SSA/P(P = 0.729)及SSA/P和TSA(P = 0.452)中组间差异性均不显著.
在本实验CDX2基因甲基化与蛋白表达相关性研究中, 我们发现在实验组HP、SSA/P和TSA中P = 0.652, r = -0.064(极弱相关); P = 0.238, r = -0.182(极弱相关); P = 0.519, r = -0.142(极弱相关), TA中P = 0.217, r = -0.289(弱相关). 通过数据我们可以看出无论实验组还是对照组, 基因甲基化和蛋白表达差异性都不是非常显著, 相关性也呈弱相关或极弱相关. 通过基因甲基化和蛋白表达及两者相关性的探究, 我们推测在锯齿状病变通路中CDX2基因启动子中上游区域极少部分甲基化有诱导CDX2蛋白表达下调, 在锯齿状通路的发生发展中影响也甚微.
So等[25]研究人正常的胃上皮细胞中的中p16、RUNX3、TIG1和LOX这4个基因的启动子甲基化状况后发现启动子甲基化与年龄密切相关. Waki等[26]研究来源于小肠、大肠、胃等不同器官或组织的甲基化相关基因如Runx3、E-cadherin、GSTP1、DAP-kinase、p16、h-MLH-1等, 发现在32岁以前的个体中, 其启动子CpG岛几乎不出现甲基化, 但在42岁后, 基因启动子CpG岛均以组织特异性的方式发生不同程度的甲基化. 本实验研究在实验组和对照组32岁以前的个体中均未发现此位点甲基化, 但在42岁以后的个体发现此位点不是每个个体在此区域的位点均发生甲基化, 但随着年龄增高, 此位点甲基化频率增高, 这些都与Waki等得出的结论相符.
另外卢筱洪等[27]通过RT-PCR发现经5'-aza-dC和/或SAHA处理前后, 无论在TC7或HT29结直肠癌细胞株中, CDX2的表达均未发生影响, 认为去甲基化药物5'-aza-dC和/或组蛋白去乙酸化酶抑制剂SAHA均不能刺激CDX2的表达发生变化, 同时观察在甲基饮食缺乏组和正常对照组大鼠大肠组织中, RT-PCR显示CDX2均表达, 且表达无显著性差异, 但两组大鼠大肠组织免疫组织化学染色显示: 甲基饮食缺乏组CDX2表达低于对照组, 最后又Western blot显示, 两组大鼠大肠组织中, 在甲基饮食缺乏组中, 主要表达磷酸化的CDX2蛋白, 而在对照组中, 则以未磷酸化的CDX2蛋白为主. 因此他们得出结论: CDX2的表达不受表遗传修饰(DNA甲基化, 组蛋白乙酰化)的调控, 而可能与转录后调节机制如CDX2蛋白的磷酸化有关. Boulanger等[28]在通过实验发现, CDX2在细胞核中表达, 并通过一定载体运送到胞质中被降解, 而这个过程需要Cdk2(cyclin-dependent kinase 2)和CRM1(chromosome region maintenance 1)等因子的参与. 在Cdk2的诱导CDX2发生磷酸化修饰, 磷酸化修饰后的CDX2表达显著下降, 同时抑制胞质中的CRM1, 激活Cdk2, 结果胞质中CDX2降解, 核输出也逐渐减少. 相反, 激活CRM1, 抑制Cdk2, CDX2表达增加, 核输出也增加. 所以他们认为Cdk2的活性主要受蛋白激酶的负向调控, 但具体机制未明确. Kawai等[29]通过实验也发现, 通过亚硫酸氢纳-限制性酶切法检测出CDX2基因启动子上游的CpG岛序列, 发现上游的CpG岛都已明显甲基化, 但他们与CDX2的表达无关, 而在下游的CpG岛, 虽然只有少数的结直肠癌细胞系有甲基化现象, 但他们却直接与CDX2的表达有关, 即CDX2启动子下游发生甲基化则引起CDX2表达明显下降. 通过MSP发现在原发肠道肿瘤中有40%的病例可出现CDX2的甲基化. 所以我们认为CDX2基因启动子中上游甲基化是否真正起到诱导CDX2蛋白表达降低, 还是磷酸化或其他未知因素才是真正诱导CDX2蛋白表达降低, 这有待进一步探究, 下一步实验我们将在HT-29和Lovo结直肠癌细胞株中通过加入去甲基化抑制剂验证CDX2蛋白是否逆转.
结直肠癌与锯齿状病变关系密切, 锯齿状癌变通路被认为是仅次于APC腺瘤-癌通路的第2条重要癌变通路. 已知结直肠癌有DNA甲基化现象, 但锯齿状病变的DNA甲基化状况尚缺乏系统研究, 许多问题还不清楚, 为了解决这一问题, 本研究拟筛选出锯齿状病变和癌变的(caudal type homeobox transcription factor 2, CDX2)基因甲基化, 为锯齿状病变鉴别诊断, 早期发现癌前病变、预防结直肠癌提供新的生物标志物. 为锯齿状病变分子分型及癌变机制奠定科学理论基础.
赵青川, 教授, 主任医师, 西京医院消化外科
目前关于锯齿状病变甲基化的研究国内未见文献报道, 国外仅报道一篇, 该文运用MSP方法检测一组小样本的锯齿状病变的17个基因甲基化状况, 研究发现发现伴有/和不伴有异型增生的SSA检测到CDX2、h-MLH-1和TLR2基因甲基化, 但增生性息肉(hyperplastic polyp)没有检测到上述基因甲基化, 为后续的大样本验证研究奠定基础.
自21世纪初, 国内王鲁平教授团队在结直肠锯齿状病变研究方面一直处于领先水平. 其团队率先描述了锯齿状病变形态学特点、免疫组织化学特征以及分子生物学改变, 并在国内外首先报告了锯齿状病变中Runx3基因rs2236851位点基因型检测及蛋白表达. DNA甲基化研究是继基因多态性后在锯齿状病变的后续研究. 目前王鲁平教授团队在锯齿状病变研究方面发表中英文论文80余篇.
首次选用一组与结直肠癌甲基化有关的基因, 用于检测根据最新分类的各类结直肠锯齿状病变甲基化状况, 从中筛选出各类病变相关甲基化基因, 为锯齿状病变的诊断及分子分型提供有力的生物标志物, 为锯齿状癌前病变提供预测指标, 为锯齿状甲基化癌变机制及靶向治疗提供理论依据. CDX2是胃肠胚胎遗传通路中一种新发现的特异性的核转录因子, 是尾型同源框基因家族中的一员. 本研究在国内外首次提出CDX2基因甲基化主要与年龄因素有关, 年龄越大, 甲基化频率越高, 其可能是一个年龄相关性甲基化基因.
本文发现CDX2基因在正常组织甲基化率53.38%, 且其和CDX2蛋白阳性率的相关性比较中虽为负相关, 但相关性极弱, 所以笔者认为CDX2基因启动子中上游区域甲基化是否真正起到诱导CDX2蛋白表达降低, 还是磷酸化或其他未知因素才是真正诱导CDX2蛋白表达降低, 这有待进一步探究, 下一步实验我们将在HT-29和Lovo结直肠癌细胞株中通过加入去甲基化抑制剂去验证CDX2蛋白是否逆转.
本文具有一定指导意义.
编辑: 田滢 电编:鲁亚静
| 1. | 赖 少清, 鞠 凤环, 王 贵齐, 王 贵齐, 贺 舜, 倪 晓光, 张 蕾, 于 桂香, 张 月明, 李 晓燕. 2004-2008年704例大肠癌临床流行特征. 中国肿瘤. 2010;19:111-113. |
| 2. | Snover DC. Update on the serrated pathway to colorectal carcinoma. Hum Pathol. 2011;42:1-10. [PubMed] [DOI] |
| 3. | Mäkinen MJ. Colorectal serrated adenocarcinoma. Histopathology. 2007;50:131-150. [PubMed] [DOI] |
| 4. | Jass JR, Whitehall VL, Young J, Leggett BA. Emerging concepts in colorectal neoplasia. Gastroenterology. 2002;123:862-876. [PubMed] |
| 5. | Mlodzik M, Gehring WJ. Expression of the caudal gene in the germ line of Drosophila: formation of an RNA and protein gradient during early embryogenesis. Cell. 1987;48:465-478. [PubMed] |
| 6. | James R, Erler T, Kazenwadel J. Structure of the murine homeobox gene cdx-2. Expression in embryonic and adult intestinal epithelium. J Biol Chem. 1994;269:15229-15237. [PubMed] |
| 7. | HamiltonSR , BosmanFT , BoffettaP . Carcinoma of the colon and rectum. WHO Classification of Tumors of the Digestive System. Pathology and Genetics Tumours and Digestive System. 4th edition. Switzerland: WHO press 2010; 134-146, 160-165. |
| 9. | Torlakovic EE, Gomez JD, Driman DK, Parfitt JR, Wang C, Benerjee T, Snover DC. Sessile serrated adenoma (SSA) vs. traditional serrated adenoma (TSA). Am J Surg Pathol. 2008;32:21-29. [PubMed] [DOI] |
| 10. | East JE, Saunders BP, Jass JR. Sporadic and syndromic hyperplastic polyps and serrated adenomas of the colon: classification, molecular genetics, natural history, and clinical management. Gastroenterol Clin North Am. 2008;37:25-46, v. [PubMed] [DOI] |
| 12. | Ogino S, Kawasaki T, Brahmandam M, Cantor M, Kirkner GJ, Spiegelman D, Makrigiorgos GM, Weisenberger DJ, Laird PW, Loda M. Precision and performance characteristics of bisulfite conversion and real-time PCR (MethyLight) for quantitative DNA methylation analysis. J Mol Diagn. 2006;8:209-217. [PubMed] [DOI] |
| 13. | Eads CA, Lord RV, Kurumboor SK, Wickramasinghe K, Skinner ML, Long TI, Peters JH, DeMeester TR, Danenberg KD, Danenberg PV. Fields of aberrant CpG island hypermethylation in Barrett's esophagus and associated adenocarcinoma. Cancer Res. 2000;60:5021-5026. [PubMed] |
| 15. | 赵 娜, 杨 廷翰, 郝 晋, 蒲 怡, 汪 晓东, 李 立. 高风险结直肠癌患者快速流程模式的临床应用. 中国现代普通外科进展. 2011;14:269-272. |
| 16. | Torlakovic E, Skovlund E, Snover DC, Torlakovic G, Nesland JM. Morphologic reappraisal of serrated colorectal polyps. Am J Surg Pathol. 2003;27:65-81. [PubMed] |
| 17. | Goldstein NS, Bhanot P, Odish E, Hunter S. Hyperplastic-like colon polyps that preceded microsatellite-unstable adenocarcinomas. Am J Clin Pathol. 2003;119:778-796. [PubMed] [DOI] |
| 18. | Spring KJ, Zhao ZZ, Karamatic R, Walsh MD, Whitehall VL, Pike T, Simms LA, Young J, James M, Montgomery GW. High prevalence of sessile serrated adenomas with BRAF mutations: a prospective study of patients undergoing colonoscopy. Gastroenterology. 2006;131:1400-1407. [PubMed] [DOI] |
| 19. | Snover DC, Jass JR, Fenoglio-Preiser C, Batts KP. Serrated polyps of the large intestine: a morphologic and molecular review of an evolving concept. Am J Clin Pathol. 2005;124:380-391. [PubMed] [DOI] |
| 20. | Kaji E, Uraoka T, Kato J, Hiraoka S, Suzuki H, Akita M, Saito S, Tanaka T, Ohara N, Yamamoto K. Externalization of saw-tooth architecture in small serrated polyps implies the presence of methylation of IGFBP7. Dig Dis Sci. 2012;57:1261-1270. [PubMed] [DOI] |
| 21. | Shimomura T, Hiyama T, Oka S, Tanaka S, Yoshihara M, Shimamoto F, Chayama K. Frequent somatic mutations of mitochondrial DNA in traditional serrated adenomas but not in sessile serrated adenomas of the colorectum. J Gastroenterol Hepatol. 2011;26:1565-1569. [PubMed] [DOI] |
| 22. | Fu X, Li L, Peng Y. Wnt signalling pathway in the serrated neoplastic pathway of the colorectum: possible roles and epigenetic regulatory mechanisms. J Clin Pathol. 2012;65:675-679. [PubMed] [DOI] |
| 23. | Dhir M, Yachida S, Van Neste L, Glöckner SC, Jeschke J, Pappou EP, Montgomery EA, Herman JG, Baylin SB, Iacobuzio-Donahue C. Sessile serrated adenomas and classical adenomas: an epigenetic perspective on premalignant neoplastic lesions of the gastrointestinal tract. Int J Cancer. 2011;129:1889-1898. [PubMed] [DOI] |
| 24. | Mochizuka A, Uehara T, Nakamura T, Kobayashi Y, Ota H. Hyperplastic polyps and sessile serrated 'adenomas' of the colon and rectum display gastric pyloric differentiation. Histochem Cell Biol. 2007;128:445-455. [PubMed] [DOI] |
| 25. | So K, Tamura G, Honda T, Homma N, Waki T, Togawa N, Nishizuka S, Motoyama T. Multiple tumor suppressor genes are increasingly methylated with age in non-neoplastic gastric epithelia. Cancer Sci. 2006;97:1155-1158. [PubMed] [DOI] |
| 26. | Waki T, Tamura G, Sato M, Motoyama T. Age-related methylation of tumor suppressor and tumor-related genes: an analysis of autopsy samples. Oncogene. 2003;22:4128-4133. [PubMed] [DOI] |
| 27. | 卢 筱洪, 罗 和生. 表型遗传修饰对同源异型框基因CDX2的表达调控影响. 2009;. |
| 28. | Boulanger J, Vézina A, Mongrain S, Boudreau F, Perreault N, Auclair BA, Lainé J, Asselin C, Rivard N. Cdk2-dependent phosphorylation of homeobox transcription factor CDX2 regulates its nuclear translocation and proteasome-mediated degradation in human intestinal epithelial cells. J Biol Chem. 2005;280:18095-18107. [PubMed] [DOI] |